冷冻保存前平衡温度对猪精子结构的影响
2017-06-26邱树磊郝福星武彩红郑筱峰
刘 莉,赵 倩,邱树磊,郝福星,吴 植,张 斌,武彩红*,郑筱峰
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏农牧科技职业学院,江苏泰州 225300;3.河南省新乡市动物卫生监督所,河南新乡 45300)
冷冻保存前平衡温度对猪精子结构的影响
刘 莉1,2,赵 倩3,邱树磊2,郝福星2,吴 植2,张 斌2,武彩红2*,郑筱峰2
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏农牧科技职业学院,江苏泰州 225300;3.河南省新乡市动物卫生监督所,河南新乡 45300)
研究冷冻保存前平衡温度对精子结构的影响,为提高猪精子冷冻效果提供参考。新鲜猪精液(Ⅰ组)稀释后于17℃过夜保存(Ⅱ组),然后于冷冻Ⅰ液中4 ℃平衡1.5 h(Ⅲ组),再加入预冷的冷冻Ⅱ液于4 ℃平衡45 min(Ⅳ组)。通过精子形态正常率及活力检测,吖啶橙(AO)染色检测精子DNA完整性,碘化丙啶(PI)染色检测精子头部质膜完整性,低渗肿胀试验(HOS)检测精子尾部质膜完整性,异硫氰荧光素标记的花生凝集素(FITC-PNA)染色检测精子顶体完整性,并用扫描电镜(SEM)观察精子结构,评价冷冻保存前平衡温度对猪精子结构的影响。结果表明,与新鲜精液相比,Ⅱ组精液的精子DNA完整性、质膜完整性、顶体完整性等精子结构检测指标所受影响无统计学意义(P>0.05); Ⅲ组和Ⅳ组的精子结构检测指标明显受到影响(P<0.05),但Ⅲ组和Ⅳ组间无显著差异(P>0.05)。扫描电镜检测结果表明,17℃过夜保存精子未见异常,头、颈、尾结构完整,顶体完整、光滑;Ⅲ组精子头部质膜及头颈结合部有轻微损伤;Ⅳ组精子尾部和头颈结合部有不同程度的断裂。冷冻前从17℃降低至4℃及4℃平衡对猪精子结构有一定程度的损伤。
精液冷冻;平衡温度;精子结构;猪
精液的有效冷冻保存在品种改良和优良种质资源保存中具有重要意义,但精子在冷冻过程中因“冷休克”和胞内冰晶形成[1],不可避免地引起精子形态、结构和功能的损伤[2-4]。与体细胞相比,精子质膜富含胆固醇、磷脂以及高密度脂肪酸[5],对“冷休克”具有更强的耐受性[6],因此,多数学者认为精子的冷冻损伤主要来自于细胞内冰晶的产生,而忽略了“冷冻休克”造成的损伤。猪精子对低温非常敏感[7],温度低于14℃时,精子因受到冷打击而失去受精能力。因此,在猪精液冷冻保存过程中,温度变化不容忽视。本试验旨在观察冷冻保存前平衡温度对猪精子结构的影响,为提高猪精液长期保存的效果提供参考。
1 材料与方法
1.1 精液采集与稀释
健康、性成熟公猪由江苏姜曲海种猪场提供,假阴道法无菌采集精液,1 h内带回实验室,分别检测形态和活力(形态正常率达到80%及活力达到70%时可用于试验)。将精液过滤至37 ℃预热烧杯中,与稀释液(德国米尼图MII配制)按1∶1.5混合。
1.2 精液冷冻前处理
稀释后精液于17 ℃恒温箱中过夜保存,然后保持17 ℃条件下离心(800 r/min,12 min),弃上清后于沉淀中1∶1加入冷冻Ⅰ液(100 mL双蒸水中含Tris、柠檬酸钠、葡萄糖、青霉素、链霉素、海藻糖分别为2.42 g、1.48 g、1.1 g、0.06 g、0.1 g和375 mmol/L,20%卵黄)于4 ℃条件下平衡1.5 h;再加入4℃预冷的冷冻Ⅱ液(冷冻Ⅰ液中添加甘油,其终浓度为3%),使精液最终稀释比为1∶2,再于4℃条件下平衡45 min。
1.3 精子形态正常率及活力检测
于相差显微镜下观察精子体积、形态及顶体是否正常或有无缺损,每个样本观察不少于200个精子。于显微镜下观察并计数向前运动精子所占的百分率,即为精子活力。每个样本观察、计数不少于200个精子。
1.4 精子DNA完整性检测
采用吖啶橙染色检查精子DNA完整性。精液样本经PBS洗3次,然后用PBS调节沉淀使精子浓度达2×104/mL;取精液直接涂片、自然干燥,于无水乙醇-冰醋酸(3∶1)混合液中固定,5 min后置入吖啶橙染液中染色10 min。蒸馏水冲洗、干燥、石蜡油封片,荧光显微镜下观察、计数至少300个精子[8]。绿色表明精子DNA 双链完整,具有受精能力;红色或黄色表明精子DNA 双链损伤的,无受精能力(图1A)。吖啶橙溶液:磷酸氢二钠溶液:Na2HPO4·12H2O 10.74 g于100 mL蒸馏水中;吖啶橙溶液:0.1 g吖啶橙溶解于100 mL蒸馏水中;枸橼酸溶液:1.91 g枸橼酸溶解于100 mL蒸馏水中。临用时,分别取吖啶橙溶液、枸橼酸和磷酸氢二钠溶液按0.75∶1∶4混合,使用。
1.5 精子膜完整性检测
1.5.1 头部质膜完整性评价方法(PI染色) 100 μL Hepes/BSA(NaCl 0.759 9 g,KCl 0.029 8 g,Hepes 0.238 3 g,BSA 0.1 g,果糖0.252 2 g,MgCl2·6H2O 0.102 g,CaCl2·2H2O 0.014 7 g,溶解于100 mL蒸馏水中)中加入2 μL碘化丙啶(PI,0.025 g溶于10 mL PBS),再加入精液悬液50 μL,37℃孵育30 min,取10 μL精液悬液滴于载玻片中央,再滴加少量抗荧光淬灭剂DABCO(10 mL甘油/PBS(9∶1)溶液中含DABCO0.02 468 g),盖片,无色指甲油封片,在荧光显微镜(Nikon,T1-SM)下观察。PI染色阳性者为头部精子质膜破损的死精子,其头部核区呈现红色荧光(图1B)。
1.5.2 尾部质膜完整性评价方法(低渗肿胀试验) 100 μL低渗液(100 mL双蒸水中含二水柠檬酸钠和果搪分别为0.735 g和1.351 g,0.22 μm滤膜过滤后4℃保存)中加入10 μL精子,置于37℃、5% CO2培养箱中孵育30 min;于显微镜下计数200个精子,计算尾部质膜完整率(图1C,即弯尾精子的百分率)。
1.6 精子顶体完整性检测
1 mL丙酮(-20 ℃预冷)中加入500 μL精液,于4 ℃固定5 min,离心(500 r/min,6 min)后弃上清,沉淀经PBS(pH 7.2)洗2次后用HEPES/BSA封闭30 min,再加入异硫氰荧光素标记的花生凝集素(FITC-PNA,0.001 g溶解于10 mL PBS中,-20 ℃避光保存)50 μL于37 ℃孵育30 min,离心(500 r/min,6 min),沉淀再用PBS(pH 7.2)洗2次,取10 μL悬液滴于载玻片中央,再滴加少量抗荧光淬灭剂DABCO,盖片,无色指甲油封片,荧光显微镜下观察、计数[9]。顶体完整精子,可见顶体呈绿色荧光且边缘光滑(图1D)。
1.7 扫描电镜样本制备
精液置于25 mL/L戊二醛中4℃条件下固定6 h,然后于PBS中洗2~3次,30 min/次;精子包埋于40 g/L琼脂后于10 mL/L锇酸(OsO4)中固定1.5 h,再经PBS清洗2~3次[11];乙醇逐级脱水,乙酸异戊脂置换;干燥、粘台、喷金;扫描电子显微镜观察、拍照。
1.8 试验分组
根据冷冻保存前平衡温度,将精液分为4组,其中Ⅰ组为新鲜精液对照组,Ⅱ组为17℃过夜保存精液,Ⅲ组为加入冷冻Ⅰ液后4 ℃平衡1.5 h精液,Ⅳ组为加入4℃预冷的冷冻Ⅱ液后4 ℃平衡45 min精液。
1.9 数据处理
每组重复3次,各组试验数据采用SPSS软件进行差异显著性分析。
2 结果
2.1 冷冻保存前平衡温度对精子DNA、头部质膜、尾部质膜及顶体完整性的影响
冷冻保存前平衡温度对猪精子DNA、头部质膜、尾部质膜及顶体的影响结果见表1和图1。

表1 冷冻保存前平衡温度对精子DNA、头部质膜、尾部质膜及顶体完整率的影响
注:*同一列中,不同字母表示差异显著,P<0.05。
Note:*In the same column,the different letters indicate significant difference,P<0.05.
由表1可见,与对照组DNA完整性、头部质膜完整率、尾部质膜完整率和顶体完整率(分别为94.3%、92.2%、92.4%和93.8%)相比,17℃过夜保存精液其精子结构检测指标虽有所下降(分别为90.6%、91.5%、88.5%和90.7%),但其变化无统计学意义(P>0.05);Ⅲ组和Ⅳ组各指标(分别为75.2%、87.4%、73.6%和83.6%;71.3%、85.2%、72.1%和82.4%)均显著低于Ⅰ组和Ⅱ组(P<0.05), 但Ⅲ组和Ⅳ组间无统计学差异(P>0.05)。
2.2 冷冻保存前平衡温度对精子超微结构的影响
在扫描电镜(SEM)下,冷冻保存前平衡温度对猪精子形态结构的影响见图2。 在SEM下可见猪新鲜精子(图2A)和Ⅱ组精子(图2B)结构完整,由头、颈、尾3部分构成。头颈部结合完好;尾部主段、中段和末端结构完整;顶体结构完整,边缘清晰,局部无隆起;Ⅲ组精子(图2C和2D)和Ⅳ组精子(图2E和2F)头、颈、尾结构完成,但头颈部有不同程度的断裂(图2D和图2F),Ⅲ组精子头部部分质膜轻微损伤(图2C),Ⅳ组精子尾部末端部分断裂(图2E)。
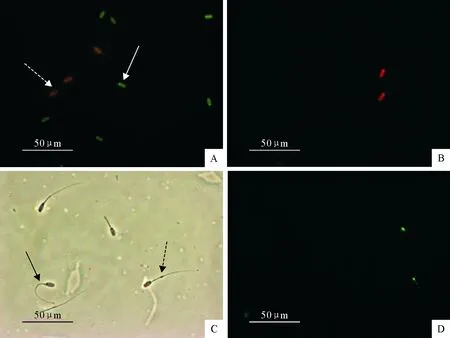
A.荧光显微镜下精子AO染色结果:绿色为DNA完整精子 ,橙色为DNA断裂精子;B.荧光显微镜下PI染色结果:红色为精子头部质膜损伤;C.显微镜下精子低渗肿胀试验结果:尾部弯曲为精子尾部质膜完整,尾部未发生弯曲为精子尾部质膜受损精;D.荧光显微镜下FITC-PNA染色结果:绿色为精子完整顶体
A.AO staining features of boar sperm under the fluorescent microscope:Green and yellow represent sperms with integrated DNA and rupture DNA,respectively.B.PI staining features of boar sperm under the fluorescent microscope:Red represents sperms with membrane damage in head.C.Experiments of hypoosmotic swelling under the microscope:crooked tail represents integrated membrane in tail.And without crooked tail represents damage membrane in tail.D.FITC-PNA staining features of boar sperm under the fluorescent microscope:Green represents sperms with integrated acrosome
图1 冷冻保存前平衡温度对猪精子DNA、头部质膜、尾部质膜及顶体的影响
Fig.1 Effects of equilibration temperature before freezing on DNA,membrane in head,membrane in tail and acrosome in boar sperms
3 讨论
猪精子对低温打击和冷冻非常敏感,猪精子冷冻后容易表现出精子活率丧失,精子膜选择通透性降低,顶体膜损伤等问题,所以精子冻存技术和方案的优化对于挖掘精子潜力尤为重要[11]。精子的形态结构与受精能力密切相关[12]。研究认为,精子质膜完整性是反映精子存活与否的重要指标;顶体结构完整是精子发生正常顶体反应的基础,是精子成功受精的关键;而精子DNA完整性则直接与精子质量及其后代生长发育相关[13]。
猪冷冻精液在生产制作过程中,稳定平衡温度在合理范围内极为重要,因它能直接影响到冷冻精液的品质[14]。本研究发现,17℃过夜平衡,精子结构未发生显著改变,但4℃平衡后精子DNA完整性及头部质膜、尾部质膜和顶体完整率都显著降低。扫描电镜下,17℃过夜平衡处理精子未见异常, 4℃平衡后精子头颈结合部轻微断裂,尾部及头部质膜也发生轻微损伤,但顶体结构未见明显异常。表明,温度在降低至4℃及4℃平衡不可避免的引起了猪精子损伤。说明尽管精子对“冷休克”具有一定的耐受性,但冰点之上的温度下降还是会对精子的结构造成一定的破坏,该研究结果与Clarke G N[15]研究结果一致。虽然本研究冷冻保存前平衡处理对精子造成了一定损伤,但仍符合精子冷冻保存前处理要求的各指标值。不过,如何降低冷冻前平衡对精子损伤仍需进一步探索。
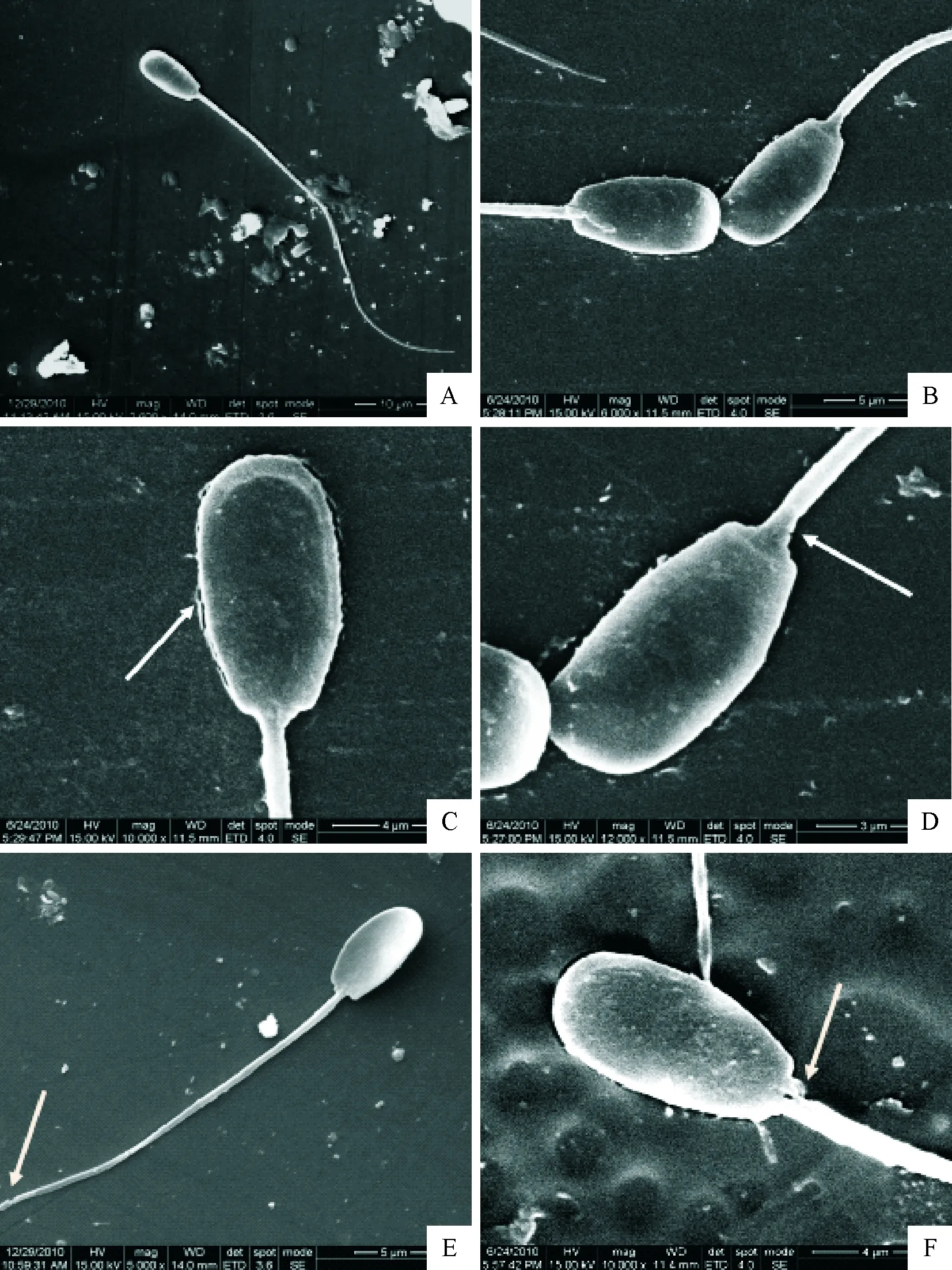
A.Ⅰ组(新鲜)精子;B.Ⅱ组精子;C~D.Ⅲ组精子;E~F.Ⅳ组精子。A.精子结构完整,无损伤(2 600×);B.头颈部未见异常,头部顶体完整,表面光滑(6 000×);C.头颈部结合完好,但头部质膜损伤(10 000×);D.头部顶体完整,表面光滑,但颈部轻微断裂(12 000×);E.精子尾部部分缺损(5 000×);F.头部顶体完整,表面光滑,但头颈结合部轻微断裂(10 000×)
A.Micrographs derived from Ⅰ group sperm; B.Micrographs derived from Ⅱ group sperm; C-D.Micrographs derived from Ⅲ group sperm; E-F.Micrographs derived from Ⅳ group sperm.A.Sperm with intact structure and no damage (2 600×); B.Sperm with acrosomal intactness,smooth surface and normal neck (6 000×); C.damaged membrane in head(10 000×); D.Partial fracture between head and neck.but with acrosomal intactness and smooth surface(12 000×); E.Partial fracture tail(5 000×); F.Partial fracture between head and neck.but with acrosomal intactness and smooth surface(10 000×)
图2 扫描电镜(SEM)下,冷冻保存前平衡温度对猪精子超微结构的影响
Fig.2 Effect of equilibration temperature before freezing on the ultrastructure of boar sperms under the SEM
[1] 平述煌,杨世华.精子冷冻保存技术及研究进展[J].中国比较医学杂志,2011,21(3):67-71.
[2] Flores E,Cifuentes D.Fernández-Novell J M.Freeze-thawing induces alterations in the protamine-1/DNA overall structure in boar sperm [J].Theriogenology,2008,69:1083-1094.
[3] Lee H L,Kim S H,Ji D B,et al.A comparative study of sephadex.glass wool and percoll separation techniques on sperm quality and IVF results for cryopreserved bovine semen [J].J Vet Sci,2009,10(3):249-255.
[4] Nijs M,Creemers E,Cox A,et al.Influence of freeze-thawing on hyaluronic acid binding of human spermatozoa[J].Reprod Biomed Online,2009,19(2):202-206.
[5] Holt W V.Fundamental aspects of sperm cryobiology:The importance of species and individual differences[J].Theriogenology,2000.53(1):47-58.
[6] Meseguer M,Garrido N,Martínez-Conejero J A,et al. Role ofcholesterol..calcium,and mitochondrial activity in the susceptibility for cryodamage after a cycle of freezing and thawing[J].Fertil Steril,2004,81( 3) :588-594.
[7] Wagner H G,Tibier M.World statistics for artificial insemination in small ruminants and swine[C]Stockholm:Proc 14th ICAR.2000.
[8] 孙静波,姜 宏,何瑞冰.精子DNA完整性与精液参数的相关性研究[J].中国男科学杂志,2010,24(4):26-29.
[9] 张 斌,李 玲,武彩红,等.犬精液品质的荧光染色评价方法[ J].江苏农业科学,2011( 1 ):240- 242.
[10] 彭 影,刘雨生,童先宏,等.扫描电镜下畸形精子增多症患者的精子形态观察 [J].中国男科学杂志,2007,21(2):37-43.
[11] 马 丽,李青旺,吴民耀.二甲基亚砜对猪精液冷冻保存效果研究[J].动物医学进展,2014,35(5):56-61.
[12] Sandra P.Martin B.Structure of mammalian spermatozoa in respect to viability fertility and cryopreservation [J].Micron,2006,37:597-612.
[13] 李刚琴,何 映.精子线粒体DNA损伤与男性不育[J].中国优生与遗传杂志,2010,18(4):4-5.
[14] 张金玲,房灵军,田国宁,等.猪精液常温保存效果观察[J].动物医学进展,2014,35(12):110-114.
[15] Clarke G N,Liu DY,Baker H W.Improved sperm cryopreservation using cold cryoprotectant [J].Reprod Fertil Dev,2003,15 (7-8):377-381.
Effect of Equilibration Temperature Before Freezing on Boar Sperm Structure
LIU Li1,2,ZHAO Qian3,QIU Shu-lei2,HAO Fu-xing2,WU Zhi2,ZHANG Bin2,
WU Cai-hong2,ZHENG Xiao-feng2
(1.VeterinaryCollegeofYangzhouUniversity,Yangzhou,Jiangsu,225009,China;2.JiangsuAnimalHusbandryandVeterinaryCollege,Taizhou,Jiangsu,225300,China; 3.InstituteofAnimalHealthSupervisionofXinxiang,Xinxiang,Henan,45300,China)
To investigate the effect of equilibration temperature before freezing on boar sperm structure and to provide reference for optimize the cryopreservation protocol of boar semen,fresh semen (Ⅰ group) was diluted and then preserved at 17℃ for overnight time (Ⅱ group).Next,the semen was mixed with Ⅰ freezing liquid at the ratio of their volume 1:1 and then kept for 1.5 hour at 4℃ (Ⅲ group).Finally,the semen was mixed with Ⅱ freezing liquid and then kept for 45minutes at 4℃(Ⅳ group).In order to evaluate the effect of equilibration temperature before freezing on boar sperm structure,we examined semen samples by the normal proportion and activity assay of sperm morphology,the acridine orange(AO) staining,propidium iodide (PI) staining,hypoosmotic swelling test (HOS),fluorescein isothiocyanate labeled peanut (FITC-PNA) staining and scanning electron microscopy (SEM) observation.Compare with fresh sperm,all the indexes of sperm from Ⅱ group decrease but no statistical difference between them (P>0.05).All the indexes of sperm from Ⅲ and Ⅳ groups decrease obviously (P<0.05).But there was no significant difference between Ⅲ group and Ⅳ group (P>0.05).Under SEM,sperm from Ⅱ group did not show abnormal and showed intact structure including head,neck and tail and intact and smooth acrosome.Sperm from Ⅲ group showed lightly damage in head member and junction between head and neck.Sperm from Ⅳ group showed different degree fracture in tail and junction between head and neck.In conclusion,temperature change can cause sperm damage when sperms undergo the temperature drop from 17℃ to 4℃ and 4℃equilibration before freezing.
sperm freezing; equilibration temperature; sperm structure; boar
2016-08-15
江苏省自然科学基金项目(BK2008589);江苏省“333工程”[苏农办人2013(3)号];江苏农牧科技职业学院“凤凰人才工程”[(2014)30号];江苏省教育厅“青蓝工程”培养对象(苏教办师〔2017〕5号)
刘 莉(1981-),女,江苏铜山人,硕士,讲师,主要从事动物医学教学研究。 *通讯作者
S857.2
A
1007-5038(2017)06-0038-05
