滁州活禽市场鸡源沙门菌的分离鉴定与药敏试验
2017-06-26郭伟娜路振香刘利晓
郭伟娜,路振香,刘利晓,龚 争
(1.安徽科技学院动物科学学院,安徽凤阳 233100;2.河南省驻马店市畜牧局,河南驻马店 463000)
滁州活禽市场鸡源沙门菌的分离鉴定与药敏试验
郭伟娜1,路振香1,刘利晓2,龚 争1
(1.安徽科技学院动物科学学院,安徽凤阳 233100;2.河南省驻马店市畜牧局,河南驻马店 463000)
从安徽滁州地区某活禽市场采集鸡的肛拭子样品110份,接种到麦康凯培养基分离纯化,再选取典型菌落进行三糖铁、吲哚、甲基红、VP等生化试验及16S rRNA的PCR鉴定,最后对沙门菌分离株进行药敏试验。110份样品经分离纯化得到29株疑似沙门菌菌株,通过生化试验及16S rRNA的分子鉴定,共分离到23株沙门菌,检出率为20.9%;药敏试验表明,沙门菌分离株对链霉素和阿米卡星的耐药率相对较低,而对庆大霉素、大观霉素、哌拉西林的耐药率均高达82.61%。对克林霉素的耐药率为100%。
沙门菌;鸡;分离鉴定;药敏试验
沙门菌是肠杆菌科的一种革兰阴性菌,广泛存在于人和多种动物肠道中,例如牛、马、猪等哺乳动物,鸡、鸭、鹅等家禽,以及其他爬行动物和两栖动物[1]。大多数沙门菌对人和动物具有致病性,其血清型有2500多个,并且不同血清型对各种动物的致病性也不相同,能够引起常见多发的人畜共患病[2]。其中致病性鸡沙门菌为禽类的重要病原菌,可引发鸡白痢、鸡伤寒和鸡副伤寒等,雏鸡感染后引起大批死亡,成年鸡导致生产性能下降,病死率高达80%,并且能够垂直传播,已成为危害养禽业的首要传染病之一[3]。目前对沙门菌病的防治主要依赖于抗生素,但由于大量使用或滥用抗生素,使得沙门菌的耐药性更加严重,甚至出现多重耐药,再加上耐药性会通过质粒传递给其他病原菌或动物,这些耐药菌株的产生及动物产品中的药物残留,进一步直接或间接地威胁到人类健康。
沙门菌在我国的感染率较高,人会因误食沙门菌污染的动物源产品而引发沙门菌病,所以已成为世界范围内一种重要的食源性致病菌[4]。沙门菌的感染一般认为是通过食物,但近年来沙门菌病的暴发情况表明,直接或间接接触动物是更常见的传播途径[5]。美国疾病控制中心报告指出,2007年开始,人沙门菌感染的暴发与接触动物及其周围环境的相关性研究越来越多,例如乌龟、松狮蜥、青蛙、刺猬和家禽等。每年美国所有的沙门菌感染中大约有11%归因于与动物接触,尤其是儿童的发病和死亡的风险更高[1]。随着活禽市场的不断增多和普及,与活禽相关的沙门菌病的暴发也在逐步增加,有研究对1990至2014年间美国活禽相关沙门菌病的流行病学进行统计分析,发现这些患者有鸡和鸭接触史的比例分别占85%和38%[6]。早在20世纪90年代美国和欧盟等西方国家就已经开展了对食品动物中沙门菌病流行性的调查,而且每年都会发布监测结果;欧盟还严格制定了肉鸡肠炎沙门菌的控制措施和目标,但目前国内对活禽市场鸡沙门菌病的流行情况研究资料较少。因此,本研究主要是对安徽滁州地区活禽市场鸡源沙门菌进行分离鉴定及药敏试验,了解该地区鸡沙门菌病的流行及耐药情况,也为该病的综合防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试剂 营养琼脂培养基、LB营养肉汤、麦康凯培养基、三糖铁培养基、蛋白胨水、葡萄糖蛋白胨水按照相关文献[7]配制;Ezup柱式基因组DNA抽提试剂盒和即用型PCR扩增试剂盒,购自上海生工生物工程股份有限公司。
1.1.2 药敏纸片 链霉素(10 μg/片)、卡那霉素(30 μg/片)、阿米卡星(30 μg/片)、庆大霉素(10 μg/片)、环丙沙星(5 μg/片)、克林霉素(2 μg/片)、大观霉素(100 μg/片)、哌拉西林(100 μg/片),以上药敏试纸片均购自杭州天和微生物试剂有限公司。
1.2 方法
1.2.1 样品采集 于2014年3月至5月期间,在安徽滁州地区某活禽市场采集鸡的肛拭子样品110份,保存于含有LB营养肉汤500 μL的1.5 mL离心管中。
1.2.2 分离培养及生化鉴定 首先在LB营养肉汤中37℃增殖培养24 h,然后用接种环挑取增菌液接种于麦康凯培养基上,37℃培养24 h后,观察菌落生长情况,并挑取沙门菌典型菌落接种于麦康凯培养基上进行纯化。挑取适量纯化后的菌落培养物分别进行三糖铁、吲哚、甲基红和VP试验。
1.2.3 16S rRNA鉴定 按照DNA提取试剂盒的说明进行疑似沙门菌的核酸提取。参考GenBank中沙门菌16S rRNA序列,设计特异性引物,扩增目的片段大小为766 bp。引物由上海生物工程股份有限公司合成,序列如下。
上游引物:5′-AAGAAGCACCGGCTAACTCC-3′
下游引物:5′-CGCTTCTCTTTGTATGCGCC-3′
PCR扩增及测序分析。PCR反应体系为50 μL,按照PCR扩增试剂盒要求加样。反应条件为:95℃ 5 min;94℃ 30 s,57℃ 45 s,72℃ 1 min,30个循环;72℃ 10 min。取10 μL PCR产物进行琼脂糖凝胶电泳检测,将有目的条带的PCR产物送至南京金斯瑞生物科技有限公司测序,并对测序结果进行比对分析。
1.2.4 药敏试验 将沙门菌分离菌株接种到LB营
养肉汤,待生长至对数期后,用涂玻棒将其涂布到营养琼脂培养基上,用无菌小镊子夹取药敏试纸片均匀贴到培养基表面,37 ℃培养18 h~24 h,观察结果。
2 结果
2.1 分离培养及生化鉴定结果
110份样品经麦康凯培养基分离纯化后,有29份样品符合沙门菌典型菌落特征,表现为圆形、半透明、边缘整齐、表面光滑湿润、灰白色的小菌落。29份样品的三糖铁试验都表现为底部产酸呈黄色,且全部产气,斜面除16号样品外,均产碱呈红色;除4、5、16、27、28、29号样品外的23份样品底部产H2S而呈黑色。吲哚试验结果表明,除16、27、28、29号样品外,其它均呈黄色为阴性反应,符合沙门菌的特性;甲基红试验结果表明,除4、5、27和29号样品外,其余均为红色呈阳性反应,符合沙门菌的特征;VP试验结果均表现为黄色,即阴性反应,符合沙门菌的特性。综合以上结果,除4、5、16、27、28、29号样品外,其余23份样品的菌落均符合沙门菌特征。
2.2 16S rRNA鉴定
16S rRNA的PCR扩增产物的电泳检测结果见图1。除4、5、27、28、29号外,其余24个样品均有766 bp的目的片段,其测序结果与沙门菌16S rRNA基因(登录号:EU118094)同源性为100%。但由于16号菌株生化特征不符合,因此共分离得到23株沙门菌。
2.3 药敏试验结果
23株沙门菌的药敏试验结果见表1。由表1可知,7、9、11、26号4个菌株对阿米卡星较为敏感,抑菌圈在20 mm以上;7号和22号菌株对链霉素的抑菌圈分别为28 mm和23 mm,高度敏感;23个菌株均对克林霉素均为耐药,其中15个菌株抑菌圈为0,其余8个菌株的抑菌圈不明显。
抑菌圈的大小可以反映待测菌对该测定药物的敏感程度,对以上药敏试验结果进行统计分析,23株沙门菌的具体耐药情况见表2。由表2可知,阿米卡星和链霉素的耐药率相对较低;但庆大霉素、大观霉素和哌拉西林的耐药率为82.61%,克林霉素耐药率高达100%,多重耐药较为严重。
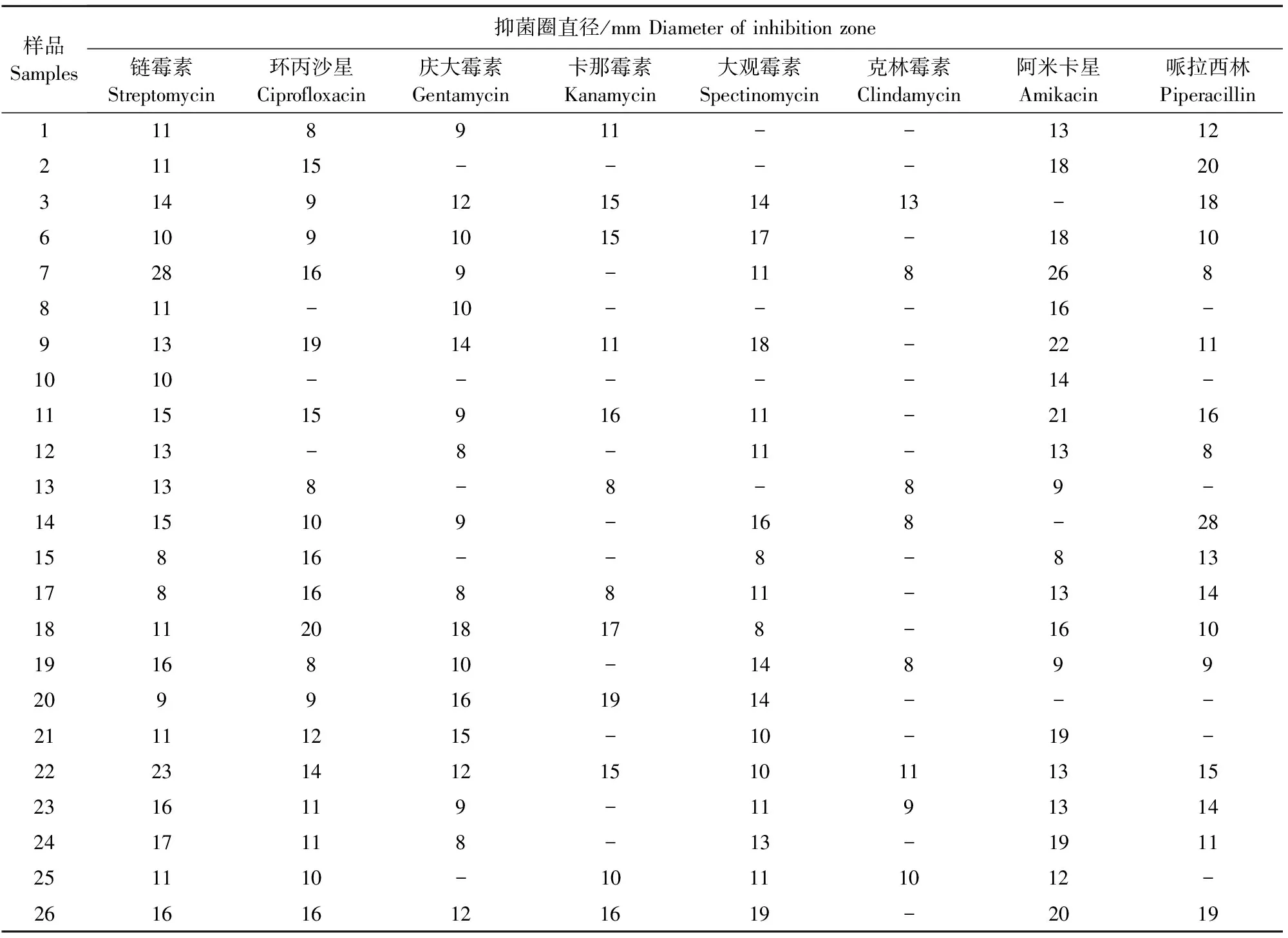
表1 药敏试验结果
注:“-”无抑菌圈。
Note:“-”no inhibition zone.
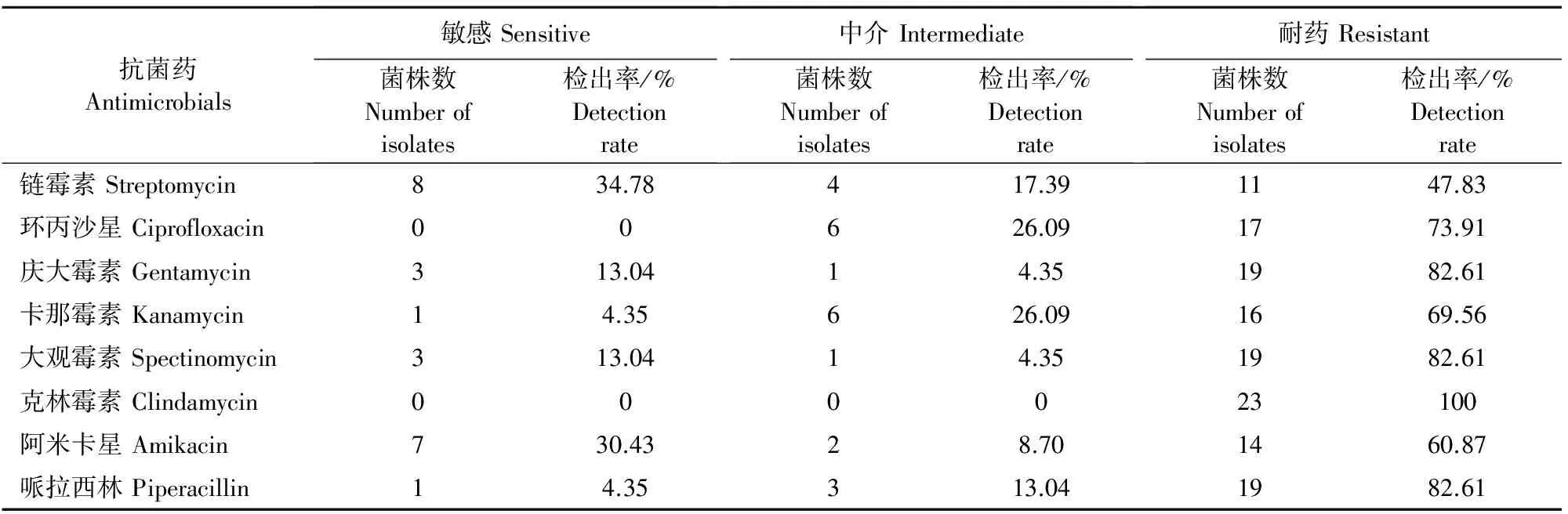
表2 药敏试验结果分析
3 讨论
沙门菌为一种无芽胞、无荚膜的革兰阴性杆菌,是世界范围最重要的人兽共患食源性病原菌,也是危害食品安全的重要风险因子,30%的食源性细菌污染由其引发[8],其污染状况直接关系着公共卫生安全。本试验采集的110份鸡肛拭子样品均来自安徽滁州地区活禽市场,具有一定的公共卫生学意义。鉴于沙门菌在麦康凯培养基上生长特征较为典型,本试验选用该培养基进行分离纯化。细菌的生化试验种类较多,但由于三糖铁、吲哚、甲基红、VP试验等是比较经典的生化试验,所以选用这几种生化鉴定方法,结合16S rRNA分子鉴定结果,从110份样品中共分离到23株沙门菌,检出率为20.9%。欧盟27个成员国在2009年和2010年对肉鸡进行的沙门菌监测结果表明,其平均带菌率分别为5.0%和4.1%[9]。方翟研究报道[10]鸡源沙门菌在湖北省各地区的分离率为9.52%,均低于本文的检出率。但陆彦等研究表明山东省部分地区肠炎沙门菌的分离率为17.9%[11];山东淄博地区在2011和2012年采集的鸡肛拭子样品中沙门菌的检出率分别为33.3%和26.9%[12];江苏常州地区的肉鸡肛拭子中沙门菌的阳性率高达46.2%[13],这些研究结果与本文一致,均具有较高的沙门菌检出率。同样,还有国外对禽类及其产品中沙门菌的检测,危地马拉活禽市场中沙门菌的流行率为34.3%[14];南斯拉夫科索沃地区39个蛋鸡场的367份样品中(粪便、灰尘、鸡蛋、病死禽的内脏等),发现19个蛋鸡场(49%)的38份样品为沙门菌感染[15];2010至2015年间捷克摩拉维亚地区52 735份肉类及其产品中沙门菌的阳性率为2.4%,但禽类产品中的检出率高达21.9%[16]。沙门菌在家禽及禽类产品中的高检出率,很可能是抗生素的不合理使用及滥用,导致多重耐药的出现。另外,家禽感染沙门菌多数是一种亚临床感染状态,外表健康但能持续排出病菌,总体来说沙门菌的排放在夏季较高,尤其在灰尘中含量最高[17]。如果不能及时对家禽进行沙门菌的定期监测,很难发现这种隐性感染,进一步还会威胁到人类健康。
本试验的药敏试验结果表明,23株沙门菌对克林霉素的耐药率高达100%,庆大霉素、大观霉素和哌拉西林的耐药率均为82.61%,环丙沙星为73.91%、卡那霉素为69.56%,最低的链霉素为47.83%,所以建议该地区防治沙门菌病时慎用这些药物。本试验结果与吴白[18]、周荣云[19]、廖成水[20]等研究结果不太相符,他们分离的禽源沙门菌对链霉素耐药率较高,甚至达100%,但对庆大霉素和卡那霉素较为敏感。国外也有类似报道,伊朗分离的沙门菌对四环素的耐药率为81%,链霉素为56.7%,卡那霉素为36.9%,但对环丙沙星和庆大霉素等较敏感[21];南斯拉夫科索沃地区的30个沙门菌分离株对庆大霉素和土霉素均较敏感,其中29个分离株对环丙沙星敏感,27个分离株对链霉素耐药[15]。这些结果与本文庆大霉素和环丙沙星的高耐药率和链霉素的低耐药率不一致,这些差异大多是与当地的临床用药情况有关。另外,沙门菌的多重耐药也较为严重,比如危地马拉活禽市场中分离的103个沙门菌分离株有59.2%对1~3种抗生素耐药,13.6%对4种以上抗生素耐药[14];在土耳其检出的沙门菌分离株有92.85%对4种以上抗生素耐药[22]。黎宗强报道了29个沙门菌分离株有51.73%的菌株为6重或7重耐药,3.45%的菌株甚至为14重耐药[23]。综合看来,各地沙门菌分离株对多种药物都产生了不同程度的耐药性,所以临床上应通过药敏试验筛选敏感药物,合理正确的使用抗生素,从而减少治疗成本和耐药性的产生。
本研究从安徽滁州地区活禽市场采集的110份鸡肛拭子样品中检出鸡源沙门菌23个,检出率为20.9%,并且这些分离株对克林霉素、庆大霉素、大观霉素、哌拉西林的耐药率较高。由于该地区活禽市场鸡沙门菌的高检出率及高耐药率,预示着暴发沙门菌病的风险较大,这就要求相关部门务必做好家禽沙门菌感染的定期监测和防治工作,指导临床合理用药进行有效防治,同时,沙门菌病的防治也有一定的公共卫生学意义。
[1] Hale C R,Scallan E,Cronquist A B,et al.Estimates of enteric illness attributable to contact with animals and their environments in the United States[J].Clin Infect Dis,2012,54(Suppl 5):S472-479.
[2] Ammari S,Laglaoui A,En-nanei L,et al.Isolation,drug resistance and molecular characterization ofSalmonellaisolates in northern Morocco[J].J Infect Dev Ctries,2009,3(1):41-49.
[3] 武志强.粤北地区鸡沙门氏菌分离株的生化反应特性[J].中国预防兽医学报,2009,31(5):406-408.
[4] 李丹丹,徐义刚,王绥家,等.动物源食品中沙门菌实时荧光定量PCR快速检测方法的建立[J].动物医学进展,2014,35(5):24-30..
[5] Steinmuller N,Demma L,Bender J B,et al.Outbreaks of enteric disease associated with animal contact:not just a foodborne problem anymore[J].Clin Infect Dis,2006,43(12):1596-1602.
[6] Basler C,Nguyen T A,Anderson T C,et al.Outbreaks of humanSalmonellainfections associated with live poultry,United States,1990-2014[J].Emerg Infect Dis,2016,22(10):1705-1711.
[7] 姚火春.兽医微生物学实验指导[M].北京:中国农业出版社,2007:37-38.
[8] 张 莉,曾艳兵,尹德风,等.畜禽沙门氏菌药敏性研究及两种测定方法比较[J].江西农业学报,2013,25(5):114-116.
[9] Eurosurveillance editorial team.The European Union summary report on trends and sources of zoonoses,zoonotic agents and food-borne outbreaks in 2010[J].Euro Surveill,2012,17(10):pii:20113.
[10] 方 翟.湖北省鸡源沙门氏菌的分离鉴定和耐药性分析[D].湖北武汉:华中农业大学,2014.
[11] 陆 彦,吕 安,赵红玉,等.鸡源肠炎沙门氏菌对抗菌药物的耐药性分析[J].中国人兽共患病学报,2014,30(1):17-22.
[12] 殷茂荣,王廷东.2011-2012年山东淄博市肉鸡屠宰场沙门菌污染情况分析[J].中国食品卫生杂志,2013,25(5):455-457.
[13] 杜 强,屠博文,徐晓怡.2012年常州市屠宰场肉鸡沙门菌污染情况调查[J].中国卫生检验杂志,2013,23(13):2809-2810.
[14] Jarquin C,Alvarez D,Morales O,et al.Salmonellaon raw poultry in retail markets in Guatemala:levels,antibiotic susceptibility,and serovar distribution[J].J Food Prot,2015,78(9):1642-1650.
[15] Hulaj B,Cabeli P,Goga I.Survey of the prevalence ofSalmonellaspecies on laying hen farms in Kosovo[J].Poult Sci,2016,95(9):2030-2037.
[16] Bardon J, Ondruskova J, Ambroz P.Prevalence ofSalmonellain meat and meat products in Moravia in 2010-2015[J].Klin Mikrobiol Infekc Lek,2016,22(2):48-53.
[17] Chousalkar K,Gole V,Caraguel C,et al.ChasingSalmonellaTyphimuriumin free range egg production system[J].Vet Microbiol,2016,192:67-72.
[18] 吴 白,杨 林,吴婷婷,等.15株禽源沙门菌的分离鉴定及耐药性试验[J].中国兽医杂志,2014,50(6):27-29.
[19] 周荣云,李军朝,邸 涛,等.21株禽源鼠伤寒沙门氏菌的分离鉴定及耐药性研究[J].黑龙江畜牧兽医,2016(8):131-133.
[20] 廖成水,程相朝,张春杰,等.鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J].中国兽医科学,2011,41(7):751-755.
[21] Sodagari H R,Mashak Z,Ghadimianazar A.Prevalence and antimicrobial resistance ofSalmonellaserotypes isolated from retail chicken meat and giblets in Iran[J].J Infect Dev Ctries,2015,9(5):463-469.
[22] Siriken B,Türk H,Yildirim T,et al.Prevalence and characterization ofSalmonellaisolated from chicken meat in Turkey[J].J Food Sci,2015,80(5):M1044-1050.
[23] 黎宗强,施开创,李凤梅,等.鸡源致病性沙门菌耐药表型与耐药基因血清群的相关性研究[J].动物医学进展,2016,37(3):25-32.
Isolation,Identification and Drug Susceptibility Test ofSalmonellafrom Chickens in Live Poultry Market of Chuzhou
GUO Wei-na1,LU Zhen-xiang1,LIU Li-xiao2,GONG Zheng1
(1.AnimalScienceCollege,UniversityofScience&TechnologyofAnhui,Fengyang,Anhui,233100China; 2.AnimalHusbandryBureauofZhumadian,Zhumadian,Henan,463000,China)
110 Cloacal swabs were collected from chickens in live poultry markets of Chuzhou in Anhui, then isolated and purified with MacConkey culture medium, and typical colonies were selected for identification through triple sugar iron test, indole test, methyl red test, VP test and PCR identification of 16S rRNA, finally drug susceptibility tests were conducted forSalmonellaisolates. There were 29 suspectedSalmonellaisolates obtained from 110 cloacal swabs of chickens, and 23Salmonellaisolates were identified through biochemical test and molecular identification of 16S rRNA. The susceptibility tests ofSalmonellashowed that the resistance for streptomycin and amikacin were relatively lower, while the resistance to gentamicin, spectinomycin, piperacillin were as high as 82.61%, and the resistance to clindamycin was even reached 100%.
Salmonella; chicken; isolation and identification; susceptibility test
2016-09-15
安徽省教育厅自然科学研究重点项目(KJ2016A822);安徽科技学院自然科学研究项目(ZRC2016497);安徽省科技攻关计划项目(1301zc03088)
郭伟娜(1982-),女,河南内黄人,讲师,博士,主要从事病原微生物致病性及防治研究。
S852.612
B
1007-5038(2017)06-0107-05
