RP-HPLC测定乳清蛋白糖基化产物中的氨基葡萄糖
2017-06-22张英华刘艳乐刘天舒朱敏
张英华,刘艳乐,刘天舒,朱敏
(东北农业大学食品学院,哈尔滨150030)
RP-HPLC测定乳清蛋白糖基化产物中的氨基葡萄糖
张英华,刘艳乐,刘天舒,朱敏
(东北农业大学食品学院,哈尔滨150030)
利用酸水解释放出的糖基化产物中氨基葡萄糖,采用Elite C18色谱柱分离,以68%的0.025 mol·L-1pH 3.6乙酸-乙酸钠缓冲溶液和32%甲醇作为流动相等度洗脱,流速为1 mL·min-1,进样体积10 μL,柱温35℃。定量分析结果表明,氨基葡萄糖0.1~100 μg·mL-1与氨基葡萄糖峰面积线性关系良好(R2=0.9998);以0.3、0.5、1.0 mg 3个添加水平作回收试验,氨基葡萄糖平均回收率为88.05%~110.79%,相对标准偏差为2.45%~5.92%;氨基葡萄糖检出限为0.02 μg·mL-1。糖基化乳清蛋白中氨基葡萄糖含量为2.03 mg·g-1。RP-HPLC测定法用于乳清蛋白-氨基葡萄糖糖基化产物制备条件优化,方法简单、重复性好、灵敏度高,可用于蛋白质-氨基葡萄糖糖基化产物中氨基葡萄糖含量分析测定。
反相高效液相色谱;乳清蛋白;氨基葡萄糖
Key words:reversed-phase high-performance liquid chromatography(RP-HPLC);whey protein; glucosamine
乳清蛋白是牛乳中含量较高的主要成份之一[1],在pH等电点处除去沉淀酪蛋白后的蛋白质统称为乳清蛋白。其含量约占乳蛋白质18%~20%,营养价值高、易消化。氨基葡萄糖是葡萄糖一个羟基被氨基取代后化合物,来源广泛,由于其分子质量较小,在糖存在蛋白溶液反应体系中更易扩散,是蛋白质糖基化重要前体。将乳清浓缩蛋白与羧甲基纤维素混合物60℃下反应5 d,可显著提高结合物乳化稳定性[2]。Jiang等将氨基葡萄糖与豌豆蛋白美拉德反应作交联,结果显示,氨基葡萄糖导入可提高豌豆蛋白体外消化性[3]。Jiang等将氨基葡萄糖分别导入大豆蛋白和酪蛋白结果表明,糖基化交联蛋白质溶解性和乳化性均提高,其中流变性质增大显著[4-5]。糖基化对乳清蛋白抗原性作用中美拉德反应糖基化产物可降低β-乳球蛋白和α-乳白蛋白致敏性[6]。可见,蛋白质-多糖美拉德反应产物可保留蛋白质表面活性,具备多糖亲水性能,其乳化活性和热稳定性良好,蛋白质致敏性低。由于糖基赋予糖基化蛋白重要功能,将乳清蛋白与氨基葡萄糖通过转谷氨酰胺酶糖基化,乳清蛋白糖基化产物可改变乳清蛋白功能性质。但糖基化蛋白中氨基葡萄糖释放和定量检测是关键问题。
还原糖常规方法无法精确定量糖基化产物中氨基葡萄糖含量。氨基糖分析方法有滴定分析法、比色法、HPLC法等,但滴定分析法适用常量组分分析测定且系统误差较大;国内较多利用比色法,即氨基葡萄糖伯氨基乙酰化后再与显色剂反应[7],但操作繁琐。高效液相色谱衍生化法采用反相柱氨基柱示差检测器检测或柱前衍生化后利用紫外或荧光检测器测定含量[8-9],用于样品常量、微量和痕量组分测定。其中衍生化步骤尤为重要,测定氨基糖衍生试剂很多[10-11]。Yan等定量测定壳聚糖含量时衍生试剂为琥珀酰亚胺[12];Stepan等选用邻氨基苯甲酸和吡唑啉酮[13],但样品前处理过程繁琐。Guan等采用衍生试剂邻苯二甲醛和巯基丙酸建立可灵敏、高效检测人尿中氨基葡萄糖液相色谱串联质谱方法[14];Eikenes等利用邻苯二甲醛作衍生试剂,经色谱分离和荧光检测器测定壳聚糖含量[15]。但都存在糖基化产物葡萄糖释放不充分、邻氨基苯甲酸和吡唑啉酮等衍生试剂有易致毒性、检测操作繁琐、分析方法不精确等不足。本研究采用盐酸水解充分释放糖基化乳清蛋白中氨基葡萄糖,邻苯二甲醛作柱前衍生,通过反相高效液相色谱法(RP-HPLC)精确测定蛋白水解物中氨基葡萄糖含量,为糖基化蛋白中氨基糖检测提供新方法。
1 材料与方法
1.1 仪器、试剂与材料
高效液相色谱仪(Waters 2695),包括荧光检测器、Empower数据处理软件(购自美国Waters公司);Milli-QR Gradient超纯水净化器(购自美国MILLIPORE公司);HH-S水浴恒温振荡器(购自巩义市予华仪器有限公司)。
色谱柱(购自大连依利特有限公司),GL-21M高速冷冻离心机(购自上海市离心机械研究所),DELTA 320型pH计(购自梅特勒-托利多仪器上海有限公司)。
乳清浓缩蛋白(WPC,购自北京泛亚乳品公司):蛋白质质量分数79.86%;氨基葡萄糖(阿拉丁):分子质量215.63 ku;转谷氨酰胺酶(TGase):酶活力110 U·g-1;浓盐酸、邻苯二甲醛(OPA)、三巯基丙酸,硼砂,冰乙酸、三水乙酸钠,氢氧化钠(均为分析纯,购自国药集团化学试剂有限公司);甲醇(色谱纯,购自天津市科密欧试剂有限公司);试验用水均为超纯水。
线性对照品溶液:精密称取氨基葡萄糖盐酸盐25 mg,置于25 mL烧杯中,加水溶解并转移至25 mL容量瓶中摇匀定容至刻度,作为对照品溶液储备液。精密量取对照品溶液储备液,用水分别稀释成浓度为1、5、10、20和40 μg·mL-1线性对照品,溶液于4℃下储存备用。
衍生试剂:50 mg OPA、1 mL甲醇和0.1 mL 3-巯基丙酸溶于10 mL pH 9.3硼砂-氢氧化钠缓冲液(0.05 mol·L-1硼酸根)中,现配现用。
1.2 RP-HPLC条件确定
色谱柱:Elite C18(Hypersil ODS 25 um 4.6 mm×250 mm)。
1.2.1 流动相pH确定
流动相A:甲醇;流动相B:0.025 mol·L-1乙酸-乙酸钠缓冲液;pH 3.6、3.8、4.0、4.2、4.6、5.0,使用前超滤、超声处理A∶B为32∶68,流速1 mL·min-1,检测时间20 min,柱温35℃,进样量10 μL。
检测器:荧光检测器激发波长337 nm,发射波长454 nm。
1.2.2 流动相体积比确定
流动相A:甲醇;流动相B:0.025 mol·L-1乙酸-乙酸钠缓冲液;pH 3.6;A∶B分别取体积比为68∶32、50∶50、32∶68,流速1 mL·min-1,35℃柱温,检测时间设定为20 min,进样量为10 μL。在荧光检测器相应激发波长和发射波长下检测。
1.3 样品制备与前处理
1.3.1 样品制备
4%(w/v)乳清蛋白溶液中添加氨基葡萄糖至3 mmol氨基葡萄糖/克乳清蛋白(每克乳清蛋白约含1 mmol酰胺基团),保证反应中蛋白质酰基供体与酰基受体氨基葡萄糖物质量比例为1∶3,用2 mol·L-1NaOH调pH至7.5。转谷氨酰胺酶添加量为10 kU·kg-1乳清蛋白,反应体系充分混匀后,置于37℃恒温培养箱内水平摇床振荡,反应时间为4 h。反应结束后,取出样品,于80℃水浴锅中灭酶10 min,冷却。pH调至5.0,加入等体积乙醇离心10min,回收沉淀,并用无水乙醇洗涤2次,除去未结合氨基葡萄糖,pH调回7.0后冻干样品。
1.3.2 样品前处理时间确定
精密称取乳清蛋白-氨基葡萄糖糖基化修饰产物60 mg,置于水解瓶中,加入6 mol·L-1盐酸5 mL并密封,100℃下水解4、5、6、7和8 h,水解结束后取水解液1 mL,调节pH至7.0,用超纯水定容至25 mL。
1.3.3 空白溶液前处理
取原料乳清蛋白60 mg,置于水解瓶中,加入6 mol·L-1盐酸5 mL并密封,100℃下与样品水解相同时间,水解结束后取水解液1 mL,调节pH至7.0,用超纯水定容至25 mL。
1.3.4 样品和空白溶液衍生
准确移取0.3 mL样品(空白溶液)于棕色瓶中并加入0.7 mL pH 9.3硼砂-氢氧化钠缓冲溶液(0.05 mol·L-1硼酸根)和0.3 mL衍生试剂混匀,置于25℃暗处衍生15 min,0.45 μm微孔滤膜过滤后上样。
1.4 方法学验证
通过添加回收率试验作方法学验证,验证线性范围、回收率、精密度和检出限等效能指标。
1.5 HPLC在乳清蛋白-氨基葡萄糖糖基化产物制备条件优化中应用
采用优化条件作样品盐酸水解、柱前衍生和HPLC,定量分析乳清蛋白糖基化修饰产物中导入氨基葡萄糖含量,以氨基葡萄糖导入量指标,优化乳清蛋白浓度、酶添加量等修饰产物制备条件。
乳清蛋白浓度选择:反应体系中不同乳清蛋白浓度(30、40和50 g·L-1)与氨基葡萄糖盐酸盐溶液混合,保证乳清蛋白酰基供体与酰基受体物质的量比为1∶3(每克乳清蛋白能够提供约1 mmol酰胺基团,每克氨基葡萄糖能够提供4.64 mmol伯胺基团),TGase添加量为10 U·g-1乳清蛋白,pH为7.5,37℃恒温水浴震荡反应4 h。反应结束后,取出样品,置于85℃水浴锅中灭酶5min,冷却。调节溶液pH至5.0,加入等体积无水乙醇离心10 min,收集沉淀,乙醇洗2次,在6 mol·L-1盐酸加入后100℃下水解4h,邻苯二甲醛衍生试剂衍生,优化HPLC分析修饰产品中氨基葡萄糖导入量。
TGase添加量选择:50 g·L-1乳清蛋白与氨基葡萄糖盐酸盐溶液混合,使酰基供体与受体比例为1∶3,TGase添加量分别为5、10和20 U·g-1乳清蛋白,37℃恒温水浴震荡反应4 h,反应结束后,取出样品,85℃水浴灭酶5 min,冷却。其余反应条件同上并用HPLC分析修饰产品中氨基葡萄糖导入量。
2 结果与分析
2.1 色谱分离条件优化
2.1.1 流动相pH确定
氨基葡萄糖与蛋白质水解后氨基酸结构相似,通过合适色谱分析条件将氨基葡萄糖与蛋白质水解后生成氨基酸分离。分别研究不同pH 0.025 mol·L-1乙酸乙酸钠缓冲溶液(pH 3.6、3.8、4.0、4.2、4.6和5.0)和甲醇溶液(体积比为68∶32)为流动相对样品溶液作色谱分离。结果表明,以0.025 mol·L-1pH 3.6乙酸-乙酸钠缓冲溶液和甲醇溶液体积比为68∶32作流动相时,氨基葡萄糖和氨基酸分离效果和峰形较好,保留时间理想。样品分析色谱图见图1。以其他pH条件作流动相时,氨基葡萄糖和氨基酸分离效果较差,分离度小,保留时间较长,峰形不理想并出现拖尾。
2.1.2 流动相体积比确定
分别研究流动相A(甲醇)与流动相B(0.025 mol·L-1)、pH 3.6醋酸-醋酸钠缓冲液以不同体积比A∶B(68∶32、50∶50、32∶68)为流动相对样品溶液作色谱分离。结果表明,以0.025 mol·L-1pH 3.6乙酸-乙酸钠缓冲溶液和甲醇溶液体积比为68∶32作流动相时,氨基葡萄糖和氨基酸分离效果和峰形较好,保留时间理想。以其他体积比条件作流动相时,氨基葡萄糖与氨基酸分离效果较差。
2.2 前处理条件优化
2.2.1 水解时间优化
水解过程需使氨基葡萄糖得到最大程度释放,本试验分别研究水解时间为4、5、6、7和8 h样品溶液,经高效液相色谱分析结果表明,水解4 h后,氨基葡萄糖含量基本不变,说明4 h时乳清蛋白-氨基葡萄糖糖基化产物中氨基葡萄糖已完全水解释放,100℃下水解时间选择4 h。
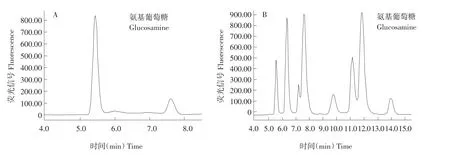
图1 氨基葡萄糖标准溶液、乳清蛋白糖基化产物HPLC分析Fig.1HPLC profiles of from a standard solution(A)and glycosylated whey protein concentrate(B)
2.3 方法学验证
2.3.1 线性关系
取1.1配制浓度为1、5、10、20和40 μg·mL-1线性对照品溶液,同样经衍生处理后作色谱分析,氨基葡萄糖标准曲线见图2。以氨基葡萄糖峰面积(Y)与氨基葡萄糖质量浓度(X,μg·mL-1)作线性回归,经Empower数据处理软件分析处理,0.02~1.00 mg·mL-1线性关系良好。线性回归方程为Y= 9.3038X+1.2668,R2=0.9998。
2.3.2 回收率、精密度和检出限
分别称取60 mg原料乳清蛋白,分别添加标准氨基葡萄糖0.3、0.5和1.0 mg,加入盐酸水解4 h,以不添加氨基葡萄糖原料乳清蛋白测定值为背景值,检测后扣除背景值,计算方法回收率。结果见表1,平均添加回收率为88.05%~110.79%,RSD为2.45%~5.92%。
取浓度为1、10和20 μg·mL-1标准氨基葡萄糖溶液衍生处理,每种浓度重复进样6次,计算方法精密度。结果见表2,保留时间RSD为0.49%~1.00%、峰面积RSD为2.66%~3.73%。说明该方法精密度良好。本方法线性范围下限0.1 μg·mL-1时S/ N>10,确定定量限为0.1 μg·mL-1;以S/N=3计算方法检出限,得到氨基葡萄糖检出限为0.02 μg· mL-1,表明此方法具有较高灵敏度。
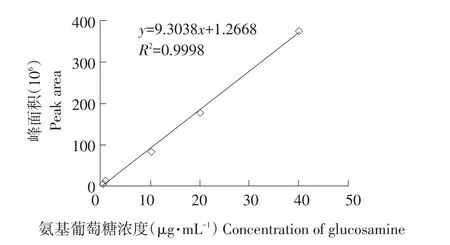
图2 氨基葡萄糖标准曲线Fig.2Standard line of glucosamine

表1 乳清蛋白-氨基葡萄糖糖基化产物中氨基葡萄糖添加回收率(n=3)Table 1Recovery of glucosamine spiked in glycosylated whey protein(n=3)

表2 氨基葡萄糖精密度(n=6)Table 2Precision of glucosamine(n=6)
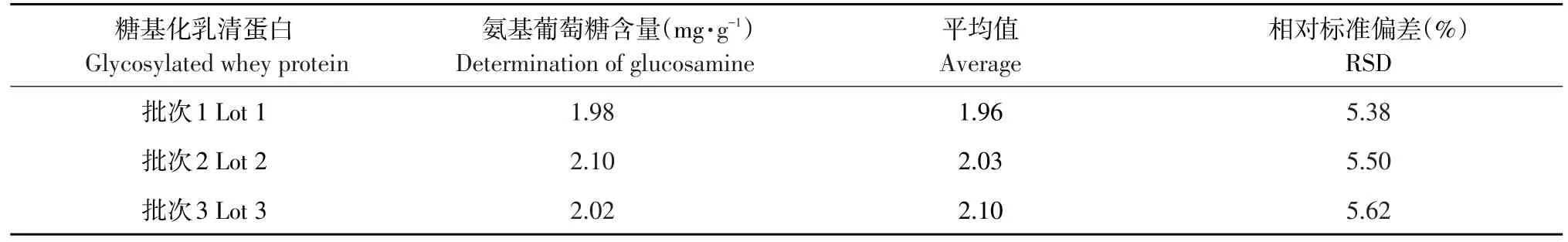
表3 糖基化乳清蛋白中氨基葡萄糖含量测定Table 3Determination of glucosamine in glycosylated whey protein
2.3.3 样品分析
取3个批次1.3.1制备乳清蛋白糖基化产物,按照试验方法处理后每个样品平行测定3次,3个批次样品中氨基葡萄糖含量见表3。
2.3.4 HPLC在乳清蛋白-氨基葡萄糖糖基化产物制备条件优化中应用
运用HPLC方法定量分析糖基化修饰产品氨基葡萄糖导入含量,以氨基葡萄糖导入量为指标,采用单因素试验方法研究反应体系乳清蛋白浓度、酶添加量对乳清蛋白糖基化修饰反应影响。
2.3.4.1 乳清蛋白浓度确定
乳清蛋白糖基化反应体系中,乳清蛋白提供谷氨酰胺与氨基葡萄糖物质的量比为1∶3、pH 7.5、转谷氨酰胺酶添加量10 U·g-1蛋白质,乳清蛋白浓度对糖基化交联乳清蛋白中氨基葡萄糖导入量影响如图3。
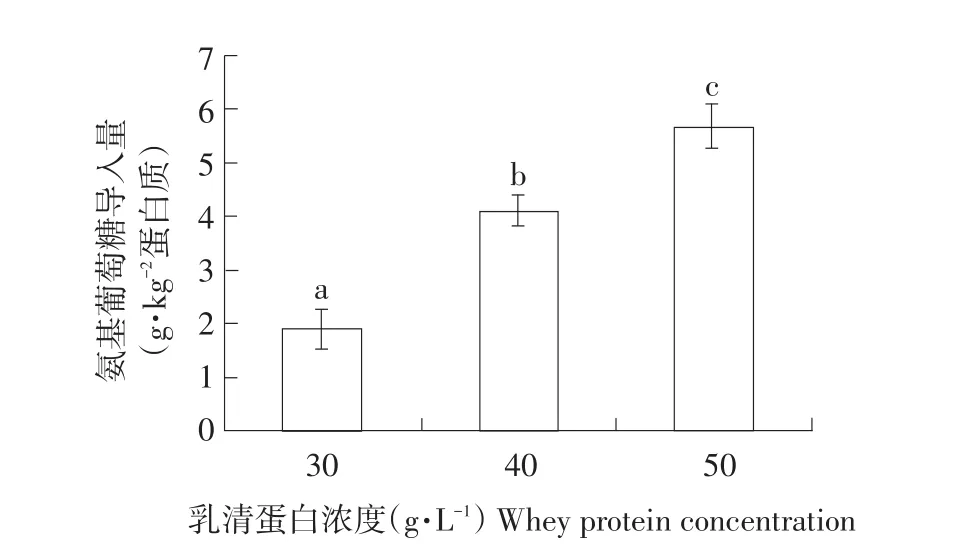
图3 乳清蛋白浓度对氨基葡萄糖导入量影响Fig.3Impacts of whey protein concentration on glucosamine conjugated into the modified whey protein
由图3可知,乳清蛋白浓度对氨基葡萄糖导入量影响较大,氨基葡萄糖导入量随着乳清蛋白浓度增加而增加。由于蛋白浓度增加到一定程度时,体系自身黏度和交联度均增加,影响反应正常进行,因此乳清蛋白最大浓度选定为50 g·L-1。当乳清蛋白浓度为50 g·L-1时,氨基葡萄糖导入量最大,为5.7 g·kg-1乳清蛋白。
2.3.4.2 转谷氨酰胺酶添加量确定
反应体系中乳清蛋白浓度为50 g·L-1,谷氨酰胺与氨基葡萄糖物质的量比为1∶3、pH 7.5、反应4 h,TGase添加量对糖基化交联乳清蛋白中氨基葡萄糖含量影响如图4。
由图4可知,通过HPLC测定TGase添加量对乳清蛋白修饰产物中氨基葡萄糖导入量影响。氨基葡萄糖导入量随着转谷氨酰胺酶添加量增加呈先增后减趋势。当体系中转谷氨酰胺酶添加量为10 U·g-1乳清蛋白时,体系中氨基葡萄糖导入量最大,达到5.7 g·kg-1蛋白质。但当转谷氨酰胺酶添加量继续增加时,氨基葡萄糖导入量反而下降。这可能是由于在利用转谷氨酰胺酶催化乳清蛋白糖基化交联反应中,乳清蛋白自身交联与糖基导入产生竞争反应。当TGase添加量较少时,不利于酶促反应,糖基导入量较少。增加转谷氨酰胺酶添加量,蛋白质自身交联程度与糖基导入均增加;酶添加量过高乳清蛋白分子迅速发生自身交联反应,占据大量氨基葡萄糖糖基导入交联位点,形成较大空间位阻,降低氨基葡萄糖与乳清蛋白底物结合位点接触机率,表现为当TGase添加量较高时,氨基葡萄糖导入量减少。所以最佳转谷氨酰胺酶添加量为10 U·g-1乳清蛋白。
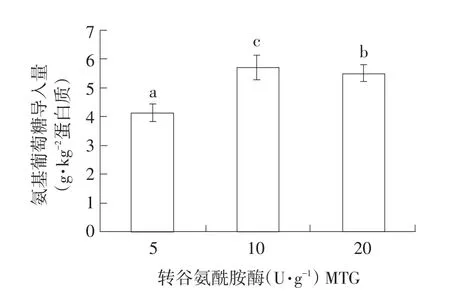
图4 转谷氨酰胺酶添加量对氨基葡萄糖导入量影响Fig.4Impacts of MTG addition on glucosamine conjugated into the modified whey protein
用HPLC结合盐酸水解、柱前衍生分析测得氨基葡萄糖糖基化交联修饰乳清蛋白修饰产物中氨基葡萄糖导入量。综合考虑酶添加量和反应时间等对糖基化交联乳清蛋白中氨基葡萄糖导入量影响,确定转谷氨酰胺酶催化乳清蛋白糖基化交联反应最佳条件为:乳清蛋白浓度为50 g·L-1,乳清蛋白与氨基葡萄糖提供酰基供体和酰基受体物质的量比1∶3,酶添加量10 U·g-1乳清蛋白、pH 7.5、反应时间4 h、反应温度为37℃。此条件下,通过HPLC定量分析,乳清蛋白糖基化修饰产物中氨基葡萄糖导入量为5.7 g·kg-1乳清蛋白。
3 讨论
测定氨基葡萄糖制品一般采用C8柱,另外氨基葡萄糖不含发色团,仅200 nm处有末端吸收,但吸光度较弱,故采用紫外检测器会造成干扰。曾茂法等在氨基葡萄糖硫酸盐含量测定研究中使用C8柱色谱柱,紫外检测器195nm检测,未发现氨基葡萄糖吸收峰,SO42-可干扰样品测定[16]。本文采用常用C18柱,衍生后作荧光检测器检测,效果较好,有较高准确度和精密度。通常使用普通液相色谱分析方法结合紫外检测器直接测定氨基葡萄糖含量,但由于氨基葡萄糖基质在测定波长处干扰色谱峰,普通液相色谱分析方法中氨基葡萄糖在反相柱保留时间较短,不易与其他杂质峰分离[17]。衍生方法应用可有效解决该问题。本文采用邻苯二甲醛衍生后利用高效液相色谱法测定含量,结合荧光检测器测定,谱图分离度较好,保留时间长。郑家概等采用相应衍生试剂检测氨基葡萄糖盐酸盐含量,发现OPA衍生适用于氨基葡萄糖及其他氨基葡萄糖盐,方法可靠[18]。本文结果表明HPLC衍生化法测定氨基葡萄糖精密度、回收率较高,具有准确、简便、专属性强特点,更适用于制剂含量测定,与王英瑛等结果一致[19]。HPLC方法可准确测定糖基化产物中葡萄糖导入量,应用于糖基化反应研究。杨岚等用RP-HPLC测定盐酸氨基葡萄糖片含量[20],杨华良等采用HPLC测定盐酸氨基葡萄糖颗粒含量[21],而陈金东等以滴定分析法和分光光度法定量测定氨基葡萄糖含量[22],测试效果良好。刘玥等DNS法测定氨基葡萄糖精密度良好,RSD为0.08%,回收率为98.86%[23]。HPLC方法与其他方法精密度、回收率是否存在差别尚待研究。
4 结论
反相高效液相色谱测定乳清蛋白-氨基葡萄糖糖基化产物中氨基葡萄糖含量方法,前处理条件为6 mol·L-1盐酸,100℃下水解4 h,流动相条件为0.025 mol·L-1、pH 3.6乙酸-乙酸钠缓冲液与甲醇体积比(68∶32)时,氨基葡萄糖释放完全、分离效果良好,样品中氨基葡萄糖含量2.03±0.055 mg·g-1。该方法操作方便,灵敏度高、重现性好、确证能力强,可用于各种蛋白质-氨基葡萄糖糖基化产物中氨基葡萄糖含量测定。
[1]王玉堂,刘宁.乳蛋白影响试验动物体脂肪酸分布及摄食相关激素研究[J].东北农业大学学报,2013,44(5):5-10.
[2]Kika K,Korlos F,Kiosseoglou V.Improvement,by dry-heating,ofthe emulsion-stabilizing properties of a whey protein concentrate obtained through carboxymethylcellulose complexation[J].Food Chemistry,2007,104(3):1153-1159.
[3]Jiang S J,Zhao X H.Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J].European Food Research and Technology,2010,231(5):679-689.
[4]Jiang S J,Zhao X H.Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product[J].International Dairy Journal, 2011,21(4):198-205.
[5]Jiang S J,Zhao X H.Cross-linking and glucosamine conjugation of casein by transglutaminase and the emulsifying property and digestibility in vitro of the modified product[J].International Journal of Food Properties,2011,15(6):1286-1299.
[6]李铮,冯力更,郑喆,等.糖基化反应条件对乳清蛋白——麦芽糖复合物抗原性的影响[J].中国乳品工业,2011,39(1):8-11.
[7]王维,尤瑜敏,周培根.D-氨基葡萄糖测定方法的比较[J].食品研究与开发,2003,24(2):84-87.
[8]Shao Y,Alluri R,Mummert M,et al.A stability-indicating HPLC method for the determination of glucosamine in pharmaceutical formulations[J].Journal of Pharmaceutical&Biomedical Analysis, 2004,35(3):625-631.
[9]黄婷,李铜铃,孙健,等.2-羟丙基-β-环糊精对尼扎替丁的包合作用[J].华西药学杂志,2005,20(6):523-524.
[10]Harazono A,Kobayashi T,Kawasaki N,et al.A comparative study of monosaccharide composition analysis as a carbohydrate test for biopharmaceuticals[J].Biologicals,2011,39(3):171-180.
[11]Harvey D J.Harvey,Derivatization of carbohydrates for analysis by chromatography,electrophoresis and mass spectrometry[J]. Journal of Chromatography B,2011,879(17-18):1196-1225.
[12]Yan X,Evenocheck H M.Chitosan analysis using acid hydrolysis and HPLC/UV[J].Carbohydrate Polymers,2012,87(2):1774-1778.
[13]Stepan H,Staudacher E.Optimization of monosaccharide determination using anthranilic acid and 1-phenyl-3-methyl-5-pyrazolone for gastropod analysis[J].Analytical Biochemistry, 2011,418(1):24-29.
[14]Guan Y,Tian Y,Li Y,et al.Application of a liquid chromatographic/tandem mass spectrometric method to a kinetic study of derivative glucosamine in healthy human urine[J].Journal of Pharmaceutical&Biomedical Analysis,2011,55(1):181-186.
[15]Eikenes M,Fongen M,Roed L,et al.Determination of chitosan in wood and water samples by acidic hydrolysis and liquid chromatography with online fluorescence derivatization[J].Carbohydrate Polymers,2005,61(1):29-38.
[16]曾茂法,李俊,王英瑛,等.D-氨基葡萄糖硫酸钾盐含量测定方法探讨[J].中国现代应用药学,2008,25(3):251-254.
[17]姜红,但晓梦,胡远华,等.HPLC-RID法测定氨基葡萄糖的含量[J].中国药品标准,2013,14(4):259-263.
[18]郑家概,王飞,农云军,等.氨基葡萄糖盐酸盐含量的HPLC柱前衍生法测定[J].分析测试学报,2009,28(9):1081-1083.
[19]王英瑛,李俊,曹苏.氨基葡萄糖3种含量测定方法的比较[J].中国现代应用药学,2009,26(4):307-309.
[20]杨岚,李铜铃,黄婷,等.RP-HPLC测定盐酸氨基葡萄糖片的含量[J].华西药学杂志,2005,20(3):259-260.
[21]杨华良,雷勇胜.HPLC法测定盐酸氨基葡萄糖颗粒中盐酸氨基葡萄糖的含量[J].天津药学,2011,23(6):17-19.
[22]陈金东,李蔚.滴定分析法和分光光度法测定保健食品中D-氨基葡萄糖盐酸盐含量的研究[J].中国卫生检验杂志,2002, 12(2):143-144.
[23]刘玥,刘晓兰,周利敏,等.DNS法测定D-氨基葡萄糖含量方法的研究[J].中国调味品,2014(10):89-93.
Analysis of glucosamine in glycosylated whey protein-glucosamine using reversed-phase high-performance liquid chromatography
ZHANG Yinghua,LIU Yanle,LIU Tianshu,ZHU Min(School of Food Sciences,Northeast Agricultural University,Harbin 150030,China)
Glucosamine in glycosylated whey protein was released hydrochloric acid hydrolysis. The RP-HPLC separation was performed on anEliteC18(Hypersil ODS25 μm 4.6 mm×250 mm)utilizing an isocratic elution of acetic acid sodium acetate buffer solution(containing 68%0.025 mol·L-1pH 3.6)and methyl alcohol(containing 32%)as the mobile phase at a flow rated of 1 mL·min-1.Injiction volume and column temperature were set at 10 μL and 35℃.The results indicate that the linear ranage was from 0.1 to 100 μg·mL-1for glucosamine and correlation coefficient(R2was greater than 0.99).The average recoveries spiked at the three concentration levels of 0.30,0.50,1.00 mg ranaged between 88.05%and 110.79%with the relative standard deviations from 1.22%to 5.92%.The limit of detection was 0.02 μg·mL-1.Content of glucosamine in glycosylated whey protein was 2.03 mg·g-1.Therefore, this method had the characteristics of simple operation,high reproducibility and sensitivity,It could be widely applied to determine glucosamine in glycosylated protein.
TS252.7
A
1005-9369(2017)05-0058-07
时间2017-5-23 12:38:37[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170523.1238.016.html
张英华,刘艳乐,刘天舒,等.RP-HPLC测定乳清蛋白糖基化产物中的氨基葡萄糖[J].东北农业大学学报,2017,48(5):58-64.
Zhang Yinghua,Liu Yanle,Liu Tianshu,et al.Analysis of glucosamine in glycosylated whey protein-glucosamine using reversed-phase high-performance liquid chromatography[J].Journal of Northeast Agricultural University,2017,48(5):58-64. (in Chinese with English abstract)
2017-03-15
国家自然科学基金(31201453)
张英华(1974-),女,教授,博士,研究方向为食品科学与工程。E-mail:yhzhang2000@126.com
