巨大芽孢杆菌对杂交鲟消化酶活性和肠道形态影响
2017-06-22徐奇友王金革王连生王常安李晋南赵志刚罗亮都雪李伟忠
徐奇友,王金革,王连生,王常安,李晋南,赵志刚,罗亮,都雪,李伟忠
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306;3.潍坊学院,山东潍坊261061)
巨大芽孢杆菌对杂交鲟消化酶活性和肠道形态影响
徐奇友1,2,王金革1,2,王连生1,王常安1,李晋南1,赵志刚1,罗亮1,都雪1,李伟忠3
(1.中国水产科学研究院黑龙江水产研究所,哈尔滨150070;2.上海海洋大学水产与生命学院,上海201306;3.潍坊学院,山东潍坊261061)
研究旨在探讨植物蛋白源饲粮基础上添加巨大芽孢杆菌对杂交鲟(Acipenser schrenckii♀×Acipenser baeri♂)幼鱼消化酶活性和肠道形态结构的影响。以鱼粉(FM)组和植物蛋白源(PM)组为对照,试验Ⅰ、Ⅱ、Ⅲ组分别在PM组基础上添加105、106和107cfu·g-1巨大芽孢杆菌。选用初始平均体重为(12.87±0.65)g杂交鲟625尾,随机分成5组,每组设置5个平行。结果表明,试验Ⅰ组肠道蛋白酶和脂肪酶活性显著高于PM组(P<0.05),与FM组无显著差异(P>0.05)。试验Ⅰ、Ⅱ、Ⅲ组幽门盲囊和瓣肠淀粉酶活性显著高于PM组(P<0.05),与FM组无显著差异(P>0.05)。试验Ⅰ组胃脂肪酶、淀粉酶活性和十二指肠绒毛高度显著高于其他组(P<0.05)。试验Ⅰ组瓣肠绒毛高度和褶皱深度显著高于PM组(P<0.05),与FM组无显著差异(P>0.05),其肌层厚度显著高于其他各组(P<0.05)。综上,植物蛋白源饲粮中添加适宜水平巨大芽孢杆菌可增强杂交鲟幼鱼机体消化酶活性并改善肠道形态,巨大芽孢杆菌适宜添加水平为105cfu·g-1。
杂交鲟;巨大芽孢杆菌;消化酶;肠道形态
芽孢杆菌是普遍存在于养殖环境中的腐生革兰氏阳性菌,通过摄食行为进入动物胃肠道,与宿主形成共生关系,维持消化道微生态平衡,具有提高机体免疫力、促进消化、改善肠道形态、提高饲粮利用率等作用[1-2],不利环境下以孢子形式存在,稳定性好、耐高温、挤压和温度变化,耐受配合饲粮制作条件。具有无残留、无毒副作用、无抗药性、环境友好等特点,成为生理学、免疫学和营养学等学科研究热点[3]。
Kozasa首次将芽孢杆菌应用于水生动物,效果良好[4],芽孢杆菌在水产养殖领域研究应用受到关注[5]。Aly等试验表明,饲粮中添加芽孢杆菌可改善水生动物肠道形态、显著提高非特异性免疫能力和消化酶活性[6-8]。目前,巨大芽孢杆菌(Bacillus megaterium)研究主要集中在菌株筛选、有机物及氮代谢能力[9-11]及作为益生菌在水产养殖水体中应用等方面[12-13]。
马恒甲等研究表明,高植物蛋白源饲粮影响水产动物消化酶活性和生长性能[14-15],饲粮中加入适量芽孢杆菌可增强养殖动物机体消化酶活性并促进其健康生长[16-17]。本研究在植物蛋白源饲粮基础上添加不同水平巨大芽孢杆菌,探讨其对杂交鲟幼鱼消化酶活性和肠道形态影响,为巨大芽孢杆菌在鲟鱼植物蛋白源饲粮中的应用提供科学依据。
1 材料与方法
1.1 材料
由黑龙江水产研究所养殖室水产养殖底泥中分离获得巨大芽孢杆菌菌株,经30℃、180 r·min-1振荡培养菌液。使用前平板计数法测定制剂中巨大芽孢杆菌数目。
1.2 试验设计及饲粮
挑选体格健壮、规格整齐杂交鲟幼鱼(购自中国水产科学研究院鲟鱼繁育技术工程中心)1 500尾,暂养并驯化2周,暂养时投喂植物蛋白源饲粮,2周后选用初体重为(12.87±0.65)g杂交鲟625尾,随机分为5组,每组设5个平行,试验周期为56 d。以褐鱼粉、豆粕、豆油和鱼油等为主要原料配制鱼粉蛋白源饲粮(FM组),以大豆浓缩蛋白、豆粕、豆油和鱼油等为主要原料配制植物蛋白源饲粮(PM组),配方原料组成见表1。
由表1可知,在植物蛋白源饲粮基础上,分别加入105(Ⅰ组)、106(Ⅱ组)、107cfu·g-1(Ⅲ组)巨大芽孢杆菌配制5种试验用饲粮。饲粮原料粉碎过40目筛,按配方比例称重后混合均匀,加入油脂后与水或巨大芽孢杆菌、水混合物充分混匀,制粒机制作粒径适宜饲粮,室温风干,装袋后保存于-20℃冰箱。
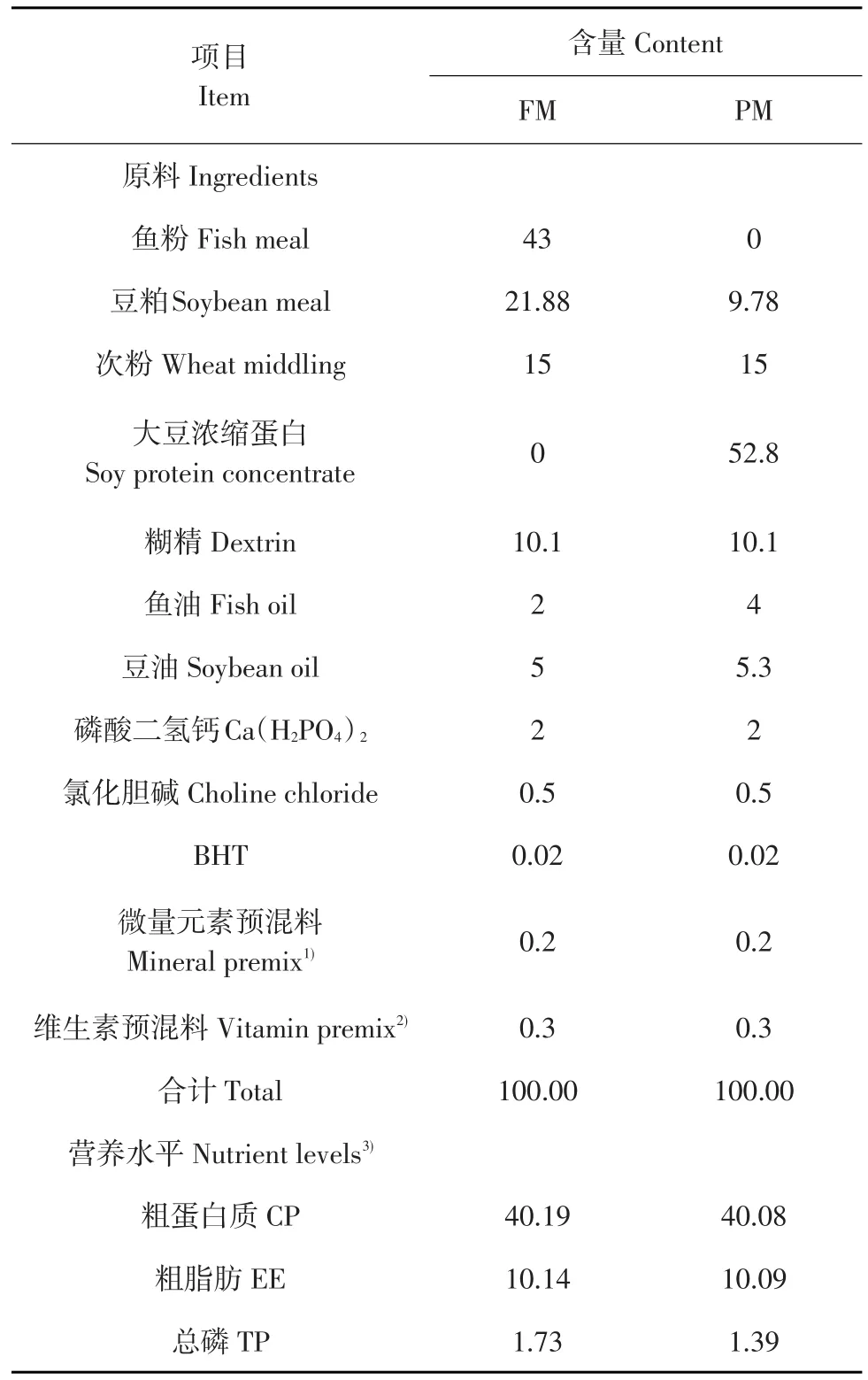
表1 基础饲粮组成及营养水平(干物质基础)Table 1Composition and nutrient levels of the basal diet(DM basis)(%)
1.3 饲养管理
在25个160 L可控温循环式水族箱内饲养,水温控制(21±0.5)℃,试验期间每天7:00、12:00、17:00饱食投喂,及时吸取残饵和粪便,每周更换箱内2/3水量,两天检测1次水质,溶氧>5 mg·L-1,pH 7.9~8.3,氨氮浓度≤0.05 mg·L-1。自然光照,每天记录杂交鲟幼鱼摄食和死亡情况。
1.4 肠道消化酶活性测定
饲养试验结束后,停止投喂1天,肠胃内容物排空,每缸随机选取3尾鱼,冰盘中快速解剖,取出肝脏、胃、幽门盲囊、十二指肠和瓣肠,冰浴0.86%氯化钠溶液冲洗内容物,滤纸吸去肠道表面水分。按1∶9质量体积比加入配制0.86%氯化钠溶液,试管放入冰盒中FJ-200CL高速匀浆机组织匀浆,4℃4 000 r·min-1离心10 min,组织匀浆上清液用1.5 mL离心管分装,置于-20℃冰箱,测定各组织消化酶活性。
测定蛋白酶活性采用福林-酚(Folin-phenol)法,试验底物为0.5%酪素,将1 mL酶粗提液37℃处理5 min后,添加酪素37℃处理15 min,加入10%三氯乙酸终止反应,离心后取上清液1 mL加入0.55 mol·L-1Na2CO35 mL,1 mL福林-酚试剂,其在碱性环境中不稳定,易被酚类化合物还原,在680 nm波长下,以对照管调零,作比色测定吸光度。淀粉酶和脂肪酶活性试剂盒均购自南京建成生物工程研究所。
1.5 肠道形态测定
养殖试验结束后,每组随机选3尾鱼,冰盘中快速解剖,丁香油完全麻醉后分离十二指肠和瓣肠,0.86%氯化钠溶液冲洗内容物,Bouin氏液中固定24 h,经乙醇逐级脱水、二甲苯透明、石蜡包埋、切片(5 um)、苏木精-伊红(H.E.)染色、脱水、透明、中性树脂封片。Leica MD-4000B拍照,Motic Images Plus 2.0测量样本长度,每段样品均测量15个以上绒毛高度、绒毛宽度、肌层厚度和褶皱深度,取平均值。
1.6 统计分析
试验数据采用平均值±标准差表示,SPSS 19.0软件单因素方差分析(one-way ANOVA)作数据处理,Duncan氏法作显著性检验,差异显著性水平设为P<0.05。
2 结果与分析
2.1 巨大芽孢杆菌对杂交鲟幼鱼蛋白酶活性影响
巨大芽孢杆菌对杂交鲟幼鱼各组织蛋白酶活性影响见表2,结果表明,试验Ⅰ组十二指肠和瓣肠蛋白酶活性显著高于PM组(P<0.05),与FM组无显著差异(P>0.05);试验Ⅰ组和Ⅱ组胃蛋白酶活性显著高于PM、FM组(P<0.05);试验Ⅰ组胃、幽门盲囊、十二指肠和瓣肠蛋白酶活性高于试验Ⅱ、和Ⅲ组,但差异不显著(P>0.05);各试验组肝脏蛋白酶活性均无显著性差异(P>0.05)。
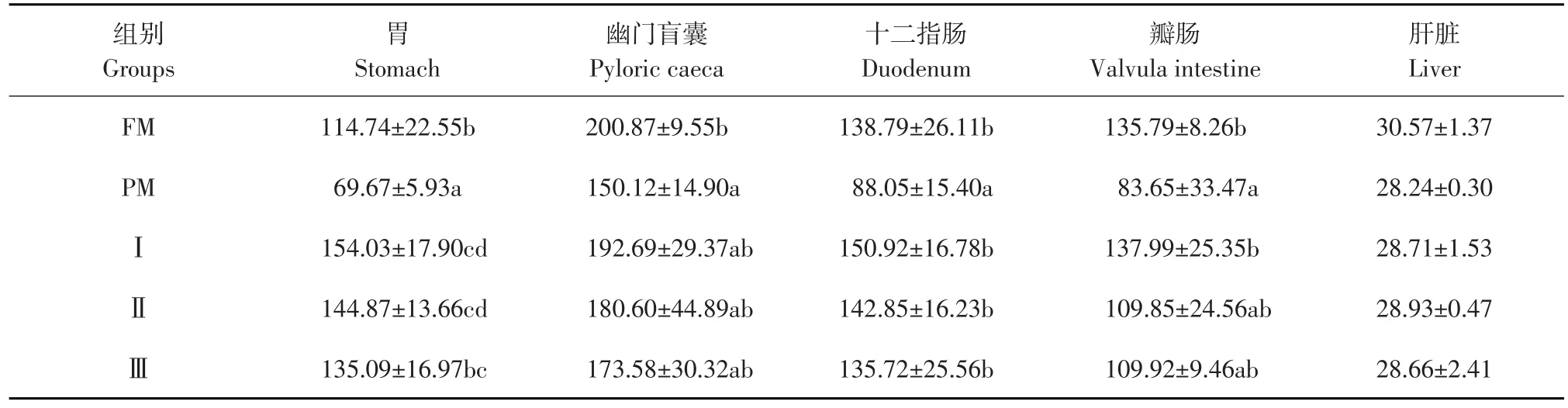
表2 巨大芽孢杆菌对杂交鲟幼鱼蛋白酶活性影响(n=5)Table 2Effect of Bacillus megaterium on protease activity of juvenile hybrid sturgeon(U·g-1prot)
2.2 巨大芽孢杆菌对杂交鲟幼鱼淀粉酶活性影响
巨大芽孢杆菌对杂交鲟幼鱼各组织淀粉酶活性影响见表3,结果表明,试验Ⅱ组胃、幽门盲囊、十二指肠和瓣肠淀粉酶活性显著高于PM组(P<0.05),与FM组无显著性差异(P>0.05);试验Ⅰ组胃淀粉酶活性显著高于其他各组(P<0.05);试验Ⅰ组幽门盲囊淀粉酶活性高于试验Ⅱ、Ⅲ组,但无显著性差异(P>0.05);各试验组间肝脏淀粉酶活性均无显著性差异(P>0.05)。
2.3 巨大芽孢杆菌对杂交鲟幼鱼脂肪酶活性影响
巨大芽孢杆菌对杂交鲟幼鱼各组织脂肪酶活性影响见表4,结果表明,试验Ⅰ、Ⅱ组十二指肠、瓣肠的脂肪酶活性显著高于PM组(P<0.05),与FM组无显著性差异(P>0.05);试验Ⅰ组胃和幽门盲囊脂肪酶活性显著高于其他各组(P<0.05),试验Ⅰ组十二指肠脂肪酶活性高于试验Ⅱ组和Ⅲ组,但无显著性差异(P>0.05);各试验组间肝脏脂肪酶活性均无显著性差异(P>0.05)。

表3 巨大芽孢杆菌对杂交鲟幼鱼淀粉酶活性影响(n=5)Table 3Effect of Bacillus megaterium on amylase activity of juvenile hybrid sturgeon(U·g-1prot)
2.4 巨大芽孢杆菌对杂交鲟幼鱼十二指肠形态影响
巨大芽孢杆菌对杂交鲟幼鱼十二指肠形态影响见表5,结果表明,试验Ⅱ组绒毛高度和褶皱深度显著高于PM组(P<0.05),与FM组无显著性差异(P>0.05);试验Ⅰ组绒毛高度显著高于其他各组(P<0.05);试验Ⅰ组肌层厚度显著高于PM组(P<0.05),且与FM组无显著性差异(P>0.05);各试验组绒毛宽度均无显著性差异(P>0.05)。各组十二指肠切片如图1所示,FM组和试验Ⅰ组的肠绒毛排列整齐紧密,发育良好,且绒毛长度和褶皱深度明显大于PM组。
2.5 巨大芽孢杆菌对杂交鲟幼鱼瓣肠形态影响
巨大芽孢杆菌对杂交鲟幼鱼瓣肠形态影响见表6,结果表明,试验Ⅰ组绒毛高度和褶皱深度显著高于PM组(P<0.05),且与FM组无显著差异性(P>0.05),肌层厚度显著高于PM和FM组(P<0.05);试验Ⅰ组绒毛高度、肌层厚度和褶皱深度显著高于Ⅱ和Ⅲ组(P<0.05);各试验组绒毛宽度均无显著性差异(P>0.05)。
各组瓣肠切片如图2所示,FM和Ⅰ组瓣肠发育良好,绒毛高度和肌层厚度均明显高于其他各组。
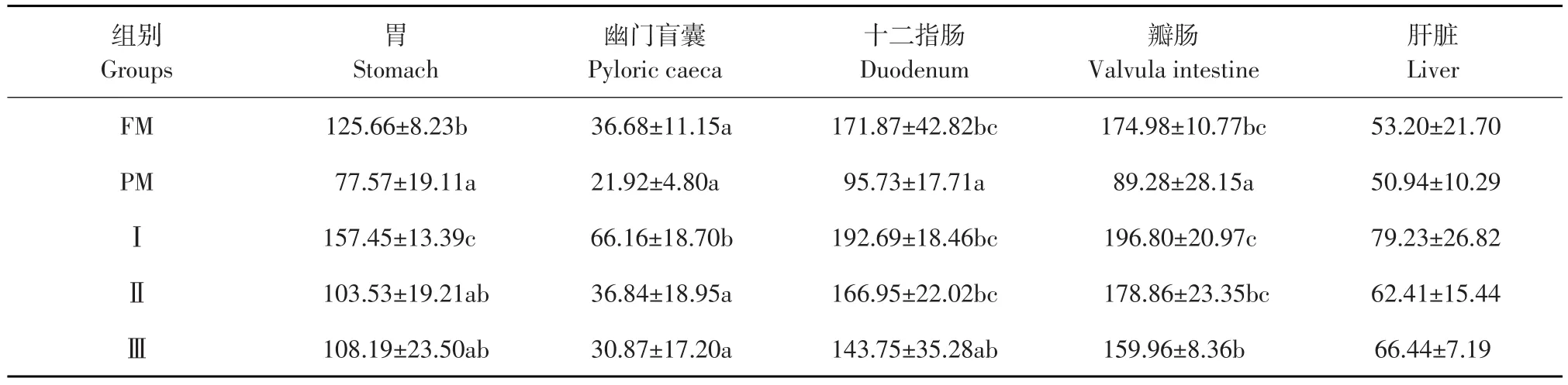
表4 巨大芽孢杆菌对杂交鲟幼鱼脂肪酶活性影响(n=5)Table 4Effect of Bacillus megaterium on lipase activity of juvenile hybrid sturgeon(U·g-1prot)
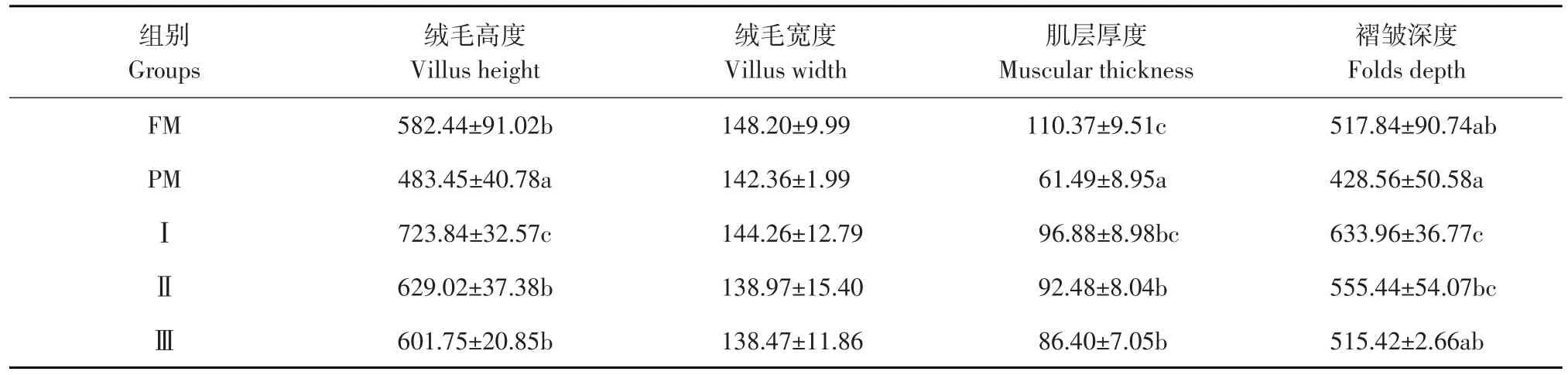
表5 巨大芽孢杆菌对杂交鲟幼鱼十二指肠形态影响(n=5)Table 5Effect of Bacillus megaterium on duodenum morphology of juvenile hybrid sturgeon(μm)
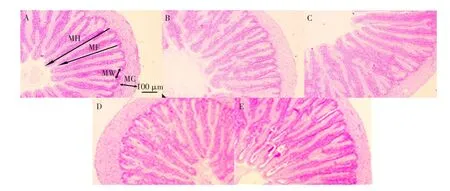
图1 杂交鲟幼鱼十二指肠组织切片Fig.1Tissue slice of duodenum of juvenile hybrid sturgeon
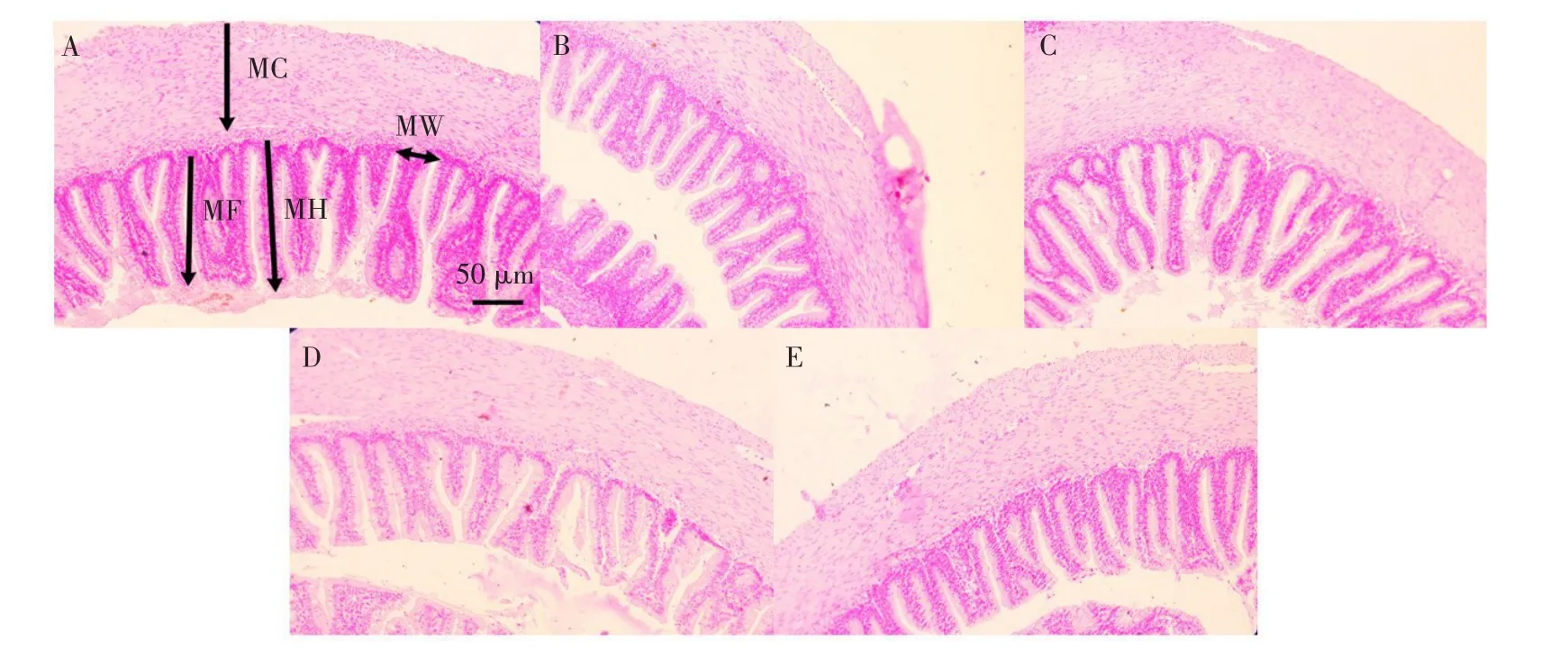
图2 杂交鲟幼鱼瓣肠组织切片Fig.2Tissue slice of valvula intestine of juvenile hybrid sturgeon

表6 巨大芽孢杆菌对杂交鲟幼鱼瓣肠形态影响(n=5)Table 6Effect of Bacillus megaterium on valvula intestine morphology of juvenile hybrid sturgeon(μm)
3 讨论
植物蛋白源含抗营养因子,氨基酸不均衡,适口性差,水产动物对营养物质吸收利用率低[18]。虹鳟(Oncorhynchus mykiss)[19]、埃及鳎(Soleaa aegyptiaca)[20]、大西洋鲑(Salmo salar)[21]等相关研究均有报道。Kaushik等研究表明,大豆蛋白源替代鱼粉饲粮>50%降低虹鳟生长性能[19]。Torstensen等研究表明,植物蛋白源和植物油替代鱼粉和鱼油饲粮投喂大西洋鲑,高替代组特定生长率低于其他组[21]。本试验在饲粮中加入105cfu·g-1巨大芽孢杆菌时,杂交鲟幼鱼十二指肠和瓣肠脂肪酶活性、蛋白酶活性,幽门盲囊和瓣肠淀粉酶活性显著高于PM组。说明饲粮中添加适宜水平巨大芽孢杆菌可促进植物蛋白源吸收和利用,改善动物生长性能,原因是①巨大芽孢杆菌孢子进入动物机体后,在肠道内复苏并繁殖代谢,分泌多种水解酶,进入消化道中,将植物蛋白源饲粮降解,提高饲粮转化率,改善生长性能[22]。沈斌乾等研究表明,将枯草芽孢杆菌添加到饲粮中投喂4.16 g青鱼鱼种56 d,显著提高鱼种后肠蛋白酶和淀粉酶活性[23]。Wang等研究表明,在饲粮中添加1×107cfu·g-1芽孢杆菌投喂6.5 g鲤鱼60 d,显著增强鲤鱼肠道消化酶活性[24]。江永明等报道,将添加3.0×108cfu·g-1枯草芽孢杆菌和凝结芽孢杆菌的饲粮投喂奥尼罗非鱼,显著提高其肝胰脏和胃蛋白酶活性[25]。②巨大芽孢杆菌在鱼类肠道内代谢繁殖,可分泌氨基酸和有机酸,降低肠道pH,促进营养物质尤其是蛋白质消化利用,提高杂交鲟幼鱼植物蛋白质利用率[26]。③巨大芽孢杆菌代谢物可降解植物蛋白源中抗营养因子(如植酸),芽孢杆菌发酵液中存在植酸酶[27-28],降解植酸,释放与其结合蛋白质,抑制内源性消化酶与植酸结合[29],促进杂交鲟幼鱼对植物蛋白质吸收利用。④从肠道切片结果可见,在饲粮中添加105cfu·g-1巨大芽孢杆菌时,十二指肠和瓣肠绒毛高度和褶皱深度显著高于PM组,肠绒毛排列整齐,肠道发育良好,表明添加适宜水平巨大芽孢杆菌可提高消化酶活性,改善肠道形态结构,与王华等在饲粮中添加一定量益生菌,改善动物肠道形态结构结果一致[30]。添加芽孢杆菌均可促进陆生和水生动物肠道发育,改善肠道形态[31-34]。肠绒毛为机体吸收和转运营养物质最重要结构[35]。绒毛高度反映动物肠道与营养物质接触面积及对营养物质吸收利用能力。芽孢杆菌促进肠道蠕动,增强机体对营养物质消化吸收能力[36]。因此,饲粮中加入适量巨大芽孢杆菌可有效防止杂交鲟幼鱼肠黏膜萎缩并维持肠道结构和功能,增强养殖动物机体对营养物质消化和吸收能力,促进植物蛋白质吸收和利用。
本试验结果显示,随着巨大芽孢杆菌添加水平增加,消化酶活性逐渐降低,过量添加导致肠道微生态失衡,机体免疫功能紊乱,改变肠粘膜透性,影响肠道健康发育。沈文英和管越强等发现添加芽孢杆菌量超过一定限度,机体消化酶活性下降[37-38]。原因是鱼类肠道内微生态环境处于动态平衡,添加菌量过多或过少,菌群结构失衡,过量则抑制鱼类机体内源酶活性,减弱对饲料中相应营养成分降解作用,营养物质消化吸收能力降低。
4 结论
a.植物蛋白源饲粮基础上添加适宜水平巨大芽孢杆菌可显著提高杂交鲟幼鱼消化酶活性并改善肠道形态。
b.本试验条件下综合组织消化酶活性和肠道形态指标,巨大芽孢杆菌适宜添加水平为105cfu·g-1。
[1]Nicholson W L.Roles of Bacillus endospores in the environment[J]. Cellular&Molecular Life Sciences Cmls,2002,59(3):410-416.
[2]Merrifield D L,Dimutroglou A,Foey A,et al.The current status and future focus of probiotic and prebiotic application for salmonids[J].Aquaculture,2010,302(1-2):1-18.
[3]郭小华,赵志丹.饲用益生芽孢杆菌的应用及其作用机理的研究进展[J].中国畜牧兽医,2010,37(2):27-31.
[4]Kozasa M.Toyocerin(Bacillus toyoi)as growth promotor foranimal feeding[J].Microbiol Aliment Nutr,1986(4):121-135.
[5]沈文英,傅玲琳,李卫芬.枯草芽孢杆菌表达的VP28对南美白对虾免疫力和抗病毒感染的影响[J].水生生物学报,2012,36 (2):375-378.
[6]Aly S M,Abdelgalil A Y,Abdelaziz G A,et al.Studies on Bacillus subtilis and Lactobacillus acidophilus,as potential probiotics,on the immune response and resistance of Tilapia nilotica(Oreochriomis nilotics)to challenge infections[J].Fish&Shellfish Immunology,2008,25(1-2):128-136.
[7]Ai Q H,Xu H,Mai K S,et al.Effects of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance,survival,non-specific immune response and disease resistance of juvenile large yellow croaker,Larimichthys crocea[J].Aquaculture,2011,317(1):155-161.
[8]Shen W Y,Fu L L,Li W F,et al.Effect of dietary supplementation with Bacillus subtilis on the growth,performance,immune response and antioxidant activities of the shrimp(Litopenaeus vannamei)[J].Aquaculture Research,2010,41(11):1691-1698.
[9]Gonzalez I,Laiz L,Hermosin B,et al.Bacteria isolated from rock art paintings:The case of Atlanterra shelter(south Spain)[J]. Journal of Microbiological Methods,1999,36(1-2):123-127.
[10]Abrusci C,Martin-Gonzalez A,Del A A,et al.Isolation and identification of bacteria and fungi from cinematographic films[J]. International Biodeterioration&Biodegradation,2005,56(1):58-68.
[11]Fisher S H.Regulation of nitrogen metabolism in Bacillus subtilis: vive la difference[J].Molecular Microbiology,1999,32(2):223-232.
[12]侯颖,孙军德,徐建强,等.养殖水体中高效氨氮降解菌的分离与鉴定[J].水产科学,2005,24(10):22-24.
[13]Burkovski A.Ammonium assimilation and nitrogen control in Corynebacterium glutamicum and its relatives:An example for new regulatory mechanisms in actinomycetes[J].FEMS Microbiology Reviews,2003,27:617-628.
[14]马恒甲,叶金云,郭建林,等.全植物蛋白饲料中添加植酸酶对草鱼生长、非特异性免疫及消化酶活力的影响[J].浙江海洋学院学报:自然科学版,2011,30(2):119-125.
[15]郑珂珂,梁萌青,姚宏波,等.在高植物蛋白饲料中添加水解鱼蛋白对牙鲆幼鱼的影响[J].水生生物学报,2011,35(5):829-834.
[16]高欣,盖力强,李美英,等.芽孢杆菌对西伯利亚鲟幼鱼摄食生长和消化率的影响[J].河北师范大学学报:自然科学版,2009, 33(3):377-382.
[17]刘晓勇,张颖,齐茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J].中国水产科学, 2011,18(6):1315-1320.
[18]Francis G,Makkar H P S,Becker K.Antinutritional factors present in plant-derived alternate fish feeding ingredients and their effects in fish[J].Aquaculture,2001,199(3-4):197-227.
[19]Kaushik S,Cravedi J,Lalles J,et al.Partial or total replacement of fish meal by soybean protein on growth,protein utilization, potential estrogenic or antigenic effects,cholesterolemia and flesh quality in rainbow trout,Oncorhynchus mykiss[J].Aquaculture, 1995,133(3):257-274.
[20]Bonaldo A,Roem A J,Pecchini A,et al.Influence of dietary soybean meal levels on growth,feed utilization and gut histology of egyptian sole(Solea aegyptiaca)juveniles[J].Aquaculture, 2006,261(2):580-586.
[21]Torstensen B,Espe M,Sanden M,et al.Novel production of atlanticsalmon(Salmosalar)proteinbasedoncombined replacement of fish meal and fish oil with plant meal and vegetable oil blends[J].Aquaculture,2008,285(1-4):193-200.
[22]李明,双宝,李海涛,等.枯草芽孢杆菌的研究与应用[J].东北农业大学学报,2009,40(9):111-114.
[23]沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J].水生生物学报,2013, 37(1):48-53.
[24]Wang Y B,Xu Z R.Effect of probiotics for common carp (Cyprinus carpio)based on growth performance and digestive enzyme activities[J].Animal Feed Science and Technology,2006, 127(3-4):283-292.
[25]江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1004.
[26]辛娜,刁其玉,张乃锋.芽孢杆菌在动物营养与饲料中的应用[J].中国饲料,2010,14(2):26-29.
[27]徐海燕,曹斌,张志焱,等.芽孢杆菌发酵代谢产物的研究[J].饲料广角,2006(9):22-23.
[28]訾乃涛,常巧玲.植酸酶在水产养殖中的应用研究[J].饲料研究,2005(4):52-55.
[29]宋金彩,单安山.植酸酶对蛋白质和氨基酸利用率的影响[J].中国饲料,2000(10):14-15.
[30]王华,张淑梅,钟颖婷,等.“乳菌宝”益生菌剂对断奶仔猪肠道生理生化指标的影响[J].东北农业大学学报,2013,44(12):27-31.
[31]齐博,武书庚,王晶,等.枯草芽孢杆菌对肉仔鸡生长性能、肠道形态和菌群数量的影响[J].动物营养学报,2016,28(6): 1748-1756.
[32]陈家祥,张仁义,王全溪,等.地衣芽孢杆菌对麻羽肉鸡肠道组织结构及盲肠微生物区系的影响[J].动物营养学报,2010,22 (3):757-761.
[33]邱燕,蔡春芳,代小芳,等.枯草芽孢杆菌对草鱼生长性能与肠道黏膜形态的影响[J].中国饲料,2010(19):34-36.
[34]Cerezuela R,Fumanal M,Tapiapaniagua S T,et al.Changes in intestinalmorphologyandmicrobiotacausedbydietary administration of inulin and Bacillus subtilis in gilthead sea bream (Sparus aurata L.)specimens[J].Fish&Shellfish Immunology, 2013,34(5):1063-1070.
[35]陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015,30 (4):363-368.
[36]李晋南,徐奇友,王常安,等.谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J].动物营养学报,2014, 26(5):1347-1352.
[37]沈文英,余东游,李卫芬,等.地衣芽孢杆菌对三角帆蚌消化酶活性、免疫指标和抗氧化指标的影响[J].动物营养学报, 2009,21(1):95-100.
[38]管越强,周环,张磊,等.枯草芽孢杆菌对中华鳖生长性能、消化酶活性和血液生化指标的影响[J].动物营养学报,2010,22 (1):235-240.
Effect ofBacillus megateriumto plant protein meal on digestive enzyme activity and intestinal morphology of juvenile hybrid sturgeon/
XU Qiyou1,2,WANG Jinge1,2,WANG Liansheng1,WANG Changan1,LI Jinnan1,ZHAO Zhigang1, LUO Liang1,DU Xue1,LI Weizhong3(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.School of Fisheries and Life Science, Shanghai Ocean University,Shanghai 201306,China;3.Weifang University,Weifang Shandong 261061,China)
This experiment was conducted to study the effect of addingBacillus megateriumto plant protein meal on digestive enzyme activity and intestinal morphology of juvenile hybrid sturgeon (Acipenser schrenckii♀×Acipenser baeri♂).The fish in the 3 experimental groups were fed plantprotein meal(group PM)with 105cfu·g-1(groupⅠ),106cfu·g-1(groupⅡ)and 107cfu·g-1Bacillus megaterium(groupⅢ),respectively,taking the fish meal(group FM)and group PM as control groups. A total of 625 hybrid sturgeon with an initial body weight of(12.87±0.65)g were randomly divided into 5 groups with 5 replicates and 25 fish per replicate.The results showed that the protease and lipase activity were significantly higher in intestine in groupⅠcompared with the group PM(P<0.05),and had no significant difference with the group FM(P>0.05).The amylase activity were significantly higher in pyloric caeca and valvula intestine in groupⅠ,groupⅡand groupⅢcompared with the group PM(P<0.05),and had no significant difference with the group FM(P>0.05).The amylase,lipase activity in stomach and the villus height in duodenum were significantly higher in groupⅠcompared with other groups(P<0.05).The muscular thickness were significantly higher in valvula intestine in groupⅠcompared with other groups(P<0.05),the villus height and folds depth were significantly higher compared with the group PM(P<0.05),and had no significant difference with the group FM(P>0.05).In conclusion,the addition ofBacillus megateriumto plant protein meal can promote intestinal morphology development and increase digestive enzyme activity.Under the condition of this experiment,the supplemental level ofBacillus megateriumin diets is suggested to be 105cfu·g-1.
hybrid sturgeon;Bacillus megaterium;digestive enzyme;intestinal morphology
S965.215
A
1005-9369(2017)05-0050-08
时间2017-5-23 12:29:30[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170523.1229.012.html
徐奇友,王金革,王连生,等.巨大芽孢杆菌对杂交鲟消化酶活性和肠道形态影响[J].东北农业大学学报,2017,48(5):50-57.
Xu Qiyou,Wang Jinge,Wang Liansheng,et al.Effect ofBacillus megateriumto plant protein meal on digestive enzyme activity and intestinal morphology of juvenile hybrid sturgeon[J].Journal of Northeast Agricultural University,2017,48(5):50-57.(in Chinese with English abstract)
2016-03-28
黑龙江水产研究所基本科研项目(HSY201407);国家公益性行业(农业)专项(201003055);潍坊学院青年科研基金项目(2012Z19);现代农业产业技术体系建设专项(CARS-46)
徐奇友(1969-),男,研究员,博士,硕士生导师,研究方向为水生动物营养学。E-mail:xuqiyou@sina.com
