死亡时间对雌性仔猪脑海马组织影响
2017-06-22包军张名岳李想刘洪贵李剑虹高利张晓卉王博
包军,张名岳,李想,刘洪贵,李剑虹,高利,张晓卉,王博
(1.东北农业大学动物科学技术学院,哈尔滨150030;2.东北农业大学生命科学学院,哈尔滨150030;3.东北农业大学动物医学学院,哈尔滨150030;4.哈尔滨工业大学校医院,哈尔滨150001)
死亡时间对雌性仔猪脑海马组织影响
包军1,张名岳1,李想1,刘洪贵1,李剑虹2,高利3,张晓卉2,王博4
(1.东北农业大学动物科学技术学院,哈尔滨150030;2.东北农业大学生命科学学院,哈尔滨150030;3.东北农业大学动物医学学院,哈尔滨150030;4.哈尔滨工业大学校医院,哈尔滨150001)
为研究母猪脑海马死亡后变化情况,试验以同一遗传背景(杜×长×大)、体重及出生日龄相近的健康雌性仔猪作研究对象,采用核磁共振成像检测及光镜技术,检测母猪麻醉状态与死后10 min、1、2、3、6和10 h时段左侧、右侧海马体积,观察两侧海马齿状回区颗粒细胞形态,建立母猪死后海马形态学变化模型,为长期处于应激状态下妊娠母猪心理疾病的核磁共振诊断提供理论依据。核磁检测结果表明,仔猪死亡10 h内,与活体对照组海马体积比较,左侧海马体积无显著变化(P=0.901);右侧及总海马体积在死亡3 h内无显著性变化(右侧P= 0.078;总P=0.104),但从死亡6 h开始显著变小(右侧P<0.01;总P<0.05);光镜观察表明,仔猪死亡3 h内,左侧及右侧海马齿状回区颗粒细胞形态与活体对照组相比,均未发生严重损害。死亡3 h内,仔猪脑海马组织无显著生理变化。
核磁共振成像;雌性仔猪;海马体积;颗粒细胞;死亡时间
集约化生产可提高畜禽生产力水平和经济效益。但过于注重简化管理、降低成本和提高生产效率,会严重抑制动物本能行为,造成慢性及急性应激反应,畜禽体质下降,降低生产性能、畜禽福利及畜产品品质,危害人类健康。在猪养殖方面,妊娠母猪限位饲养易形成慢性应激[1],长期限位饲养可导致妊娠母猪无法正常表达行为与动机[2],影响母猪行为、生理和心理[3-5],严重危害母猪福利状况[6-8]。
研究表明,应激是引起人类心理疾病(抑郁症)主要病因[9-10],造成脑部结构改变[11-13]。其中脑海马体是最易受应激损害的脑部边缘系统组织,应激导致抑郁类心理疾病表现为海马神经元萎缩,海马体积减小[8]。Lv等研究发现,长期限位饲养妊娠母猪脑海马体等区域的神经细胞呈明显炎症反应[14]。Staay等研究结果表明,长期慢性应激导致母猪产生类似人类抑郁症状[8]。核磁共振成像技术(MRI)是检测因心理类疾病(如抑郁症、焦虑症、阿尔兹海默病等)导致脑组织结构异常的重要手段[15]。长期限位饲养的妊娠期经产母猪易出现类似抑郁的心理疾病,但因体积、体重过大,难以完成核磁共振成像检测。因此,本文探讨在短时间内将母猪头部取下作离体核磁共振检测,替代活体状态检测的可行性[16]。
本试验以体型和体重较小雌性仔猪为研究对象,采用核磁共振检测及光镜技术,检测母猪麻醉状态与死后10 min、1、2、3、6和10 h时段左侧、右侧海马组织体积,观察海马齿状回区颗粒细胞形态,建立母猪死后海马形态学变化模型,为长期处于应激状态下妊娠母猪心理疾病的核磁共振诊断提供理论依据。
1 材料与方法
1.1 仔猪选择与麻醉
试验用雌性仔猪购自东北农业大学畜牧科技园区,遗传背景相同(杜×长×大),体重(10 kg±2.5)及出生日龄(20 d±2)相近,相同福利型产圈中饲养,饲养标准一致。
随机选择3头健康试验仔猪,肌肉注射麻醉剂(由东北农业大学动物医学学院提供)在3~5 min内将仔猪麻醉(剂量为0.01 mL·kg-1),无应激状态运至哈尔滨工业大学医院作核磁共振检测。待深度麻醉后,将其平放在操作台上,保证检测对象头部垂直于机器冠状面[17]。
1.2 核磁共振检测
核磁检测使用飞利浦1.5T核磁共振仪(飞利浦医学系统,德国),采取脑部冠状面T1W-IR CLEAR序列扫描,扫描层数24层,层厚3 mm;层间距0;扫描参数为:TR=1 838 ms,TE=15 ms,翻转角90°,体素尺寸=0.83 mm×1.04 mm×3 mm,NSA=1,FOV(视野)=200 mm×187 mm×72 mm,矩阵体积=240 mm×175 mm×208 mm,图像以DICOM格式传至电脑作体积描绘与计算。于矢状面T1WI定位相,选择海马体显示最佳层面,扫描线垂直海马体长轴,从颞极到海马体尾后方范围,垂直于海马体长轴倾斜冠状面液体衰减反转恢复序列(FLAIR)T2WI成像,成像参数为TR=8 000 ms,TI=1 700 ms,TE=125 ms,NSA=3,层厚3 mm,无间隔,层数24。
每个离体检测时段,随机选取3头仔猪,待麻醉后立即安乐处死,迅速取下头部,血迹处理完毕后分别于死后10 min,1、2、3、6和10 h内作离体脑部核磁共振检测,检测方法、参数选择与活体检测均保持一致。检测等待期,猪头部置于8℃恒温冷藏间保存[18]。
1.3 体积计算
运用Philips DICOM Viewer(R2.5版)中ROI体积分析功能。打开矢状面、冠状面、横轴面及斜冠状面4个视窗,调节窗宽、窗位至灰白质对比明显,用鼠标按照上述标准结合矢状面、冠状面、轴面三维图像在斜冠状面上逐层勾画海马体边界[19-20]。由一名经训练具备猪脑部解剖学知识的神经影像学家统一评定。评定程序约30 min,两次重复。获得被试海马组织体积原始数据后,为消除头颅体积差异对上述结构体积数据影响,需标准化校正海马组织原始体积。颅腔内体积是较好校正因素[21]。通过颅腔内径线可推算颅腔内体积[22],本研究通过前后径(在T2WI轴面及矢状面上经大脑前后联合线(AC-PC线)连接额极与枕极颅骨内板间距离)、上下径(在T2WI轴面及矢状面上,以枕骨大孔前下缘为定点,经AC-PC线中点至顶骨内板间距离)和左右径(在AC-PC线层面的水平面上,垂直于该线经中点至左、右两侧颅骨内板间距离)的乘积推算颅腔内体积(见图1)。
按Cendes等提出计算方法(下简称Cendes法)对原始数据作标准化处理V标=V原×V均/Vn。其中,V标为海马体标准化后体积;V原为海马体原始体积;V均为平均颅腔体积;Vn为被测颅腔体积。然后再比较标准化后海马体积。

图1 颅腔内部径线Fig.1Diameter parameters of cranial cavity
1.4 齿状回区细胞形态学检测
核磁共振检测完毕后立即解剖取脑,取0.5 g海马齿状回组织置于装有4%多聚甲醛固定液EP管中,4°C冰箱过夜,脑组织包埋在石蜡中(BMJ-Ⅲ型包埋机,常州中威仪器公司),切成5 um厚切片(石蜡切片机,Leica RM2125-RTS,徕卡生物医用公司,德国),在二苯甲中脱蜡,浸入一系列等级乙醚中(100%,95%,85%和75%)水化,用中性胶封片,利用光学显微镜观察。
1.5 数据统计
SPSS 23.0软件作统计分析(IBM公司,Chicago,USA),所得左侧、右侧及总海马体积数据采用非参数检验下的柯尔莫诺夫-斯米尔诺夫检验过程作正态检验,用均值比较下的单因素方差分析检验死亡时间对海马体积影响,采用Duncan's多重检验法比较各死亡时段与活体麻醉状态海马体积,设定显著水平P=0.05。
2 结果与分析
由图2~4可知,与活体状态相比,各死亡时段仔猪脑颅腔体积无显著性变化(P=0.342);随着死亡时间增加(死亡10 h内),母猪左侧海马体积呈先增后减趋势,但与活体状态相比,未发生显著变化(P=0.108);而右侧及总海马体积则显著减小(右侧P<0.05;总P<0.05)。其中,与活体状态相比,死亡6 h后,右侧海马体积极显著减小(P<0.01),死亡10 h后,总海马体积显著减小(P<0.05)。采用Philips DICOM Viewer程序,根据猪脑部解剖学经验及手工测量法,在每一层出现海马体的脑斜冠状位核磁共振成像图像中勾画海马体轮廓(见图5)。
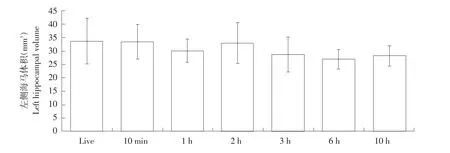
图2 死亡时间对左侧海马体积影响Fig.2Effect of postmortem interval on the left hippocampal volume
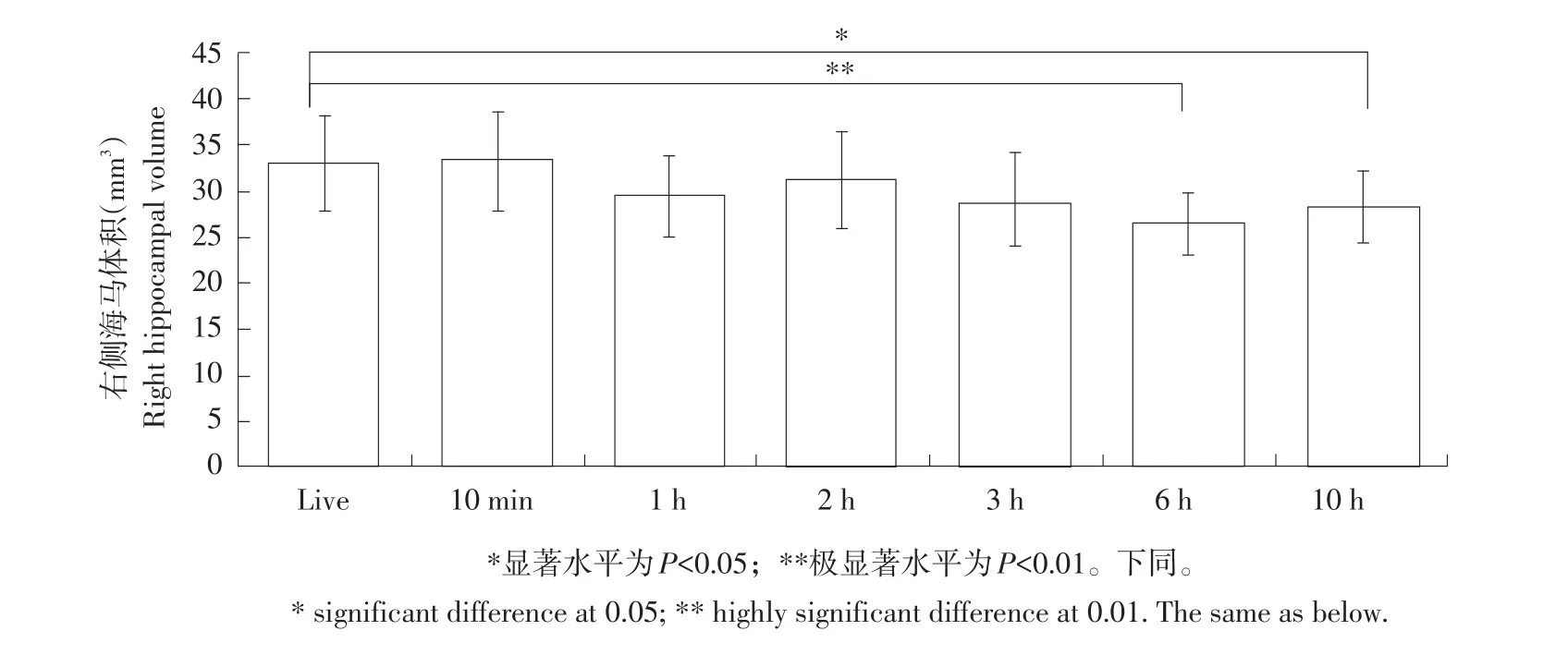
图3 死亡时间对左侧海马体积影响Fig.3Effect of postmortem interval on the right hippocampal volume

图4 死亡时间对总海马体积影响Fig.4Effect of postmortem interval on the total hippocampal volume
比较活体状态冠状面液体衰减反转恢复序列(FLAIR)和T2加权像快速自旋回波序列扫描(T2WTSE)检测结果表明,各死亡时段脑部未发现海马体硬化迹象。由光镜结果可知,死亡3 h内,左侧及右侧海马体齿状回区颗粒细胞形态和数量均无明显变化(见图6、7),但死亡6 h后,右侧海马体齿状回区颗粒细胞数量明显减少,出现大量空泡现象,死亡10 h时段最明显(见图7)。
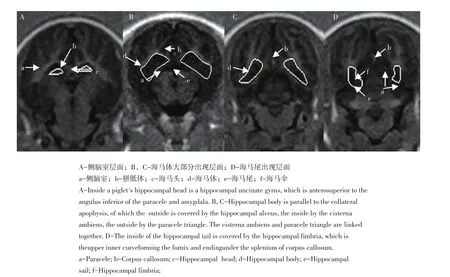
图5 海马体冠状面T1W-IR CLEAR扫描图像变化Fig.5Coronal plane of hippocampals scaning by T1W-IR CLEAR
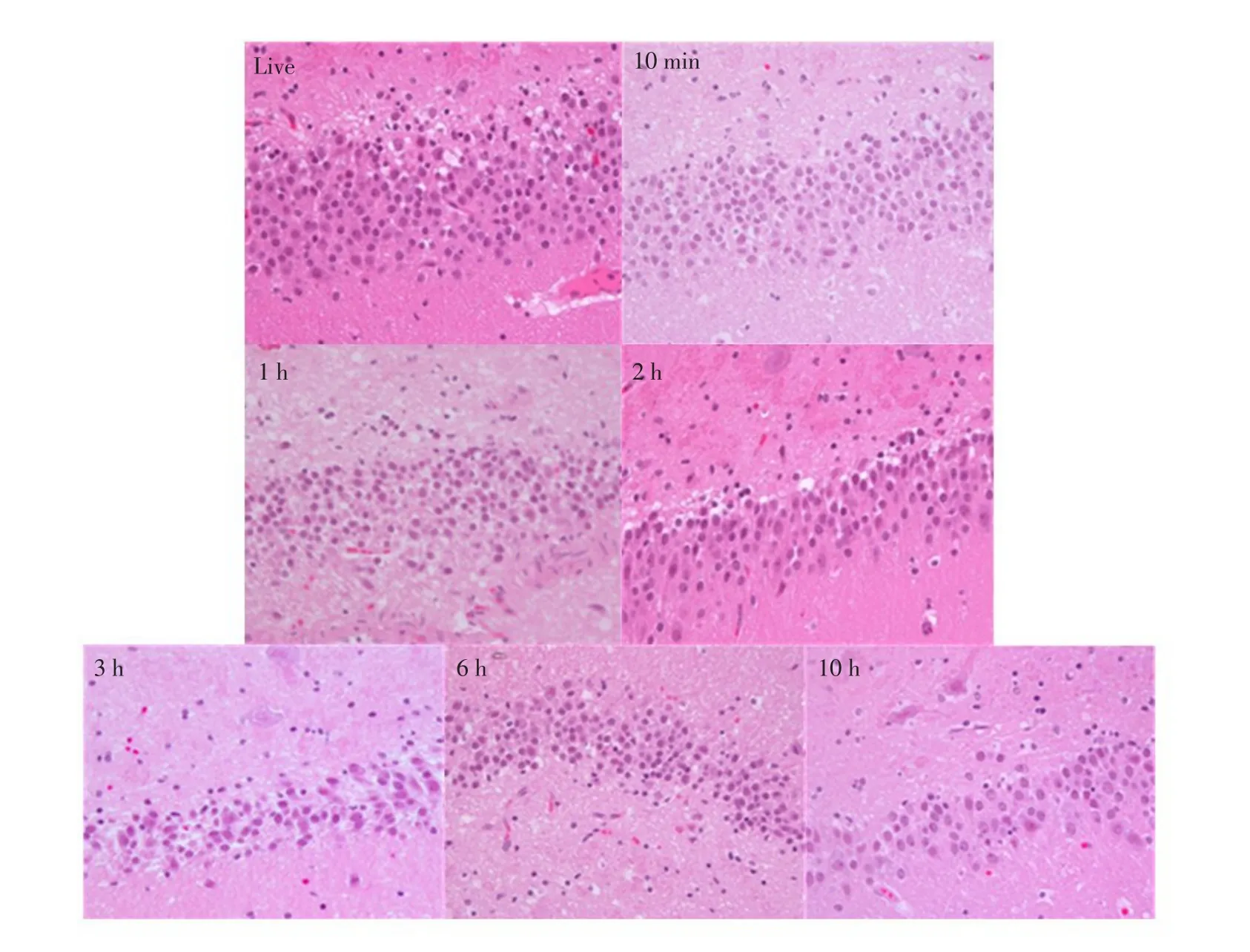
图6 死亡时间对左侧海马体齿状回区颗粒细胞形态学的光镜观察(100倍)Fig.6Effect of postmortem interval on granule cells morphology structure in the left hippocampal DG region(×100)
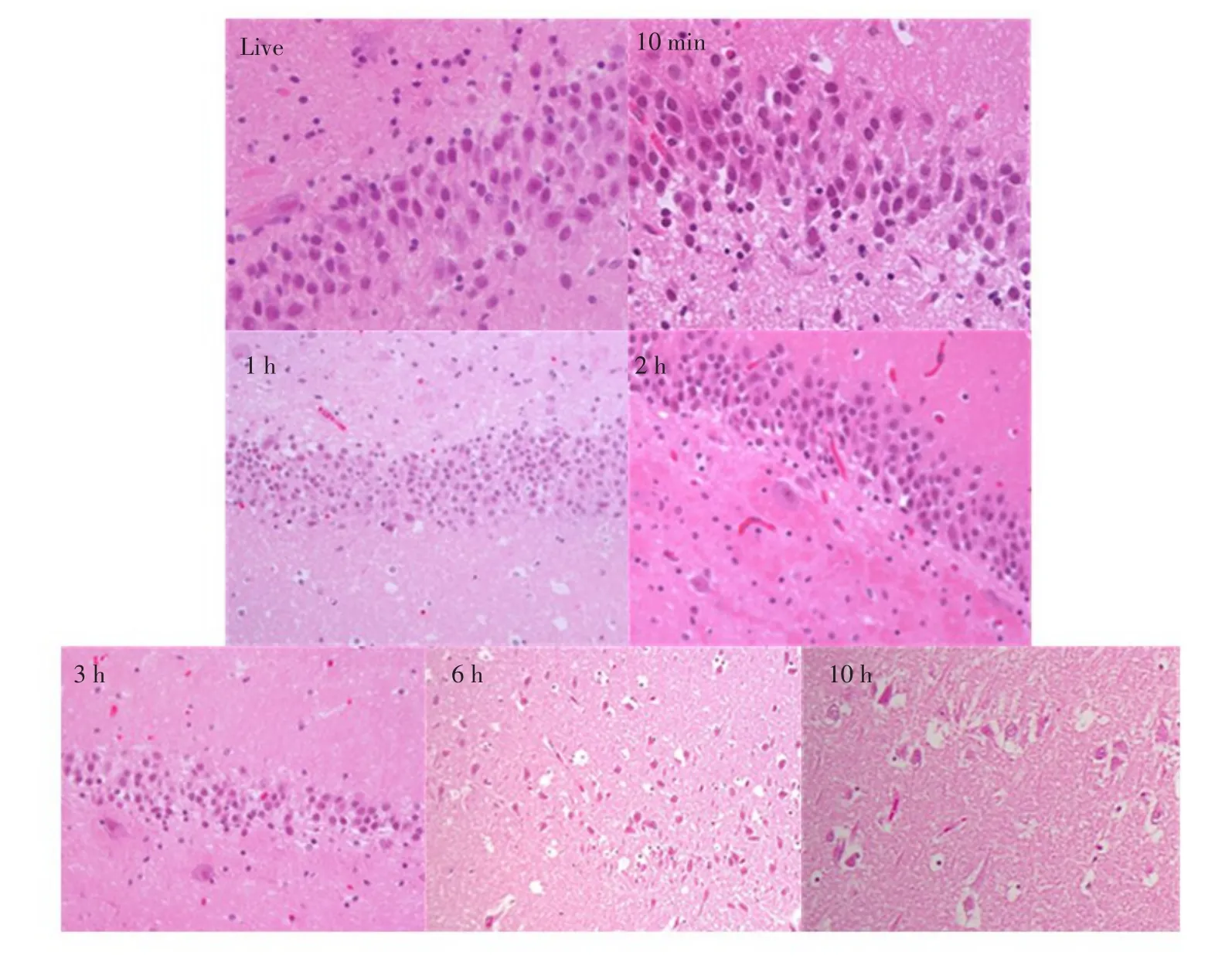
图7 死亡时间对右侧海马体齿状回区颗粒细胞形态学的光镜观察(100倍)Fig.7Effect of postmortem interval on granule cells morphology structure in the right hippocampal DG region(×100)
3 讨论
仔猪死后脑海马体积变化主要原因有内在生理和外在环境两方面。本研究发现,随着死亡时间延长,无论是仔猪左侧、右侧还是总海马体积均逐渐减小,说明血液循环停止后,体内缺乏氧气,细菌滋生造成脑细胞逐渐死亡并发生系列复杂化学及生物反应,符合死亡后尸体腐化规律。而仔猪死亡2 h,海马体积突然变大,但变化不明显,原因是随着脑脊液流失,尸僵现象逐渐缓解。仔猪死亡3 h内,左侧、右侧及总海马体积与活体状态相比,均未发生显著性改变,且在该段时间内,通过光镜观察海马体齿状回区颗粒细胞形态学变化发现,细胞形态及数量无显著性改变。说明死亡3 h内,外界环境未对海马体积造成明显生理损害,说明颅骨对颅腔内脑组织有暂时保护作用,外界环境变化不会在短时间内对脑组织造成显著影响[16]。
另外,年龄增加及由应激引起神经疾病导致脑海马体积减小[23]。其中,以海马体硬化为基本症状的疾病(如癫痫等)海马体积显著改变。因为海马体硬化主要病理特征是神经元丢失[24],海马体积萎缩,核磁共振成像表现为海马体积减小[25]。为排除内在神经类疾病对脑海马体积变化影响,本试验在常规TSE、IR序列核磁共振检测基础上加入FLAIR序列检测。结果表明,在所有海马体MRI图像中,与活体相比,无论是左侧还是右侧海马体在各死亡时段均未发现硬化等疾病症状、海马体内部解剖结构细节也无明显变化。但在细胞层面上,从仔猪死亡6 h开始,右侧海马体齿状回区颗粒细胞形态和数量均发生明显病理性改变。
与活体状态仔猪海马体积相比,左侧海马体积在死亡10 h内未发生明显改变,而右侧海马体积在死亡3 h内变化不明显,死亡6 h后变化较大。说明个体死后血液输送氧气途径中断造成脑组织缺氧,大脑神经细胞和胶质细胞死亡,脑组织发生软化、液化,但本试验中左侧与右侧海马体积变化趋势不一致,原因是死亡缺氧时间不足,左侧海马神经细胞未完全死亡。但与活体状态MRI图像相比,在每一层海马体MRI图像上均未发现明显解剖学细节改变,推测与海马体功能性MRI的T1和T2信号变化有关。功能性MRI检测本试验尚未涉及。Gyorffy-Wagner等应用质子磁共振(MR)技术观察猪离体脑组织随时间延长其弛张时间T1规律性试验发现,死亡96 h内,猪脑组织T1信号未随死亡时间增加而发生明显改变[18]。而Jelsing等麻醉后仔猪脑部MRI检测与死后不同时段脑部各组织物理切片显微镜观察对比试验发现,从死亡到观察结束(30 min~1 h),包括全脑、大脑皮质、脑白质、脑灰质及小脑,无论是MRI活体还是死后检测,体积均无显著性变化[26],证明基于MRI技术的脑部体积计算与死亡后物理切片脑组织体积计算结果一致。
由于条件有限,本试验未作海马体功能性核磁共振成像(fMRI)检测。目前在体积分析MRI应用中,运用计算机软件技术,基于体素的海马体形态学分析以及图谱自动分割法测量海马体积方法,在人类脑神经影像学领域发挥重要作用。后续研究将在猪海马体积分析中运用计算机自动分割技术,提高运算速度、精度。
综上所述,本试验在死亡时间3 h内、尸体头部处理得当情况下,死亡并未对仔猪脑部海马组织造成明显生理性损害。
[1]Schouten W G,Wiepkema P R.Coping styles of tethered sows[J]. Behavioural Processes,1991,25(2-3):125-132.
[2]Marchant J N,Broom D M.Factors affecting posture changing in loose-housed and confined gestating sows[J].Animal Science, 1996,63(3),477-485.
[3]Averós X,Brossard L,Dourmad J Y,et al.Quantitative assessment of the effects of space allowance,group size and floor characteristics on the lying behaviour of growing-finishing pigs[J]. Animal,2010,4(5):777-783.
[4]Antonijevic I A.Depressive disorders-is it time to endorse different pathophysiologies[J].Psychoneuroendocrinology,2006,31(1): 1-15.
[5]Frazer A,Morilak D A.What should animal models of depression model[J].Neuroscience Biobehavioral Review,2005,29(4-5): 515-523.
[6]Broom D M.Indicators of poor welfare[J].British Veterinary Journal,1986,42:438-439.
[7]Broom D M.Relationship between welfare&disease susceptibility in farm animals[C]//Bva Animal Welfare Foundations,1987.
[8]Van der Staay F J,Schuurman T,Hulst M,et al.Effects of chronic stress:A comparison between tethered and loose sows[J].Physiology Behavior,2010,100(2):154-164.
[9]Olff M.Stress,depression and immunity:the role of defense and coping styles.[J].Psychiatry research,1999,85(1):7-15.
[10]Ehlert U,Gaab J,Heinrichs M.Psychoneuroendocrinological contributions to the etiology of depression,posttraumatic stress disorder,and stress-related bodily disorders:the role of the hypothalamus-pituitary-adrenal axis[J].Biological Psychology, 2001,57(1-3):141.
[11]McKittrick C R,Magarinos A M,Blanchard D C,et al.Chronic social stress reduces dendritic arbors in CA3 hippocampus and decreases binding to serotonin transporter sites[J].Synapse,2000, 36(2):85-94.
[12]McLaughlin K J,Baran S E,Wright R L,et al.Chronic stress enhances spatial memory in ovariectomized female rats despite CA3 dendritic retraction:possible involvement of CA1 neurons[J]. Neuroscience,2005,135(4):1045-1054.
[13]Drevets W C,Price J L,Furey M L.Brain structural and functional abnormalities in mood disorders:implications for neurocircuitry models of depression[J].Brain Structure and Function,2008,213(1):93-118.
[14]Lv F L,Li X,Li J H,et al.Morphological changes in hippocampus and prefrontal cortex of confined sows with prolonged pupillary light reflex[J].Journal of Northeast Agricultural University∶English Edition,2016,23(3):39-46.
[15]Sheline Y I.Depression and the Hippocampus:Cause or Effect?[J] Biological Psychiatry,2011,70(4):308-309.
[16]安志远,张晓东,郑吉龙,等.脑组织与法医学死亡时间推断[J].中国法医学杂志,2009,24(4):257-259.
[17]Lind N M,Moustgaard A,Jelsing J,et al.The use of pigs in neuroscience:modelingbraindisorders[J].Neuroscience& Biobehavioral Reviews,2007,31(5):728-751.
[18]Györffy-Wagner Z,Englund E,Larsson E M,et al.Proton magnetic resonance relaxation times T1 and T2 related to postmortem interval.An investigation on porcine brain tissue[J]. Acta Radiologica Diagnosis,1986,27(1):115-118.
[19]Holm I E,West M J.Hippocampus of the Domestic Pig:A stereological study of subdivisional volumes and neuron numbers [J].Hippocampus,1994,4(1):115-126.
[20]Amunts K,Kedo O,Kindler M,et al.Cytoarchitectonic mappingof the human amygdala,hippocampal region and entorhinal cortex: intersubject variability and probability maps[J].Brain Structure and Function,2005,210(5):343-352.
[21]Ryu S Y,Kwon M J,Lee S B,et al.Measurement of Precuneal and Hippocampal Volumes Using Magnetic Resonance Volumetry in Alzheimer's Disease[J].Journal of Clinical Neurology,2010,6 (4):196-203.
[22]Hatipoglu H G,Ozcan H N,Hatipoglu U S,et al.Age,sex and body mass index in relation to calvarial diploe thickness and craniometric data on MRI[J].Forensic Science International, 2008,182(1-3):46-51.
[23]Bartsch T,Wulff P.The hippocampus in aging and disease:From plasticity to vulnerability.[J].Neuroscience,2015,309:1-16.
[24]Falconer M A,Serafetinides E A,Corsellis J A.Etiology andpathogenesis of temporal lobe epilepsy[J].Archives of Neurology,1964, 10(8):233-248.
[25]Ashtari M,Barr W B,Schaul N,et al.Three-dimensional fast low-angle shot imaging and computerized volume measurement of the hippocampus in patients with chronic epilepsy of the temporal lobe[J].American Journal of Neuroradiology,1991,12(5):941-947.
[26]Jelsing J,Rostrup E,Markenroth K,et al.Assessment of in vivo MR imaging compared to physical sections in vitro-a quantitative study of brain volumes using stereology[J].Neuroimage,2005,26 (1):57-65.
Effect of postmortem interval on female piglet hippocampal change/
BAO Jun1,ZHANG Mingyue1,LI Xiang1,LIU Honggui1,LI Jianhong2,GAO Li3,ZHANG Xiaohui1, WANG Bo4(1.School of Animal Science and Technology,Northeast Agricultural University,Harbin 150030,China;2.School of Life Science,Northeast Agricultural University,Harbin 150030,China; 3.School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;4.Hospital, Harbin Institute of Technology,Harbin 150001,China)
In order to study the changes of hippocampus in female piglets during death,in this study,healthy female crossbred piglets(Duroc×Landrace×Large White)with similar age and weight were the experimental animals.The left,right-side and total hippocampal volumes were scanned with Philips 1.5-T MR scannerin vivoand at 10 min,1,2,3,6 and 10 h after death.After MRI detecting and observe the morphology of granulosa cells in dentate gyrus of hippocampus by using light microscope. The results showed that within 10 h after death,the size of the hippocampus on the left side of the piglet did not change significantly with the increase of the time of death(P=0.901)compared with that of the anesthesia piglets,and the volume of the right and the total hippocampus did not change significantly within 3 h after death(right:P=0.078;total:P=0.104),while the right and the total hippocampal volumesshowed a significant decrease after 6 h postmortem(P<0.01;P<0.05).At the same time,compared with the living control group,within 3 h after death,the granulocyte morphology of the left and right hippocampal dentate gyrus did not occur the phenomenon of serious damage with the increase of postmortem interval.In conclusion,within 3 h postmortem,the death did not cause significant physical damage to the hippocampus of the female piglet in the case of the head corpse treated properly.
magnetic resonance imaging(MRI);female piglet;hippocampal volume;granulosa cell;postmortem interval
S858.28
A
1005-9369(2017)05-0042-08
时间2017-5-23 12:29:10[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170523.1229.010.html
包军,张名岳,李想,等.死亡时间对雌性仔猪脑海马组织影响[J].东北农业大学学报,2017,48(5):42-49.
Bao Jun,Zhang Mingyue,Li Xiang,et al.Effect of postmortem interval on female piglet hippocampal change[J].Journal of Northeast Agricultural University,2017,48(5):42-49.(in Chinese with English abstract)
2017-03-15
国家自然科学基金面上项目(31472131/C170109)
包军(1961-),男,教授,博士,博士生导师,研究方向为动物行为与福利。E-mail:jbao@neau.edu.cn
