黑龙江省东部大豆疫霉群体结构及其时空动态
2017-06-22文景芝揭岩田苗陈宇飞张斌丁俊杰顾鑫武文旭吴迪赵钰琦高新颖
文景芝,揭岩,田苗,陈宇飞,张斌,丁俊杰,顾鑫,武文旭,吴迪,赵钰琦,高新颖
(1.东北农业大学农学院,哈尔滨150030;2.黑龙江省农业科学院佳木斯分院,黑龙江佳木斯154007)
黑龙江省东部大豆疫霉群体结构及其时空动态
文景芝1,揭岩1,田苗1,陈宇飞1,张斌1,丁俊杰2,顾鑫2,武文旭1,吴迪1,赵钰琦1,高新颖1
(1.东北农业大学农学院,哈尔滨150030;2.黑龙江省农业科学院佳木斯分院,黑龙江佳木斯154007)
为明确大豆疫霉群体结构及其时空变化规律,连续3年对黑龙江省东部4个具有代表性地块桦南县土龙山镇生产田Ht、桦南县曙光一队生产田Hs、黑龙江省农科院佳木斯分院大豆品种试验田Jn和农垦科学院大豆品种试验田Nk土样,采用叶碟诱捕法分离其中的大豆疫霉,利用一套含单个不同抗病基因的大豆近等基因系,通过国际通用下胚轴伤口接种法鉴定大豆疫霉生理小种。结果表明,379株大豆疫霉分别属于105种致病型,其中包括24个生理小种,1种IRT和80种新致病型,每种致病型优势度不明显。24个生理小种中,0、10、14和40号小种为中国首次报道。供试大豆疫霉群体对单个Rps基因的致病频率显示,在黑龙江省东部种植含有Rps7基因的大豆品种风险较高,而种植含有Rps1c、Rps1k和Rps3a基因的大豆品种较安全。随着时间推移,黑龙江省东部大豆疫霉单个菌株聚合对更多Rps基因毒性,单个菌株毒性增强。大豆疫霉群体毒性结构复杂,且随时间推移群体毒性也增强。空间上,生产田大豆疫霉群体较试验田群体毒性结构更复杂多样。
大豆疫霉;生理小种;群体结构;时空动态;黑龙江东部
由大豆疫霉(Phytophthora sojae Kaufmann&Gerdemann)侵染引起的大豆疫霉根腐病(Phytophthora root and stem rot)于1948年首次在美国印第安纳州发现[1],我国1989年在东北大豆产区分离到大豆疫霉[2],该病目前已成为危害黑龙江省大豆生产主要病害之一[3]。大豆疫霉是典型土传病原卵菌,卵孢子可在土壤中存活数年[4],高温高湿土壤环境可促使卵孢子萌发产生游动孢子囊,释放游动孢子侵染大豆[5]。大豆疫霉在自然界仅侵染栽培大豆,其与寄主大豆间互作满足基因对基因学说[6]。迄今为止,已鉴定出至少26个抗大豆疫霉基因(Rps基因)[7]。利用一套含有单个不同抗病基因(Rps基因)的大豆近等基因系可有效鉴定大豆疫霉生理小种。国内外已鉴定至少59个生理小种和众多新致病型[8-10]。中国已鉴定出至少30个生理小种,包括1~9、11、13、15、17、21、23~26、29、33、34、38~39、42~45、48~49和54号小种[11-15],除6和7号外的28个小种在黑龙江省均有报道,截止到2010年,1号小种一直为黑龙江省优势小种[16-19]。近年来黑龙江省大豆疫霉根腐病研究较多,但研究者采样地点不同,数据零散,系统性不足。黑龙江省大豆疫霉根腐病主要发生在东部地区[20],为揭示大豆疫霉毒性结构年度变化规律,定点调查东部发病严重的两块大豆生产田和两块大豆品种试验田,连续3年对土壤中大豆疫霉作诱捕分离和生理小种鉴定,分析大豆疫霉群体结构及时空间变化规律,为利用品种抗病基因控制黑龙江省大豆疫霉根腐病提供依据。
1 材料与方法
1.1 土样采集
取样地点为黑龙江省东部严重发病的两块大豆生产田,分别位于桦南县土龙山镇(Ht,130.39N,46.26E)和桦南县曙光一队(Hs,130.32N,46.17E),两块大豆品种试验田,分别位于黑龙江省农业科学院佳木斯分院(Jn,130.24N,46.47E)和黑龙江省农垦科学院(Nk,130.25N,46.46E)。于2014~2016年7~8月在4个地块固定区域(低洼处)随机取大豆疫霉根腐病典型病株根围土壤。取样时拔掉病株,去除根部表土,取5~10 cm深处土壤。若病株少或无病株,则在健康大豆植株根围取土样。每个地块至少随机取样10份,带回实验室阴干备用。
1.2 大豆疫霉分离及致病性鉴定
土壤中大豆疫霉分离参照王子迎等叶碟诱捕法[21]。取单孢菌株目标菌丝显微镜下观察,若菌丝无隔,直角分支,平均宽3.5 μm,产生球形菌丝膨大体(平均直径23 μm)和同宗配合卵孢子(直径30~35 μm),在水中产生无乳突、不脱落、倒梨形孢子囊(35~58 μm×34~45 μm),则初步认定为大豆疫霉[22]。将目标菌落转移至CA培养基上纯化4~6次。采用刘春来等大豆疫霉特异性引物5'-CTGGA TCATGAGCCCACT-3'/5'-TCTCCATCCACCGACTA CA-3'将获得菌株作PCR检测,产生288 bp条带则认定为大豆疫霉[23]。将单孢菌株回接感病大豆品种Sloan作致病性测定[24],综合发病症状及重分离培养物形态学特征,将确认大豆疫霉菌株移至CA斜面15℃保存。
1.3 生理小种鉴定
大豆疫霉生理小种鉴定采用国际通用下胚轴伤口接种法[21]。鉴别寄主为8个含有单个不同抗病基因(Rps基因)的大豆近等基因系,分别为Harlon(Rps1a),Harosoy 13XX(Rps1b),Williams 79(Rps1c),PI103091(Rps1d),Williams 82(Rps1k),Chapman(Rps3a),Harosoy62XX(Rps6)和Harosoy(Rps7),以Sloan(rps)为感病对照[25]。参照朱振东等方法调查各菌株与8个鉴别寄主互作反应结果,列出感病互作中Rps基因,即为该菌株致病型(pathotype)[26],对照Grau(2004)生理小种鉴定表,确定对应生理小种号[27]。试验作3次重复。
1.4 数据处理
利用数据分析软件population genetic analysis 1.3.2的Shannon's Information index选项计算多样性指数。利用DPS数据处理软件UPGMA方法作聚类分析并建立聚类分析树状图。
2 结果与分析
2.1 黑龙江省东部大豆疫霉群体结构分析
2.1.1 大豆疫霉生理小种多样性
2014~2016年从黑龙江省东部4个代表性地块土壤样品中共分离379株大豆疫霉。8个单基因鉴别寄主接种鉴定结果显示,379个菌株分别属于105种致病型,每种致病型分离频率为0.3%~4.0%,优势度不明显。根据Grau等生理小种鉴定表[27],29.6%菌株为24个已知生理小种,其中0、10、14和40号小种为中国首次报道。69.9%菌株为80种新致病型,每种新致病型分离频率为0.3%~4.0%,优势度不明显。其中致病型1k,7和1a,3a分离频率位居一二,分别为4.0%和3.7%。0.5%菌株为中间反应型(Intermediate reaction type,IRT)(见表1)。

表1 2014~2016年从379个菌株中鉴定出生理小种、IRT和新致病型及其分离频率Table 1Races,IRT and new pathotypes of Phytophthora sojae identified from 379 isolates from 2014 to 2016
2.1.2 大豆疫霉对8个Rps基因致病频率
379个菌株对8个Rps基因致病频率为24%~56%(见表2)。<30%菌株对Rps1c(29%)、Rps1k(24%)和Rps3a(28%)有毒性,>50%菌株对Rps7(56%)有毒性,对其余4个Rps基因致病频率为30%~40%。可见,含有Rps1c、Rps1k和Rps3a基因大豆品种比较安全,而含有Rps7基因大豆品种感染风险较高。

表2 379株大豆疫霉对单个Rps基因及Rps基因组合致病频率Table 2Virulence frequencies of 379 Phytophthora sojae isolates to single Rps gene and Rps genes combination
2.1.3 大豆疫霉群体致病力
大豆疫霉群体可击毁0~8个Rps基因(见表2),击毁0~4个Rps基因菌株数占87.0%,而击毁5~8个Rps基因菌株数占13.0%。可见大豆疫霉群体毒力偏弱。
2.2 黑龙江省东部大豆疫霉群体结构时间动态
2.2.1 生理小种年度间差异
不同年份鉴定出的生理小种种类和数量差异较大。值得注意的是仅1号小种连续3年持续稳定分离到,出现频率依次为3.2%、2.1%和5.6%,有递增趋势。1号小种仅对Rps7基因有毒性,除此之外其他小种也对Rps7基因有毒性(见表1),因此在黑龙江省东部Rps7基因无应用价值;3、5和13号小种同时出现在2014和2015年,29号小种同时出现在2014和2016年,这4个小种2014~2015年重叠率75%,2014和2016年重叠率25%,说明2014与2015年小种重叠较多,而与2016年重叠较少,2016年小种发生较大变异;其余19个小种仅出现在一年,2014年分离5个小种,2015年分离4个小种,2016年分离10个小种,2016年新小种显著增多,说明生理小种随时间推移发生显著变异。从各年度生理小种多样性指数看,2014~2016年多样性指数依次为0.4499、0.4551和0.5191,多样性指数越大,毒性变异度越大。可见随时间推移,生理小种越来越复杂多样。
2.2.2 毒性结构年度间演变
分析24个小种致病型,0号小种对8个Rps基因均无毒,1号小种仅对Rps7有毒性,其他22个小种除对Rps7有毒外,还对其他1~7个Rps基因有毒性。可见其他22个小种是在1号小种基础上聚合对更多Rps基因毒性演变而来。
3年分离鉴定小种不同,分析发现,2015年新增4个小种,其中1个小种由2014年小种聚合或失去对某些Rps基因毒性演变而来,如2015年11号小种(1b,6,7)既可由2014年13号小种(6,7)聚合对Rps1b毒性,也可由23号小种(1a,1b,6,7)失去对Rps1a毒性演变而来。其他3个小种均由2014年小种聚合对某些Rps基因毒性演变而来,如2015年8号小种(1a,1d,6,7)由2014年13号小种(6,7)聚合对Rps1a,1d毒性演变而来等。
2016年12个小种仅1号小种与2014和2015年相同,29号与2014年相同,其他10个小种仅0号小种(Avr)由2015年1号小种(7)失去对Rps7的毒性演变而来;5个小种由2014或2015年小种聚合或失去对某些Rps基因毒性演变而来;其余4个小种均由2014和2015年小种聚合对某些Rps基因毒性演变而来,如2016年38号小种(1a,1b,1c,1d,1k,3a,6,7)由2015年45号小种(1a,1b,1c,1k,6,7)聚合对Rps1d,3a毒性演变而来等(见表1)。随时间推移,大豆疫霉单个菌株聚合对更多Rps基因毒性,单个菌株毒性增强。
2.2.3 群体致病力时间动态
2016年大豆疫霉可击毁0~8个Rps基因,较2015和2014年增多,表明随时间推移,大豆疫霉群体致病力增强,出现1个可击毁全部8个Rps基因菌株。2016年可击毁1~4个Rps基因的菌株数占81%,较2015和2014年分别降低3.2%和11.4%;2016年可击毁5~8个Rps基因的菌株数占17.4%,较2015和2014年分别提高1.6%和9.8%(见表3)。进一步说明随时间推移大豆疫霉群体致病力增强。

表3 2014~2016年大豆疫霉对Rps基因组合的致病频率Table 3Virulence frequencies of Phytophthora sojae isolates to Rps genes combination from 2014 to 2016
2.3 黑龙江省东部大豆疫霉群体结构空间动态
2.3.1 生产田和试验田生理小种差异
不同田块大豆疫霉生理小种种类和数量不同。6个小种同时存在生产田和试验田中,分别是1、2、5、13、24和39号。10个小种单独存在于生产田,8个小种单独存在于试验田(见表4),可见生产田和试验田小种数量差异不大,但毒性结构差异较大,相异性为75%。生产田和试验田菌株在毒性结构上有较大程度重叠。将生产田和试验田菌株毒性作聚类分析,当遗传距离为0.61时,分为4个聚类组,其中两大组同时包含生产田和试验田菌株,两个地块菌株毒性存在重叠,另外两组分别仅包含生产田1个菌株(见图1),说明生产田菌株毒性结构更复杂。
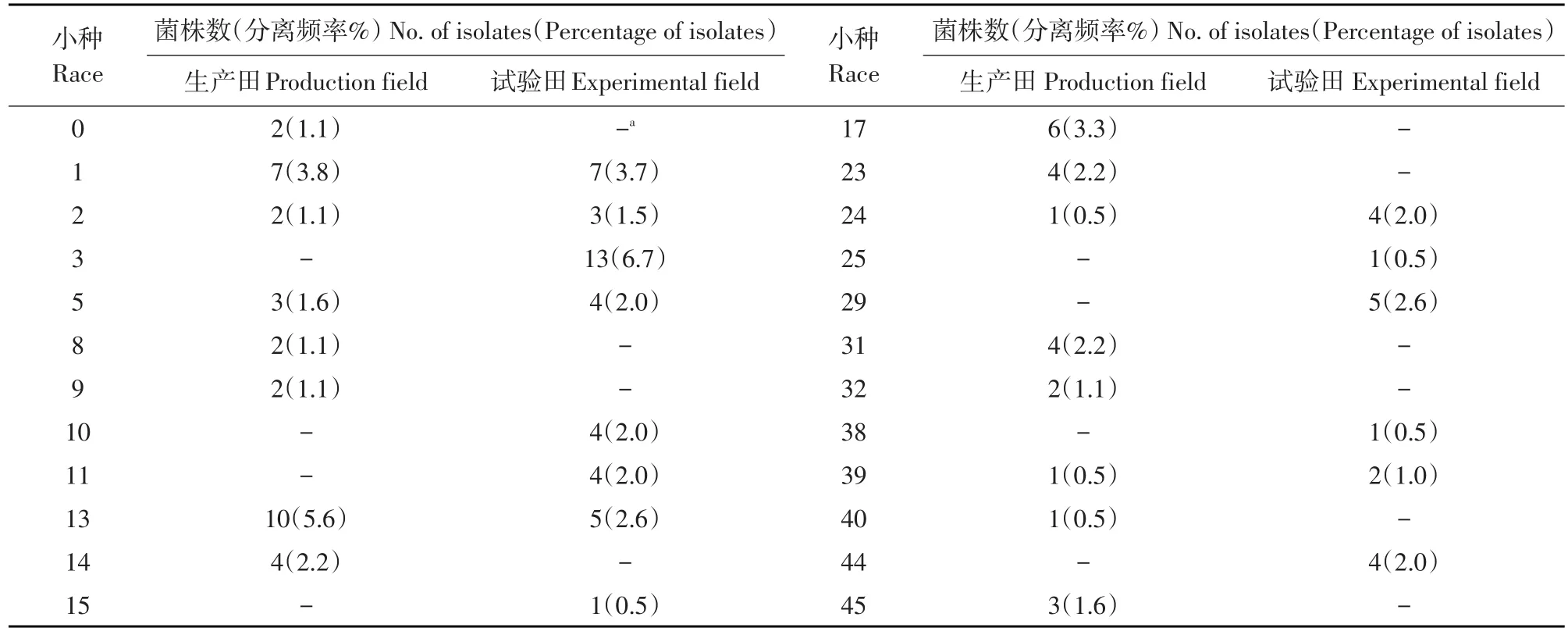
表4 生产田和试验田鉴定的生理小种及其分离频率Table 4The races and virulence frequencies of Phytophthora sojae isolates in different fields
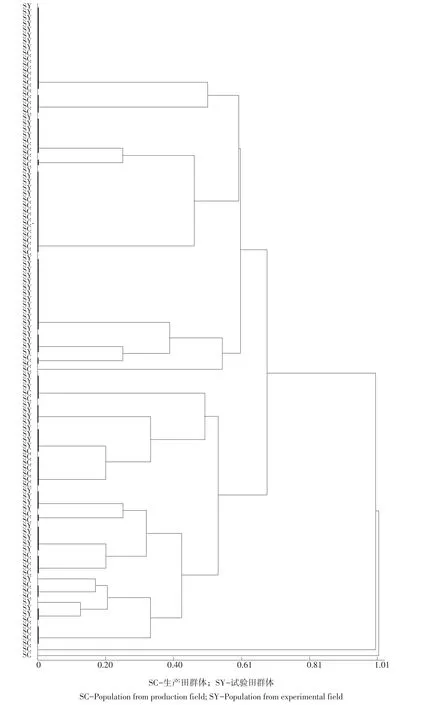
图1 生产田与试验田菌株毒性聚类分析Fig.1Dendrogram of the relation among Phytophthora sojae isolates in production field and experimental field based on virulence
生产田3年累计有54个菌株鉴定出16个小种,多样性指数为0.5176,试验田有58个菌株鉴定出14个小种,多样性指数为0.4583。因此生产田大豆疫霉群体毒性结构更复杂。
2.3.2 生产田和试验田群体致病力差异
生产田群体分别可击毁0~7个Rps基因,而试验田群体可击毁1~8个Rps基因。生产田可击毁0~4个Rps基因的菌株数占86.9%,试验田为87.3%;生产田可击毁5~8个Rps基因的菌株数占13.1%,试验田为12.7%(见表5)。可见生产田和试验田大豆疫霉群体致病力基本相当。
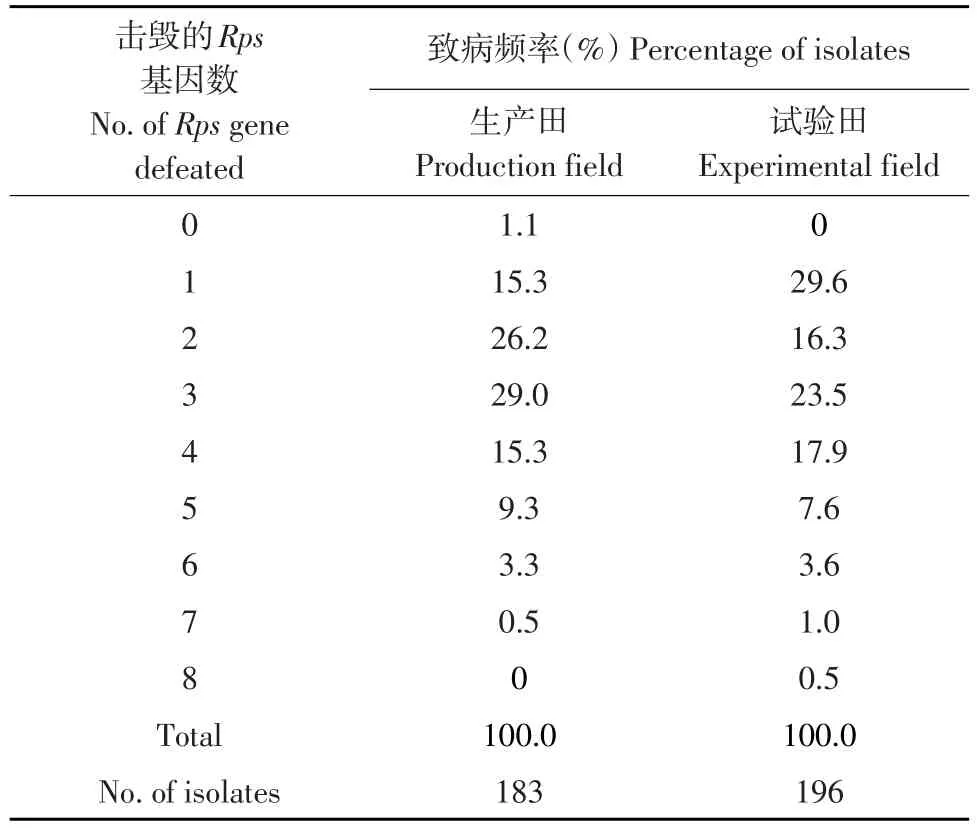
表5 生产田和试验田大豆疫霉群体对Rps基因组合致病频率Table 5Virulence frequencies of Phytophthora sojae population from different fields to Rps gene combinations
3 讨论
大豆疫霉为典型土传病原菌[28]。一株大豆可同时感染多个不同致病型菌株,但土壤中存在对当年所种植大豆品种无毒的菌株,因此病株分离大豆疫霉仅代表土壤中大豆疫霉群体一部分。本试验利用不含任何抗病基因大豆品种叶片诱捕土壤中大豆疫霉,分析土壤中大豆疫霉群体毒性结构及其随时空变化规律,全面反映土壤中大豆疫霉情况。
大豆疫霉常与土壤中多种镰孢菌(Fusarium spp.)和腐霉菌(Pythium spp.)复合侵染大豆引起根腐病[29]。大豆疫霉在培养基上生长缓慢,易被其他快速生长病原菌或腐生菌覆盖,分离纯化并获得单孢株(尤其从土壤中)难度较大。本试验改良土壤分离大豆疫霉方法,在土样处理时加入与选择性培养基相同药剂,提高分离效率。
关于大豆疫霉优势生理小种,各国差异较大,如美国优势小种为1、10、15和24号[30],加拿大为25号[31],澳大利亚和阿根廷均为1号[18],我国优势小种早期认定为1号[16-19],3号在黑龙江省出现频率也较高[25],但田苗近期发现黑龙江大豆疫霉群体具有综合毒力,小种优势度并不明显[25]。本研究从379个菌株中鉴定出24个生理小种,其中0、10、14和40号小种为中国首次报道。1号小种在本研究中分离频率仅为3.6%,位居第二,原因可能是1号小种毒性结构简单,仅对Rps7有毒,而其他小种均在1号小种基础上,聚合对更多Rps基因毒性后演变而来。由此说明随时间推移,黑龙江省东部大豆疫霉毒性结构日渐复杂,单个菌株即可击毁更多Rps基因,群体毒性不断增强,此结论与田苗一致。
黑龙江省东部大豆疫霉群体可击毁0~8个Rps基因,击毁0~4个Rps基因菌株数占87.0%,而击毁5~8个Rps基因菌株数占13.0%,可见黑龙江省东部大豆疫霉群体毒力偏弱。黑龙江省东部大豆疫霉群体对8个Rps基因致病频率范围从2014年20%~53%到2015年19%~65%再到2016年27%~52%,2016年致病频率范围变窄,即曾经有效Rps基因逐渐失去抗病优势而风险性较高的Rps基因风险性略有降低。对4个Rps基因致病频率提高2%~28%,对3个Rps基因致病频率降低1%~5%,对1个Rps基因致病频率保持不变,说明黑龙江省东部大豆疫霉对单个Rps基因毒力微弱增强。2014年可在黑龙江应用的Rps基因(Rps1b、Rps1k)逐渐失去抗病优势,而2014年风险性较高的Rps7基因在2016年依旧较高。2016年同时出现全毒和全无毒小种,预示黑龙江省东部可能存在某些中强毒性菌株且可同时克服多个Rps基因,而应用单一Rps基因或对菌株无效,一旦中强毒性菌株成为大豆疫霉根腐病菌优势群体,将对黑龙江省大豆生产造成严重损失[32]。因此在黑龙江东部大豆生产中,应利用风险性较低Rps基因培育抗病品种。从大豆育种长期角度考虑,利用新发掘和风险性较低Rps基因培育含有2个或2个以上抗病基因品种。在合理利用抗病基因同时,重视耐病品种选育,降低对大豆疫霉的选择压力,延长抗病基因使用寿命。
[1]Schmitthenner A F.Problems and progress in control of Phytophthora root rot of soybean[J].Plant Disease,1985,69(4):362-368.
[2]沈崇尧,苏彦纯.中国大豆疫霉病菌的发现及初步研究[J].植物病理学报,1991,21(4):298.
[3]张淑珍,徐鹏飞,靳立梅,等.野生大豆对大豆疫霉根腐病抗感反应及聚类分析[J].东北农业大学学报,2009,40(11):1-6.
[4]Schmitthenner A F.Phytophthora rot of soybean[M]//Hartman G L, Sinclair J B,Rupe J C.Compendium of soybean diseases.4th Edition. St.Paul USA:The American Phytopathological Society Press,1999.
[5]Dorrance A E,Mills D,Robertson A E,et al.Phytophthora root and stem rot of soybean[J/OL].Plant Health Instructor.2007,doi: 10.1094/PHI-I-2007-0830-07.
[6]Dorrance A E,Mcclure S A,Martin S K S.Effect of partial resistance on Phytophthora stem rot incidence and yield of soybean in ohio[J].Plant Disease,2003,87(3):308-312.
[7]成瑢,董铮,李魏,等.大豆根腐病研究进展[J].中国农学通报, 2016,32(8):58-62.
[8]李增辉,蒋绿荣,冷冰雪,等.安徽省大豆疫霉根腐病菌的鉴定及rDNA-ITS序列分析[J].植物保护学报,2017,44(1):121-128.
[9]Stewart S,Abeysekara N,Robertson A E.Pathotype and genetic shifts in a population of Phytophthora sojae under soybean cultivar rotation[J].Plant Disease,2014,98(5):614-624.
[10]Grigalba P E,Gally M E.Virulence of Phytophthora sojae in the pampeana subregion of Argentina from 1998 to 2004[J].Journal of Phytopathology.2015,163(9):723-730.
[11]马淑梅,丁俊杰,郑天琪,等.黑龙江省大豆疫霉根腐病生理小种鉴定结果[J].大豆科学,2005,24(4):260-262.
[12]马淑梅,韩新华.黑龙江省大豆疫霉菌毒性变异及毒力结构分析[J].大豆科学,2013,32(2):229-233+237.
[13]许修宏,吕慧颖,曲娟娟,等.大豆疫霉根腐病菌生理小种鉴定及毒性分析[J].植物保护学报,2003,30(2):125-128.
[14]张淑珍,吴俊江,徐鹏飞,等.黑龙江省大豆疫霉根腐病菌毒力类型及15号小种的首次报道[J].中国油料作物学报,2008,30 (2):229-234.
[15]尹庆.大豆疫霉病致病性分化及品种抗性评价[D].哈尔滨:黑龙江大学,2012.
[16]Xu X H,Lu H Y,Qu J J,et al.Phytophthora sojae races in northeast of China and virulence evaluation of the isolates[J].Journal of Northeast Agricultural University:English Edition,2003,10(2): 97-100.
[17]Zhang S Z,Xu P F,Wu J J,et al.Races of Phytophthora sojae and their virulences on soybean cultivars in Heilongjiang,China[J]. Plant Disease,2010,94(1):87-91.
[18]文景芝,陈宏宇.大豆疫霉病菌致病性分化研究[J].中国油料作物学报,2002,24(1):63-66.
[19]许修宏,曲娟娟.张喜萍,等.大豆疫霉根腐病研究进展[J].东北农业大学学报,2003,34(4):474-477.
[20]王晓鸣,Schmitthenner A F,马书君.黑龙江省大豆疫霉根腐病调查与病原分离[J].植物保护,1998,24(3):9-11.
[21]王子迎,王源超,张正光,等.土壤中大豆疫霉菌诱捕方法的改进[J].植物病理学报,2005,35(6):557-559.
[22]文景芝,张明厚.黑龙江省大豆疫病病原鉴定[J].中国油料作物学报,1998,20(4):76-78.
[23]刘春来,杨明秀,文景芝.大豆疫霉菌ITS分子检测程序的建立及其应用[J].微生物学通报,2007,34(6):1158-1162.
[24]吴浩,王良华,吴新华,等.大豆疫霉在江苏省适生性的初步研究[J].南京农业大学学报,2002,25(1):39-42.
[25]Tian M,Zhao L,Li S,et al.Pathotypes and metalaxyl sensitivity of Phytophthora sojae,and their distribution in Heilongjiang,China 2011-2015[J].Journal of General Plant Pathology,2016,82(3):132-141.
[26]朱振东,王晓鸣,常汝镇,等.黑龙江省大豆疫霉菌生理小种鉴定及大豆种质的抗性评价[J].中国农学科学,2000,33(1):62-67.
[27]Grau C R,Dorrance A E,Bond J,et al.Fungal diseases[M]// Boerma H R,Specht J E,Soybeans:improvement,production,and uses.3rd Edition:Madison,Wisconsin:American Society of Agronomy,Crop Science Society of America,Soil Science Society of America,2004.
[28]陈秋明,肖彩霞,孙欠欠,等.大豆疫霉Phytophthora sojae卵孢子在黑龙江省土壤中的越冬存活率[J].植物保护学报,2015, 42(1):72-78.
[29]陈庆河,翁启勇,王源超,等.福建省大豆疫病病原鉴定及其核糖体DNA-ITS序列分析[J].植物病理学报,2004,34(2):112-116.
[30]Jackson T A,Kirkpatrick T L,Rupe J C.Races of Phytophthora sojae in Arkansas soybean fields and their effects on commonly grown soybean cultivars[J].Plant Disease,2004,88(4):345-351.
[31]Xue A G,Marchand G,Chen Y H et al.Races of Phytophthora sojae in Ontario,Canada,2010-2012[J].Canadian Journal of Plant Pathology,2015,37(3):376-383.
[32]王晓鸣,朱振东,王化波,等.中国大豆疫霉根腐病和大豆种质抗病性研究[J].植物病理学报,2001,31(4):324-329.
Spatial-temporal dynamics of Phytophthora sojaeon population struc-ture in the east of Heilongjiang Province
/WEN Jingzhi1,JIE Yan1,TIAN Miao1,CHEN Yufei1,ZHANG Bin1,DING Junjie2,GU Xin2,WU Wenxu1,WU Di1,ZHAO Yuqi1,GAO Xinying1(1.School of Agriculture,Northeast Agricultural University,Harbin 150030,China;2.Jiamusi Branch of Heilongjiang Academy ofAgricultural Sciences,Jiamusi Heilongjiang 154007,China)
In order to clarify the spatial-temporal dynamics of population structure ofPhytophthora sojaein Heilongjiang Province,the soil samples of four typical fields,including the production fields of Ht and Hs and the experimental fields of Jn and Nk,were isolated forPhytophthora sojaeby using a modified leaf disc baiting method.The pathotypes of theP.sojaeisolates were determined by using the universal hypocotyl inoculation method on a set of soybean near-isogenic line which had eight different Rpsalleles.The investigation showed that 379 isolates belonged to 105 pathotypes which included 24 races,1 IRT and 80 new pathotypes.The dominance of each pathotype was not obvious.Race 0,10, 14 and 40 were the first report in China.The virulence frequencies of the testedP.sojaepopulation to each singleRspgene showed that soybean cultivars containingRps7 gene would have a higher risk and these containingRps1c,Rps1k,andRps3a genes were more secure than the other fiveRpsgenesin the east of Heilongjiang.P.sojaein the east of Heilongjiang tended to integrate more virulence toRps genes within individual isolate with time,which resulted in appearance of more virulent isolates.The virulence composition ofP.sojaepopulation in the east of Heilongjiang became more complicated and more virulent with time.Compared with the experimental fields,the virulence structure ofP.sojae population from production fields was more complex.
Phytophthora sojae;race;population structure;spatial-temporal dynamics;the east of Heilongjiang
S435.651
A
1005-9369(2017)05-0001-08
时间2017-5-23 12:23:36[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170523.1223.002.html
文景芝,揭岩,田苗,等.黑龙江省东部大豆疫霉群体结构及其时空动态[J].东北农业大学学报,2017,48(5):1-8.
Wen Jingzhi,Jie Yan,Tian Miao,et al.Spatial-temporal dynamics ofPhytophthora sojaeon population structure in the east of Heilongjiang Province[J].Journal of Northeast Agricultural University,2017,48(5):1-8.(in Chinese with English abstract)
2017-03-30
公益性行业(农业)科研专项(201303018);国家自然科学基金(31370449,31670444)
文景芝(1964-),女,教授,博士,博士生导师,研究方向为大豆疫霉。E-mail:jzhwen2000@163.com
