脑室内注射瘦素对大鼠迷走复合体瘦素受体表达的影响
2017-06-05赵艳军马立新吴瑞芹乔跃兵李炳庆
赵艳军,马立新,吴瑞芹,乔跃兵,李炳庆
(1承德医学院附属医院,河北承德 067000;2承德医学院解剖教研室)
脑室内注射瘦素对大鼠迷走复合体瘦素受体表达的影响
赵艳军1,马立新1,吴瑞芹1,乔跃兵2,李炳庆1
(1承德医学院附属医院,河北承德 067000;2承德医学院解剖教研室)
目的 探讨脑室内注射瘦素后大鼠迷走复合体瘦素受体(Ob-R)表达的变化。方法 将SD大鼠24只随机分为对照组和瘦素干预1 h组(A组)、3 h组(B组)、5 h组(C组),每组6只。给药前1周行侧脑室置管,置管1周后无麻醉状态下对照组侧脑室注射生理盐水, A、B、C组侧脑室注射瘦素,剂量均为3.5 μg/μL。实验结束后取脑组织,用HE染色进行迷走复合体定位,用免疫组化方法测定Ob-R在迷走复合体的表达。结果 A、B、C组Ob-R阳性细胞数分别为(12.49±1.66)、(12.54±2.16)、(12.89±1.86)个,对照组阳性细胞数为(5.66±1.04)个;A、B、C组Ob-R阳性细胞光密度积分分别为 (28.41±3.60)、(26.18±6.17)、(24.56±4.14)分,对照组为(16.02±2.06)分;与对照组比较,A、B、C组Ob-R阳性细胞数、阳性细胞光密度积分增多(P均 <0.05)。A、B、C三组间Ob-R阳性细胞数、阳性细胞光密度积分比较差异无统计学意义(P均 >0.05)。结论 瘦素中枢干预后可刺激迷走复合体上Ob-R的表达上调,瘦素刺激时间与Ob-R水平无关。
瘦素;瘦素受体;阿黑皮素;迷走复合体;侧脑室内注射
瘦素属于蛋白质类激素,由脂肪细胞分泌,主要在白色脂肪组织产生[1],在神经内分泌、新陈代谢、生殖功能、刺激造血功能以及骨代谢等[2~6]方面均具有生物学活性。研究发现机体内瘦素的减少会引起过量进食,进而导致体质量超标;相反,瘦素通过对靶器官下丘脑的调节,抑制脂肪合成,减少进食,可导致体质量下降[7]。脑干背侧的迷走神经复合体包括三部分:迷走运动背核、最后区、孤束核。迷走神经是混合神经,其中运动神经纤维由迷走运动背核发出,感觉纤维的中枢突终止于孤束核,通过迷走反射对靶器官功能(如胃肠动力等)进行调控[8]。研究显示,瘦素对靶器官调节的生物学作用是通过与瘦素受体(Ob-R)结合而实现的[9]。2015年10月~2016年3月,我们对大鼠中枢神经注射瘦素后迷走神经复合体上Ob-R的表达变化进行了研究。
1 材料与方法
1.1 材料 SD大鼠24只(雌雄各半、单笼饲养)、Ob-R(购买于上海斯信生物科技有限公司)、瘦素(派普泰克公司产品)、免疫组织化学方法二抗相关试剂盒、DAB试剂盒、多聚甲醛、大鼠脑立体定向仪、脑室置管系统装备(包括实验使用的不锈钢外套管、与外管相配套的内芯、螺纹钉、螺母、牙科粘合剂、微量注射器)、手术相关器械、光学显微镜、Motic计算机图像分析系统。
1.2 侧脑室瘦素注射 将SD大鼠24只随机分为对照组和瘦素干预1 h组(A组)、3 h组(B组)、5 h组(C组),每组6只。给药前1周行侧脑室置管,置管1周后对照组侧脑室注射生理盐水, A、B、C组侧脑室注射瘦素;注射在大鼠清醒、没有麻醉状态下进行,生理盐水及瘦素注射剂量均为3.5 μg/μL,注射时间为4 min,最后注射美蓝溶液0.5 μL(20 g/L)。注射美蓝溶液目的是为了确定瘦素注射位置,将美蓝未入脑室内的大鼠剔除。
1.3 迷走神经复合体上Ob-R的表达检测 对照组侧脑室注射生理盐水1 h及A、B、C组侧脑室注射瘦素1、3、5 h后,将大鼠以水合氯醛深麻醉,开胸,通过升主动脉先用生理盐水行心脏灌注,后用甲醛灌注固定。待固定液灌注完毕后取脑组织,再以4%多聚甲醛溶液再固定24 h后取迷走神经复合体,制片后以中脑导水管为标志,HE染色进行迷走神经复合体定位判断,胞质被染成棕色的为Ob-R表达阳性细胞,采用免疫组化方法测定迷走神经复合体上Ob-R的表达。随机选取含有阳性细胞的切片组织,然后随机取6个视野(×400),计数阳性细胞数。另选6个视野, 每个视野不相互重叠,应用Motic计算机图像分析系统依据染色的强度和面积,计算各个视野的阳性细胞光密度积分,作为Ob-R表达的定量指标。
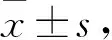
2 结果
四组24只大鼠美蓝溶液均进入脑室内。A、B、C组Ob-R阳性细胞数分别为(12.49±1.66)、(12.54±2.16)、(12.89±1.86)个,对照组阳性细胞数为(5.66±1.04)个;与对照组比较,A、B、C组Ob-R阳性细胞数增多(P均<0.05)。A、B、C三组间Ob-R阳性细胞数比较差异无统计学意义(P>0.05)。A、B、C组Ob-R阳性细胞光密度积分分别为 (28.41±3.60)、(26.18±6.17)、(24.56±4.14)分,对照组为(16.02±2.06)分;与对照组比较,A、B、C组Ob-R阳性细胞光密度积分增多(P均<0.05)。A、B、C三组间Ob-R阳性细胞光密度积分比较差异无统计学意义(P>0.05)。见图1。
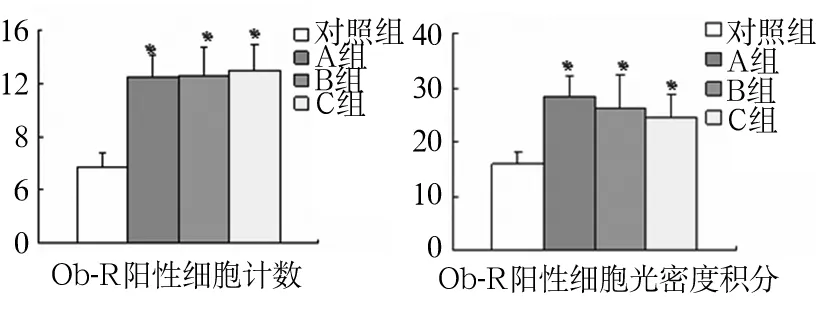
注:与对照组比较,*P<0.05。
图1 四组迷走神经复合体Ob-R表达比较
3 讨论
瘦素是一种由脂肪组织分泌的激素。人们之普遍认为瘦素进入血液循环后会参与糖、脂肪及能量代谢的调节,促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,进而使体质量减轻。研究表明,在婴儿时期摄取瘦素,可能可以固定大脑对食欲的反应,进而一生都不会过度饮食。瘦素的功能是多方面的,主要表现在对脂肪及体质量的调控。瘦素可使人类进食明显减少,体质量和体脂含量下降。瘦素可作用于中枢,增加交感神经活性,使大量贮存的能量转变成热能释放。瘦素可直接抑制脂肪合成,促进其分解。胰岛素可促进瘦素的分泌,反过来瘦素对胰岛素的合成、分泌发挥负反馈调节。
迷走神经支配整个胃肠系统,脑内向胃肠的传出纤维由迷走运动背核发出,胃肠向脑内的传入纤维止于孤束核。迷走神经将胃肠信息整合后向脑内传递,经中枢加工后又经传出纤维指挥胃肠活动,因此迷走神经是脑-肠轴对胃肠运动调节的重要途径[10]。位于脑干上的迷走运动复合体内,各种神经肽、神经递质相互作用。不同情况下迷走反射在外周靶器官的作用可能表现为抑制,也可表现为增强[11]。研究表明,许多肽类的激素诸如瘦素、胰岛素等均可以作用于脑,通过迷走神经将信息传递到胃肠道,从而影响其生物学活性[12]。进一步研究表明,瘦素主要是通过与下丘脑核团上的特异性受体结合,从而发挥其生物学功能。孤束核上的神经元含有Ob-R,而且这类神经元正是Ob-R结合的靶细胞。在孤束核的迷走运动复合体上,是否与下丘脑上的核团(如弓状核)一样,瘦素通过与其受体结合实现其对胃肠运动的调控尚不明了。
既往有研究显示,瘦素作用于动物下丘脑的弓状核后,该部位Ob-R表达增加,瘦素通过与其受体结合影响胃肠运动,使胃排空延迟,从而产生摄食抑制效应。本研究通过大鼠侧脑室置管,在无麻醉状态下进行中枢注射瘦素,观察迷走运动复合体上Ob-R的表达变化。结果显示,瘦素干预后,Ob-R在迷走运动复合体表达增多,与对照组比较有统计学差异。证实在迷走运动复合体上,瘦素可能部分通过与其受体结合实现其对胃肠运动等功能的调控。临床上肥胖症患者多出现不同程度的血液瘦素水平上升。由于瘦素的正常生理功能主要是通过Ob-R介导的,肥胖症患者中瘦素水平的上升直接造成了Ob-R水平的反馈性下调或是受体后信号转导受阻,这就是瘦素抵抗。脑室内注射瘦素使中枢Ob-R表达增加,从而使瘦素发挥应有的生物学活性,此为相关肽类激素的研究提供了新的思路。但是,人体是一个十分复杂的有机体。孤束核迷走复合体神经元不仅存在Ob-R,同时也存在其他肽类激素受体,中枢注射瘦素后对迷走复合体其他受体影响及其效应也需要进一步的研究。
[1] Park HK, Ahima RS. Physiology of leptin: energy homeostasis, neuroendocrine function and metabolism[J]. Metabolism, 2015,64(1):24-34.
[2] Dalamaga M, Chou SH, Shields K, et al. Leptin at the intersection of neuroendocrinology and metabolism:current evidence and therapeutic perspectives [J].Cell Metab, 2013,18(1):29-42
[3] Moon HS, Dalamaga M, Kim SY, et al. Leptin′s role in lipodystrophic and nonlipodystrophic insulin-resistant and diabetic individuals[J].Endocr Rev, 2013,34(3):377-412.
[4] Hausman GJ, Barb CR, Lents CA. Letin and reproductive function[J]. Biochimie, 2012, 94(10):2075-2081.
[5] Alix PM, Guebre-Egziabher F, Soulage CO.Leptin as an uremic toxin:Deleterious role of in chronic kidney disease[J]. Biochimie, 2014,105(10):12-21.
[6] Upadhyay J, Farr OM, Mantzoros CS.The role of leptin in regulating bone metabolism[J]. Metabolism, 2015, 64(1): 105-113.
[7] van Swieten MM, Pandit R, Adan RA, et al. The neuroanatomical function of leptin in the hypothalamus[J]. J Chem Neuroanat, 2014,61-62(11): 207-220.
[8] Fujimiya M,Inui A.Peptidergic regulation of gastrointestinal motility in rodents[J]. Peptides, 2000,21(10):1565-1582.
[9] Schaab M, Kratzsch J. The soluble leptin receptor[J].Best Pract Res Clin Endocrinol Metab, 2015, 29(5): 661-670.
[10] Travagli RA, Rogers RC. Receptors and transmission in the brain-gut axis: potential for novel therapies[J].Am J Physiol Gastrointest Liver Physiol, 2001,281(3):G595-601.
[11] Lewis MW, Hermann GE, Rogers RC, et al. In vitro and in vivo analysis of the effects of corticotropin releasing factor on rat dorsal vagal complex[J].J Physiol, 2002,543(Pt 1):135-146.
[12] Buhmann H, le Roux CW, Bueter M. The gut-brain axis in obesity[J]. Best Pract Res Clin Gastroenterol, 2014,28(4): 559-571
河北省科学技术研究与发展计划项目(08276101D-20)。
李炳庆(E-mail:nobody50@163.com)
10.3969/j.issn.1002-266X.2017.17.012
R745.1
A
1002-266X(2017)17-0037-03
2017-01-23)
