MiR-105抑制肝癌细胞增殖能力的实验研究
2017-05-11李勇传石永杰嘉红云黄思聪
李勇传,石永杰,嘉红云,黄思聪
(1.广州市红十字会医院检验科,广东广州510220;2.广州医科大学附属第二医院检验科,广东广州510260)
MiR-105抑制肝癌细胞增殖能力的实验研究
李勇传1,石永杰2,嘉红云2,黄思聪2
(1.广州市红十字会医院检验科,广东广州510220;2.广州医科大学附属第二医院检验科,广东广州510260)
目的探讨miR-105对人肝癌细胞增殖的影响及可能机制。方法改变QGY-7703及HepG2两种细胞的miR-105表达,细胞克隆形成实验和软琼脂增殖试验检测细胞增殖能力的改变;流式细胞仪检测细胞周期改变。结果细胞克隆形成和软琼脂增殖实验显示,过表达miR-105可抑制QGY-7703及HepG2细胞增殖,反之抑制miR-105表达则促进细胞增殖;细胞流式检测显示miR-105过表达能促进两种癌细胞G0/G1期阻滞。结论miR-105抑制肝癌细胞增殖,其机制与引起细胞周期阻滞有关。
MiR-105;肝细胞癌;细胞增殖;细胞凋亡
我国肝癌发病率高居恶性肿瘤病谱第四位,病死率为肿瘤死因谱第二位,且每年持续上升[1]。肝细胞癌(hepatocellular carcinoma cells,HCC)是目前肝癌的主要类型,尽管现在对肝癌的诊断和治疗方法较过去都有了很大的提高,但HCC的5年存活率仍然只有5%,且远期疗效很不理想[2]。现阶段HCC发生发展的机制还存在很多未知领域。研究表明,microRNA在HCC的病理进程中起重要作用,并可能成为HCC诊断和治疗的新方向[3]。近年发现miR-105对部分肿瘤来说可能是一个有效的抑癌基因[4-5],但其对HCC的作用目前尚未清晰。因此本研究希望通过体外实验研究miR-105表达对QGY-7703及HepG2两种人类肝癌细胞增殖、细胞周期和凋亡的影响,探讨miR-105在HCC发生发展中的作用和可能机制,为HCC的治疗提供潜在靶点。
1 材料与方法
1.1 细胞来源及培养肝癌细胞株QGY-7703和HepG2细胞由广州医科大学附属第二医院分子实验室留存,常规方法复苏后置于37℃、5%CO2的细胞培养箱中培养。取对数生长期细胞用于实验。
1.2 主要试剂胎牛血清(FBS)和DMEM培养液购自美国Gibco公司,TRIzol溶液、Lipofectamine 2000、Opti-MEI溶液购自美国Invitrogen公司。miR-105模拟物、miR-105抑制物、阴性对照购自广州市锐博生物科技有限公司。
1.3 细胞转染分别用阴性对照(NC)、miR-105模拟物(miR-105)和miR-105抑制物(miR-105-in)转染QGY-7703及HepG2细胞。用Opti-MEI稀释待转染核酸至浓度为0.02 μg/μL,加入LipofectamineTM2000/Opti-MEI混匀液,置室温20 min后加入待转染的贴壁细胞中,4~6 h后更换培养液为含10%FBS的DMEM,继续培养24 h。
1.4 克隆形成实验QGY-7703和HepG2细胞种于6孔板(每孔0.5×103个细胞)连续培养10 d,观察克隆(>50个细胞的集落为1个克隆)的生长情况。用10%甲醛固定10 min,1.0%结晶紫染色5 min,倒置显微镜下计数克隆数量。结果以miR-105/NC、miR-105-in/NC克隆数量比值表示。
1.5 软琼脂增殖实验取2×103的QGY-7703和HepG2细胞悬浮在2 mL含有0.33%琼脂的完全培养基中。0.66%完全培养基琼脂混合物作为琼脂底层,琼脂细胞混合物作为琼脂上层。培养10 d后,用目镜测微尺计数克隆直径>0.1 mm的细胞集落。
1.6 流式细胞仪检测细胞周期收集消化后的QGY-7703及HepG2细胞,磷酸盐缓冲液(PBS)洗涤后加入80%冰冷乙醇的PBS溶液固定。细胞沉淀后重悬,加入2 μg/mL牛胰RNA酶,37℃培养30 min,随后在10 μg/mL碘化丙啶中室温孵育30 min。流式细胞仪检测细胞DNA的含量,重复3次。
1.7 统计学方法用Exce2003进行数据整理,SPSS17.0进行统计学分析,计量数据以均数±标准差()表示,两组计量资料比较采用双侧t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-105表达对肝癌细胞增殖的影响克隆形成实验显示,与NC组比较,miR-105组的QGY-7703和HepG2细胞克隆数量比值为(0.28±0.08)、(0.22±0.06)(图1A);miR-105-in组克隆数量比值分别为(2.80±0.30)、(3.20±0.50)(图1B)。软琼脂增殖实验显示,NC组的菌落数量约(50±5)个,miR-105组的QGY-7703和HepG2细胞菌落数量为(17±2)个、(15±1)个(图1C);miR-105-in组克隆数量比值分别为(135±15)、(155±25)(图1D)。表明miR-105的过表达可导致QGY-7703和HepG2细胞克隆及菌落数量明显下降(P<0.05);抑制miR-105表达两种细胞的克隆及菌落数量则明显增多(P<0.05)。
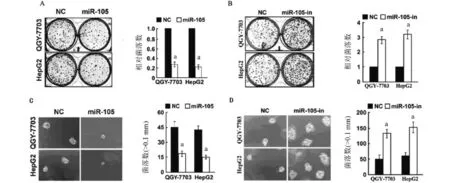
图1 miR-105在克隆形成和软琼脂增殖实验中对HCC细胞增殖的影响(与NC比较,aP<0.05)
2.2 miR-105表达对肝癌细胞周期的影响与NC比较,miR-105过表达的两种细胞G1/G0期细胞所占比例均显著增加,差异有统计学意义(P<0.05),而抑制miR-105表达后,两种细胞G1/G0期细胞所占比例则显著下降,差异有统计学意义(P<0.05),见表1。

表1 miR-105表达对HCC细胞G0/G1期比例的影响
3 讨论
miRNA的失调经常发生在各种人类肿瘤中,miRNA表达的异常可通过影响多个基因的表达最终导致人类癌症形成[6]。研究发现,在多种肿瘤类型中,miR-105表达都有改变,如前列腺癌患者的癌变组织和血中均发现miR-105表达下调,且在体外和体内的实验中证实其下调有助于前列腺肿瘤细胞的增殖[4]。结肠癌组织中也发现miR-105表达显著下调[7]。提示miR-105可能对部分肿瘤具有较大的抑制作用。
本次细胞实验结果显示,miR-105的过表达可导致肿瘤细胞的克隆及集落数量下降;反之抑制miR-105表达肿瘤细胞的克隆及集落数量明显增多。提示miR-105过表达可以抑制肝癌细胞的增殖,而抑制其表达,则使肝癌细胞增殖加速。说明对于HCC,miR-105有可能通过抑制肝癌细胞增殖而发挥其抑癌作用。
从一定意义上讲,肿瘤是多基因变化导致细胞周期紊乱,细胞失控性生长所导致的一类细胞周期性疾病[8]。一个完整的细胞周期有G0、G1、S、G2、M五个时期,细胞DNA的含量随各时相呈现周期性变化。流式细胞仪根据细胞增殖时各阶段的DNA含量不同,将细胞的复制期分为G0/G1、S、G2/M期。具有2C DNA含量的细胞为G0/G1期细胞,具有4C DNA含量的细胞为G2/M期细胞,DNA含量介于G1和G2期之间为S期细胞[9]。本次流式细胞检测发现,过表达miR-105能使QGY-7703和HepG2两种肝癌细胞处于G0/G1期的比例增多,表明miR-105有使肝癌细胞产生G0/G1期阻滞的能力,而抑制miR-105表达,癌细胞G0/G1期的比例减少,表示进入S期的细胞比例会相应增加。结果提示miR-105表达影响肝癌细胞增殖的机制可能与其影响细胞周期改变有关。
综上所述,miR-105也许在抑制HCC的发生和发展中起着重要的积极作用,有望能成为针对HCC治疗的有效作用靶点,为原发性肝癌的治疗提供新的治疗方向。
[1]甘雨,于新发,周成宇,等.甲胎蛋白在原发性肝癌的诊断和预后判断中的临床价值[J].海南医学,2016,27(6):891-894.
[2]Motawi TK,Shaker OG,El-Maraghy SA,et al.Serum microRNAs as potential biomarkers for early diagnosis of hepatitis C virus-related hepatocellular carcinoma in Egyptian patients[J].PLoS One, 2015,10(9):e0137706.
[3]Wen Y,Han J,Chen J,et al.Plasma miRNAs as early biomarkers for detecting hepatocellular carcinoma[J].Int J Cancer,2015,137(7): 1679-1690.
[4]Honeywell DR,Cabrita MA,Zhao H,et al.miR-105 inhibits prostate tumor growth by suppressing CDK6 levels[J].PLoS One,2013,8 (8):e70515.
[5]Guan Y,Chen L,Bao Y,et al.Identification of low miR-105 expression as a novel poor prognostic predictor for human glioma[J].Int J Clin Exp Med,2015,8(7):10855-10864.
[6]Ohtsuka M,Ling H,Doki Y,et al.MicroRNA processing and human cancer[J].J Clin Med,2015,4(8):1651-1667.
[7]Wang ZM,Du WJ,Piazza GA,et al.MicroRNAs are involved in the self-renewal and differentiation of cancer stem cells[J].Acta Pharmacol Sin,2013,34(11):1374-1380.
[8]林东昕.肿瘤的遗传易感因素[J].海南医学,1999,10(6):83-85.
[9]崔巍.流式细胞术PI染色进行细胞周期分析的原理是什么?[J].中华检验医学杂志,2004,27(3):151.
MiR-105 suppress the proliferation of hepatocellular carcinoma cells.
LI Yong-chuan1,SHI Yong-jie2,JIA Hong-yun2,HUANG Si-cong2.1.Department of Clinical Laboratory,Guangzhou Red Cross Hospital,Guangzhou 510220, Guangdong,CHINA;2.Department of Clinical Laboratory,the Second Affiliated Hospital of Guangzhou Medical University, Guangzhou 510260,Guangdong,CHINA
ObjectiveTo investigate the effects of miR-105 expression on the proliferation of human hepatocellular carcinoma(HCC)cells.MethodsOver-expression of miR-105 was transfected by miR-105 mimics,and inhibition of miR-105 expression was transfected by miR-105 inhibitors.The effects of miR-105 expression on the proliferation of QGY-7703 and HepG2 cells were detected by colony formation assay and soft agar proliferation experiment. Flow cytometry was used to examine the influence of miR-105 expression on the cell cycle distribution of HCC cells. ResultsColony formation assay and soft agar proliferation experiment showed that,the proliferation of QGY-7703 and HepG2 cells were suppressed by miR-105 over-expression(P<0.05),while miR-105 inhibitor accelerated the proliferation of HCC cells.The G0/G1phase cells dramatically increased in the miR-105 over-expressing QGY-7703 and HepG2 cells,while decreased in miR-105-inhibited cells.ConclusionMiR-105 inhibits the proliferation of HCC cells.The mechanisms may be related to the cell cycle arrested.
miR-105;Hepatocellular carcinoma;Cell proliferation;Cell apoptosis
R735.7
A
1003—6350(2017)07—1038—03
10.3969/j.issn.1003-6350.2017.07.003
2016-10-11)
广东省广州市科技和信息化局项目(编号:2014J4100063)
黄思聪。E-mail:58218826@qq.com
