血脑屏障渗透性改变的细胞和分子机制研究进展
2017-05-10朱安,王旗,2,3
朱 安,王 旗,2,3
(1.北京大学公共卫生学院毒理学系,北京 100191;2.国家中医药管理局中药配伍减毒重点研究室,北京 100191;3.食品安全毒理学研究与评价北京市重点实验室,北京 100191)
血脑屏障(blood-brain barrier,BBB)位于外周血液循环系统和中枢神经系统(central nervous system,CNS)之间,由内皮细胞、星形胶质细胞、小胶质细胞、周细胞、基膜组成,细胞之间连接紧密且屏障中含有大量代谢酶和外排转运体。BBB的特性使病毒、炎症因子和重金属等神经毒性物质难以进入并蓄积在脑组织,对维持CNS的正常生理功能具有重要意义。然而,以CNS为预期靶标的治疗性化合物中98%因理化特性限制而无法穿过BBB,对CNS药物的开发和应用带来挑战。本文主要对影响BBB渗透性的细胞和分子机制研究进展予以综述。
1 细胞和基膜
1.1 脑微血管内皮细胞(brain microvascular endothelial cells,BMEC)
BMEC表达多种特异性生物标志物(表1),可用于细胞鉴定和功能监测。Xu等[1]研究发现,神经元释放的包含miR-132的外泌体可促进血管内皮钙黏蛋白(vascular endothelial cadherin,VE-钙黏蛋白)的表达,从而维持脑血管的完整性。BMEC表达少量的黏附分子,使白细胞黏附于血管壁并发挥免疫作用。在肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)或白细胞介素1β(interleukin-1β,IL-1β)诱导的神经炎症模型中,BMEC与白细胞的黏附性受趋化因子、神经调节蛋白和氧化应激的调控[2]。每平方微米脑毛细血管内皮含有10~14个囊泡,是心肌毛细血管的14倍,提示BMEC经胞吞作用的大分子物质转运较活跃。癫痫等病理状态下,BMEC中囊泡数量上升导致的胞吞作用增强是BBB紊乱的主要原因,吲哚美辛等药物可通过减少囊泡数量维持BBB的功能稳定性。此外,与脑室相邻的下丘脑正中隆起、脑下垂体、脉络丛和松果体中,BMEC上存在直径40~60 nm的圆形窗孔,窗孔被带电荷的隔膜封闭,使血液与脑组织可交换非极性小分子。透射电镜下可见BMEC之间存在宽约4 nm的裂隙,裂隙间存在连接蛋白;且内皮细胞表达的分子呈现极性分布,可限制极性分子以及超过400 ku的大分子通过[3]。

表1 内皮细胞标志物
1.2 星形胶质细胞
星形胶质细胞足突能够诱导BBB的紧密连接(tight junction,TJ)形成,胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、谷氨酸转运体和S100β是其最常见的特异性标志物。近年有研究报道,乙醛脱氢酶1蛋白家族L1作为新应用的鼠类灰质和白质星形胶质细胞的特异性标志物,在胞体和突起中均能着色,原位杂交和免疫组化的切片染色效果优于GFAP[4]。星形胶质细胞释放的转化 生 长 因 子 β1(transforming growth factor-β1,TGF-β1)、IL-6、胶质细胞源性神经营养因子和碱性成纤维细胞生长因子可改变BMEC的屏障特征,而BMEC释放的白血病抑制因子可诱导星形胶质细胞分化[5]。星形胶质细胞足突上高度表达水通道蛋白4(aquaporin 4,AQP4)。在病理条件下,AQP4表达障碍、排列紊乱,导致水分子跨膜转运功能受阻[6]。AQP4基因敲除小鼠的星形胶质细胞GFAP表达下调,足突肿胀,BMEC的TJ表达下调,血管周的足突覆盖面积下降,最终导致BBB通透性升高[7]。目前发现的星形胶质细胞内向整流K+通道有Kir2.1,2.3,3.1,4.1和5.1。细胞外间隙K+浓度升高时,Kir4.1开放使K+进入星形胶质细胞并转运至血管内,从而清除细胞外高浓度K+[8]。
1.3 小胶质细胞
小胶质细胞的鉴定主要采用离子钙接头蛋白1(ionized calcium binding adaptor molecule-1,Iba-1)免疫染色[9]。脑缺血和神经炎症等病理条件下,Toll样受体 4(Toll-like receptor 4,TLR4)、γ 干扰素(interferon-γ,IFN-γ)等通路可单独或协同激活小胶质细胞,促使细胞因子分泌和组织相容性抗原表达,从而发挥吞噬和抗原呈递作用[10]。小胶质细胞具有神经毒性和神经保护的双重作用。肾上腺素诱导的BBB开放模型中,IgG可以从血浆进入脑组织并激活小胶质细胞Fcγ受体Ⅰ/脾酪氨酸激酶通路,促进下游抑炎因子IL-4和IL-10分泌[11]。Yenari等[12]在BMEC和星形胶质细胞共培养BBB模型中加入小胶质细胞,发现总体系中乳酸脱氢酶活性增强,细胞死亡数量上升;小胶质细胞活化抑制剂米诺环素可明显改善上述细胞毒性,减少小胶质细胞在损伤区域的过度聚集,从而降低脑梗死区域体积并减少神经功能缺陷。小胶质细胞TLR4通路活化后过量分泌TNF-α,可致MDCK细胞TJ蛋白密封蛋白1(claudin-1)表达下调,闭锁小带蛋白1(zonula occluden 1,ZO-1)结构断裂产生碎片[13]。
1.4 周细胞
周细胞覆盖22%~32%的脑毛细血管外腔,其常用标志物有血小板衍生生长因子受体β(plateletderived growth factor receptor-β,PDGFR-β),CD13和Kir6.1[14]。周细胞可表达多种TJ蛋白和转运蛋白[15]。周细胞与BMEC经PDGF/PDGFR-β通路相互黏附,且均能通过分泌TGF-β1抑制成熟血管壁细胞的迁移,从而维持BBB的屏障特性[16]。周细胞可抑制共培养BMEC组织纤溶酶原激活剂的表达,但增强Ⅰ型纤溶酶原激活物抑制因子的表达,即周细胞通过负向调节BMEC纤维蛋白溶解来维持血管壁完整性[17]。Gerhardt等[18]研究发现,在血管形成期,阻断周细胞与BMEC间的神经钙黏蛋白,可致周细胞黏附性下降、血管生成障碍或异位,甚至发生脑部大出血。脑缺血状态下,周细胞通过缩紧BMEC使毛细血管直径降低并维持血流,但周细胞死亡数量急剧增加,最终导致BBB结构破坏[19]。周细胞功能缺陷的PDGF基因敲除小鼠中,BBB对水和小分子量示踪剂的通透性显著上升[20]。PDGFR-β+/-转基因小鼠的大脑皮质和海马的渗透性表面产物升高,TJ蛋白ZO-1和闭合蛋白(occludin)表达下调,脑组织中堆积的神经毒性和血管毒性物质无法清除[21]。
1.5 BBB的内侧血管基膜
BBB的内侧血管基膜主要由BMEC和周细胞分泌,含有层粘连蛋白411(laminin α4β1γ1,LN411)和LN511;外侧实质基膜由星形胶质细胞分泌,含有LN111和LN211。基膜主要成分LN、Ⅳ型胶原和纤连蛋白(fibronectin,FN)等[22-23]。机体发生炎症时,细胞外基质中断裂的透明质酸等可激活白细胞TLR通路,分泌TNF和TGF-β并调控基质金属蛋白酶(matrix metalloproteinase,MMP)和趋化因子的表达,从而激活免疫系统并重塑细胞外基质[24]。LN411-/-转基因小鼠中,LN511可在脉管系统中稳定表达并通过整合素α6β1使T淋巴细胞无法进入脑组织,在机体炎性反应时,维持CNS稳定性[25]。Savettieri等[26]研究报道,Ⅳ型胶原能上调BMEC中TJ蛋白闭合蛋白的mRNA表达。Tilling等[27]研究发现,采用Ⅳ型胶原、LN和FN单独包被培养板能提高BMEC细胞培养体系的跨膜电阻(trans-epithellal electric resistance,TEER)。此外,LN111通过整合素α2调节周细胞分化,使其表达少量PDGFR-β和收缩蛋白。LN基因敲除小鼠中,周细胞PDGFR-β和收缩蛋白表达上调,包被周细胞的基膜破碎分散,脑实质伊文思蓝染色的荧光强度高于对照组,转运体AQP4、连接蛋白闭合蛋白和密封蛋白5表达下调[28]。
2 影响BBB渗透性的重要蛋白分子
2.1 紧密连接
2.1.1 闭合蛋白
闭合蛋白主要存在于CNS内皮细胞,相对分子质量为65 ku。闭合蛋白结构见图1,其通过细胞外环(extracellular loop,EL)与相邻细胞形成闭合蛋白-闭合蛋白二聚体,在细胞间隙中形成TJ。COOH端含有磷酸化位点,经信号转导参与BMEC渗透性调节。敲除闭合蛋白的NH2端后,细胞的TJ蛋白缺失严重,渗透系数(permeability coefficient,Pe)和TEER异常。但也有研究显示,闭合蛋白-/-基因敲除小鼠BBB中TJ形态和屏障功能正常,可能是其他TJ蛋白代偿表达所致;该研究同时观察到基底核和小脑中出现钙、磷化合物片状沉积,微静脉和毛细血管管壁可见钙点状沉积,提示闭合蛋白参与脑组织钙、磷离子转运调节[29]。BMEC中β分泌酶过量并抑制闭合蛋白表达,该过程对淀粉样脑血管病的发生起重要作用[30]。外伤性脑损伤时,过表达的轴突导向因子可上调闭合蛋白表达,维持TJ结构完整性,减少外源性物质的细胞旁路渗透[31]。闭合蛋白参与BMEC细胞分化和信号传导。血管内皮生长因子(vascular endothelial growth factors,VEGF)可激活蛋白激酶C(protein kinase C,PKC)信号通路,致使闭合蛋白磷酸化并影响BMEC渗透性。
2.1.2 密封蛋白
目前发现的密封蛋白家族有27种蛋白亚型,序列一致性为12.5%~69.7%,相对分子质量20~34 ku。密封蛋白结构(图1)与闭合蛋白类似,但无序列同源性[32]。哺乳动物BBB中主要表达密封蛋白5,也可表达少量的密封蛋白1,2,3,11,12和18。密封蛋白对维持BBB结构和功能稳定具有重要作用,其表达异常与脑肿瘤、阿尔茨海默症等多种CNS疾病有关[33]。密封蛋白5的基因和蛋白表达受性别决定区Y盒蛋白18调控[34]。发生缺血性脑损伤时,密封蛋白5-/-可被MMP-9降解,导致BBB通透性升高。密封蛋白5-/-小鼠脑组织中未见出血和水肿,BMEC形态正常,但对相对分子质量<800 ku的小分子物质的通透性升高[35]。近年有研究表明,密封蛋白参与细胞应激、胞内Ca2+吸收、肠道稳态调节和胚胎形态发生等过程[36-37]。
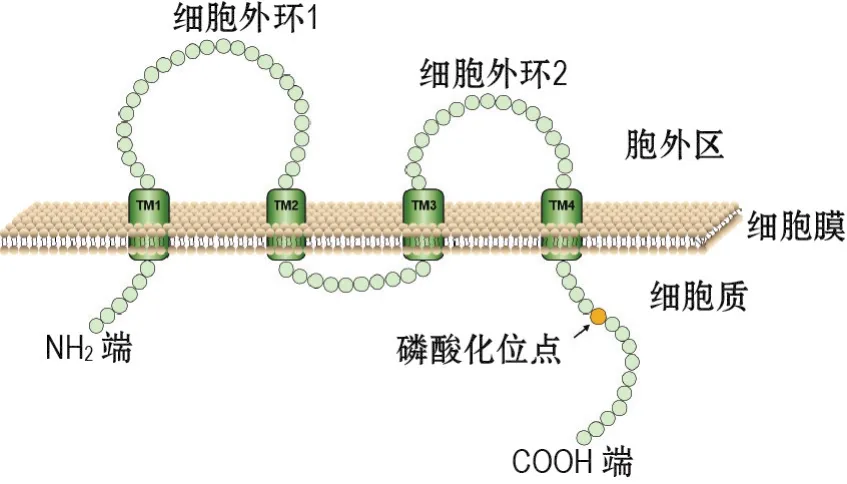
图1 闭合蛋白和密封蛋白结构.闭合蛋白和密封蛋白亚型的NH2端、COOH端、跨膜区(TM)和细胞外环所含的氨基酸数量不同.
2.1.3 Tricellulin
Tricellulin(TRIC)蛋白表达于BMEC和星形胶质细胞,含有TRIC-a,a1,b和c 4种亚型,相对分子质量分别为64,62,54和52 ku,可通过EL2形成TRIC-TRIC多聚肽,也可形成TRIC-闭合蛋白杂聚肽[38]。TRIC主要存在于3个细胞间,限制4~10 ku大分子物质转运,但不影响离子渗透性;极少量存在于2个细胞间,调节不同大小的溶质转运。在敲除闭合蛋白的细胞中,大量TRIC错位分布于2个细胞间[39]。质粒转染的TRIC低表达细胞中,Pe显著升高。重金属铅暴露可下调脑组织TRIC蛋白表达,且通透性升高,转染高表达TRIC质粒可使屏障功能恢复正常。机体炎性反应时,TRIC蛋白表达下调,而密封蛋白2蛋白表达上调,TEER降低且Pe升高。采用IL-13处理细胞或染毒大鼠均可观察到与炎性反应一致的结果。IL-13通过多种途径影响BBB中TJ蛋白表达,经IL-13R2α受体激活c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)、细胞外信号调节激酶1和2(extracellular signal-regulated kinases 1 and 2,ERK1/2)通路并下调TRIC表达;经IL-13R1α和IL-4Rα受体活化丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)、信号转导和转录激活因子6(signal transducers and activator of transcription 6,STAT6)、磷脂酰肌醇3激酶(phosphatidyl inositol 3 kinase,PI3K)通路并上调密封蛋白2表达[40]。
2.1.4 连接黏附分子
连接黏附分子(junctional adhesion molecules,JAM)含JAM-A,B,C,4和L 5种亚型,其中JAM-A主要表达于内皮细胞、上皮细胞和白细胞,相对分子质量为32 ku[41]。JAM(图2)通过2个Ig样EL形成同源性TJ,经磷酸化位点参与PI3K和Ras/Raf/MAPK等通路的调控[42]。在内皮细胞表面,JAM-A与整合素αvβ3形成蛋白复合物,促使碱性成纤维细胞生长因子激活MAPK信号通路,从而参与血管生成[43]。促炎因子TNF-α和IFN-γ单独作用时可促使黏附分子跨膜迁移并黏附于内皮细胞,但两者共同处理细胞时,细胞连接处的JAM-A消失但总量未发生改变,提示JAM-A重分布[44]。JAM-A的D2区可结合整合素αLβ2的β2亚基,介导T细胞、白细胞的跨内皮细胞转运和黏附[45]。BV11单克隆抗体可阻断该转运过程,但不影响D1区同源二聚体的形成和细胞旁路的物质转运。
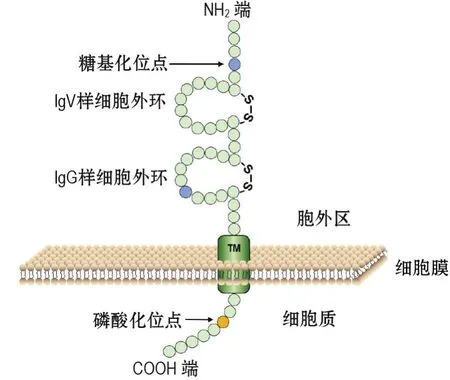
图2 连接黏附分子蛋白结构.
2.1.5 闭锁小带蛋白
ZO包括ZO-1,ZO-2和ZO-33种亚型,相对分子质量分别为220,160和130 ku。由图3可见,ZO-1蛋白包含多个功能性结构域,可结合不同的蛋白发挥多种生理功能[46]。BMEC中的吞蛋白1(endophilin-1,Endo-1)可通过表皮生长因子受体-ERK1/2通路调节ZO-1表达,Endo-1过表达可抑制ZO-1并增强细胞旁路渗透,短发夹RNA(shRNA)干扰Endo-1表达后,ZO-1表达升高且细胞旁路渗透性降低[47]。Tornavaca 等[48]采用小干扰 RNA(siRNA)沉默微血管内皮细胞和小鼠ZO-1表达,发现细胞在愈合迁移实验中的移动性下降,纤维凝胶血管生成实验中血管芽数量少且长度短,小鼠皮下种植的基质凝胶中血管生成量低于野生型对照组;同时发现,ZO-1缺失可使肌球蛋白IIA和β肌动蛋白重分布,进一步导致连接力传导因子黏着斑蛋白和P21激活激酶表达下调,黏着斑蛋白与α-联蛋白(α-catenin)VE-钙黏蛋白复合物分离,连接蛋白VE-钙黏蛋白的张力降低,最终导致细胞间连接力降低。此外,ZO-1可通过Ras/Raf/MAPK通路介导细胞信号转导。
2.2 黏附连接
2.2.1 血管内皮钙黏蛋白
VE-钙黏蛋白仅表达于血管内皮细胞,通过5个EL形成同源性TJ,经TGF-βR和PI3K等信号通路参与功能调节[49]。在血管生成和成熟过程中,整合素β1可介导VE-钙黏蛋白在内皮细胞中的定位及黏附连接(adherens junction,AJ)形成[50]。毒蕈碱型乙酰胆碱受体M3可促进Rac1活性,以此维持VE-钙黏蛋白/β-联蛋白复合物与肌动蛋白细胞骨架的连接[51]。VE-钙黏蛋白的COOH端有9个磷酸化位点,其中Y654,Y658,Y685,Y731和Y733参与BBB紧密性调节[52]。钙池操纵性Ca2+内流时,血管内皮细胞的Pyk2被激活,诱导VE-PTP的酪氨酸磷酸化并结合Src,活化的Src进一步诱导VE-钙黏蛋白磷酸化,最终导致内皮渗透性升高。此外,VEGF和LPS等可使VE-PTP与VE-钙黏蛋白分离,导致血管渗透性降低,白细胞外渗[53]。
2.2.2 血小板内皮细胞黏附分子
血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecule-1,PECAM-1)存在于内皮细胞、血小板和白细胞中,相对分子质量为130 ku[54],其蛋白结构见图4。PECAM-1基因第3外显子C+373G的Leu125Val突变可影响其蛋白同源二聚体的形成,是引发中国人群血管病变的重要遗传易患因素[55]。PECAM-1调控β-联蛋白在内皮细胞中的定位及其磷酸化水平,也可将γ-联蛋白募集至血管内皮细胞间连接处以维持自身在细胞骨架中的稳定性。PECAM-1刺激整合素α6β1,α4β1,β2和α2bβ3的表达,促进中性粒细胞跨过内皮细胞和基底膜进行迁移,参与免疫、炎症和愈合等过程[56]。在基质衍生因子刺激下,PECAM-1-/-小鼠的成熟巨核细胞因缺失基质衍生因子受体CXCR4而无法发生迁移[57]。PECAM-1可与整合素β3形成异源性复合物,促进脑血管发生。PECAM-1可感应BMEC的流体剪切应力、渗透压休克等机械力变化,使Tyr-663和Tyr-686磷酸化并结合SHP-2,激活Ras-d/2和JNK通路,引起胞核内相关基因表达变化[58]。此外,PECAM-1上调抗凋亡蛋白胱天蛋白酶3,Bcl-2、A1和STAT的表达,抑制凋亡通路PI3K/蛋白激酶B(protein kinase B,AKT),由此调控脑血管细胞凋亡[59]。
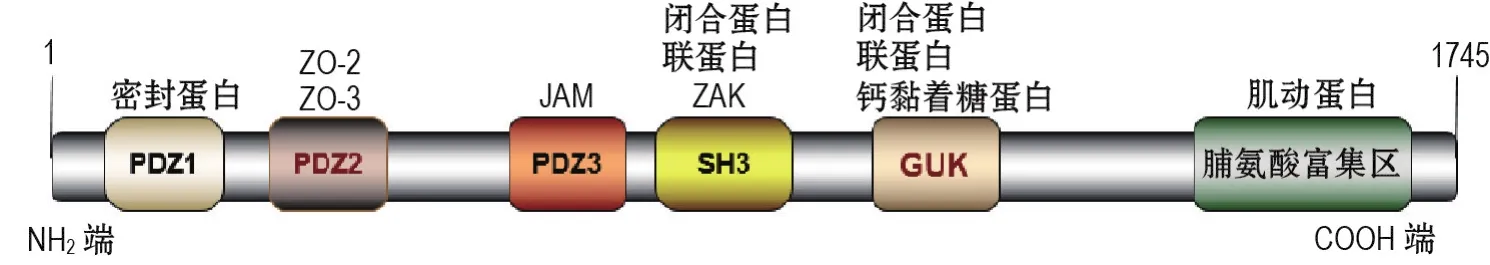
图3 闭锁小带蛋白1(ZO-1)蛋白结构示意图.ZO-1包含1745个氨基酸,划分为5个功能性结构域和1个脯氨酸富集区,通过结合不同的蛋白发挥相应的生理功能.PDZ:突触后密度蛋白PSD-95/果蝇肿瘤抑制蛋白DLG-A/ZO-1;SH3:Src同源结构域3;GUK:鸟苷酸激酶结构域;JAM:连接黏附因子;ZAK:紧密连接相关激酶.
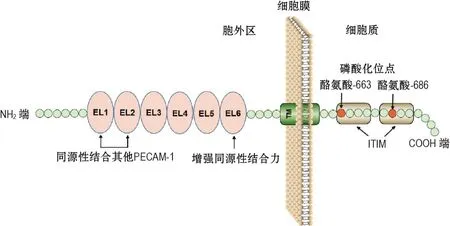
图4 血小板内皮细胞黏附分子1(PECAM-1)蛋白结构.EL6可增强EL1和EL2介导的同源性结合力,免疫受体酪氨酸抑制基序(ITIM)结构域包含2个酪氨酸磷酸化位点.EL:细胞外环.
2.3 转运体
2.3.1 离子转运体
TJ和AJ严格限制了BBB的细胞旁路运输,仅O2、CO2和小分子质量脂质分子可自由通过,BMEC上的Na+-K+-ATP酶、Na+-K+-2Cl-、Na+-HCO3-共转运体、Na+/H+和Na+/Ca2+交换体为离子转运提供了通道。Na+-K+-ATP酶在脑中含量较高,在酶构象的快速改变过程中消耗1个ATP能量,完成3个Na+和2个K+的主动转运[60]。Na+-K+-2Cl-依靠Na+-K+-ATP酶产生的Na+浓度差势能将1个Na+,1个K+和2个Cl-同向转运至胞内。细胞内的碳酸酐酶将CO2和H2O转化为H+和HCO3-,细胞膜外侧的Na+/H+交换体将H+排出胞外,Na+交换进入胞内。Na+/Ca2+交换体介导Na+内流、Ca2+外排(Na+∶Ca2+=3∶1)的前向模式和Na+外排、Ca2+内流(Na+∶Ca2+=1∶1)的反向模式[61]。此外,金属转运蛋白和AQP4等参与BBB中Hg2+,Zn2+,Pb2+,Fe2+和Mn2+等离子转运[62]。离子转运体协同作用可维持细胞渗透压、pH和膜电位稳定。
BBB毛细血管管腔侧和基底膜侧可表达多种溶质载体蛋白,主要包括单羧酸转运蛋白(monocarboxylate transporter,MCT)、有机阴离子转运多肽(organic anion transporting polypeptide,OATP)、有机阴离子转运体(organic anion transporter,OAT)和有机阳离子转运体(organ cation transporter,OCT)[63]。MCT双向转运青霉素和水杨酸等一元羧酸药物。OATP介导BBB代谢物外排及普伐他汀(pravastatin)和非索非那定(fexofenadine)等药物摄取,牛胆酸为其活性抑制剂。OAT转运环磷腺苷酸、神经递质、抗癫痫药和抗病毒药等,西咪替丁(cimetidine)可抑制OAT的活性。OCT可转运神经毒素和单胺类神经递质等内源性物质,也可转运地昔帕明(desipramine)和奎尼丁(quinidine)等外源性药物,甲非他明(methamphetamine)可抑制OCT的活性。
2.3.2 分子转运体
ABC转运体(ATP-binding cassette transporter)是BBB最重要的脂溶性分子外排转运体,分为ABC A~H共8种亚型,依靠ATP水解产生的能量排出有害物质,减少药物等在脑组织中的蓄积,但也增加了CNS靶向药物的给药难度[64]。目前研究较多的ABC转运体有P-糖蛋白(P-glycoprotein,P-gp,ABCB1)、多药耐药蛋白(multidrug resistance protein,MRP,ABCC)和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP,ABCG2),3 种蛋白均高表达于脑毛细血管内腔侧[65]。TNF-α/PKCβ/磷酸鞘氨醇1受体1型通路可通过调控ET受体和一氧化氮信号分子使P-gp活性增强,而VEGF通过激活flk-1及其下游Src激酶使陷窝蛋白(caveolin)-1磷酰化,最终降低P-gp活性。雌激素受体通路可激活PI3K,GSK,PTEN和AKT等信号分子,分解BCRP转运蛋白[66]。帕金森病、阿尔茨海默症、抑郁症和癫痫等疾病中,P-gp,MRP和BCRP均表达异常。此外,BBB中存在大量葡萄糖转运体、氨基酸载体和胰岛素受体等转入蛋白为脑组织提供营养物质[67]。
3 BBB渗透性影响因素
机体的年龄、体温、血液酸碱度和内分泌系统差异可影响BBB渗透性,但难以通过内源性因素的控制来提高CNS治疗性药物的药效。利用BBB渗透性改变的细胞和分子机制,在药物设计阶段对分子理化特征加以优化,结合生物学新材料和新技术的应用,可突破常规的剂型和转运限制,大幅度提高药物在脑组织中的蓄积量,降低对外周系统的潜在毒性风险。
3.1 药物的理化特征
BBB高渗透性药物分子通常具有的理化特征包括:相对分子质量<400;极性表面积<80 Å2;截面积<70 Å2;脂溶性好;含少量正电荷;氢键供体较少,氮、氧原子总数≤5;辛醇/水分配系数为1~3[68]。目前,药物定量构效关系研究充分考虑了分子理化特性对BBB渗透性的影响,已出现多种相关性较高的BBB渗透性预测方程。CNS靶向药物设计时,可将有效成分进行酯化、酰胺化,增强其脂溶性,但同时会增加药物的毒副作用。此外,可在递药系统表面修饰正电荷,与BBB膜表面阴离子结合,诱导胞吞转运。Rousselle等[69]采用带正电荷、含疏水残基的SynB1与抗癌药多柔比星制成SynB1-多柔比星复合物,对大鼠颈动脉原位灌注后发现,穿透BBB并转运到脑实质的多柔比星含量高于对照组20倍。
3.2 RNA干扰
RNA干扰可通过诱导BBB关键分子的mRNA在体内降解,导致转录后基因沉默,从而使屏障相关蛋白无法表达。在神经胶质瘤细胞系和BMEC共培养体系中,采用shRNA沉默维持屏障特性和血管发生的Robo4,发现下调ZO-1和闭合蛋白的Scr和ERK1/2通路被激活,分解密封蛋白5的MMP-9表达上调,ZO-1、闭合蛋白和密封蛋白5蛋白表达均下调且TEER降低,BBB渗透性升高有利于抗癌药物进入脑组织[70]。采用siRNA沉默MDCK细胞的ZO-1蛋白表达,发现闭合蛋白、密封蛋白和扣带蛋白下调,TEER降低且Pe升高,粒径<4 Å的溶质渗透性增强[71]。在BMEC细胞培养体系和C57/B16小鼠中,均采用siRNA同时抑制闭合蛋白和密封蛋白5,结果可见,BMEC的TEER降低且Pe升高,右旋糖酐(3 ku)转运增强,而凝集素(10 ku)转运无明显变化;小鼠脑组织中β淀粉样蛋白经细胞旁路的排出量增加,在脑组织与血浆中的浓度比值下降,最终使小鼠空间记忆水平升高[72]。
3.3 模拟肽
外源性肽经口服后在体内被大量降解代谢,且肽类分子的柔性使其以多种构象被非药效受体识别后产生毒副作用。此外,外源性肽难以穿透BBB,无法有效治疗CNS疾病。为克服天然肽的自身缺陷,可设计短链多肽并对其结构进行改造或替换以制成模拟肽,提高肽类药物的生物学活性。
模拟密封蛋白1所设计的C1C2模拟肽可被细胞囊泡摄取。采用C1C2处理MDCK细胞。结果可见,密封蛋白和闭合蛋白的细胞内定位增加,细胞膜上形成的TJ不连续。C1C2处理BMEC可致其TEER降低且呈时间-效应关系,荧光黄(0.4 ku)和右旋糖酐(3 ku)的转运均增强[73]。给Wistar大鼠注射C1C2模拟肽可下调神经组织中密封蛋白的mRNA和蛋白表达[74]。C1C2对BBB渗透性的影响与密封蛋白和闭合蛋白在细胞内重新分布定位有关。
小带毒素(ZO toxin,Zot)是霍乱弧菌产生的内毒素,可结合蛋白酶活化受体2,导致TJ屏障短暂性开放。以Zot为基础设计的AT1002模拟肽包含Zot活性域,但其在体内易形成半胱氨酸-半胱氨酸二聚体,且在中性和弱碱性介质中失活,限制了AT1002的使用和疗效。为此,采用烯丙基甘氨酸替代2号位的半胱氨酸可减少二聚体形成,或采用5%右旋葡萄糖预处理AT1002使其在中性介质中维持活性长达6 h,保留AT1002的TJ屏障调节能力并提升利用价值。AT1002可使Caco-2和BMEC的TEER降低,白蛋白(65 ku)和荧光素(376 u)的转运增强,与ZO-1和闭合蛋白在细胞内重新分布定位有关[75]。
3.4 纳米材料
纳米材料能够以被动扩散、转胞吞和跨细胞间隙等方式穿透BBB。治疗药物包被于病毒、脂质、聚合物和陶瓷等纳米载体,以特洛伊木马方式进入细胞,解体并释放内含药物。用于诊断和追踪的纳米颗粒包括荧光纳米球和磁纳米颗粒等,通过成像技术观察靶标中纳米颗粒的富集程度。Kolter等[76]制备了Tween-80表面活性剂修饰的酯类载药纳米颗粒,处理BMEC可致其TEER降低且呈时间-效应和浓度-效应关系,低于3 h和500 mg·L-1时不影响BMEC的代谢活性和细胞活性,炎症因子和趋化因子的表达水平无明显变化,肝、肾、血液功能均未见异常。纳米材料应用时需严密监测其可能导致的毒性。SD大鼠BMEC和星形胶质细胞共培养体系中,通过透射电镜可见到纳米银致BMEC的TJ连接断裂、细胞间隙增宽、细胞空泡化、细胞器坏死、粗面内质网脱颗粒并解聚和线粒体肿胀等损伤[77]。
3.5 高频聚焦超声
高频聚焦超声(high-frequency focused ultra-sound,HIFU)利用超声的组织穿透性、定位性和能量沉积性,通过热效应、空化效应和机械效应使靶标部位吸收能量快速升温。de Smet等[78]采用HIFU加热大鼠神经胶质瘤至42℃,经尾静脉注射包裹化疗药物多柔比星的温度敏感脂质体,脂质体开放释出药物,7 d后神经胶质瘤中的多柔比星含量显著高于空白对照组,同时血药浓度低于对照组。Park等[79]发现大鼠脑组织经HIFU干扰后,脑组织中阿霉素的容量转移常数Ktrans显著高于对照组,且HIFU区域HE染色切片未见明显病理损伤。现有研究发现,HIFU可使内源性IgG和IgM抗体穿过BBB并清除脑内淀粉样蛋白斑,为阿尔兹海默症的治疗提供了新思路[72]。
4 展望
随着分子生物学和医学工程的快速发展,BBB的研究方法不断改进。体外研究方面,BMEC、星形胶质细胞、周细胞、神经元等单培养和共培养技术已较为成熟,但静态的培养模型缺少血流动力学因素,故模仿流体剪切应力的3D流动模型发展迅速[80]。同时,可分化为BMEC的干细胞、兼具内皮和上皮特性的非脑源性ECV304细胞系,以及无细胞的仿生物膜技术如磷脂膜色谱法、平行人造膜通透性评价法、固体支撑脂质膜法等已应用于BBB研究[81]。体内研究方面,传统的电子显微镜、功能磁共振成像、正电子发射型计算机断层显像、单光子发射计算机化断层显像、定量放射自显影等影像技术,以及单次颈动脉注射技术、原位脑灌流技术、脑内微透析法等提供了多种BBB研究的方法学选择[82]。果蝇和斑马鱼等模式生物被引入BBB研究,其中斑马鱼的成本较低,与人类BBB的基因序列同源性高达45%~70%,大部分转运体、受体等相似,且幼虫阶段的斑马鱼是透明的,适于示踪性药物代谢和筛选研究[83]。计算毒理学方面,在神经生理和神经行为研究结果基础上,兼顾分子特性和组织差异性的定量构效关系和生理药代动力学模型广泛应用,已出现多种BBB内向转运和外向排出的预测方法[84-85]。
与此同时,应认识到现有BBB研究中存在的不足。BBB损伤中的分子起始事件、BBB中各种细胞和分子的相互作用关系、不同脑区的BBB特征差异、最佳的体外BBB模拟条件等关键问题尚未明确。加强BBB渗透性影响因素研究,将为CNS治疗性药物的高效跨屏障转运和药效发挥提供新的思路和方法。
参考文献:
[1] Xu B,Zhang Y,Du XF,Li J,Zi HX,Bu JW,et al.Neurons secrete miR-132-containing exosomes to regulate brain vascular integrity[J].Cell Res,2017,27(7):882-897.
[2] O′Carroll SJ,Kho DT,Wiltshire R,Nelson V,Rotimi O,Johnson R,et al.Pro-inflammatory TNFα and IL-1β differentially regulate the inflammatory phenotype of brain microvascular endothelial cells[J/OL].J Neuroinflammation,2015,12:131(2015-07-08).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4506411/
[3] Khanna AK,Farag E.Essentials of Neuroanesthesia[M].Amsterdam:Elsevier Press,2017:51-58.
[4] Cahoy JD, Emery B, Kaushal A, Foo LC,Zamanian JL,Christopherson KS,et al.A transcriptome database for astrocytes,neurons,and oligodendrocytes:a new resource for understanding brain development and function[J].J Neurosci,2008,28(1):264-278.
[5] Alvarez JI,Katayama T,Prat A.Glial influence on the blood brain barrier[J].Glia,2013,61(12):1939-1958.
[6] Stokum JA,Kurland DB,Gerzanich V,Simard JM.Mechanisms of astrocyte-mediated cerebral edema[J].Neurochem Res,2015,40(2):317-328.
[7] Zhou J,Kong H,Hua X,Xiao M,Ding J,Hu G.Altered blood-brain barrier integrity in adult aquaporin-4 knockout mice[J].Neuroreport,2008,19(1):1-5.
[9] Guillemin GJ,Brew BJ.Microglia,macrophages,perivascular macrophages,and pericytes:a review of function and identification[J].J Leukoc Biol,2004,75(3):388-497.
[10] da Fonseca AC,Matias D,Garcia C,Amaral R,Geraldo LH,Freitas C,et al.The impact of microglial activation on blood-brain barrier in brain diseases[J/OL].Front Cell Neurosci,2014,8:362(2014-11-03).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4217497/
[11] Li YN,Qin XJ,Kuang F,Wu R,Duan XL,Ju G,et al.Alterations of Fc gamma receptorⅠand Toll-like receptor 4 mediate the antiinflammatory actions of microglia and astrocytes after adrenaline-induced blood-brain barrier opening in rats[J].J Neurosci Res,2008,86(16):3556-3565.
[12] Yenari MA,Xu L,Tang XN,Qiao Y,Giffard RG.Microglia potentiate damage to blood-brain barrier constituents:improvement by minocyclinein vivoandin vitro[J].Stroke,2006,37(4):1087-1093.
[13] Poritz LS,Garver KI,Tilberg AF,Koltun WA.Tumor necrosis factor alpha disrupts tight junction assembly[J].J Surg Res,2004,116(1):14-18.
[14] Kamouchi M,Ago T,Kitazono T.Brain pericytes:emerging concepts and functional roles in brain homeostasis[J].Cell Mol Neurobiol,2011,31(2):175-193.
[15] Shimizu F, Sano Y, Maeda T, Abe MA,Nakayama H,Takahashi R,et al.Peripheral nerve pericytes originating from the blood-nerve barrier expresses tight junctional molecules and transporters as barrier-forming cells[J].J Cell Physiol,2008,217(2):388-399.
[16] Sá-Pereira I,Brites D,Brito MA.Neurovascular unit:a focus on pericytes[J].Mol Neurobiol,2012,45(2):327-347.
[17] Kim JA,Tran ND,Li Z,Yang F,Zhou W,Fisher MJ.Brain endothelial hemostasis regulation by pericytes[J].J Cereb Blood Flow Metab,2006,26(2):209-217.
[18] Gerhardt H,Wolburg H,Redies C.N-cadherin mediates pericytic-endothelial interaction during brain angiogenesis in the chicken[J].Dev Dyn,2000,218(3):472-479.
[19] Hall CN,Reynell C,Gesslein B,Hamilton NB,Mishra A,Sutherland BA,et al.Capillary pericytes regulate cerebral blood flow in health and disease[J].Nature,2014,508(7494):55-60.
[20] Armulik A,Genové G,Mäe M,Nisancioglu MH,Wallgard E,Niaudet C,et al.Pericytes regulate the blood-brain barrier[J].Nature,2010,468(7323):557-561.
[21] Bell RD,Winkler EA,Sagare AP,Singh I,LaRue B,Deane R,et al.Pericytes control key neurovascular functions and neuronal phenotype in the adult brain and during brain aging[J].Neuron,2010,68(3):409-427.
[22] Daneman R,Prat A.The blood-brain barrier[J/OL].Cold Spring Harb Perspect Biol,2015,7(1):a020412(2015-01-05).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4292164/
[23] Thomsen MS,Routhe LJ,Moos T.The vascular basement membrane in the healthy and pathological brain[J].J Cereb Blood Flow Metab,2017,37(10):3300-3317.
[24] Sorokin L.The impact of the extracellular matrix on inflammation[J].Nat Rev Immunol,2010,10(10):712-723.
[25] Wu C,Ivars F,Anderson P,Hallmann R,Vestweber D,Nilsson P,et al.Endothelial basement membrane laminin alpha5 selectively inhibits T lymphocyte extravasation into the brain[J].Nat Med,2009,15(5):519-527.
[26] Savettieri G,Di Liegro I,Catania C,Licata L,Pitarresi GL,D′Agostino S,et al.Neurons and ECM regulate occludin localization in brain endothelial cells[J].Neuroreport,2000,11(5):1081-1084.
[27] Tilling T, Engelbertz C, Decker S, Korte D,Hüwel S,Galla HJ.Expression and adhesive properties of basement membrane proteins in cerebral capillary endothelial cell cultures[J].Cell Tissue Res,2002,310(1):19-29.
[28] Yao Y,Chen ZL,Norris EH,Strickland S.Astrocytic laminin regulates pericyte differentiation and maintains blood brain barrier integrity[J/OL].Nat Commun,2014,5:3413(2014-03-03).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3992931/
[29] Saitou M,Furuse M,Sasaki H,Schulzke JD,Fromm M,Takano H,et al.Complex phenotype of mice lacking occludin,a component of tight junction strands[J].Mol Biol Cell,2000,11(12):4131-4142.
[30] Cheng X,He P,Yao H,Dong Q,Li R,Shen Y.Occludin deficiency with BACE1 elevation in cerebral amyloid angiopathy[J].Neurology,2014,82(19):1707-1715.
[31] Wen J,Qian S,Yang Q,Deng L,Mo Y,Yu Y.Overexpression of netrin-1 increases the expression of tight junction-associated proteins,claudin-5,occludin,and ZO-1,following traumatic brain injury in rats[J].Exp Ther Med,2014,8(3):881-886.
[32] Gupta IR,Ryan AK.Claudins:unlocking the code to tight junction function during embryogenesis and in disease[J].Clin Genet,2010,77(4):314-325.
[33] Cardoso FL,Brites D,Brito MA.Looking at the blood-brain barrier:molecular anatomy and possible investigation approaches[J].Brain Res Rev,2010,64(2):328-363.
[34] Fontijn RD,Volger OL,Fledderus JO,Reijerkerk A,de Vries HE,Horrevoets AJ.SOX-18 controls endothelial-specific claudin-5 gene expression and barrier function[J].Am J Physiol Heart Circ Physiol,2008,294(2):H891-H900.
[35] Nitta T,Hata M,Gotoh S,Seo Y,Sasaki H,Hashimoto N,et al.Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice[J].J Cell Biol,2003,161(3):653-660.
[36] Capaldo CT,Nusrat A.Claudin switching:physiological plasticity of the tight junction[J].Semin Cell Dev Biol,2015,42:22-29.
[37] Ahmad R,Kumar B,Chen Z,Chen X,Müller D,Lele SM,et al.Loss of claudin-3 expression induces IL6/gp130/Stat3 signaling to promote colon cancer malignancy by hyperactivating Wnt/β-catenin signaling[J].Oncogene,2017,36(47):6592-6604.
[38] Mariano C,Sasaki H,Brites D,Brito MA.A look at tricellulin and its role in tight junction formation and maintenance[J].Eur J Cell Biol,2011,90(10):787-796.
[39] Ikenouchi J,Sasaki H,Tsukita S,Furuse M,Tsukita S.Loss of occludin affects tricellular localization of tricellulin[J].Mol Biol Cell,2008,19(11):4687-4693.
[40] Krug SM,Bojarski C,Fromm A,Lee IM,Dames P,Richter JF,et al.Tricellulin is regulated via interleukin-13-receptor α2,affects macromolecule uptake,and is decreased in ulcerative colitis[J/OL].Mucosal Immunol,2017(2017-06-14).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5730503/
[41] Arcangeli ML,Frontera V,Aurrand-Lions M.Function of junctional adhesion molecules(JAMs)in leukocyte migration and homeostasis[J].Arch Immunol Ther Exp(Warsz),2013,61(1):15-23.
[42] Jia W,Martin TA,Zhang G,Jiang WG.Junctional adhesion molecules in cerebral endothelial tight junction and brain metastasis[J].Anticancer Res,2013,33(6):2353-2359.
[43] Naik MU,Mousa SA,Parkos CA,Naik UP.Signaling through JAM-1 and alphavbeta3 is required for the angiogenic action of bFGF:dissociation of the JAM-1 and alphavbeta3 complex[J].Blood,2003,102(6):2108-2114.
[44] Ozaki H,Ishii K,Horiuchi H,Arai H,Kawamoto T,Okawa K,et al.Cutting edge:combined treatment of TNF-alpha and IFN-gamma causes redistribution of junctional adhesion molecule in human endothelial cells[J].J Immunol,1999,163(2):553-557.
[45] Ostermann G,Weber KS,Zernecke A,Schröder A,Weber C.JAM-1 is a ligand of the beta 2 integrin LFA-1 involved in transendothelial migration of leukocytes[J].Nat Immunol,2002,3(2):151-158.
[46] Erickson KK,Sundstrom JM,Antonetti DA.Vascular permeability in ocular disease and the role of tight junctions[J].Angiogenesis,2007,10(2):103-117.
[47] Liu W,Wang P,Shang C,Chen L,Cai H,Ma J,et al.Endophilin-1 regulates blood-brain barrier permeability by controlling ZO-1 and occludin expression via theEGFR-ERK1/2pathway[J].Brain Res,2014,1573:17-26.
[48] Tornavaca O,Chia M,Dufton N,Almagro LO,Conway DE,Randi AM,et al.ZO-1 controls endothelial adherens junctions,cell-cell tension,angiogenesis,and barrier formation[J].J Cell Biol,2015,208(6):821-838.
[49] Giannotta M,Trani M,Dejana E.VE-cadherin and endothelial adherens junctions:active guardians of vascular integrity[J].Dev Cell,2013,26(5):441-454.
[50] Yamamoto H,Ehling M,Kato K,Kanai K,van Lessen M,Frye M,et al.Integrin β1 controls VE-cadherin localization and blood vessel stability[J/OL].Nat Commun,2015,6:6429(2015-03-10).http://www.nature.com/articles/ncomms7429
[51] Jiao ZY,Wu J,Wen B,Zhao WZ,Du XL.M3 muscarinic acetylcholine receptor dysfunction inhibits Rac1 activity and disrupts VE-cadherin/β-catenin and actin cytoskeleton interaction[J].Biochem Cell Biol,2014,92(2):137-144.
[52] Gavard J.Endothelial permeability and VE-cadherin:a wacky comradeship[J].Cell Adh Migr,2013,7(6):455-461.
[53] Soni D,Regmi SC,Wang DM,DebRoy A,Zhao YY,Vogel SM,et al.Pyk2 phosphorylation of VE-PTP downstream of STIM1-induced Ca2+entry regulates disassembly of adherens junctions[J].Am J Physiol Lung Cell Mol Physiol,2017,312(6):L1003-L1017.
[54] Feng YM,Chen XH,Zhang X.Roles of PECAM-1 in cell function and disease progression[J].Eur Rev Med Pharmacol Sci,2016,20(19):4082-4088.
[55] Li G,Han ZL,Dong HG,Zhang X,Kong XQ,Jin X.Platelet endothelial cell adhesion molecule-1 gene 125C/G polymorphism is associated with deep vein thrombosis[J].Mol Med Rep,2015,12(2):2203-2210.
[56] Dangerfield J,Larbi KY,Huang MT,Dewar A,Nourshargh S.PECAM-1(CD31)homophilic interaction up-regulates alpha6beta1 on transmigrated neutrophilsin vivoand plays a functional role in the ability of alpha6 integrins to mediate leukocyte migration through the perivascular basement membrane[J].J Exp Med,2002,196(9):1201-1211.
[57] Dhanjal TS,Pendaries C,Ross EA,Larson MK,Protty MB,Buckley CD,et al.A novel role for PECAM-1 in megakaryocytokinesis and recovery of platelet counts in thrombocytopenic mice[J].Blood,2007,109(10):4237-4244.
[58] Meza D,Shanmugavelayudam SK,Mendoza A,Sanchez C,Rubenstein DA,Yin W.Platelets modulate endothelial cell response to dynamic shear stress through PECAM-1[J].Thromb Res,2017,150:44-50.
[59] Brown S,Heinisch I,Ross E,Shaw K,Buckley CD,Savill J.Apoptosis disables CD31-mediated cell detachment from phagocytes promoting binding and engulfment[J].Nature,2002,418(6894):200-203.
[60] Cui X,Xie Z.Protein interaction and Na/K-ATPasemediated signal transduction[J/OL].Molecules,2017,22(6):990(2017-06-14).http://www.mdpi.com/1420-3049/22/6/990
[61] Klumpp L,Sezgin EC,Eckert F,Huber SM.ion channels in brain metastasis[J/OL].Int J Mol Sci,2016,17(9):1513(2016-09-08).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5037790/
[62] Ximenes-da-Silva A.Metal ion toxins and brain aquaporin-4 expression:an overview[J/OL].Front Neurosci,2016,10:233(2016-06-01).http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4887506/
[63] Geier EG,Chen EC,Webb A,Papp AC,Yee SW,Sadee W,et al.Profiling solute carrier transporters in the human blood-brain barrier[J].Clin Pharmacol Ther,2013,94(6):636-639.
[64] Beis K.Structural basis for the mechanism of ABC transporters[J].Biochem Soc Trans,2015,43(5):889-893.
[65] Löscher W,Potschka H.Blood-brain barrier active efflux transporters:ATP-binding cassette gene family[J].NeuroRx,2005,2(1):86-98.
[66] Miller DS,Cannon RE.Signaling pathways that regulate basal ABC transporter activity at the blood-brain barrier[J].Curr Pharm Des,2014,20(10):1463-1471.
[67] Campos-Bedolla P,Walter FR,Veszelka S,Deli MA.Role of the blood-brain barrier in the nutrition of the central nervous system[J].Arch Med Res,2014,45(8):610-638.
[68] Nicolazzo JA,Charman SA,Charman WN.Methods to assess drug permeability across the blood-brain barrier[J].J Pharm Pharmacol,2006,58(3):281-293.
[69] Rousselle C,Clair P,Lefauconnier JM,Kaczorek M,Scherrmann JM,Temsamani J.New advances in the transport of doxorubicin through the bloodbrain barrier by a peptide vector-mediated strategy[J].Mol Pharmacol,2000,57(4):679-686.
[70] Cai H,Liu W,Xue Y,Shang X,Liu J,Li Z,et al.Roundabout 4 regulates blood-tumor barrier permeability through the modulation of ZO-1,occludin,and claudin-5 expression[J].J Neuropathol Exp Neurol,2015,74(1):25-37.
[71] Van Itallie CM,Fanning AS,Bridges A,Anderson JM.ZO-1 stabilizes the tight junction solute barrier through coupling to the perijunctional cytoskeleton[J].Mol Biol Cell,2009,20(17):3930-3940.
[72] Jordão JF,Thévenot E,Markham-Coultes K,Scarcelli T,Weng YQ,Xhima K,et al.Amyloid-β plaque reduction,endogenous antibody delivery and glial activation by brain-targeted,transcranial focused ultrasound[J].Exp Neurol,2013,248:16-29.
[73] Staat C,Coisne C,Dabrowski S,Stamatovic SM,Andjelkovic AV,Wolburg H,et al.Mode of action of claudin peptidomimetics in the transient opening of cellular tight junction barriers[J].Biomaterials,2015,54:9-20.
[74] Sauer RS,Krug SM,Hackel D,Staat C,Konasin N,Yang S,et al.Safety,efficacy,and molecular mechanism of claudin-1-specific peptides to enhance blood-nerve-barrier permeability[J].J Control Release,2014,185:88-98.
[75] Bocsik A,Walter FR,Gyebrovszki A,Fülöp L,Blasig I,Dabrowski S,et al.Reversible opening of intercellular junctions of intestinal epithelial and brain endothelial cells with tight junction modulator peptides[J].J Pharm Sci,2016,105(2):754-765.
[76] Kolter M,Ott M,Hauer C,Reimold I,Fricker G.Nanotoxicity of poly(n-butylcyano-acrylate)nanoparticles at the blood-brain barrier,in human whole blood andin vivo[J].J Control Release,2015,197:165-179.
[77] Tang J,Xiong L,Zhou G,Wang S,Wang J,Liu L,et al.Silver nanoparticles crossing through and distribution in the blood-brain barrierin vitro[J].J Nanosci Nanotechnol,2010,10(10):6313-6317.
[78] de Smet M,Heijman E,Langereis S,Hijnen NM,Grüll H.Magnetic resonance imaging of high intensity focused ultrasound mediated drug delivery from temperature-sensitive liposomes:anin vivoproofof-concept study[J].J Control Release,2011,150(1):102-110.
[79] Park J,Zhang Y,Vykhodtseva N,Jolesz FA,McDannold NJ.The kinetics of blood brain barrier permeability and targeted doxorubicin delivery into brain induced by focused ultrasound[J].J Control Release,2012,162(1):134-142.
[80] Takeshita Y,Obermeier B,Cotleur A,Sano Y,Kanda T,Ransohoff RM.Anin vitroblood-brain barrier model combining shear stress and endothelial cell/astrocyte co-culture[J].J Neurosci Methods,2014,232:165-172.
[81] Vastag M,Keseru GM.Currentin vitroand in silico models of blood-brain barrier penetration:a practical view[J].Curr Opin Drug Discov Devel,2009,12(1):115-124.
[82] Ding H,Wu F,Nair MP.Image-guided drug delivery to the brain using nanotechnology[J].Drug Discov Today,2013,18(21-22):1074-1080.
[83] Li Y,Chen T,Miao X,Yi X,Wang X,Zhao H,et al.Zebrafish:A promisingin vivomodel for assessing the delivery of natural products,fluorescence dyes and drugs across the blood-brain barrier[J].Pharmacol Res,2017,125(Pt B):246-257.
[84] Morales JF,Montoto SS,Fagiolino P,Ruiz ME.Current state and future perspectives in QSAR models to predict blood-brain barrier penetration in central nervous system drug R&D[J].Mini Rev Med Chem,2017,17(3):247-257.
[85] Sjöstedt N,Kortejärvi H,Kidron H,Vellonen KS,Urtti A,Yliperttula M.Challenges of usingin vitrodata for modeling P-glycoprotein efflux in the bloodbrain barrie[rJ].Pharm Res,2014,31(1):1-19.
