维药异叶青兰总黄酮对去甲肾上腺素诱导的大鼠心肌细胞肥大的影响
2017-05-10蒋红,何雯,张晨
蒋 红,何 雯,张 晨
(新疆医科大学1.公共卫生学院,2.第五附属医院,新疆乌鲁木齐 830011)
心肌肥厚是人类心血管疾病的主要危险因子,在医学界早已形成共识,主要表现为心肌细胞蛋白增加、细胞体积增大、间充质成分改变以及心脏顺应性和循环功能降低,且多种因素参与了心肌肥厚的形成[1]。心肌肥厚时,心肌标志蛋白表达水平升高,发生心肌细胞肥大,同时伴随有心肌细胞外间充质增多、心脏质量增加,还伴有心肌成纤维细胞的增殖与转化,以及心肌间充质纤维化等病理改变,病理性心肌肥厚最终将导致心肌病和心衰[2]。其中,肾素-儿茶酚胺系统是与心肌肥厚发生发展有直接关系的神经体液因素。去甲肾上腺素(norepinephrine,NE)是儿茶酚胺中的一种,能激活相应受体与G蛋白(Gq和Gs蛋白受体)偶联,激活相应的细胞信号传导通路,参与心肌肥厚的发生,表现为细胞蛋白含量、蛋白合成及体积均增大,但细胞数目无明显变化,说明对细胞增殖没有影响。NE通过激活α1和β肾上腺素能受体。α1受体激活后,可激活细胞内磷酸酯酶C(phosphatase C,PLC),水解磷脂酰肌醇4,5-双磷酸(phosphatidylinositol 4,5-bisphosphate,PIP2),升高肌醇三磷酸(inositol triphosphate,IP3)和甘油二酯(diglyceride,DAG),DAG的升高可激活蛋白激酶C(protein kinase C,PKC)。β受体激活后可活化腺苷酸环化酶(adenyl cyclase,AC),使ATP转变成cAMP,导致细胞内cAMP蓄积,进而激活PKA。PKA可使许多在心脏收缩中起作用的蛋白磷酸化,包括L型钙通道蛋白、肌质网受体蛋白和肌钙蛋白等,增强它们的活性,进而增强心肌的收缩。PKC和PKA的激活是导致心肌肥厚的关键步骤,二者都可激活MAPK信号转导通路,引起心肌肥厚[3-4]。异叶青兰总黄酮(total flavonoids ofDracocephalum heterophyllumbenth,TFDH)是维吾尔族及藏族民间传统用药,有研究表明,其可治疗高血压、肺热咳嗽和支气管炎等,具有良好的抗氧化、保护心肌、治疗冠心病和降血压等作用[5]。鉴于此,本研究拟在NE诱导的新生SD大鼠心肌细胞肥大模型基础上,观察TFDH对心肌细胞肥大作用的影响,从离体水平上探讨TFDH对心肌细胞肥厚的抑制作用。
1 材料与方法
1.1 实验动物
出生0~3 d的SD大鼠,由新疆医科大学实验动物中心提供,许可证号:SCXK(新)2003-0001。饲养于新疆医科大学SPF环境,许可证号:SCXK(新)2011-0004。
1.2 药品、试剂和主要设备
TFDH由中国科学院新疆理化技术研究所提供,提取率为3.76 mg·g-1,经鉴定总黄酮含量为57.97%;D-Hanks溶液、胰蛋白酶、5-溴脱氧尿嘧啶核苷(BrdU)、CCK-8检测试剂盒和NE均购自美国Sigma公司;Ⅱ型胶原酶购自美国Worthington公司;DMEM培养基和胎牛血清购自美国Gibco公司;抗心肌肌钙蛋白T抗体和Dy Light594标记驴抗大鼠IgG二抗购自英国Abcam公司;逆转录酶试剂盒购自德国Thermo科技有限公司;驴血清为北京索莱宝生物技术有限公司产品;NO测定试剂盒和Ca2+荧光探针Fluo-3 AM为江苏碧云天生物技术研究所产品;NOS测定试剂盒、Ca2+-ATP酶测定试剂盒为南京建成生物工程研究所产品;定量PCR试剂盒购置美国ABI公司。LSM 710共聚焦显微镜购自德国Leica公司;逆转录仪为伯乐生命医学产品(上海)有限公司Bio-Rad产品;定量PCR仪为美国ABI 7500产品。
1.3 新生大鼠原代心肌细胞分离和培养[6]
无菌开胸,迅速取出心脏,置于盛有4℃的D-Hanks溶液中,减去整个心脏的1/3~1/2,留心尖部心室组织,剪碎后加入0.1%的胰蛋白酶溶液,4℃振荡过夜。次日加入与胰蛋白酶等量的含胎牛血清的高糖DMEM培养液,终止消化后,加入浓度为0.08%的Ⅱ型胶原酶置37℃水浴箱,以80次·min-1的频率震荡10 min,收集上清液,并以等体积的含胎牛血清的培养液终止消化,此步骤重复4~5次,到组织基本消失为止。完毕后用200目的尼龙筛网除去残留的组织块,接种于100 mm培养皿中,静置90min差数贴壁后,取上清液,加入BrdU0.1mmol·L-1抑制非心肌细胞增殖,吹打均匀,细胞分别以3×106L-1密度接种于25 mm培养瓶、1.5×106L-1接种于60 mm培养皿、3×108L-1接种于96孔板和1×106L-1接种于6孔板中,置于5%CO2,37℃孵箱中培养。
1.4 细胞分组及处理
将上述细胞用含10%小牛血清的DMEM培养液培养48 h后,换无血清培养液,按照处理分为细胞对照组、NE模型组和NE+TFDH组。细胞对照组和NE模型组加入PBS,NE+TFDH组分别加TFDH 10,25和50 μmol·L-1作用30 min,而后,除细胞对照组外,各组分别加入NE 2 μmol·L-1作用48 h。
1.5 CCK-8法检测细胞存活率
将接种在96孔板的各组原代心肌细胞用含10%小牛血清的DMEM培养液培养48 h后,换无血清培养液,按1.4方法加药处理后,用PBS洗3遍,每孔加入10 μL CCK-8检测液孵育2 h,于酶标仪430 nm波长处检测吸光度(A)值。检测过程中设不加细胞的调零孔。每组设5个复孔。细胞存活率(%)=(给药组A430nm-调零组A430nm)(/细胞对照组A430nm-调零组A430nm)×100%。
1.6 RT-PCR法检测心肌细胞心房利钠肽(atrial natriuretic peptide,ANP)和 β-肌球蛋白重链( βmyosin heavy chain, β-MHC)mRNA 表达水平
将接种在60 mm培养皿中的各组原代心肌细胞用含10%小牛血清的DMEM培养液培养48 h后,换无血清培养液,按1.4处理细胞48 h后,加入TRIzol试剂1 mL裂解细胞,收集细胞裂解液,氯仿抽提,异丙醇沉淀,用DEPC处理水回收总RNA,紫外分光光度计A260nm/A280nm鉴定其浓度及纯度,并逆转录成cDNA。所用PCR引物由上海生工有限公司设计,反应条件:95℃ 30 s,95℃ 5 s,62℃ 20 s,40个循环。取1 μg cDNA进行RT-PCR检测,将甘油醛-3-磷酸脱氢酶(GAPDH)作为内参因子,以2-ΔΔct法计算目标基因的相对表达水平。引物序列见表1。

Tab.1 Primer sequence for PCR
1.7 激光共聚焦进行心肌细胞鉴定及心肌细胞表面积检测
取出接种在6孔板的心肌细胞,按1.4方法药物处理48 h后,弃培养基,用PBS清洗细胞3次,用4%多聚甲醛固定15 min,再用0.25%Triton X-100透化10 min,驴血清室温封闭30 min,加入抗心肌肌钙蛋白T抗体(1∶500)室温孵育1 h。加入荧光二抗(1∶1000)避光室温孵育1 h。避光加入0.1 mL DAPI 50 μg·L-1作用3 min。心肌细胞图像通过 LSM 710激光共聚焦仪获取。每次独立实验中,每组各取3孔细胞进行处理。每孔细胞样品随机获取4个不同视野的图片,每个图片取10个细胞,并通过Image-Pro Plus 6.0软件测量3次实验的细胞表面积,以μm2表示面积。
1.8 心肌细胞[Ca2+]i浓度和Ca2+-ATP酶活性测定
取出接种在6孔板的心肌细胞,按1.4方法药物处理48 h后,弃培养基,用PBS清洗3次,加入钙离子探针 Fluo-3/AM(终浓度为 5 μmol·L-1)置于5%CO2,37℃培养箱内孵育 45~60 min,PBS清洗3次,加入培养基,采用激光共聚焦显微镜每组随机选择20个细胞进行动态扫描,通过分析软件分析细胞内钙离子荧光强度。同时,取出接种在60 mm培养皿中的各组原代心肌细胞,按1.4方法药物处理48 h后,用胰酶消化细胞,胎牛血清培养基中和胰酶,生理盐水稀释后离心20 min,吸出上清液后破碎细胞,酶促反应测定磷的含量,根据标准曲线计算酶活性。严格按试剂盒说明书进行操作。
1.9 细胞匀浆液中一氧化氮(nitric oxide,NO)浓度和一氧化氮合酶(nitric oxide synthase,NOS)活性的测定
取出接种在25 mm培养瓶中的心肌细胞,按1.4方法药物处理48 h后,收集细胞并制成细胞匀浆液。采用比色法测定NO浓度和NOS活性,严格按照试剂盒说明书操作。用酶标仪于540 nm测定NO2-与Griess试剂反应后溶液的吸光度,根据标准曲线计算每孔NO水平。在530 nm测定吸光度,根据吸光度计算NOS活性。
1.1 0统计学分析
实验结果数据采用x±s表示,用SPSS17.0统计软件对数据进行分析。两组之间比较使用t检验;多组间比较采用单因素方差分析,各组间的两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 TFDH对NE诱导肥大心肌细胞存活率的影响
CCK-8检测结果显示,与细胞对照组比较,NE模型组细胞存活率明显下降(P<0.05);与NE模型组比较,NE+TFDH 25和50 μmo·L-1组细胞存活率显著升高(P<0.05),且具有浓度依赖性(r=0.998,P<0.05)(图1)。表明TFDH可使NE诱导肥大心肌细胞的存活率升高。
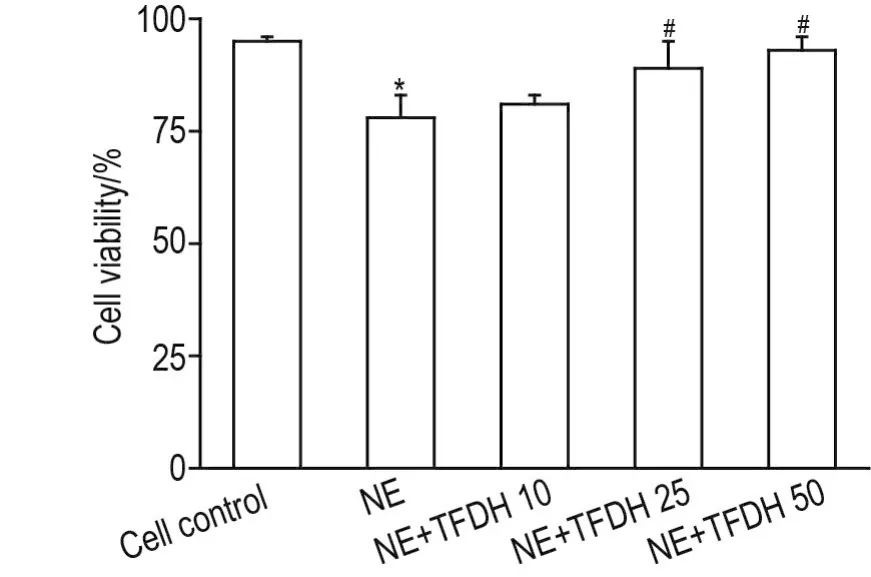
Fig.1 Effect of total flavonoids of Dracocephalum heterophyllum benth(THDH)on survival rate of myocar⁃dial cells induced by norepinephrine(NE).The cells were cultured for 30 min with TFDH 0,10,25 and 50 μmol· L-1,respectively,then NE 2 μmol·L-1was added and cultured for 48 h.±s,n=5.*P<0.05,compared with cell control group;#P<0.05 ,compared with NE group.
2.2 TFDH对NE诱导肥大心肌细胞ANP和 β-MHC mRNA表达的影响
RT-PCR检测结果显示(表2),与细胞对照组相比,NE模型组ANP和β-MHC的mRNA表达均上调,分别增加2.14±0.42和(2.03±0.19)倍(P<0.05);与NE 模型组比较,NE+TFDH 10,25和50 μmol·L-1组ANP和 β-MHC 的mRNA表达均下调,其中以NE+TFDH 25和50 μmol·L-1处理组较为明显(P<0.05),且具有浓度依赖性(r=-0.995,P<0.05;r=-0.997,P<0.05)。结果表明,TFDH可阻断由NE诱导的心肌细胞ANP和β-MHC mRNA表达上调。
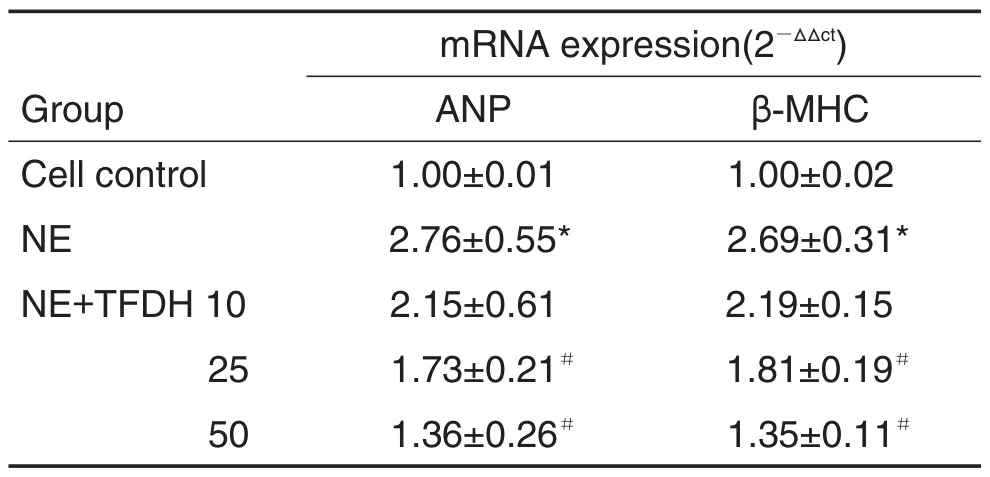
Tab.2 Effect of TFDH on expression of mRNA of atrial natriuretic peptide(ANP)and β-myosin heavy chain( β-MHC) to myocardial cells induced by NE
2.3 TFDH对NE诱导的肥大心肌细胞表面积的影响
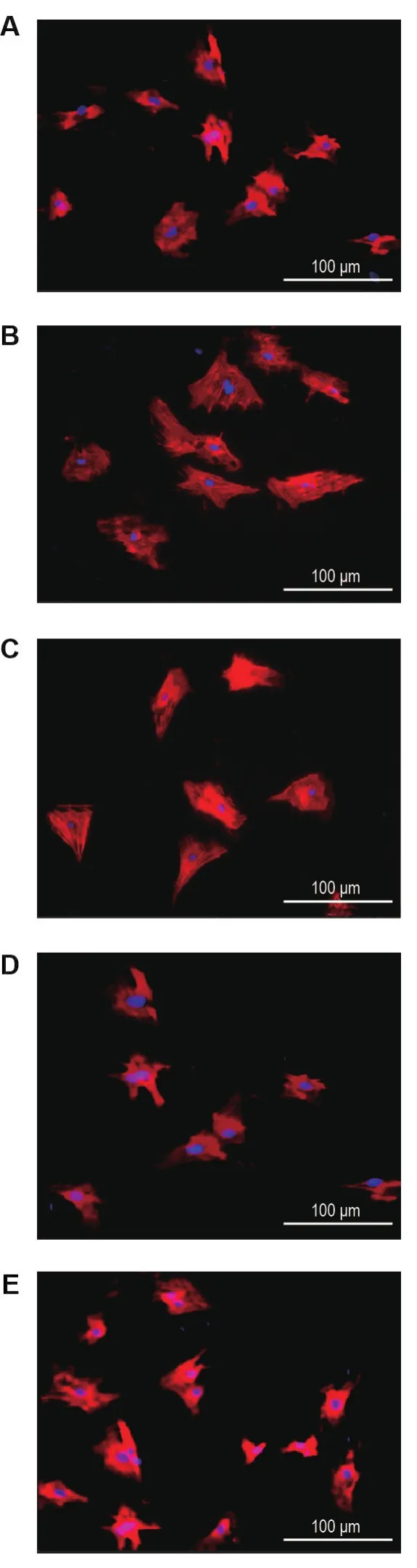
Fig.2 Effect of TFDH on surface area of myocardial cells induced by NE observed by phase contrast microscopy.See Fig.1 for the cell treatment.A:cell control group;B:NE 2 μmol·L-1;C:NE+TFDH 10 μmol·L-1group;D:NE+TFDH 25 μmol·L-1group;E:NE+TFDH 50 μmol·L-1group.
使用Image-Pro Plus 6.0软件计算各组心肌细胞表面积结果显示(图2),与细胞对照组心肌细胞表面积(178±29)μm2相比,NE 模型组心肌细胞明显增大,为(274±38)μm2(P<0.05);与 NE模型组比较,NE+TFDH 10,25和50 μmol·L-1组心肌细胞表面积分别为242±43,223±32和(201±30)μm2,均明显缩小(P<0.05)。表明TFDH可缓解由NE诱导的心肌细胞表面积增大。
2.4 TFDH对NE诱导肥大心肌细胞内[Ca2+]i和Ca2+-ATP酶活性的影响
与细胞对照组比较,NE模型组明显使心肌细胞[Ca2+]i增加(P<0.05)和 Ca2+-ATP 酶的活性下降;与 NE模型组比较,NE+TFDH 10,25和50 μmol·L-1组均对心肌细胞[Ca2+]i有明显的抑制作用(P<0.05),使Ca2+-ATP酶活性明显增加(P<0.05),并呈浓度依赖性(r=0.995,P<0.05)(表3)。表明TFDH可抑制由NE诱导的心肌细胞[Ca2+]i增加和Ca2+-ATP酶活性降低。
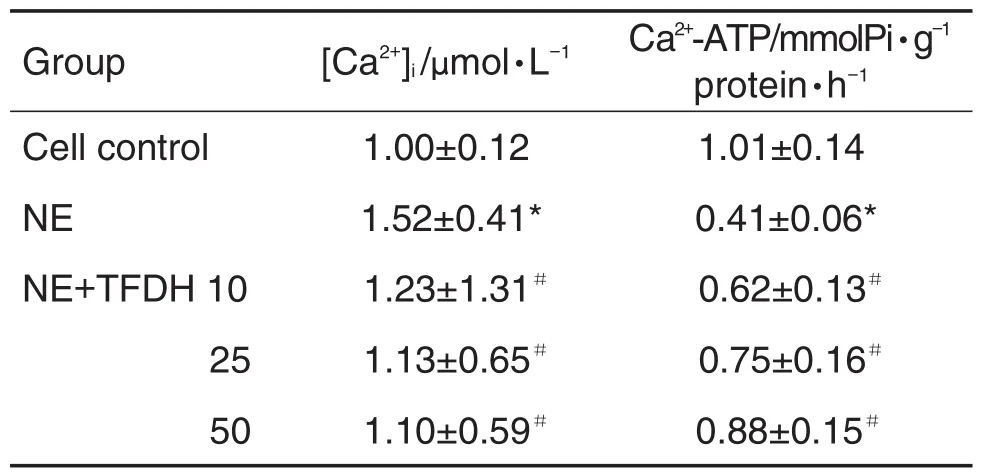
Tab.3 Effect of TFDH on[Ca2+]iand activity of Ca2+-ATP of hypertrophic cardiomyocytes induced by NE
2.5 TFDH对NE诱导的肥大心肌细胞NO浓度和NOS活性的影响
比色法测定结果显示(表4),与细胞对照组相比,NE模型组心肌细胞NO浓度和NOS活性明显降低(P<0.05);与 NE 2模型组比较,NE+TFDH 10,25和50 μmol·L-1组心肌细胞NO 浓度和NOS活性明显增加(P<0.05),并呈浓度依赖性(r=0.997,P<0.05)。表明TFDH可返转NE诱导的心肌细胞NO浓度和NOS活性降低。

Tab.4 Effect of TFDH on concentration of nitric oxide(NO)and activity of nitric oxide synthase(NOS)of hypertrophic cardiomyocytes induced by NE
3 讨论
本研究结果显示,TFDH能明显提高由NE诱导的肥大心肌细胞存活率、抑制心肌肥大标志物ANP和β-MHC的mRNA表达以及减小肥大心肌细胞表面积,提示其对肥大心肌细胞起到了明显的保护作用。笔者课题组前期研究发现,TFDH可降低肾血管性高血压大鼠的血压,改善左心室舒缩功能和心肌收缩力,其机制可能与降低血循环、心肌组织和肾组织中的内皮素水平,升高NO水平,调节体内内皮素与NO平衡状态有关[7-8]。
本研究中,由NE诱导的心肌细胞肥大模型组中,NO浓度和NOS的活性均减低,提示NE一方面可引起心肌细胞肥大,同时可减低NO浓度和NOS活性,而这些作用均可能与α1受体和酪氨酸蛋白激酶受体不敏感的G蛋白介导有关,通过增加外源性NO可防止NE诱导的心肌细胞肥大反应,提示NO除引起冠脉舒张、冠脉血流量增加和心肌收缩力下降外,可能在防止心肌肥厚反应中起重要作用[9-11】。本研究结果显示,TFDH抑制NE诱导的心肌细胞肥大的同时,明显升高心肌细胞匀浆液中NO的浓度和NOS的活性,而心脏中NO浓度升高可引起冠脉舒张血流量增加等,并抑制心肌肥厚。提示TFDH对心肌肥厚的保护作用可能与心脏NO浓度有关。
心肌肥大是一种由多种因素参与调节的复杂动态过程,现已证实磷脂酰肌醇3激酶/蛋白激酶通路、钙调神经磷酸酶通路、MAPK通路、NO/cGMP通路等多条信号通路均参与其病理过程[12-13]。在分子水平表现为心肌重构时心肌细胞核内基因表达模式改变、BNP和ANP表达上调、胚胎型成熟基因表达下降,以及心肌蛋白合成增加、单个细胞蛋白含量增高、心肌细胞肥大和收缩力减弱。本研究结果显示,TFDH能明显降低NE诱导的心肌细胞ANP和β-MHC mRNA表达,提示TFDH抑制心肌细胞肥大作用与多条信号传导通路有关。同时,心肌肥厚常伴有肌浆网钙泵活性降低、Ca2+紊乱等,而心肌肌浆网Ca2+-ATP通过摄取和释放Ca2+在心脏的舒张活动中起重要作用。在心肌兴奋收缩中,Ca2+参与了心肌动作电位的形成,同时Ca2+还能直接与肌丝结合,引起心肌收缩。当细胞内Ca2+浓度降低时,Ca2+从肌钙蛋白上解离下来,引起心肌舒张。Ca2+是细胞内最重要的第二信使,通过出入胞浆传递多种生物信号调节细胞的生长发育等途径,其中包括调节心脏功能[14]。Ca2+也是心肌细胞肥大反应的重要信号通路,而钙调磷酸酶(calcineurin,CaN)和钙调素依赖性蛋白激酶Ⅱ(calmodulin dependent protein kinase,CaMKⅡ)是重要调节信号。胞内Ca2+信号的改变是肥厚反应的首要刺激,在心脏肥厚和基因表达中发挥中心作用,Ca2+依赖的CaN/NFAT途径和CaMKⅡ/HDAC途径均参与其中[13,15】。本研究结果显示,TFDH抑制NE诱导的心肌细胞肥大的同时明显降低心肌细胞Ca2+浓度和升高Ca2+-ATP酶的活性,并呈浓度依赖性,提示TFDH对心肌细胞Ca2+浓度和Ca2+-ATP酶活性的调节可能是其抗心肌肥厚的机制之一。
综上所述,本研究显示,TFDH对NE诱导的肥大心肌细胞具有明显的保护作用,其机制可能与促进NO释放、调节细胞内Ca2+浓度和Ca2+-ATP酶活性有关。其他的作用机制及细胞传导信号通路还有待进一步研究。
参考文献:
[1] Kawai H,Mohan A,Hagen J,Dong E,Armstrong J,Stevens SY,et al.Alterations in cardiac adrenergic terminal function and beta-adrenoceptor density in pacing-induced heart failure[J].Am J Physiol Heart Circ Physiol,2000,278(5):H1708-H1716.
[2] Yamamoto S,Kita S,Iyoda T,Yamada T,Iwamoto T.New molecular mechanisms for cardiovascular disease:cardiac hypertrophy and cell-volume regulation[J].J Pharmacol Sci,2011,116(4):343-349.
[3] Barry SP,Davidson SM,Townsend PA.Molecular regulation of cardiac hypertrophy[J].Int J Biochem Cell Biol,2008,40(10):2023-2039.
[4] Liu XL,Xing XW,Huang LH,Huang ZJ,Yuan H.Research advances on the role of β1-adrenergic receptor in heart failure,hypertension and myocardial fibrosis[J].Chin Pharmacol Bul(l中国药理学通报),2013,29(12):1640-1644.
[5] X,Janifer Raj,Chaurasia OP,Vajpayee PK,Pal Murugan M.Antioxidative activity and phytochemical investigation on a high altitude medicinal plantDracocephalum heterophyllumBenth[J].Phcog J,2010,2(6):112-117.
[6] Qin XY,Lu XZ,Zhang H,Yang YQ,Yang XH,Zheng HJ,et al.Influence of zofenopril to rats hypertrophic cardiomyocytes on ACE2 and Mas[J].Chin J Clin Pharmacol(中国临床药理学杂志),2014,30(1):11-13.
[7] He W,Yiming WLY,Si LJ,Miao N,Aisa HJ Akber,Kerram Parhat.Effects ofDracocephalum hetero⁃phyllumBenth flavonoid on cardiac hypertrophy of hypertension rats[J].Chin Pharmacol Bul(l中国药理学通报),2013,29(7):1008-1011.
[8] Ma XL.Effect ofDracocephalum heterophyllumBenth of the renovascular hypertensive rats andmechanisms investigation(异叶青兰总黄酮对肾性高血压大鼠的影响和作用机制研究)[D].Urumqi:Xinjiang Medical University(新疆医科大学),2012.
[9] Haynes MP,Li L,Sinha D,Russell KS,Hisamoto K,Baron R,et al.Src kinase mediates phosphatidylinositol 3-kinase/Akt-dependent rapid endothelial nitric-oxide synthase activation by estrogen[J].J Biol Chem,2003,278(4):2118-2123.
[10] Cozza EN,Gomez-Sanchez CE,Foecking MF,Chiou S.Endothelin binding to cultured calf adrenal zona glomerulosa cells and stimulation of aldosterone secretion[J].J Clin Invest,1989,84(3):1032-1035.
[11] Shah MS,Brownlee M.Molecular and cellular mechanisms of cardiovascular disorders in diabetes[J].Circ Res,2016,118(11):1808-1829.
[12] Klawitter J,Klawitter J,Agardi E,Corby K,Leibfritz D,Lowes BD,et al.Association of DJ-1/PTEN/AKT-and ASK1/p38-mediated cell signalling with ischaemic cardiomyopathy[J].Cardiovasc Res,2013,97(1):66-76.
[13] Liou SF,Hsu JH,Chen YT,Chen IJ,Yeh JL.KMUP-1 attenuates endothelin-1-induced cardiomyocyte hypertrophy through activation of heme oxygenase-1 and suppression of the Akt/GSK-3β,calcineurin/NFATc4 and rhoA/ROCK pathways[J].Molecules,2015,20(6):10435-10449.
[14] Kohlhaas M,Zhang T,Seidler T,Zibrova D,Dybkova N,Steen A,et al.Increased sarcoplasmic reticulum calcium leak but unaltered contractility by acute CaMK Ⅱ overexpression in isolated rabbit cardiac myocytes[J].Circ Res,2006,98(2):235-244.
[15] Ito H.Endothelins and cardiac hypertrophy[J].Life Sci,1997,61(6):585-593.
