苦参碱对PC12细胞的毒性及线粒体损伤机制
2017-05-10沈芳,梁培,陆红
沈 芳,梁 培,陆 红
(浙江中医药大学药学院,浙江杭州 311402)
苦参碱(matrine,MT)具有抗心律失常[1]、减轻心肌损伤、抗纤维化[2-4]、抗炎[5-6]、抗病毒和升白细胞[7]等多种药理活性,是苦参(Sophora flavescensAit.)、山豆根(S.onkinensisGapnep.)和苦豆子(S.alopecuroidesL.)等中药材的活性成分[8]。苦参碱葡萄糖注射液、注射用苦参碱和含苦参碱的中药复方消银方等多种临床常用中药均含有苦参碱成分。在与苦参碱相关的不良反应报道中,最为严重的是神经系统不良反应[9],临床表现为异常步态[10]、心跳加速、头晕眼花[11]、易兴奋、疲乏、言语不清和肌肉抽搐[12]等。本课题组前期研究结果表明,MT在10和40 mg·kg-1剂量下可抑制ICR小鼠中枢神经系统,损害其平衡协调能力[13]。
大脑组织富含多价不饱和脂肪酸[14],对自由基非常敏感[15];神经细胞为了维持正常生理功能需依赖高浓度葡萄糖代谢,线粒体氧化磷酸化是其主要糖代谢途径,当外界刺激使线粒体氧化磷酸化受损,导致神经细胞内活性氧(reactive oxygen species,ROS)堆积,引起氧化应激反应[16-17],进而损伤DNA和蛋白质的结构,产生细胞毒效应[18]。本研究以PC12细胞为受试对象,研究MT的神经毒性,并探讨其毒性机制是否与ROS参与的线粒体途径诱导细胞凋亡有关。
1 材料与方法
1.1 药品、试剂和仪器
MT购于南京广润制品有限公司(白色粉末,纯度≥98%,批号:GR-133-140103);DMEM/F12 培养基购于美国Gibco公司;胎牛血清(批号:130126)购于杭州四季青生物工程材料有限公司;胰蛋白酶-EDTA消化液(0.25%,T1320)购于中国Solarbio公司;甲基噻唑基四唑(methylthiazolyltetrazolium,MTT,批号:822A054)购于美国Sigma公司;Hoechst33342染色液(C1025)、AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒(C1063)、丙二醛(malondialdehyde,MDA)检测试剂盒(S0131)、总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(S0101)、ROS检测试剂盒(S0033)、线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(C2006)、二辛可酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(P0012)均购于碧云天生物技术有限公司;β肌动蛋白(sc-47778)购于美国 Santa Cruz 公司;HRP-山羊抗小鼠lgG(BL001A)购于Biosharp公司;HRP-山羊抗兔lgG(BA1054)购于博士德生物公司;抗胱天蛋白酶原9抗体(ab32068)和抗胱天蛋白酶原3抗体(9ab32068)均购于美国Abcam公司;抗活化的胱天蛋白酶3抗体(#9665)购于美国CST公司;Bax抗体(#5023)和Bcl-2抗体(#4223)购于美国CST公司。
Electron 1287生物安全柜、HEPA CLASS100型细胞CO2培养箱和全波长多功能酶标仪(美国Thermo公司),UNIVERSAL320/320R台式(常温/冷冻)离心机(德国Hettich公司),Ti-U荧光倒置显微镜(日本Nikon公司),Mini-PROTEAN165-8004电泳仪(美国Bio-Rad公司)。
1.2 细胞培养
PC12细胞为浙江中医药大学药学院杨元宵博士馈赠,用含10%胎牛血清和1%双抗的DMEM/F12培养基(即培养液)在37℃,5%CO2的恒温培养箱中培养。倒置显微镜下观察PC12细胞生长情况,细胞融合至80%以上时经胰酶消化,传代。选取对数生长期的细胞用于实验。
1.3 MTT法检测细胞存活率
将PC12细胞以每孔5×103个接种于96孔板,置37℃,5%CO2饱和湿度培养箱内培养,至细胞融合度达70%~80%用于实验。将细胞分为正常对照组和MT 2,4和8 mmol·L-1组,各组吸弃旧培养液,分别加入含MT 0,2,4和8 mmol·L-1的培养液每孔100 μL,每组设6个复孔。另设调零组(只加培养液,无细胞),用于去除溶液本底。分别于给药6,12,24和48 h后,每孔加MTT(5 g·L-1)溶液20 μL,继续孵育4 h后小心吸弃上清液,每孔加DMSO 150 μL,室温下振荡10 min,充分溶解结晶物,用酶标仪于490 nm波长测定各孔吸光度(A490nm)值,实验重复3次。细胞存活率(%)=(给药组A490nm-调零组A490nm)(/正常对照组A490nm-调零组A490nm)×100%。
1.4 Hoechst33342荧光染色观察细胞核形态
细胞以每孔1×105接种于6孔板中,置37℃,5%CO2饱和湿度培养箱内培养,至细胞融合度达70%~80%时用于实验。细胞分为正常对照组和MT(2,4和8 mmol·L-1)组,各组吸弃旧培养液,分别加入含 MT 0,2,4 和 8 mmol·L-1的培养液每孔2 mL,药物作用24 h后,按Hoechst33342染色液说明书操作,置荧光显微镜下观察细胞核形态变化。
1.5 AnnexinV-FITC/PI双染检测细胞凋亡
细胞接种、分组与药物处理步骤同1.4,药物作用24 h后收集PC12细胞,1000×g4℃离心5 min,充分吸弃上清液。按AnnexinV-FITC/PI细胞凋亡检测试剂盒说明书操作,样品在1 h内采用流式细胞仪(激发波长488 nm,发射波长530 nm及575 nm)检测PC12细胞凋亡率。
1.6 DCFH-DA染色后流式细胞仪检测细胞内ROS含量
细胞接种、分组与药物处理步骤同1.4,药物作用24 h后收集细胞,1000×g室温离心5 min,弃上清,加入1 mL DCFH-DA(10 μmol·L-1)重悬,置于37℃细胞培养箱内孵育20 min,无血清培养液洗涤3次,按ROS检测试剂盒说明书操作,用流式细胞仪检测荧光值计算ROS含量,激发光488 nm,发射光525 nm。
1.7 细胞内SOD活性及MDA含量的测定
PC12细胞以4×106接种于25 cm2玻璃培养瓶,至细胞融合度达70%~80%时吸弃旧培养液,细胞分组与药物处理步骤同1.4,每瓶加药4 mL作用24 h。按照SOD和MDA试剂盒方法操作,用酶标仪分别测定A550nm和A450nm,计算样品中总SOD活性及MDA含量。
1.8 细胞MMP测定
细胞以每孔1×105接种于6孔板中,置37℃,5%CO2饱和湿度培养箱内培养,至细胞融合度达70%~80%时用于实验。将细胞分为正常对照组、MT(2,4和8 mmol·L-1)组和阳性处理(羰基氰化物间-氯苯基腙10 μmol·L-1)组,药物作用24 h后吸弃培养液,用PBS洗2遍,按照MMP检测试剂盒说明操作后,用荧光显微镜观察荧光强度变化,以此反映线粒体膜电位变化。
1.9 Western蛋白印迹法检测胱天蛋白酶原3,胱天蛋白酶原9,活化的胱天蛋白酶3,Bax和Bcl-2蛋白含量
细胞接种、分组与药物处理步骤同1.4,药物作用24 h后吸弃旧培养液,将细胞裂解,1000×g4℃离心5 min,取上清液,用BCA法测定各组样品总蛋白浓度,取20 μg总蛋白上样,经12%SDSPAGE电泳后转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,一抗(1∶1000)4°C孵育过夜,二抗(1∶5000)室温下孵育2 h,用Bio-Rad凝胶成像系统进行图像采集,Imagel软件进行半定量分析,以目标蛋白与内参蛋白条带积分吸光度(IA)值的比值表示目标蛋白相对表达水平。
1.1 0统计学分析
2 结果
2.1 MT对PC12细胞存活率的影响
如图1所示,与正常对照组相比,MT作用8 h后,2 mmol·L-1组细胞存活率无显著性差异,4和8 mmol·L-1组细胞存活率显著性降低(P<0.01);当作用时间为≥12 h,MT各浓度组细胞存活率均显著降低(P<0.05,P<0.01),表明随着苦参碱浓度的增加及作用时间的延长,其对PC12细胞的损伤愈加明显。
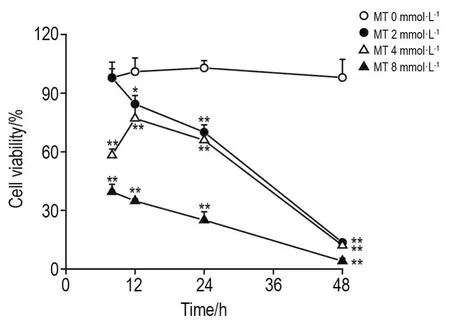
Fig.1 Effect of matrine(MT)on viability of PC12 cells by methylthiazolyltetrazolium(MTT)assay.±s,n=6.*P<0.05,**P<0.01,compared with control(0)group.
2.2 MT对PC12细胞凋亡的影响
Hoechst33342染色结果显示,正常对照组细胞核大小均匀,染色质无浓缩;而MT组随浓度升高细胞数减少,胞质浓缩,边缘化,形态大小不一,甚至出现细胞核破碎(图2)。AnnexinⅤ/FITC-PI双染检测结果显示,与正常对照组相比,MT各浓度组细胞凋亡率显著升高(P<0.01)(图3)。
2.3 MT对PC12细胞ROS含量的影响
如图4所示,与正常对照组相比,MT 2,4和8 mmol·L-1组细胞内ROS含量均显著增加(P<0.05,P<0.01)。
2.4 MT对PC12细胞内SOD活性及MDA含量的影响
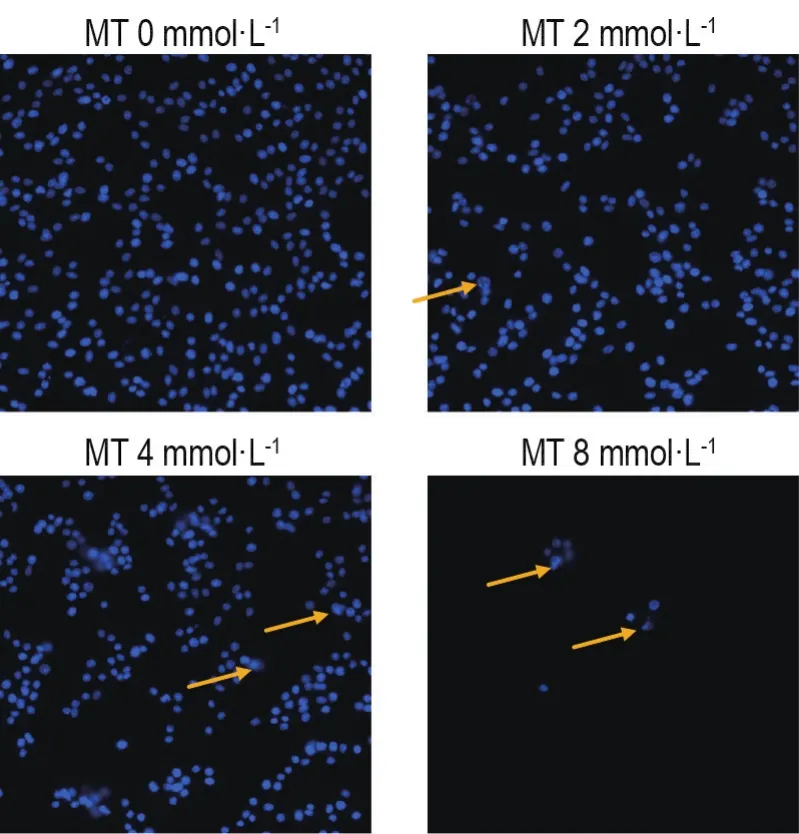
Fig.2Effect of MT on apoptosis of PC12 cells by Hoechst33342 staining(×200).Cells were treated with MT for 24 h,followed by staining with Hoechst3334210 mg·L-1 for 30 min at 37°C and observed under a fluorescence inverted microscope.Arrows indicate apoptotic cells.
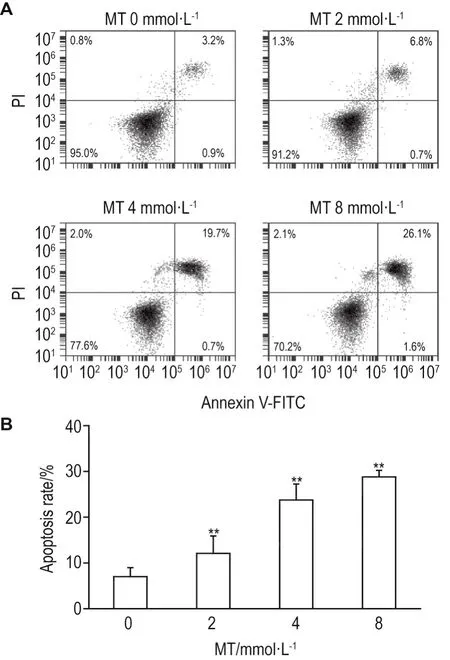
Fig.3 Effect of MT on apoptotic of PC12 cells by flow cytometry.PC12 cells were treated with MT for 24 h,followed by incubation with AnnexinⅤ-FITC/PI for 20 min.B was the quantitative result of A.±s,n=3.**P<0.01,compared with control(0)group.
与正常对照组相比,MT处理24 h后PC12细胞内SOD活性显著降低(P<0.01)(图5A);MDA含量显著增加(P<0.01)(图5B)。

Fig.4 Effect of MT on reactive oxygen species(ROS)level of PC12 cells by flow cytometry.Cells were treated with MT for 24 h,followed by staining with DCFH-DA 10 μmol·L-1 for 20 min at 37°C.B was the quantitative result of A.FI:fluoresccncc intensity.±s,n=3.*P<0.05,**P<0.01,compared with control(0)group.

Fig.5 Effect of MT on superoxide dismutase(SOD)activity(A)and malondialdehyde(MDA)content(B)of PC12 cells by hydroxylamine method and thiobarbi⁃turic acid method.Cells were treated with MT for 24 h.±s,n=3.**P<0.01,compared with control(0)group.
2.5 MT对PC12细胞MMP的影响
如图6所示,正常对照组PC12细胞在荧光显微镜下呈均匀而强烈的红色荧光,说明细胞MMP正常。羰基氰化物间-氯苯基腙10 μmol·L-(1阳性处理)组细胞线粒体受损,视野下几乎无红色荧光,而显示绿色荧光;MT处理24 h后,随给药浓度增加PC12细胞红色荧光强度逐渐减弱,绿色荧光增强,表明MT能降低PC12细胞MMP。
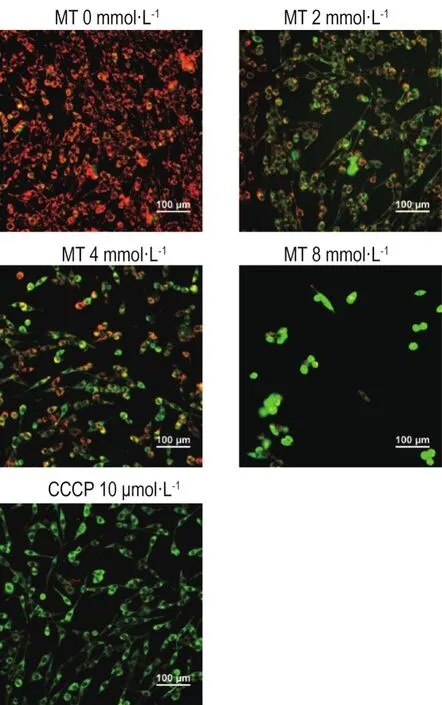
Fig.6 Effect of MT on mitochondrial membrane potential(MMP)of PC12 cells by JC-1 staining.Cells were treated with MT for 24 h,stained with JC-1 and observed under a fluorescence inverted microscope.The red fluorescence represents the normal MMP,and the green fluorescence represents the decrease of MMP,carbonyl cyanide m-chlorophenylhydrazone(CCCP)was the positive control(0)group.
2.6 MT对PC12细胞内胱天蛋白酶原3、胱天蛋白酶原9、活化的胱天蛋白酶3、Bax和Bcl-2蛋白表达的影响
图7所示,与正常对照组相比,MT各浓度组PC12细胞内胱天蛋白酶9和胱天蛋白酶3蛋白水平显著下降(P<0.01,P<0.05),活化的胱天蛋白酶3蛋白水平显著上升(P<0.05,P<0.01),提示胱天蛋白酶被剪切发生活化。图8所示,与正常对照组相比,MT各浓度组PC12细胞内Bcl-2蛋白水平显著下降(P<0.01),Bax蛋白水平显著上升(P<0.01)。与正常对照组相比,MT各浓度组均显著降低Bcl-2/Bax的比值(P<0.01)(图8C),也进一步表明苦参碱能诱导PC12细胞凋亡。
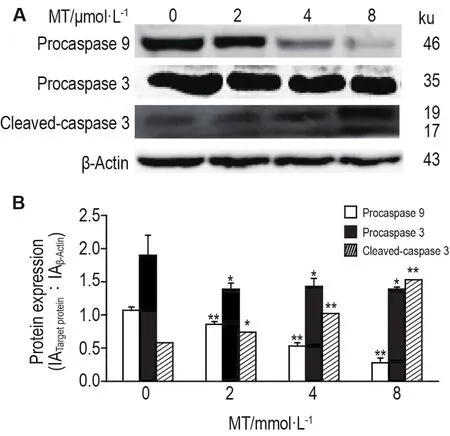
Fig.7 Effect of MT on expression of procaspase 3,procaspase 9 and cleaved-caspase 3 of PC12 cells by Western blotting.See Fig.5 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with control(0)group.
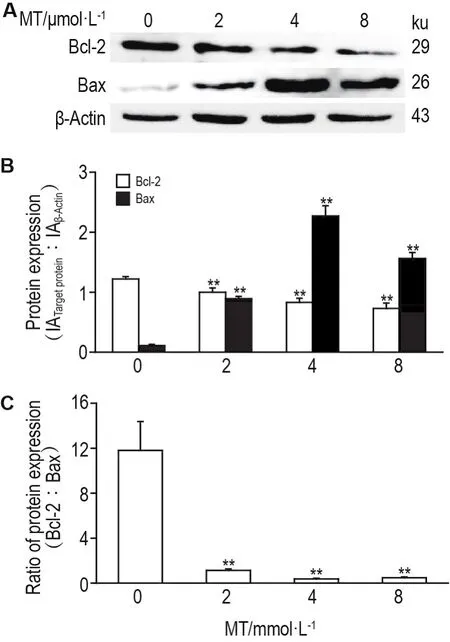
Fig.8 Effect of MT on Bcl-2 and Bax expression of PC12 cells by Western blotting.See Fig.5 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with control(0)group.
3 讨论
研究结果表明,随着MT的浓度增加及作用时间延长,MT对PC12细胞的毒性增强。Hoechst33342染色后,荧光倒置显微镜下观察PC12细胞核固缩、破裂,且AnnexinⅤ-FITC/PI染色结果表明MT能够引起PC12细胞凋亡,提示MT具有一定的神经毒性。
氧化应激学说在神经毒性机制的研究中占有重要地位,中枢神经系统对ROS的攻击特别敏感,ROS过多可以损伤细胞,细胞损伤后又会加剧ROS的蓄积,从而进一步诱导细胞凋亡。线粒体是为细胞生命活动提供能量的直接场所,线粒体呼吸链通过歧化作用和超氧负离子生成ROS,过量的ROS可以诱发线粒体膜电位降低[19],使线粒体膜通透性增加,细胞色素c和细胞凋亡诱导因子(apoptosis inducing factor,AIF)等从线粒体膜内释放至胞质中,细胞色素c与凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1)形成多聚复合体,通过Apaf-1使胱天蛋白酶原9自我剪切活化并激活胱天蛋白酶级联反应,从而激活胱天蛋白酶原3,导致细胞凋亡的发生[20]。而线粒体通路由含结构域的Bcl-2家族成员Bid,Bim和Bax等在接受到细胞内的死亡信号后激活[21]。Bcl-2蛋白家族以抗凋亡蛋白Bcl-2和抑凋亡蛋白Bax为代表,而Bcl-2/Bax可作为判断细胞凋亡敏感性的指标[22]。本研究结果显示,给予MT处理的PC12细胞MMP降低,且胱天蛋白酶原9和胱天蛋白酶原3显著下降,表明胱天蛋白酶9和胱天蛋白酶3被激活,而Bcl-2/Bax的比值也显著下降,提示MT通过激活线粒体途径诱导PC12细胞凋亡。进一步研究发现,不同浓度MT处理PC12细胞24 h后ROS含量增加,并呈剂量依赖性;同时SOD活性显著下降,而MDA含量显著增加。
综上所述,MT对PC12细胞具有一定毒性,其机制可能与促发氧化应激损伤,激活线粒体途径,诱导细胞凋亡有关。
参考文献:
[1] Xu Y,Peng Z,Ji W,Li X,Lin X,Qian L,et al.A novel matrine derivative WM130 inhibits activation of hepatic stellate cells and attenuates dimethylnitrosamine-induced liver fibrosis in rats[J/OL].Biomed Res Int,2015,2015:203978(2015-06-18).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4488526/
[2] Liu ZW,Yang Y,Xu J,Jiang X,Wang JK.GW27-e1128 Matrine inhibits cardiac fibrosis by inhibiting TGFβ1/smad signaling pathway[J/OL].J Am Coll Cardiol,2016,68(16):C40(2016-10-10).https://doi.org/10.1016/j.jacc.2016.07.149
[3]Feng Y,Ying HY,Qu Y,Cai XB,Xu MY,Lu LG.Novel matrine derivative MD-1 attenuates hepatic fibrosis by inhibiting EGFR activation of hepatic stellate cells[J].Protein Cell,2016,7(9):662-672.
[4] Li YL,Zhang HH.Effects of matrine and its derivatives on liver fibrosis[J].Chin J Gerontol(中国老年学杂志),2015,35(12):3248-3250.
[5] Pu J,Fang FF,Li XQ,Shu ZH,Jiang YP,Han T,et al.Matrine exerts a strong anti-arthritic effect on type Ⅱ collagen-induced arthritis in rats by inhibiting inflammatory responses[J/OL].Int J Mol Sci,2016,17(9):1410(2016-08-26).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5037690/
[6] Liu X,Liang YH,Zhao XQ,Wang SQ,Cai J,Zhang M,et al.Synthesis of TNF-α inhibitors,antiinflammatory activity evaluation and molecular docking study of matrine derivatives[J].Comput Appl Chem(计算机与应用化学),2016,33(5):521-524.
[7] Zhang YB,Zhan LQ,Li GQ,Wang F,Wang Y,Li YL,et al.Dimeric matrine-type alkaloids from the roots ofSophora flavescensand their anti-hepatitis B virus activities[J].J Org Chem,2016,81(15):6273-6280.
[8] Guo LF,Tong SS,Yu JN,Xu XM.Advance in studies on anti-tumor mechanism of matrine[J].China J Chin Mater Med(中国中药杂志),2013,38(20):3409-3412.
[9] Tian XS.Research progress on toxicity of alkaloids in Radix et Rhizoma Sophorae Tonkinensis[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2016,22(6):230-234.
[10] Chen P,Xue CH,Du X.One case of ataxia caused by Radix Sophorae Subprostratae[J].J Baotou Med Coll(包头医学院学报),2016,32(4):151-152.
[11] Yan YH,Pan KG,Zheng F.Retrospective analysis of 92 cases of Radix Sophorae Subprostratae poisoning reaction[J].Strait Pharm J(海峡药学),2012,24(9):256-257.
[12] Cen Y,Zhu JY.Adverse reactions caused by matrine injection in 3 cases[J].Chin J Drug Abuse Prev Treat(中国药物滥用防治杂志),2012,18(4):245.
[13] Liang P,Yuan TJ,Gu LL,Lu H.Study of hepatotoxicity and neural behavioral changes ofSophora flavescensand matrine in mice[J].Chin J Mod Appl Pharm(中国现代应用药学),2015,32(12):1444-1448.
[14] Qi QQ,Lyu PY.The role of NADPH oxidase in neurodegenerative diseases[J].J Int Neurol Neu⁃rosurg(国际神经病学神经外科学杂志),2015,42(2):173-177.
[15] Huang DH,Zhou SS,Zhang LM.Oxidative stress and Alzheimer′s disease[J].J Int Neurol Neuro⁃surg(国际神经病学神经外科学杂志),2012,39(3):268-270.
[16] Han CN.Study on phenolic composition C extract from Gastrodia elata protect PC12 cells against antioxidant injury(天麻酚性成分C对氧化应激损伤PC12细胞的保护作用研究)[D].Kunming:Yunnan University of Traditional Chinese Medicine(云南中医学院),2015.
[17] Satoh T,Enokido Y,Aoshima H,Uchiyama Y,Hatanaka H.Changes in mitochondrial membrane potential during oxidative stress-induced apoptosis in PC12 cells[J].J Neurosci Res,1997,50(3):413-420.
[18] Miyamoto H,Doita M,Nishida K,Yamamoto T,Sumi M,Kurosaka M.Effects of cyclic mechanical stress on the production of inflammatory agents by nucleus pulposus and anulus fibrosus derived cellsin vitro[J].Spine(Phila Pa 1976),2006,31(1):4-9.
[19] Wang L.Irgarol 1051 induces apoptosis by disrupting the structure and function of mitochondria(Irgarol 1051通过破坏线粒体的结构和功能而诱发细胞凋亡)[D].Shantou:Shantou University(汕头大 学),2013.
[20] Eshkar-Oren I,Krief S,Ferrara N,Elliott AM,Zelzer E.Vascular patterning regulates interdigital cell death by a ROS-mediated mechanism[J].Devel⁃opment,2015,142(4):672-680.
[21] Yang SJ,Meng JP,Qu Y,Liu YB.The progress on the signal transduction pathways of apoptosis[J].Chin J Comp Med(中国比较医学杂志),2007,17(5):297-301.
[22] Yang LJ,Cao XT,Yu YZ.Bcl-2,Bax and tumor cell apoptosis[J].Chin J Cancer Biother(中国肿瘤生物治疗杂志),2003,10(3):232-234.
