小分子糖及糖醇体外抑制α-葡萄糖苷酶活性的影响
2017-04-26刘国玉柳嘉万宁王玺倪庆桂喻勤孙忠伟杜玉兰严建刚王菲段盛林
刘国玉,柳嘉,万宁,王玺,倪庆桂,喻勤,孙忠伟,杜玉兰,严建刚,王菲,段盛林*
1(中国食品发酵工业研究院,北京,100015) 2(完美(中国)有限公司,广东 广州,528402) 3(北京市科学技术委员会,北京,100195)
小分子糖及糖醇体外抑制α-葡萄糖苷酶活性的影响
刘国玉1,柳嘉1,万宁1,王玺1,倪庆桂2,喻勤2,孙忠伟2,杜玉兰2,严建刚2,王菲3,段盛林1*
1(中国食品发酵工业研究院,北京,100015) 2(完美(中国)有限公司,广东 广州,528402) 3(北京市科学技术委员会,北京,100195)
研究了D-木糖、L-阿拉伯糖、海藻糖、棉籽糖、水苏糖、赤藓糖醇、异麦芽酮糖醇、山梨糖醇、木糖醇以及麦芽糖醇等小分子糖及糖醇对α-葡萄糖苷酶活性的抑制作用,以期为降糖营养食品的开发提供参考。通过高效液相色谱法,确定α-葡萄糖苷酶对糖及糖醇的分解作用,进一步检测各种糖及糖醇在蔗糖底物存在下对α-葡萄糖苷酶的抑制作用,将抑制效果较好的糖及糖醇进行复配,利用Calcusyn软件计算复配结果,观察样品的相互作用。D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇、异麦芽酮糖醇、山梨糖醇均能抑制α-葡萄糖苷酶的活性,且D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇、异麦芽酮糖醇以及山梨糖醇的IC50值分别为23.89 mg/mL、15.03 mg/mL、9.75 mg/mL、3.19 mg/mL、20.64 mg/mL、106.19 mg/mL。赤藓糖醇分别与海藻糖、异麦芽酮糖醇复配后对α-葡萄糖苷酶的抑制作用明显增强(联合指数CI<1),表现出协同效应。结论:赤藓糖醇与海藻糖或异麦芽酮糖醇复配后(CI<1)有助于增强对α-葡萄糖苷酶的抑制作用。
功能性糖;糖醇;α-葡萄糖苷酶;复配;体外抑制
由于环境和生活方式变化,人类疾病谱发生了很大转变,糖尿病、心血管疾病、肥胖症等慢性疾病比例不断上升,已成为目前全球性重大的公共卫生问题[1]。其中,糖尿病已成为继心脑血管病、肿瘤之后位居第3的慢性非传染疾病,在临床上以高血糖为主要特征[2-3],若血糖控制不佳则会导致全身多系统、多脏器损害,引发各种急慢性并发症。研究表明,血糖主要来源于食物中的糖类[4],α-葡萄糖苷酶是调节食物来源血糖的关键酶,食物中的碳水化合物经过口腔、胃到达小肠时,被小肠上皮绒毛膜刷状缘上的多种α-葡萄糖苷酶(如蔗糖酶、麦芽糖酶、淀粉葡萄糖苷酶等)分解为单糖,最终被机体吸收利用。因此,设计安全有效的α-葡萄糖苷酶抑制剂来抵抗糖尿病成为人们研究的热点。目前,临床上多采用药物疗法[5],如阿卡波糖和伏格列波糖作为α-葡萄糖苷酶抑制剂来控制血糖,但其制备工艺复杂,生产成本高昂且副作用明显。研究发现,部分功能性糖能抑制α-葡萄糖苷酶活性,减少葡萄糖生成量,进而降低餐后引起的血糖波动。功能性糖包括功能性单糖、寡糖、糖醇等小分子糖以及植物性多糖。关于功能性糖对血糖值的影响国外报道较多[6-9],而国内多通过研究植物多糖组分探究其对α-葡萄糖苷酶的抑制作用[10-12]。目前,有关海藻糖、棉籽糖、水苏糖及糖醇对α-葡萄糖苷酶抑制作用的探究鲜见报道,且关于寡糖与糖醇的复配物对α-葡萄糖苷酶抑制作用的研究未见报道。故本研究对部分单糖、寡糖、糖醇及其复配物的α-葡萄糖苷酶抑制活性进行了探究,筛选出具有降糖特性的糖及糖醇复配物,并将其运用到糖尿病患者饮食中,如制备糖尿病患者食用的谷物食品、焙烤食品、甜味剂和牛奶等食物,以期为降糖食品的开发提供参考。
目前,试验室多采用紫外分光光度法筛选α-葡萄糖苷酶抑制剂,试剂消耗大且重现性差,准确度相对较低,尤其对有颜色干扰的样品,其假阳性高[13]。而利用高效液相色谱法,以蔗糖为底物时,不仅出峰时间快,与其他样品峰无重叠现象,而且底物峰面积随酶解时间的延长呈现规律性变化,准确性高且重现性好,有学者[12,14]曾分别以蔗糖和麦芽糖为底物探究L-阿拉伯糖和桑叶多糖对α-葡萄糖苷酶的抑制作用,发现L-阿拉伯糖和桑叶多糖以蔗糖为底物时对酶活的抑制作用要显著大于以麦芽糖为底物时对酶活的抑制作用。本研究采用高效液相色谱法,以蔗糖为底物,利用Hypersil NH2S氨基色谱柱分离糖及糖醇的特性,根据蔗糖峰面积的变化,分析各种糖及糖醇对α-葡萄糖苷酶活性的抑制作用,并将不同糖及糖醇复配组合,观察复配物对抑制酶活是否有增强作用,通过Calcusyn数据处理系统对不同浓度的抑制剂和相应抑制率进行分析,得到半数抑制浓度(half maximal inhibitory concentration,IC50)。IC50值越小,抑制活性越强,以此为依据研究各种糖及糖醇的活性差异。
1 材料与方法
1.1 材料与试剂
糖醇:麦芽糖醇、异麦芽酮糖醇 、赤藓糖醇、木糖醇、山梨糖醇;单糖:D-木糖、L-阿拉伯糖;二糖:海藻糖;三糖:棉籽糖,以上原料均来自上海士丰生物科技有限公司,纯度>98%;四糖:水苏糖,中国食品发酵工业研究院制备,纯度>97%;α-葡萄糖苷酶(50 U/mg),上海士丰生物科技有限公司;蔗糖(化学纯);乙腈、甲醇(均为色谱纯或优级纯)。
1.2 仪器与设备
LC-20AT型高压液相色谱仪、RID-10A示差折光检测器,日本岛津公司;GL-20G-Ⅱ型高速冷冻离心机,上海安亭科学仪器厂;DK-8D三温三控水槽,上海博迅实业有限公司;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司;分析天平,梅特勒-托利多仪器有限公司。
1.3 色谱条件
色谱柱:Hypersil NH2S氨基色谱柱(4.6 mm×250 mm,5 μm);柱温:40 ℃;流动相:V(乙腈)∶V(水)=70∶30;流速:1.0 mL/min;进样量:10 μL。
1.4 溶液的配制
1.4.1 母液的配制
分别精确称取0.50 g蔗糖、D-木糖、L-阿拉伯糖、水苏糖、麦芽糖醇、赤藓糖醇、木糖醇、山梨糖醇、异麦芽酮糖醇、海藻糖、棉籽糖样品,用去离子水定容于 10 mL 容量瓶中,制成质量浓度为 50 mg/mL的母液,备用。
1.4.2 样品溶液的配制
用移液管分别吸取按1.4.1配制的母液,用去离子水定容至10 mL容量瓶中,分别配制质量浓度为2、4、6、8、10 mg/mL的赤藓糖醇溶液,3、6、9、12、15 mg/mL的海藻糖溶液、D-木糖溶液、L-阿拉伯糖溶液、山梨糖醇溶液以及5、10、15、20、25 mg/mL的异麦芽酮糖醇溶液。
1.4.3 复配溶液的配制
用移液管分别吸取按1.4.1配制的母液,分别配制赤藓糖醇溶液终质量浓度为0.5、1.0、1.5、2.0、2.5 mg/mL,海藻糖、D-木糖、L-阿拉伯糖、异麦芽酮糖醇以及山梨糖醇样品相应终质量浓度为1.5、3.0、4.5、6.0、7.5 mg/mL的混合溶液。
1.4.4α-葡萄糖苷酶溶液的配制
精密称取20.0 mgα-葡萄糖苷酶于10 mL容量瓶中,用去离子水定容,得到0.1 U/μL的α-葡萄糖苷酶溶液。
1.5 标准曲线的制作
用移液管分别取0.2、0.4、0.6、1、2 mL上述蔗糖母液,用去离子水定容于10 mL容量瓶中,配制质量浓度分别为1、2、3、5、10 mg/mL的标准溶液,充分摇匀,溶液过0.45 μm微孔滤膜后上高效液相色谱测定。以峰面积为纵坐标(y),以蔗糖浓度为横坐标(x),做标准曲线,得线性回归方程y=81 035x+1 678,r2=0.999 6,在0~10 mg/mL质量浓度范围内呈良好的线性关系。
1.6 试验过程与计算方法
试验分组如下,依次加入去离子水、样品溶液,混合均匀,于37 ℃保温10 min,结束后,取出,加入37 ℃酶溶液,充分混匀,于37 ℃反应40 min后,沸水浴灭酶,而后10 000 r/min离心10 min,取上清液过 0.45 μm 微孔滤膜后上高效液相色谱测定。
试验共设定4个组,每组3个平行,分别为:
①对照组(900 μL去离子水+100 μL样品)
②测试组(850 μL去离子水+100 μL样品+50 μL酶液 )
③样品对照组(850 μL去离子水+100 μL底物+50 μL酶液 )
④样品测定组(750 μL去离子水+100 μL样品+100 μL底物+50 μL酶液)
抑制率按公式(1)计算:
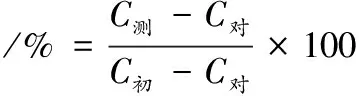
(1)
式中:C对为样品对照组蔗糖浓度,mg/mL;C测为样品测定组蔗糖浓度,mg/mL;C初为初始蔗糖浓度,mg/mL。
1.7 数据分析方法
每组试验重复3次,结果以x±s表示。试验数据采用Origin8.1 软件进行单因素方差(One-Way ANOVA)分析,来判断显著性差异,P<0.05代表有显著性差异,P<0.01代表有极显著性差异,样品复配后的相互作用通过Calcusyn软件进行分析,根据联合指数(Combination Index,CI)值来判断,CI<1、CI=1、CI>1分别代表协同、叠加、拮抗。
2 结果与分析
2.1 糖及糖醇对α-葡萄糖苷酶的影响
配制对照组和测试组,按1.3的色谱条件和1.6的方法操作,比较酶存在或不存在的条件下,糖及糖醇样品峰的变化,以考察其能否被酶分解。
研究发现,酶存在时,D-木糖、L-阿拉伯糖、海藻糖、棉籽糖、水苏糖、山梨糖醇、木糖醇和赤藓糖醇的液相色谱图与未加酶时对应的色谱图相比,出峰时间一致且出峰面积基本相等,可知此类糖及糖醇不能被α-葡萄糖苷酶分解(图略)。而麦芽糖醇和异麦芽酮糖醇(如图1)在酶存在时峰面积比未加酶的峰面积小,且色谱图中出现了2个小峰(如箭头所示),说明麦芽糖醇和异麦芽酮糖醇能部分被α-葡萄糖苷酶分解,经检测,异麦芽酮糖醇分解生成的物质出峰时间与葡萄糖、山梨糖醇出峰时间一致,表明异麦芽酮糖醇能被α-葡萄糖苷酶分解为葡萄糖和山梨糖醇。

a-未加酶时糖醇样品;b-加酶时糖醇样品图1 麦芽糖醇(A)和异麦芽酮糖醇(B)的高效液相色谱图Fig.1 High performance liquid chromatogram of maltitol (A) and isomaltitol (B)
2.2 糖及糖醇对α-葡萄糖苷酶分解蔗糖能力的影响
配制样品对照组和不同糖及糖醇的样品测定组,观察各种糖及糖醇对酶分解蔗糖能力的影响,溶液中剩余的蔗糖浓度越高,表明该糖或糖醇抑制酶分解蔗糖的能力越强,试验结果如图2所示。
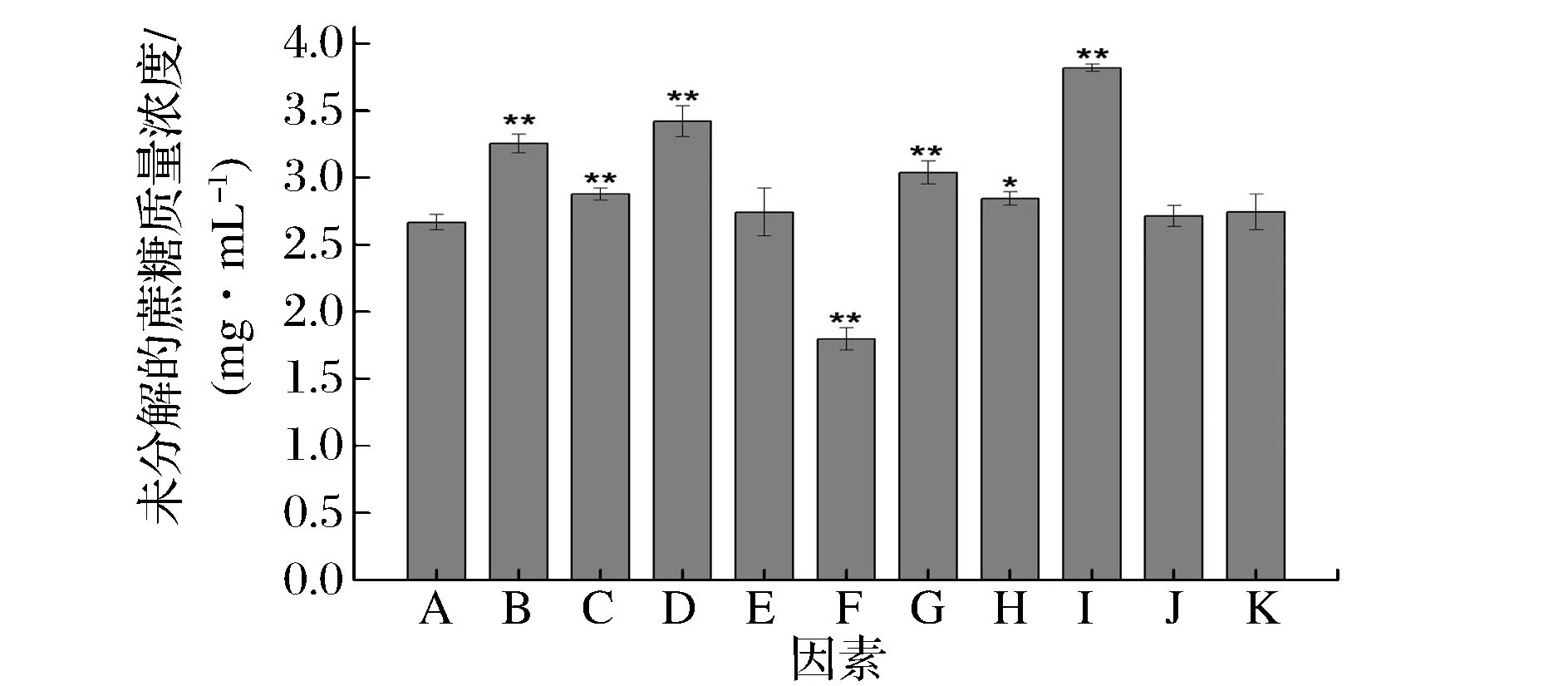
A-蔗糖+酶;B-L-阿拉伯糖+蔗糖+酶;C-D-木糖+蔗糖+酶;D-海藻糖+蔗糖+酶;E-棉籽糖+蔗糖+酶;F-水苏糖+蔗糖+酶;G-异麦芽酮糖醇+蔗糖+酶;H-山梨糖醇+蔗糖+酶;I-赤藓糖醇+蔗糖+酶;J-麦芽糖醇+蔗糖+酶;K-木糖醇+蔗糖+酶图2 各种糖及糖醇对α-葡萄糖苷酶分解蔗糖程度的影响Fig.2 The effect of various sugars and sugar alcohols on the sucrose decomposition degree of α-glucosidase*p<0.05,与A组相比有显著性差异,** p<0.01,与A组相比有极显著性差异。
由图2可知,L-阿拉伯糖、D-木糖、海藻糖、赤藓糖醇、异麦芽酮糖醇能极显著(P<0.01)抑制α-葡萄糖苷酶的活性,山梨糖醇能显著(P<0.05)抑制α-葡萄糖苷酶的活性,从而使蔗糖分解减少。水苏糖能极显著(P<0.01)促进蔗糖分解,即能促进酶对蔗糖的分解作用,水苏糖是由果糖、葡萄糖以及2个半乳糖聚合形成的四糖结构,难以被人体消化酶分解,且王晓莉[15]等研究发现,水苏糖具有降血糖的作用,本试验中水苏糖促进蔗糖分解,表明其降糖作用并不是通过抑制α-葡萄糖苷酶的活性来实现的,具体的降糖机制还需进一步探究;棉籽糖、麦芽糖醇和木糖醇对蔗糖分解未见显著影响。实验结果表明,糖及糖醇抑制体外α-葡萄糖苷酶活性试验中,D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇、异麦芽酮糖醇、山梨糖醇均能较好地抑制α-葡萄糖苷酶活性,而其他的糖及糖醇对该酶的抑制活性表现较差。为研究各种糖及糖醇抑制α-葡萄糖苷酶活性强弱,选取上述有酶抑制作用的糖及糖醇,设计浓度梯度,计算相应的酶抑制率,通过Calcusyn软件对数据进行分析,求得IC50值,从而得到抑制α-葡萄糖苷酶的最佳糖及糖醇样品。
2.3 不同浓度的糖及糖醇对α-葡萄糖苷酶的抑制作用
按1.4.2小节配制样品溶液,测定蔗糖峰面积,计算反应后蔗糖终质量浓度,计算抑制率,试验结果如图3所示。
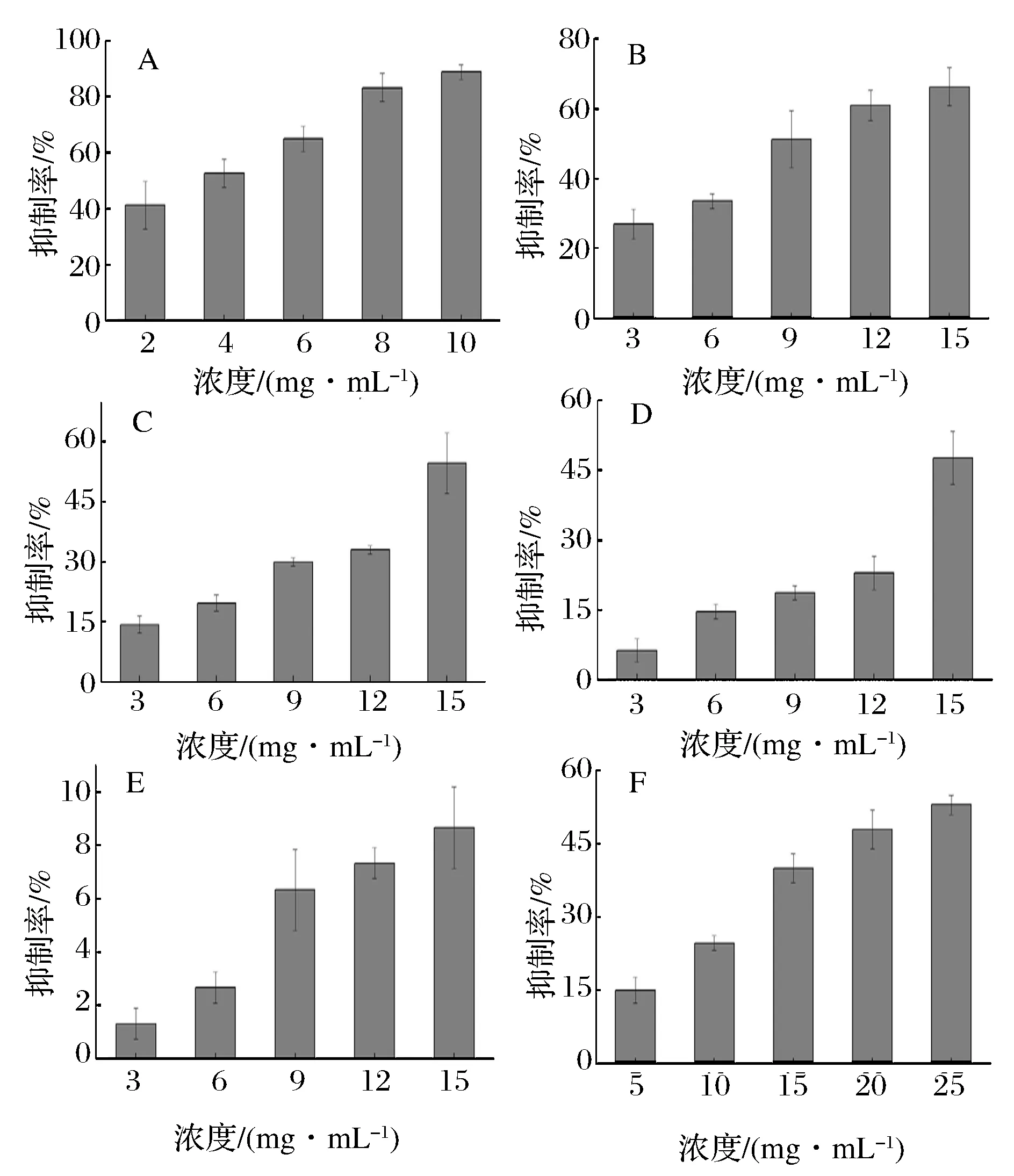
图3 不同浓度下赤藓糖醇(A)、海藻糖(B)、L-阿拉伯糖(C)、D-木糖(D)、山梨糖醇(E)、异麦芽酮糖醇(F)对α-葡萄糖苷酶的抑制作用Fig.3 The inhibitory effects of different concentrations of erythrito(A), trehalose (B), L-arabinose (C),D-xylose (D), sorbitol (E) and isomaltitol (F) on α-glycosidase activity
由图3可以看出,D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇以及异麦芽酮糖醇随着浓度的增加,对酶的抑制率逐渐增强。通过Calcusyn软件处理数据,得到D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇以及异麦芽酮糖醇的IC50值分别为23.89 mg/mL、15.03 mg/mL、9.75 mg/mL、3.19 mg/mL和20.64 mg/mL,与其他小分子糖及糖醇比较,赤藓糖醇作用浓度较低且有较好
的酶抑制效果,IC50值较小,因此,本试验选用赤藓糖醇与其他糖及糖醇复配。
2.4 赤藓糖醇与其他糖及糖醇复配后对α-葡萄糖苷酶的抑制作用
由2.3可知,糖及糖醇抑制率达到50%时,赤藓糖醇相应的作用浓度较低,而其他糖及糖醇作用浓度较高,因此,按1.4.3配制混合溶液,计算抑制率,实验结果见图4。
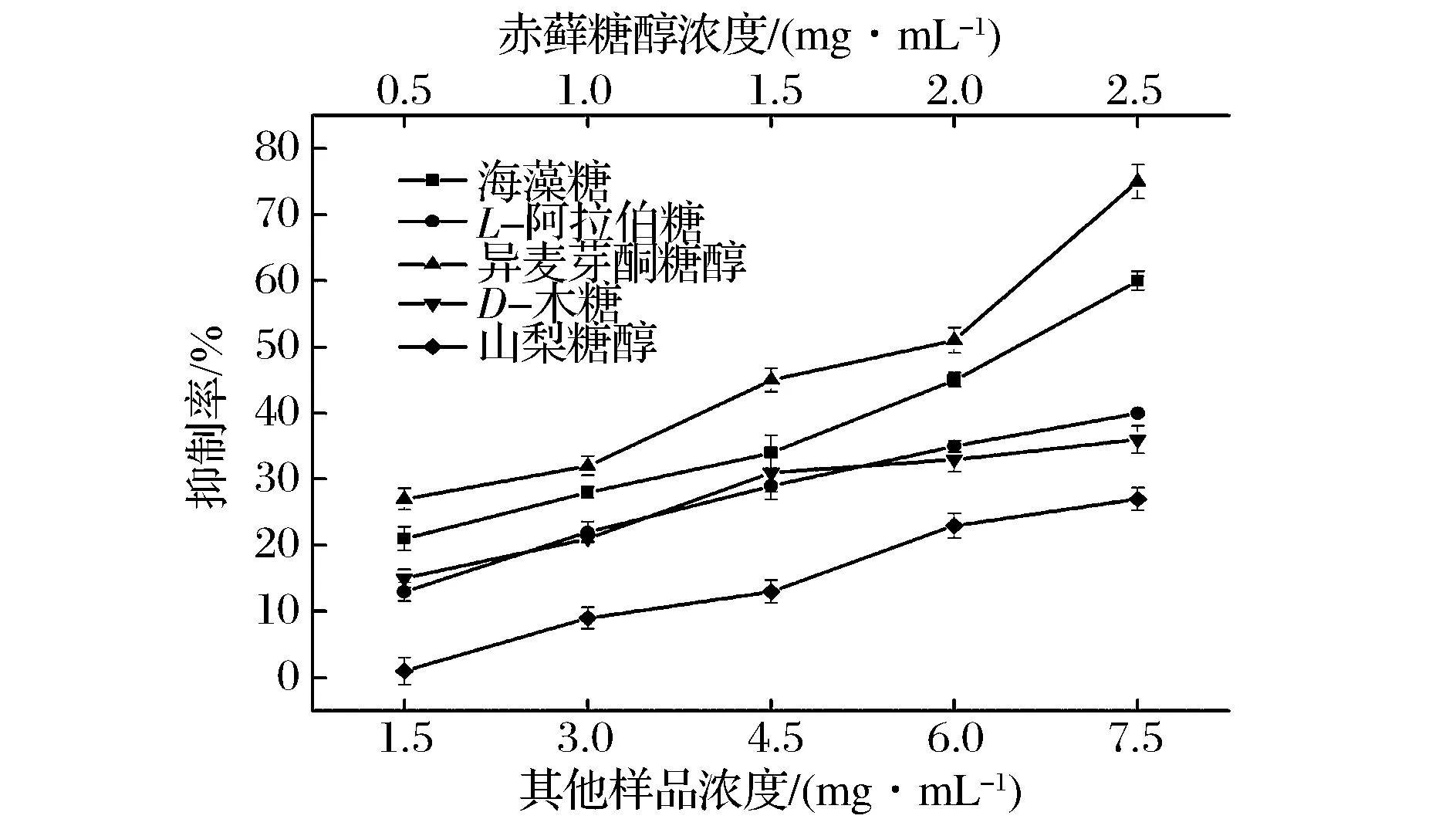
图4 赤藓糖醇与各种糖及糖醇不同配比对α-葡萄糖苷酶的抑制作用比较Fig.4 Comparison of erythritol combined with other sugars and sugar alcohols on the inhibition of α-glycosidase
由图4看出,随着浓度的增加,赤藓糖醇分别与海藻糖、D-木糖、L-阿拉伯糖、异麦芽酮糖醇以及山梨糖醇复配后对酶的抑制率逐渐增强,表现出一定的剂量依赖性,利用Calcusyn软件计算赤藓糖醇分别与海藻糖、异麦芽酮糖醇、D-木糖、L-阿拉伯糖以及山梨糖醇复配后的CI,并比较抑制率为25%、50%、75%和90%时赤藓糖醇与其他糖及糖醇的联合作用,结果见表1。
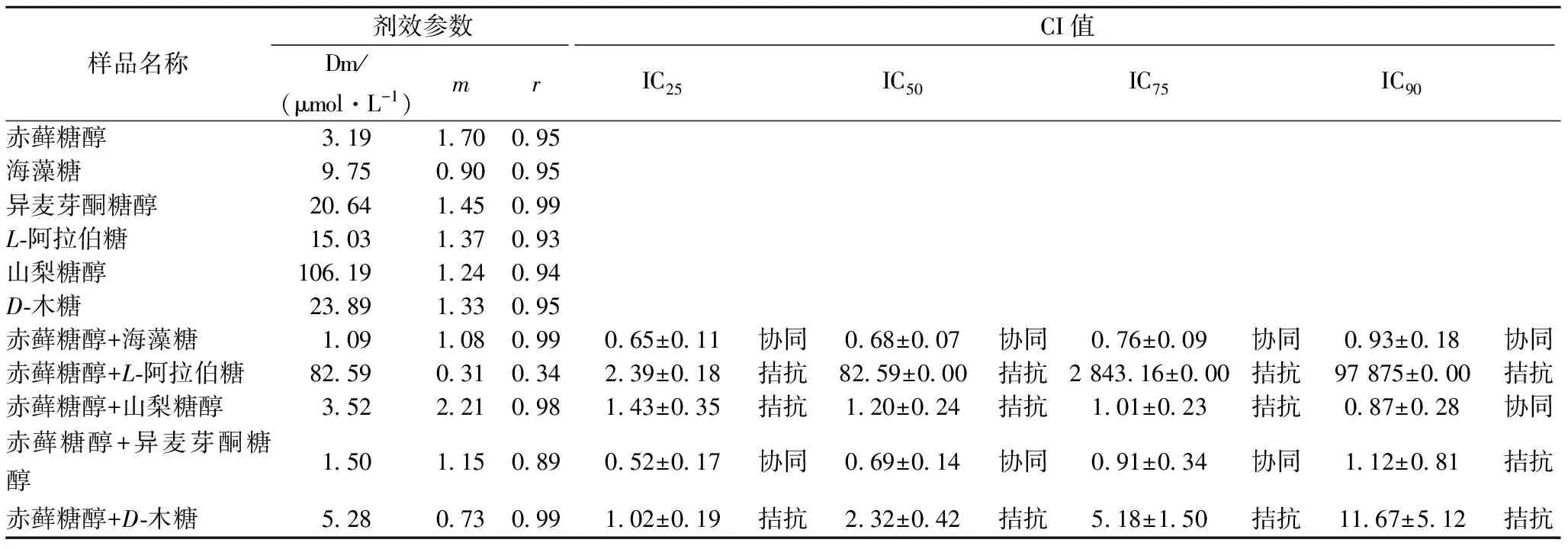
表1 赤藓糖醇与其他糖及糖醇不同配比对α-葡萄糖苷酶的联合作用
注:Dm代表中效剂量即IC50值。
由表1可知,当抑制率在25% ~75%范围内,赤藓糖醇分别与海藻糖、异麦芽酮糖醇复配时,抑制作用明显增强,且CI值<1,表现出协同作用,即两者复配后抑制率高于两者单独作用时抑制率之和。赤藓糖醇分别与D-木糖、L-阿拉伯糖、山梨糖醇复配时,与各糖及糖醇单独使用时比较,复配后的抑制率明显降低,CI值>1,表现出拮抗作用,即两者复配后抑制率低于两者单独作用时抑制率之和。
3 讨论
本试验系统检测了10种小分子糖及糖醇对α-葡萄糖苷酶的抑制作用,通过高效液相法,以α-葡萄糖苷酶为靶标,检测糖及糖醇在底物不存在时能否被α-葡萄糖苷酶分解,结果表明,部分异麦芽酮糖醇能被α-葡萄糖苷酶分解为葡萄糖和山梨糖醇。张坚[16]等研究发现,异麦芽酮糖醇在胃、小肠能被缓慢且不完全地水解为葡萄糖、山梨糖醇,本试验结果与其研究发现一致。试验中部分赤藓糖醇被α-葡萄糖苷酶分解生成两种物质,而苏永[17]等研究表明,目前尚未发现人体消化系统的正常微生物菌群和人体所分泌的α-1,4-糖苷酶对麦芽糖醇分子中的糖苷键有分解作用,即麦芽糖醇不能被人体内的α-葡萄糖苷酶分解,本试验中麦芽糖醇部分分解,其具体机制还需进一步探究。
各种糖及糖醇对α-葡萄糖苷酶的作用结果表明,随着浓度增大,D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇、异麦芽酮糖醇等对酶的抑制能力逐渐增强。L-阿拉伯糖对蔗糖-酶中间体有高亲和力,形成三聚体后使酶活性中心空间结构发生改变,这可能是L-阿拉伯糖抑制α-葡萄糖苷酶活性的原因[14]。在对α-葡萄糖苷酶抑制剂的结构研究过程中,GABRIELA[18]发现,该类物质存在着某些共性,化合物中的羟基数目、构型以及糖的构象都会影响化合物对酶的抑制作用[4]。赤藓糖醇、异麦芽酮糖醇多羟基,木糖多以寡糖和多糖形式存在,海藻糖有多种同分异构体,因此,D-木糖、海藻糖、赤藓糖醇以及异麦芽酮糖醇等多样性结构可能与其对α-葡萄糖苷酶的抑制作用相关。复配结果表明,赤藓糖醇与D-木糖、L-阿拉伯糖、山梨糖醇分别复配时,抑制率明显降低,且复配物的抑制率低于单因素实验中两者抑制率之和,即表现出拮抗作用,出现该结果的原因可能是,降糖物质在人体内起作用是一个多成分、多靶点的过程[19],试验选用的α-葡萄糖苷酶抑制模型,靶点单一,当赤藓糖醇分别与D-木糖、L-阿拉伯糖、山梨糖醇复配时,导致两者在抑制α-葡萄糖苷酶活性过程中存在竞争性抑制,从而使抑制率降低。本试验对糖及糖醇体外抑制α-葡萄糖苷酶活性作用进行了初步探讨,由于机制复杂,有待进一步选用体内多靶点模型进行深入研究。
综上,D-木糖、L-阿拉伯糖、海藻糖、赤藓糖醇、异麦芽酮糖醇、山梨糖醇均能抑制α-葡萄糖苷酶的活性,且赤藓糖醇与海藻糖或异麦芽酮糖醇复配后有助于增强对α-葡萄糖苷酶的抑制作用。通过研究糖与糖醇及其复配物的特殊功能,从而为降糖营养食品的开发提供参考,降低食品中糖对特殊人群的影响[20-21],对于研究糖尿病的预防和饮食治疗具有重要意义。
[1] 缪铭,江波,张涛.低血糖生成指数淀粉类衍生物的研究进展[J].食品科学, 2008,29(4):452-456.
[2] 张冬慧,唐智柳,李岚,等.我国21世纪初糖尿病患病率系统综述[J].上海预防医学,2012,24(9): 492-495.
[3] 陈骁熠.糖尿病功能性食品[M].北京:化学工业出版社,2006:23-28.
[4] 王谦,张璐,边晓丽,等.α-葡萄糖苷酶抑制剂及构效关系的研究进展[J].中国新药杂志,2014,23(2):190-195.
[5] AZUMA T,KAYANO S I,MATSUMURA Y,et al.Antimutagenic and α-glucosidase inhibitory effects of constituents fromKaempferiaparviflora[J].Food Chem,2011,125(2):471-475.
[6] 杨远志,杨海军.功能性糖醇[J].精细与专用化学品,2004,12(1): 11-12.
[7] 尤新.功能性糖醇[J].中国食品添加剂,2002(6): 1-4.
[8] LUO J Y,PERSELLE M V, RIZKALLA S W, et al.Chronic consumption of short chain fructooligosaccharides does not affect basal hep-atic glucose production or insulin resistance in type 2 diabetics[J]. Journal of Nutrition,2000, 130(6):1 572-1 577.
[9] LEVRAT M A,REMESY C,DEMIGNE C.High propionic acid fermentations and mineral accumulation in cecum of rats adapted to different levels of inulin[J]. Journal of Nutrition,1991,121(11): 1 730-1 737.
[10] 李湘洲,张胜,李文生.油茶饼粕多糖对体外α-葡萄糖苷酶的抑制作用[J].湖南大学学报,2012,36(11): 71-73.
[11] 朱振元,刘晓翠,郭蓉,等.蛹虫草多糖对α-葡萄糖苷酶活性的抑制研究[J].现代食品科技,2012,30(12):55-60.
[12] 罗晶洁,王尉,曹学丽.桑叶多糖的分离纯化及对α-葡萄糖苷酶的抑制活性[J].食品科学,2011,32(3):112-115.
[13] ZUOU R J, GU L J, LI Z G, et al.Study on ultrasonically aided solvent extraction of walnut oil[J]. Journal of Food Science,2003,24(10): 34-37.
[14] 姚晓芬,王鑫,应茵,等.L-阿拉伯糖对 α-葡萄糖苷酶抑制活性的体外试验研究[J].中国食品卫生杂志,2012,24(2):102-105.
[15] 王晓莉,张汝学,贾正平,等.地黄低聚糖灌胃对糖尿病大鼠的降糖作用及对肠道菌群的影响[J].西北国防医学杂志, 2003, 24(2): 121-123
[16] 张坚.异麦芽酮糖醇在慢性疾病预防中的作用[J].中国食物与营养,2006(12):46-48.
[17] 苏永,黄宝平,王丽,等.麦芽糖醇对糖尿病及非糖尿病人群血糖的影响[J].医药论坛杂志,2012,33(5):25-26.
[18] GABRIELA P B. RAWLEL I. A preparation and screening strategy for glycosidase inhibitors[J]. Tetrahedron,2001,57(42): 8 773-8 779.
[19] 杜冠华,王月华,张冉,等.多成分多靶点是对中药作用机制的表面认识[J].世界科学技术-中医药现代化,2009,11(4): 480-484.
[20] 胡学智.功能性低聚糖[J].营养健康新观察,1999(2): 5-9.
[21] 尤新.功能性低聚糖发展动向及前景[J].中国食品添加剂,2008(3):45-49.
The inhibitory effects of functional sugars and sugar alcohols on α-glucosidase activityinvitro
LIU Guo-yu1,LIU Jia1,WAN Ning1,WANG Xi1,NI Qing-gui2,YU Qin2, SUN Zhong-wei2,DU Yu-lan2,YAN Jian-gang2,WANG Fei3,DUAN Sheng-lin1*
1(China National Research Institute of Food & Fermentation Industries,Beijing 100015,China) 2(Perfect (China) Co., Ltd,Guangzhou 528402,China) 3(Beijing Municipal Science & Technology Commission ,Beijing 100195,China)
In order to provide references for the development of hypoglycemic nutrition diet, the inhibitory effects ofD-xylose,L-arabinose,trehalose, raffinose, lupeose, erythritol, isomaltitol, sorbitol, xylitol, and maltitol on the α-glucosidase activity were investigated. By using the high performance liquid chromatography method, the decomposition of sugars and sugar alcohols by α-glucosidase was detected, and their inhibitory effects on α-glucosidase were tested in the presence of sucrose. Further, the compounds with better inhibitory effects were designed to observe their interaction by using Calcusyn software.L-arabinose,D-xylose, trehalose, erythritol, isomaltitol and sorbitol all could inhibit the activity of α-glucosidase, and the value of IC50ofD-xylose,L-arabinose, trehalose, erythritol, isomaltitol and sorbitol were 23.89 mg/mL, 15.03 mg/mL, 9.75 mg/mL, 3.19 mg/mL, 20.64 mg/mL, 106.19 mg/mL, respectively. The inhibition of α-glucosidase were significantly increased when erythritol was combined with trehalose or isomaltitol (Combination Index <1) and showed a synergistic effect. The compounds of erythritol and trehalose or isomaltitol may contribute to the enhancement of inhibition of α-glucosidase.
functional sugar; sugar alcohol; α-glucosidase; combination;the inhibitory effectsinvitro
10.13995/j.cnki.11-1802/ts.201703007
硕士研究生(段盛林教授级高级工程师为通讯作者,E-mail:dslbeijing@163.com)。
农业科技成果转化资金(2014GB2A000268)
2016-08-09,改回日期:2016-10-13
