微液滴适应性进化强化大肠杆菌耐受高浓度L-山梨糖
2021-01-20曾伟主单小玉房峻周景文
曾伟主,单小玉,房峻,周景文*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2 (江南大学 未来食品科学中心,江苏 无锡,214122)
2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KLG)是生产维生素C的直接前体[1]。维生素C是人体维持正常生命活动必需的维生素,是一种有效的抗氧化剂,广泛应用于化妆品、食品、饮料、制药和饲料等领域[2-4]。我国是维生素C生产大国,产能占世界90%以上,生产技术水平和生产规模均达到世界领先水平[5]。维生素C生产通常先利用微生物发酵合成2-KLG,再将2-KLG酯化生成维生素C。目前,维生素C生产主要依赖由氧化葡萄糖酸杆菌(Gluconobacteroxydans)、巨大芽胞杆菌(Bacillusmegaterium)和普通生酮基古龙酸菌(Ketogulonicigeniumvulgare)组成的三菌二步发酵法[6-7]。随着发酵工业的不断发展,三菌二步发酵法存在的缺陷日益凸显,如菌株选育困难、操作复杂且稳定性差、原材料与能源消耗大等,不仅导致生产成本显著高于类似产品,菌株选育也一直未能取得重要突破[8-9]。
研究人员企图通过构建一菌一步发酵法从根源上解决三菌二步发酵法中存在的问题。ANDERSONT等试图通过在欧文氏菌(Erwiniaherbicola)过量表达来源于谷氨酸棒状杆菌(Corynebacteriumglutamicum)的2,5-二酮基-D-葡萄糖酸还原酶,以葡萄糖为底物生产2,5-二酮基-D-葡萄糖酸,然后再生产2-KLG,但由于酶活力较低以及辅因子再生不匹配等问题,该方法始终未能实现2-KLG的高效生产[10]。SAITO等将来源于G.oxydansT100中合成2-KLG的2个关键脱氢酶山梨糖脱氢酶(sorbose dehydrogenase,SDH)和山梨酮脱氢酶(sorbosone dehydrogenase,SNDH)在G.oxydans表达,可以实现2-KLG的少量积累,但在大肠杆菌中进行过表达,却不能实现2-KLG的积累,经过深入研究发现,SDH低酶活力是其主要的限制因素[11]。本研究室前期在G.oxydansWSH-003中表达山梨糖/山梨酮脱氢酶(SSDHs),成功构建了2-KLG一步发酵菌,但脱氢酶SSDHs的底物/产物特异性较差,2-KLG得率始终低于70%[12-13]。目前,一步一菌发酵法存在的问题主要包括辅因子再生、关键酶的鉴定以及中间代谢副产物的竞争等[14-15]。
本研究室通过建立基于2-KLG还原酶的高通量筛选方法,筛选到1株可直接积累2-KLG的G.oxydansWSH-004,该菌株含有依赖辅助因子FAD的SDH,可以转化L-山梨糖直接生成2-KLG,转化率几乎100%,但由于酶活性较低,2-KLG积累量仍较低[16]。在EscherichiacoliBL21 (DE3)中组成型表达SDH,获得了1株能积累2-KLG的菌株E.coliBL21(DE3)-pMD19-cspA-SDH,但该菌株能在低浓度L-山梨糖培养基中良好生长,在较高浓度L-山梨糖培养基中生长速度很慢,而菌种前期的生长状态对目的产物的高效积累具有关键作用[17]。近年来,通过适应性进化策略显著提高了工业微生物的底物耐受性以及生产性能[18-19]。张翀等开发了一种基于微流控技术的全自动高通量微生物液滴培养系统(microbial microdroplet culture system,MMC),能够实时在线检测微生物的生长(OD),定时定量更换新鲜培养基或添加化学因子,并完成微生物继代培养,从而实现菌株的进化和筛选[20-21]。基于此,本研究应用MMC对出发菌株进行不同浓度梯度L-山梨糖的适应性进化,提高出发菌株对L-山梨糖的耐受性,并考察其发酵生产2-KLG的性能。结果表明进化菌株具有较好的积累2-KLG的能力,该研究为一菌一步发酵法生产维生素C前体2-KLG提供了参考。
1 材料与方法
1.1 材料
1.1.1 菌株
EscherichiacoliBL21(DE3)-pMD19-cspA-SDH由本实验室前期研究构建[17],氧化葡萄糖酸杆菌G.oxydansWSH-004 (保藏号:CCTCC M2019481),由本研究室前期筛选获得,用于扩增SNDH基因[16]。
1.1.2 主要试剂
蛋白胨和酵母粉,Oxoid公司;氨苄青霉素(Amp)、NaCl,上海国药集团;各种用于构建载体的一步克隆酶、连接酶以及商品化的pMD19-T Simple Vector,大连宝生物(TaKaRa)有限公司;L-山梨糖,本实验室发酵提取获得。
1.1.3 主要仪器
摇床,上海知楚仪器有限公司;岛津液相色谱仪,日本shimadzu公司;Nanodrop ND-2000分光光度计,美国Thermo公司;PCR仪,美国Bio-Rad公司;离心机,美国Eppendorf公司;全自动高通量微生物液滴培养仪,无锡源清天木生物科技有限公司。
1.1.4 培养基
种子培养基(g/L):酵母粉 5,蛋白胨 10,NaCl 10,115 ℃,灭菌20 min。
发酵培养基(g/L):酵母粉 5,蛋白胨 10,NaCl 10,根据需要添加不同浓度的L-山梨糖,115 ℃,灭菌20 min。
1.2 实验方法
1.2.1 全自动高通量微生物液滴培养
将出发菌株E.coliBL21(DE3)-pMD19-cspA-SDH通过MMC进行适应性进化培养。首先,在MMC上进行生长曲线测定,获得该菌株培养至生长对数期的时间,选择在对数中期开始进行下次传代。根据前期生长曲线的测定设定传代时间,在分别添加10.00、13.33、16.67和20.00 g/L四个不同低质量浓度的L-山梨糖培养基中培养进化,每个质量浓度传代2次。在此基础上,在10.00、20.00和30.00 g/L三个中质量浓度梯度的L-山梨糖培养基中进化,每个梯度传代至少5次,第1轮进化结束后,获得较好的进化菌株。继续进行第2轮进化,将第1轮获得的进化菌株培养到对数中期,依次按照含有30、50、70和100 g/L四个不同质量浓度L-山梨糖培养基中进化,每个梯度传代5次,获得更好的耐受高L-山梨糖的菌株。
1.2.2 菌株构建
参照文献[17]设计引物。应用PCR技术将G.oxydansWSH-004来源的SNDH,应用一步克隆的方法获得诱导型表达SNDH的质粒(pET28a-SNDH),转入进化菌株2-F6。

表1 本研究所用引物Table 1 Primers used in this study
1.2.3 细胞培养的方法
种子培养:将保存在-80 ℃冰箱的菌株划线,放置37 ℃恒温培养箱中培养12 h,挑取平板上的单菌落转接至14 mL摇菌管种子液,37 ℃,220 r/min培养9~12 h。
1.2.4 进化菌株摇瓶生长状况
在LB培养基中添加不同质量浓度的L-山梨糖,配制不同底物质量浓度L-山梨糖培养基(10、30、100和200 g/L),25 mL分装至250 mL摇瓶中。以体积分数2%的接种量接入培养好的种子液,37 ℃、220 r/min培养2 h,调节温度至30 ℃继续培养,取不同时间点检测OD600值。
1.2.5 发酵条件的优化
接种量分别选择2%、4%、6%、8%、10%、12%和14% (体积分数),每个接种量做3个平行,37 ℃、220 r/min培养2 h,调节温度至30 ℃继续培养,发酵72 h后检测2-KLG的积累量;在优化接种量的基础上进行发酵温度的优化,选择了25、30和37 ℃三个温度进行对比,发酵72 h后,检测2-KLG的产量;在优化了接种量和培养温度的基础上,对SNDH的IPTG诱导时间和诱导浓度进行优化。本部分所用发酵培养基组成为:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,L-山梨糖添加量为1%(体积分数)。
1.2.6 发酵罐分批发酵
在5 L发酵罐中,装液量为2.5 L,接种量为2%。接种前加入50 μg/mL卡纳抗生素和100 μg/mL氨苄抗生素,通气量1 vvm,转速300 r/min。当OD600值为3~4时加入IPTG诱导,同时加入底物L-山梨糖。
1.2.7 液相检测条件
采用高效液相色谱法检测2-KLG含量。色谱柱:Aminex HPX-87H (Bio-Rad, Hercules, CA),检测器:示差检测器,检测条件:流动相5 mmol/L H2SO4,流速0.5 mL/min,柱温35 ℃[12]。
2 结果与分析
2.1 耐高浓度L-山梨糖菌株的进化
以E.coliBL21(DE3)-pMD19-cspA-SDH为出发菌株,在MMC上测定生长曲线,确定6 h时为传代时间(图1-a)。在6~48 h依次在添加10.00、13.33、16.67和20.00 g/L四个不同低质量浓度的L-山梨糖培养基进化(图1-b),继续在10.00、20.00和30.00 g/L三个中质量浓度梯度L-山梨糖培养基中进化(图1-c)。第1轮进化后获得了1株较好的耐受菌1-18,比较耐受菌株1-18 (b)与出发菌株(a)的生长状况,发现在30 g/L的L-山梨糖培养基中耐受菌株前期生长明显快于出发菌株(图1-d)。为了获得耐受性更好的菌株,在含有30、50、70和100 g/L四个不同质量浓度L-山梨糖培养基中进行第2轮进化(图1-e),最终获得了1株能耐受更高L-山梨糖浓度的菌株2-F6。对比耐受菌株2-F6 (d)与出发菌株(c)生长状况,发现在100 g/L的高浓度L-山梨糖培养基中,耐受菌株生长明显快于出发菌株(图1-f)。表明通过MMC的培养提高了菌株对L-山梨糖的耐受性,进化菌株在高浓度L-山梨糖培养基中能够生长良好。
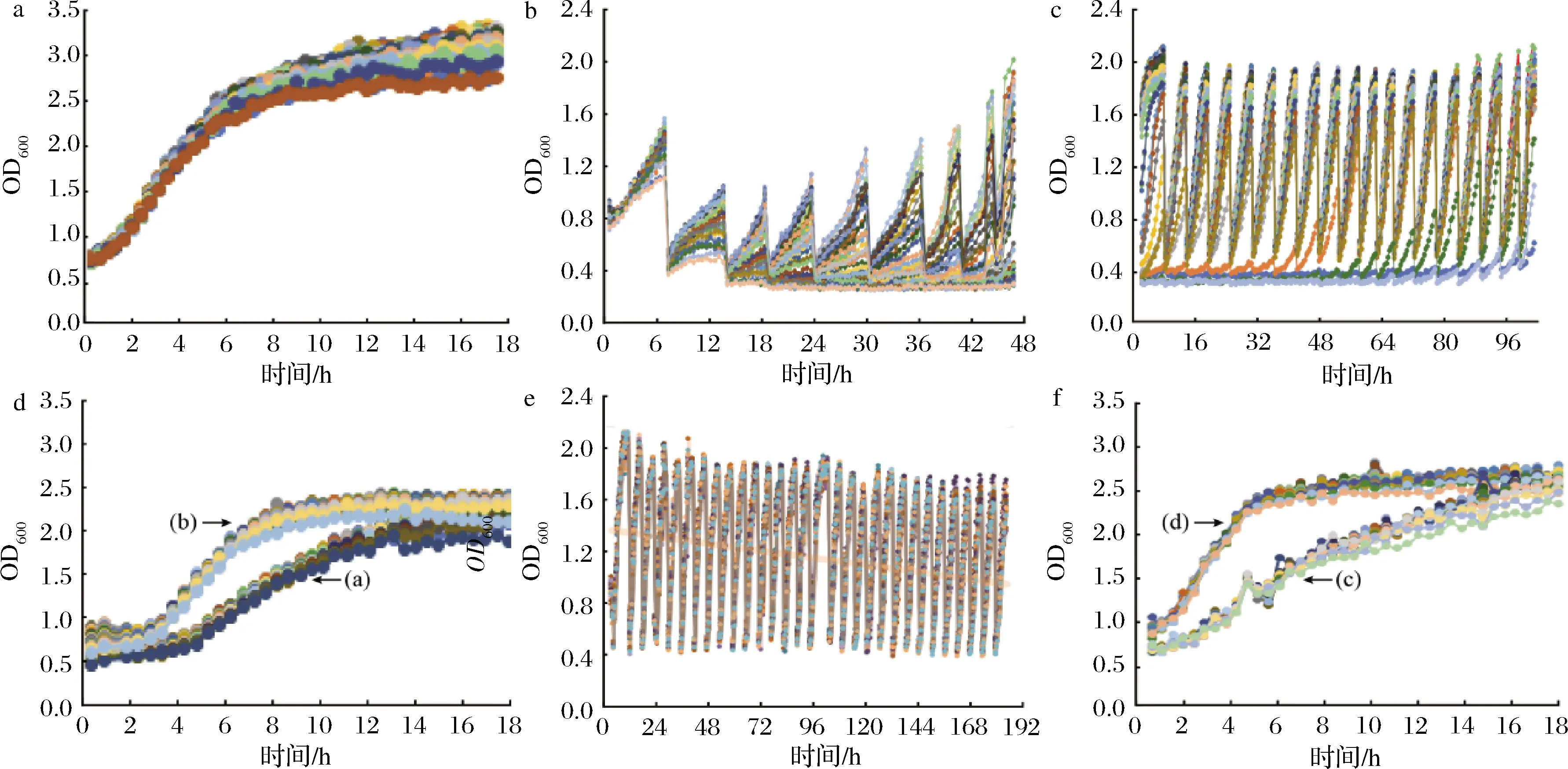
a-出发菌株生长曲线;b-较低质量浓度L-山梨糖(梯度质量浓度为10.00、13.33、16.67和20.00 g/L)培养基中的进化过程;c-中质量浓度 L-山梨糖(梯度质量浓度为10.00、20.00和30.00 g/L)培养基中的进化过程;d-出发菌株(a)和进化菌株1-18 (b)的生长对比;e-高质量浓度 L-山梨糖(梯度质量浓度为30.00、50.00、70.00和100.00 g/L)培养基中的进化过程;f-出发菌株(c)和进化菌株2-F6 (d)的生长对比图1 菌株耐高浓度L-山梨糖的适应性进化结果Fig.1 Results of adaptive laboratory evolution of high concentration L-sorbose
2.2 进化菌株在摇瓶水平上的生长情况验证
为了检测在MMC上获得的进化菌株能否在摇瓶中有着同样良好的生长状况,在摇瓶水平上考察了2株进化菌株的生长状况,以出发菌株为对照。将3株菌株分别在1%、3%、10% 和20%四个不同浓度的L-山梨糖培养基中进行摇瓶培养,结果如图2-a所示。发现进化菌株的生长状况与出发菌株存在明显差异,在添加10 g/LL-山梨糖的培养基中培养时,进化菌株与出发菌株均可良好生长,而当培养基中L-山梨糖含量增加至30 g/L后,出发菌株出现了生长缓慢的现象,生长趋势明显迟于进化菌株,而进化菌株2-F6更优于1-18。结果表明进化得到的高浓度L-山梨糖耐受菌,在添加高浓度L-山梨糖培养基中进行摇瓶培养也具有良好的生长能力,且在不同L-山梨糖培养基中均可较好地生长。
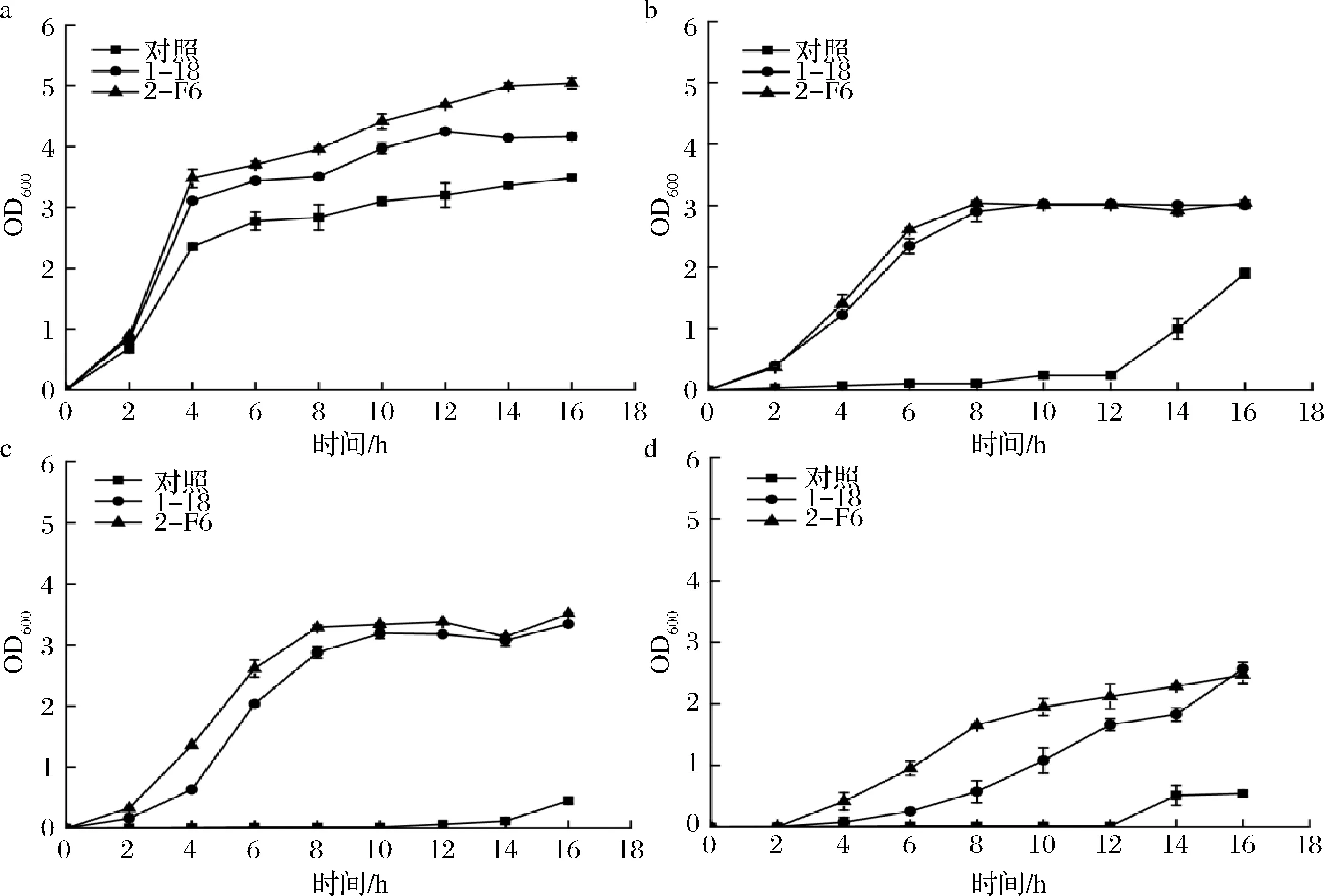
a-添加10 g/L L-山梨糖;b-添加30 g/L L-山梨糖;c-添加100 g/L L-山梨糖;d-添加200 g/L L-山梨糖图2 进化菌株在摇瓶中的生长状况Fig.2 Growth of evolutionary strains in shaking flasks
2.3 进化菌株积累2-KLG的发酵条件优化
前期研究发现,在组成型表达了SDH的大肠杆菌工程菌中继续表达关键酶山梨酮脱氢酶SNDH能提高2-KLG的产量。基于前期构建的双酶表达系统,在进化菌株2-F6中游离表达了SNDH提高菌株利用L-山梨糖生产2-KLG的能力[17]。在摇瓶水平上,比较了不同接种量、发酵温度以及对SNDH诱导时间和IPTG诱导浓度对进行菌株积累2-KLG的影响,结果如图3所示。
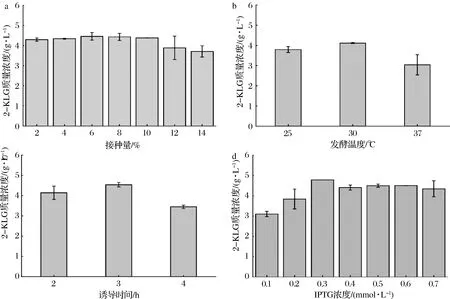
a-接种量的影响;b-发酵温度的影响;c-诱导时间的影响;d-IPTG浓度的影响图3 摇瓶培养条件的优化Fig.3 Optimization of culture conditions in shaking flasks
当接种量在体积分数10%以内时,2-KLG产量没有明显差异,而超过10%后,2-KLG产量有所下降(图3-a)。培养温度为30 ℃最佳,继续升高温度反而不利于2-KLG的积累(图3-b)。培养3 h后诱导更有利于2-KLG的积累(3-c)。诱导剂IPTG的浓度对2-KLG产量的影响结果显示,IPTG浓度为0.3 mmol/L时2-KLG产量最高(图3-d)。
2.4 L-山梨糖添加量对进化菌株积累2-KLG的影响
上述实验表明,经MMC进化后的进化菌株在低浓度的L-山梨糖培养基中的生长明显优于出发菌株,考虑到进化菌株仍无法完全将培养基中添加的L-山梨糖转化生成2-KLG。因此,在摇瓶水平上继续考察添加10、20和30 g/L三个较低浓度L-山梨糖的培养基对共表达SDH/SNDH的进化菌株2-F6积累2-KLG的影响,以表达SDH的进化菌株2-F6为对照,结果如图4所示。
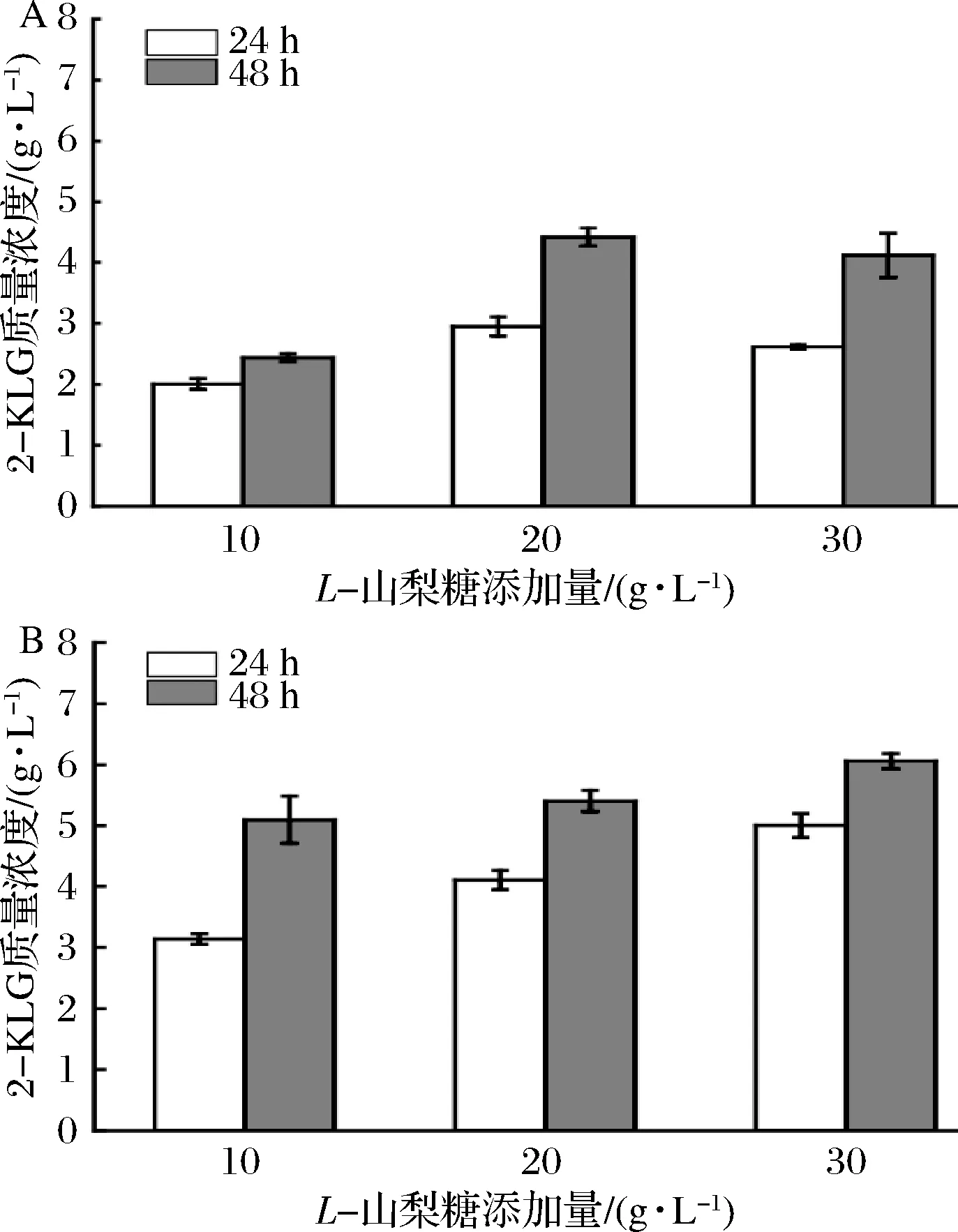
a-只表达SDH的进化菌株2-F6;b-共表达SDH/SNDH的进化菌株图4 不同L-山梨糖浓度对进化菌株积累2-KLG的影响Fig.4 Effects of different L-sorbose concentrations on 2-KLG accumulation in evolutionary strain
共表达SDH/SNDH的进化菌株(图4-b)的发酵性能明显优于表达SDH的进化菌株(图4-a)。共表达SDH/SNDH的进化菌株发酵24 h时,不同L-山梨糖添加量对产物的影响较为明显;当发酵至48 h时,添加10、20和30 g/L三种不同质量浓度的L-山梨糖培养基发酵生产的2-KLG量分别为5.10、5.40和6.05 g/L,含有10 g/LL-山梨糖和20 g/LL-山梨糖的发酵液中2-KLG产量差异不明显,含有30 g/LL-山梨糖的发酵液中2-KLG产量最高。结果表明菌株已具有耐受较高浓度L-山梨糖的能力,不同L-山梨糖浓度对2-KLG产量的影响不显著。
2.5 进化菌株在5 L罐上发酵生产2-KLG
在摇瓶上对重组进化菌株的生长以及2-KLG的产量进行了较全面的优化,得到最佳接种量为体积分数2%,培养3 h后加入终浓度为0.3 mmol/L的IPTG进行诱导,底物L-山梨糖的添加量为30 g/L。为了解重组菌在发酵罐上的生长特性,在5 L发酵罐上参考摇瓶发酵条件上进行一次性发酵培养。发酵过程中菌体的浓度、pH、L-山梨糖消耗及2-KLG产量的变化如图5所示。0~8 h菌体生长较快,8~12 h菌体生长较慢,32~36 h菌体出现二次生长,36 h后达到稳定期。发酵前24 h内底物被快速利用,产物2-KLG快速积累,24 h之后底物缓慢被消耗,底物生成量变化不大,2-KLG的最高产量为5.70 g/L。而过程中pH呈现先增加后降低的趋势,由于2-KLG的积累变慢,pH降低至5~6之间后变化较少。取样检测发现,L-山梨糖初始质量浓度为28.56 g/L,发酵结束后L-山梨糖仍剩余20.91 g/L,已利用部分的底物转化率达74.5%。发酵后期发酵液中仍在大量底物剩余,后期研究可进一步优化提高2-KLG的产量。

图5 5 L罐发酵过程曲线Fig.5 Process curve in 5 L fermenter
3 结论
与维生素C生产相关的研究主要集中在其前体2-KLG,目前,2-KLG主要采用三菌二步发酵法生产。随着新一代发酵工程技术的兴起,三菌二步发酵法存在的菌株选育困难、操作复杂、稳定性差和原材料与能源消耗大等问题缺陷日益显著,建立高效的一菌一步法显得日趋重要。近年来,虽然研究人员已开展大量工作,但一菌一步工程菌生产2-KLG的效率远比经典三菌两步发酵法低,始终未达到工业生产的目标。因此,要实现一菌一步发酵法工业化生产仍面临许多挑战[24]。
本研究基于前期构建的1株组成型表达山梨糖脱氢酶SDH转化L-山梨糖生产2-KLG,但不能耐受高浓度底物L-山梨糖的大肠杆菌工程菌为研究对象,应用全自动高通量微生物液滴培养系统,筛选获得了1株能耐受高浓度L-山梨糖的进化菌株2-F6。在进化菌株中共表达2-KLG合成的另一个关键酶山梨酮脱氢酶SNDH,并在摇瓶水平上对接种量、发酵温度、SNDH诱导表达时间、诱导剂IPTG添加量以及初始山梨糖添加量等条件进行了优化,之后进一步在5 L发酵罐中进行了放大培养。最终,在5 L发酵罐中2-KLG的产量达5.70 g/L,已利用部分的底物转化率达74.5%,发酵液中剩余大量的底物。在后续研究中,我们将采取强化基因表达、提高关键酶活性、敲除或抑制副产物生成途径以及发酵过程优化等策略进一步提高2-KLG的产量和底物L-山梨糖的实际转化率。
