猪捷申病毒的分离鉴定及其VP1基因的序列分析
2017-04-20郭容利温立斌范宝超何孔旺
郭容利 , 李 彬 , 温立斌 , 范宝超 , 何孔旺
(江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室国家兽用生物制品工程技术研究中心 , 江苏南京210014)
猪捷申病毒的分离鉴定及其VP1基因的序列分析
郭容利 , 李 彬 , 温立斌 , 范宝超 , 何孔旺
(江苏省农业科学院兽医研究所农业部兽用生物制品工程技术重点实验室国家兽用生物制品工程技术研究中心 , 江苏南京210014)
应用 PK 细胞,从临床症状上表现为腹泻的仔猪肠内容物中分离到一株病毒,对该病毒进行RT-PCR检测,证明该病毒为猪捷申病毒(PTV),命名为PTVJS2013。对该病毒进行细胞半数感染量(TCID50)测定,动物试验以及VP1蛋白基因序列测定,并与国内外16株不同血清型PTV的VP1基因序列进行了同源性比较及系统进化树分析。 结果表明,猪捷申病毒JS2013 VP1基因核苷酸与8型血清型PTV 同源性达到 99.6%。而与其他血清型的 PTV VP1基因核苷酸的同源性仅在 58.3%~74.7%之间;与国内分离的PTV-Jilin/2003/2(JN710381/PTV-8)和PTV-Fuyu/2009(HQ020378/ PTV-8)亲缘关系最近,同属于 PTV-8血清型一个分支。
猪捷申病毒; 分离与鉴定; VP1基因; 序列分析
猪捷申病毒Porcineteschovirus(PTV)属于小核糖核酸病毒科,猪捷申病毒属,目前至少有11个血清型,不同血清型毒株,可引起繁殖障碍、肺炎、心肌炎和心包炎、腹泻和脑脊髓炎等多种症状[1]。1929年,猪捷申病首次暴发在原捷克斯洛伐克的捷申城,发病猪主要表现为非化脓性脑脊髓炎,此次疫情造成猪群死亡率高达90%,经济遭受严重损失,随后蔓延到欧洲,在北美、澳大利亚、非洲等各地相继出现。亚洲国家中日本对此病的报道相对较多[2]。在我国,早在2003年,哈尔滨兽医研究所在我国内蒙古自治区首次分离到了猪捷申病毒swine/CH/IMH/03株[3],近年来,关于PTV 流行病学调查报告显示,在我国及周围国家与地区大部分猪场均有感染,如韩国、泰国、台湾等,给养猪业带来巨大的损失。
PTV基因组为单股正链RNA ,长约7.2 kb,仅含有1个完整的开放阅读框(ORF);ORF编码1个多聚蛋白,该产物可被蛋白水解酶裂解为结构蛋白L、VP1、VP2、VP3、VP4 和非结构蛋白2A、2B、2C、3A、3B、3C、3D[4]。VP1是 PTV 的主要结构蛋白之一,在 VP1 蛋白基因组的区域中的设计的引物适用于血清型的评估,而且被广泛的应用[5],Cano等[6]指出,对PTV VP1蛋白基因组序列的比较分析有可能是鉴别不同毒株血清型的一个方法。
本试验应用 PK 细胞,从临床上表现为腹泻症状的仔猪肠内容物中分离获得一株PTV,对该病毒进行空斑纯化,TCID50测定与动物试验,并设计引物对其VP1蛋白基因序列进行了扩增、克隆及序列分析, 以期为该病毒在致病、检测及分子生物学等方面的研究提供参考。
1 材料与方法
1.1 细胞及试剂 猪肾细胞(PK),购自ATCC;TRIZol LS Reagent 为美国Invitrogen 公司产品;HSTMMix, 购自东盛公司;DNA Marker DL-2 000,购自 TaKaRa 公司;Agarose Gel DNA Purification Kit,购自 Axygen 公司。
1.2 病毒分离
1.2.1 腹泻病料的处理 疑似病料来自上海淇淋某猪场,取临床症状表现为腹泻的仔猪肠内容物,1∶5加入PBS,用研钵研碎,冻融3次,12 000 r/min离心10 min,取上清液, 过滤除菌,滤液置-80 ℃保存备用。
1.2.2 病毒的分离与病毒细胞半数感染量(TCID50)的测定 长满单层的PK细胞,用Hank′s液清洗2遍,接种上述过滤除菌的病毒液,置37 ℃,5%CO2w温箱吸附1 h后加入细胞维持液(DMEM 2%FBS GIBCO),每日观察,3~5 d后收获细胞病毒混合液,冻融3次,再盲传多代,观察细胞病变。利用病毒蚀斑技术单层法,将病毒进行3次挑斑,最后得到单纯的病毒。病毒在PK细胞连续传代后对其进行病毒细胞半数感染量(TCID50)的测定。
1.3 RT-PCR扩增鉴定
1.3.1 引物的设计与合成 引物设计参照GenBank上登录的PTV F65毒株(AJ011380)基因序列,利用Primer软件设计一对引物:上游引物VP1F; 5′-CTAAAGGGACCCTCCAACAT-3′,下游引物VP1R:5′-CTCATCATAGGCTTCACAAA-3′,引物由上海英骏生物技术有限公司合成。
1.3.2 疑似病料上清液以及分离毒10代病毒RNA的提取与RT反应 参考文献[7]。
1.3.3 PTV VP1基因的扩增与测序 PCR反应:在25 μL反应体系中,2×HSTMMix12.5 μL,引物对1μL/1μL(20 pmol.μL-1),cDNA 2 μL,加无RNA酶的ddH2O至终体积为25 μL。反应条件:95 ℃预变性5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min ;38个循环;72 ℃延伸7 min。PCR产物电泳,胶回收送至上海英骏生物技术有限公司进行测序。
1.4 分离株VP1基因核苷酸序列比较及系统进化分析 分离株PTV VP1基因的全基因序列,结合GenBank中有代表性的16个PTV参考毒株的VP1基因的全基因序列,应用DNAStar分析软件CLUSTALW方法进行序列比对并绘制了VP1基因序列系统进化树,分析各个病毒间亲缘关系和VP1的基因序列的同源性。
1.5 动物试验 取未吃初乳初生仔猪4头,随机分为2组隔离饲养,分离株PTV第10代口服接种2头,接种剂量为2 mL(106.5TCID50/mL)。对照组仔猪2头,口服接种无血清的DMEM 2 mL,观察病毒对仔猪的致病性。
2 结果
2.1 病毒分离以及TCID50的测定 病毒液在接种PK细胞5 d后开始出现不典型病变,只是表现细胞堆积,收获细胞病毒液,接种二代,3 d就出现病变,细胞变圆脱落,病毒继续传代培养,随着代次的增加,细胞病变24 h就达到95%,细胞病变呈圆形,类似葡萄串样聚集在一起,然后脱落(图1)。病毒进行3次挑斑,最后得到单纯的病毒,命名为PTVJS2013,目前传代至10代,20代的TCID50分别为106.5/mL、107.0/mL。

图1 分离株接种PK细胞24 h后细胞病变 (40×)
A:感染病毒的PK细胞; B:对照 PK 细胞
2.2 RT-PCR鉴定 PTVJS2013部分基因片段(包含完整的VPI基因片段)RT-PCR产物在1%琼脂糖上电泳后在紫外灯下观察,可以见到清晰的特异性条带,在957 bp,与预期大小一致(图2)。

图2 PTV分离株VP1基因片段RT-PCR电泳图
1:疑似病料; 2:分离株10代; 3:阴性对照; 4:DNA Marker DL-2 000
2.3 VP1基因系统进化树分析 RT-PCR产物胶回收后测序结果显示,测序的产物核苷酸为957 bp,包含全长VP1基因756 bp。PTVJS2013 VP1基因系统进化分析结果(图3)表明,本实验室分离的PTVJS2013株属于PTV-8血清型 。与Jilin/2003/2(JN710381.1)、Fuyu/2009(HQ02037)两个毒株遗传关系最近,其VP1核苷酸的同源性达到99.6%,与国内PTV-8型分离株VP1核苷酸的同源性达到96.5%~99.6%,而与德国的PTV-8(AF296118.1)VP1核苷酸的同源性只有87.8%,PTV-8型毒株与其他血清型的毒株分属于不同的分支,PTV JS2013株与其他血清型的毒株之间亲缘关系较远,核苷酸的同源性只有58.3%~74.7% 之间。PTV JS2013株与国内Jilin/2003/2(JN710381.1)、Fuyu/2009(HQ02037)、 HB/2010 (JQ664746.1)、Jilin/2003/1(GQ293092)及德国的1个毒株(AF296118.1),这6个毒株同属PTV-8型于一个分支。而与其他血清型的PTV毒株的亲缘关系相对较远。
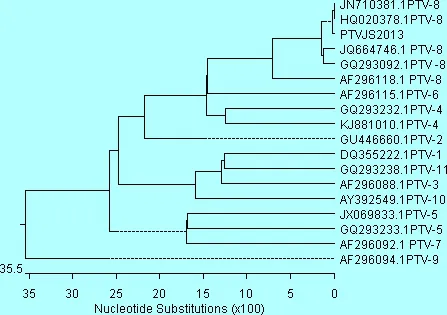
图3 PTVJS2013株VP1基因系统进化树
2.4 动物试验 攻毒组仔猪24 h后开始腹泻,排黄色水样稀便,没有观察到明显的神经症状,44 h后攻毒组1头仔猪死亡,另外1头在52 h死亡;剖检见肠道病变明显,结肠肠壁变薄,肠道和肠系膜出血严重,肠腔内充满黄色腥臭水样液体。肠内容物RT-PCR检测PTV呈阳性。对照组仔猪生长正常,肠内容物检测为阴性。
3 讨论
本实验室在进行PEDV,TGEV流行病学调查时检测到TGEV与PTV的混合感染,应用PK细胞,从临床上表现为腹泻症状的仔猪肠内容物中分离获得1株PTV ,通过挑斑纯化,继续传代,病毒滴度达到107/0.1 mL,对未吃初乳的仔猪具有很强的致病性,临床症状主要表现为腹泻,与 PEDV,TGEV对仔猪的致病时临床症状表现一样;剖检时肠的病理变化极为相似,从肉眼上观察,很难区分是哪种病毒的感染,因此,需借助实验室诊断来确定病原。近些年来,对PEDV,TGEV的报道相对较多[7],也有PTV与TGEV混合感染的报道[8],而PTV在引起腹泻病例中起什么样的作用,关注甚少。王瑶[9]、Chaofan Zhan[10]等利用不同的方法对不同地区的猪捷申病进行了流行病学调查,其阳性率分别达到 60.17%,79.12% ,说明PTV感染在我国已非常普遍,严重威胁我国养猪业,应引起高度重视。
Cano[6]指出,对PTV VP1蛋白基因组序列的比较分析有可能是鉴别不同毒株血清型的一个方法。PTV共分为11个血清型,近年又有新的血清型PTV -12出现的报道[11]。本试验对PTVJS2013 VP1基因系统进化分析结果显示,分离株PTVJS2013株与Jilin/2003/2(JN710381.1)、Fuyu/2009(HQ02037)两个毒株遗传关系最近,其VP1核苷酸的同源性达到99.6% ,与国内另外的两个HB/2010 (JQ664746.1)、Jilin/2003/1(GQ293092)及 德国的1个毒株(AF296118.1),这6个毒株的同属于PTV-8型一个分支,证明本实验室分离的PTV JS2013株属于PTV-8血清型。PTV-8型毒株与其他血清型的毒株分属于不同的分支,PTV JS2013株与其他血清型的毒株之间亲缘关系较远,核苷酸的同源性只有58.3%~74.7%之间。说明PTV不同血清型毒株 VP1基因组差异性显著。
不同的毒株在感染猪群后产生的临床症状也不同,Fuyu/2009(HQ02037)与PTV JS2013 VP1核苷酸同源性为99.6%,而对猪群的致病性大有不同,PTV JS2013表现对仔猪的急性腹泻,而PTV-Fuyu/2009(HQ02037)则变为繁殖障碍、死胎、流产等症状[12];swine/CH/IMH/0(PTV-1)3接种未吃初乳的仔猪表现为腹泻和神经症状[13],因此,PTV不同血清型,以及相同血清型不同的毒株感染猪群后临床表现的多样性给此病的防控带来更大的挑战。
[1] 中国农业科学院哈尔滨兽医研究所.动物传染病学[M],北京:中国农业出版社,2008:279-281.
[2] M Yamada, R Kozakura, K Nakamura,etal. Pathological Changes in Pigs Experimentally Infected with Porcine Teschovirus [J]. J Comp Path, 2009, Vol. 141: 223e228.
[3] Feng L, Shi H Y,Liu S W,etal. Isolation and molecular characterization of a porcine teschovirus 1 isolate from Chine[J].Acta Virol ,2007,51(1):7-11.
[4] Roland Z,Simone S,Andrea S H,etal. Link-age map of protein interactions of porcine teschovirus [J],J Gen Virol,2005,86:2763-2768.
[5] La Rosa G, Muscillo M, Di Grazia A,etal.Validation of RT-PCR Assays for Molecular Characterization of Porcine Teschoviruses and Enteroviruses [J].J Vet Med B Infect Dis Vet Public Health, 2006, Aug;53(6):257-265.
[6] Cnao C G, Palero F, Buitrgo M D,etal. Aanlyzing the genetic,diversity of Teschoviruses in spinsh pig population using complete VP1sequences[J]. Infect Genet Evol,2011,11(8):2144-2158.
[7] 郭容利,何孔旺,倪艳秀,等.PEDV、TGEV、PARV多重RT-PCR方法的建立及其应用 [J],江苏农业学报,2013,29(5):1065-1069.[8] Wang L, Ge C, Wang D,etal.The survey of porcine teschoviruses, porcine circovirus and porcine transmissible gastroenteritis virus infecting piglets in clinical specimens in China [J]. Trop Anim Health Prod,2013, Jun;45(5):1087-1091.
[9] 王瑶,田志军,王斌,等.株猪捷申病毒的分离鉴定及血清学初步调查[J].黑龙江畜牧兽医,2011,2:14-17.
[10] Chaofan Zhang, Zhongtian Wang, Feng Hu,etal. The survey of porcine teschoviruses in field samples in China with a universal rapid probe real-time RT-PCR assay [J] .Trop Anim Health Prod,2013,45:1057-1061.
[11] Cano-Gómez M A. Jiménez-Clavero.Complete Coding Genome Sequence of a Putative Novel Teschovirus Serotype 12 Strain [J].Genome Announc,2016, Mar 10;4(2):107-116.
[12] Lin W, Cui S, Zell R .Phylogeny and evolution of porcine teschovirus 8 isolated from pigs in China with reproductive failure[J]. Arch Virol, 2012, Jul;157(7):1387-1391.
[13] 冯力,胡守萍,时洪艳,等.猪捷申病毒Swine/CH/lMH/O3分离株细胞适应性和致病性研究[J].中国预防兽医学报.2012,34(7):530-533.
2016-06-01
江苏省农业科技自主创新资金[CX(15)1056]
郭容利(1974-),女,副研究员,硕士,主要从事动物疫病防控研究,E-mail:guorl1974@163.com
何孔旺,E-mail:kwh2003@263.com
S852.659.6
A
0529-6005(2017)03-0043-04
