吡硫醇在低氧与常氧环境下大鼠体内的药代动力学研究
2017-04-19杨一帆徐唯哲徐平湘
杨一帆 秦 一 徐唯哲 徐平湘 薛 明*
(1.首都医科大学基础医学院药理学系,北京 100069;2.首都医科大学附属北京佑安医院国家药物临床试验机构,北京 100069;3.首都医科大学附属北京儿童医院药学部,北京 100045;4.中国民用航空局民用航空医学中心(民航总医院),北京 100123;5.首都医科大学生物医学检测技术与仪器北京实验室,北京 100069)
·基础研究 ·
吡硫醇在低氧与常氧环境下大鼠体内的药代动力学研究
杨一帆1,2秦 一3徐唯哲4徐平湘1,5薛 明1,5*
(1.首都医科大学基础医学院药理学系,北京 100069;2.首都医科大学附属北京佑安医院国家药物临床试验机构,北京 100069;3.首都医科大学附属北京儿童医院药学部,北京 100045;4.中国民用航空局民用航空医学中心(民航总医院),北京 100123;5.首都医科大学生物医学检测技术与仪器北京实验室,北京 100069)
目的 研究比较吡硫醇在低氧和常氧状态大鼠体内的药代动力学特征。方法 将SD大鼠采用数字表法随机分为低氧组与常氧组,低氧动物预处理后进行吡硫醇单次灌胃给药的药代动力学研究。采用本课题组建立的快速灵敏的超高效液相质谱联用测定不同时间的血药浓度,用DAS2.0软件计算药动学参数,并用SPSS13.0软件进行统计学分析。结果 吡硫醇在常氧和低氧大鼠体内的主要药动学参数分别为:AUC(0-t)(88.26±9.86)ng·h·mL-1和(80.67±8.95)ng·h·mL-1;MRT(0-t)(4.14±0.32)h和(3.67±0.26)h;t1/2(3.72±1.82)h和(3.14±1.42)h;tmax(0.58±0.20)h和(0.67±0.26)h;Cmax(30.12±2.36)ng/mL和(20.05±1.31)ng/mL。与常氧状态大鼠的药动学参数相比,低氧状态下吡硫醇在大鼠体内的Cmax和MRT(0-t)有显著性降低,而其他主要药动学参数差异均无统计学意义。结论 低氧影响药物在大鼠体内达峰浓度,进而可影响药物的稳态血药浓度、治疗效果和毒性反应。
吡硫醇;药代动力学;低氧;常氧;超高效液相色谱-质谱联用法
低氧不仅影响机体细胞的生命活动、自身平衡和内外环境的稳定,也影响着相关疾病的发生和发展[1]。低氧可以导致组织器官的代谢功能、甚至形态结构发生异常变化,这些变化均可能影响药物在体内的转运和转化等药代动力学过程,进而影响药物的治疗效果和不良反应[2-3]。高原低氧环境的影响和急进高原人群的快速增加,致使机体的适应性对药物的影响等研究引起了广泛关注[4-5]。随着精准医学的深入发展和低氧环境用药的临床需要,抗低氧药物的药代动力学亟待深入研究,以满足不同病人的临床个体化治疗要求。
吡硫醇(Pyritinol)又称脑复新,是脑代谢改善和促智药,临床用于脑震荡综合征以及脑外伤、脑炎及脑膜炎后遗症等引起的头痛、头晕、失眠、记忆力减退、注意力不集中、情绪变化等症状的改善,亦可用于脑动脉硬化症和老年性痴呆等[6]。吡硫醇可促进脑内葡萄糖及氨基酸的代谢,改善机体同化作用,并可增加颈动脉血流量,改善脑血流量。进一步研究[7]表明,吡硫醇可降低糖尿病大鼠的伤害感受和氧化应激反应。与长春西丁联合用药可降低血液黏稠度[8]。吡硫醇耐酸、不受胃酸破坏,胃肠道吸收好,血药浓度稳定。已知吡硫醇的药理作用与其药代动力学密切相关,然而,目前缺乏更加灵敏的吡硫醇血药浓度测定方法,因此,本课题组应用超高效液相色谱串联质谱(ultra-performance liquid chromatography-mass spectrometry,UPLC-MS/MS)建立了吡硫醇的灵敏快速的体内测定方法,研究比较了低氧和常氧状态下大鼠体内药代动力学特征,结果为吡硫醇的低氧临床用药提供了坚实的实验依据。
1 材料与方法
1.1 实验动物
健康Sprague-Dawley (SD) 大鼠,雄性,体质量220~260 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK (京) 2012-0001。
1.2 实验仪器
超高效液相色谱与串联三重四级杆质谱备用(ACQUITY UPLCTQD,美国Waters公司);ACQUITY BEH C18色谱柱(2.1×50 mm, 1.7 μm,美国Waters公司),高速离心机(美国eppendorf公司);2D5-2A型低速离心机(北京医用离心机厂);万分之一电子天平(北京赛多利斯科学仪器有限公司);旋涡混合器(海门市其林贝尔仪器制造有限公司);Milli-Q超纯水机(德国默克公司);超低温冰箱(日本三泽公司)。
1.3 药品与试剂
吡硫醇(批号:068F03031V,图1)和甘草素(批号:XH-13050901,图1)标准品均购自中国食品药品检定研究院,纯度≥98%;乙腈(色谱纯,美国Thermo Fisher公司);甲醇(色谱纯,美国Thermo Fisher公司);水为超纯水;甲酸(色谱纯,北京Dikma公司);实验所用其他试剂纯度均为色谱纯。

图1 吡硫醇和内标甘草素的化学结构
1.4 色谱与质谱条件
采用超高效液相色谱和三重四级杆质谱串联,MassLynxV4.1工作站。选用C18色谱柱。流动相∶乙腈-水[0.1 %(体积分数)甲酸]=2∶98,流速:0.3 mL/min;柱温:40 ℃;进样量:5 μL。电喷雾离子化离子源(electron spray ionization, ESI)选用正离子检测模式;离子源温度110 ℃;去溶剂温度400 ℃;毛细管电压为600 V。扫描方式为多重反应监测模式(multiple reaction monitoring, MRM),定量分析的离子(m/z)分别为369→153(吡硫醇,26 V)和255→135(内标甘草素,15 V)。
1.5 标准溶液配制
分别精密称取吡硫醇5 mg于5 mL容量瓶中,用甲醇溶解并(体积分数)少量0.1%甲酸溶解之后用甲醇定容,分别配制成的吡硫醇(1 mg/mL),同法配置内标甘草素储备液(1 mg/mL)。储备液存放在4 ℃冰箱中。用流动相将吡硫醇储备液稀释成不同梯度工作液:1 000、500、250、100、50、25、10、5、2.5、1 ng/mL,同时将内标甘草素储备液稀释成100 ng/mL的工作液。
1.6 血浆样品处理
取1.5 mL离心管,准确吸取大鼠血浆样品100 μL,依次加入内标(甘草素)溶液(100 ng/mL)20 μL,甲醇300 μL,涡旋2 min使其混合混匀。于13 000 r/min高速离心10 min,吸取上清液。使用0.22 μm的滤膜过滤,之后转移到样品瓶中,5 μL上样。
1.7 标准曲线的制备及精密度准确度考察
取大鼠空白血浆0.1mL,依次加入吡硫醇系列标准溶液20 μL,配制成吡硫醇浓度分别为0.2、0.5、1、2、5、10、20、100、200 ng/mL的溶液,加入100 ng/mL的内标溶液20 μL,按照“1.6血浆样品处理”项下操作,按1.4色谱质谱条件测定。
按“1.6血浆样品处理”项下操作分别配成低、中、高3个浓度的质控样品,每个浓度各重复5份,连续测定3批样品,计算样品和内标峰面积的比值,进行日内和日间准确度与精密度考察。
1.8 吡硫醇的药代动力学试验
常氧实验:使用配对比较法随机分组,选择插管大鼠进入常氧实验组,编号后在室温常氧条件下进行预适应。给药前禁食12 h,给予自由饮水。称体质量后根据每只大鼠的体质量按照40 mg/kg的剂量口服灌胃给药。给药前(0 min)及给药后5、10、15、30 min及1、2、4、8、12 h共10个时间点,颈静脉取血约0.4 mL,置于含肝素的EP管中,立即13 000 r/min离心10 min获取血浆,保存于-80 ℃冰箱中。按“1.6血浆样品处理”项下操作处理血浆样品。
低氧实验:使用配对比较法随机分组,取1只大鼠放入低氧箱[9%(体积分数) 氧分压]内,持续低氧72 h并且给药前禁食12 h,自由饮水。根据大鼠体质量按照40 mg/kg的剂量口服灌胃给药。重复上述操作6次。每次分别于给药前(0 min)及给药后5、10、15、30 min及1、2、4、8、12 h颈静脉取血约0.4 mL,置于含肝素的EP管中,立即13 000 r/min离心10 min获取血浆。保存于-80 ℃冰箱中。按“1.6血浆样品处理”项下操作处理血浆样品。
1.9 统计学方法
采用 DAS 2.0 软件处理吡硫醇的经时血药浓度数据,统计距方法计算其药代动力学参数,主要包括药时曲线下面积(area under concentration-time curve,AUC),平均滞留时间(mean retention time, MRT),血浆半衰期(t1/2),达峰浓度(Cmax)和达峰时间(tmax)等。采用SPSS13.0 统计学软件对常氧和底氧条件下的药代动力学参数进行两独立样本均数的t检验,考察主要药动学参数是否存在差异。以P<0.05为差异有统计学意义。
2 结果
2.1 方法学验证
2.1.1 方法的专属性
按照1.4的质谱条件,分别对吡硫醇和甘草素进行质谱扫描,测得吡硫醇(m/z369→153)详见图2。与甘草素(m/z 255→119)的子离子图谱(图3)。大鼠空白血浆、空白血浆加对照品、样品血浆的MRM模式色谱图见图4,吡硫醇和内标甘草素的出峰时间分别为2.2 min和2.6 min。由图可知血浆中内源性物质对吡硫醇与甘草素的测定均不产生干扰。

图2 吡硫醇子离子图谱

图3 甘草素(内标)子离子图谱

图4 大鼠血浆中吡硫醇和甘草素的色谱图
A:blank rat plasma;B:blank rat plasma spiked with Pyritinol (50 ng/mL) and Liquiritigenin (100 ng /mL); C:rat plasma sample obtained 8 h after p.o. administration with a dose of 40 mg/kg of Pyritinol.
2.1.2 标准曲线的制备及定量下限
记录药物和内标的峰面积,以两者之比y为纵坐标对吡硫醇浓度x加权线性回归,得标准曲线方程为y=0.074 4+0.032 8x,r=0.997,在0.2~200 ng/mL范围内线性关系良好,其最低定量下限为0.2 ng/mL。
2.1.3 准确度与精密度
日内相对标准偏差(relative standard deviation RSD)值在2.5%~11.1%,日间RSD值在3.6%~10.4%,符合生物样品分析要求测定要求。结果详见表1。
表1 大鼠血浆中吡硫醇的精密度与准确度

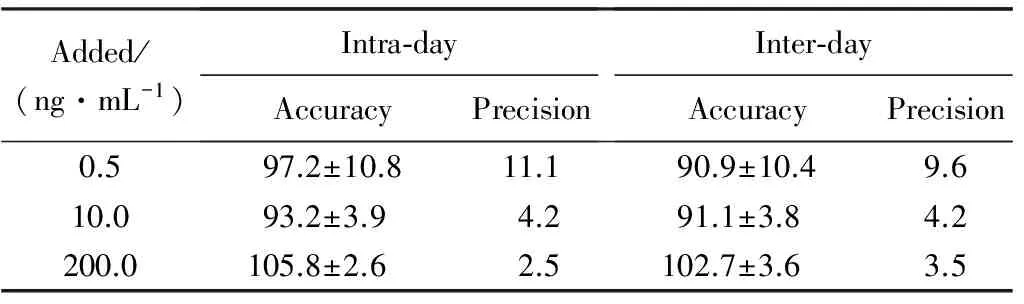
Added/(ng·mL-1)Intra⁃dayAccuracyPrecisionInter⁃dayAccuracyPrecision0.597.2±10.811.190.9±10.49.610.093.2±3.94.291.1±3.84.2200.0105.8±2.62.5102.7±3.63.5
2.1.4 提取回收率
低、中、高3个浓度的质控样品各5份,测定所得吡硫醇的峰面积与空白血浆经样品处理后加入对应浓度的标准溶液的峰面积之比,结果详见表2,提取回收率均符合要求。
表2 大鼠血浆中吡硫醇的提取回收率


Added/(ng·mL-1)RecoveryRSD0.599.2±11.011.110.0100.7±5.45.4200.0104.4±1.71.6
RSD:relative standard deviation
2.1.5 稳定性实验
低、中、高3个浓度的质控样品各5份,分别考察室温放置24 h、反复冻融3次、-80 ℃放置30 d稳定性。结果详见表3,表明吡硫醇在这3种条件下的样品稳定存在。
2.2 吡硫醇在大鼠体内的药代动力学比较
对于正常状态下和低氧状态下的大鼠,分别给药后使用液质联用测定其相应时间点的血浆中的吡硫醇浓度,经过DAS软件拟合,得到常氧条件下与低氧条件下相同剂量组的大鼠对应的药物浓度-时间曲线,与常氧相比,低氧条件下30 min血药浓度明显降低。详见图5。
表3 大鼠血浆中吡硫醇的稳定性


Added/(ng·mL-1)Stability/%24hFreezingandthawing3times-80℃,30d0.594.4±8.485.6±6.886.8±4.210.091.4±2.788.8±4.090.4±2.4200.0103.7±1.298.5±1.599.4±1.7
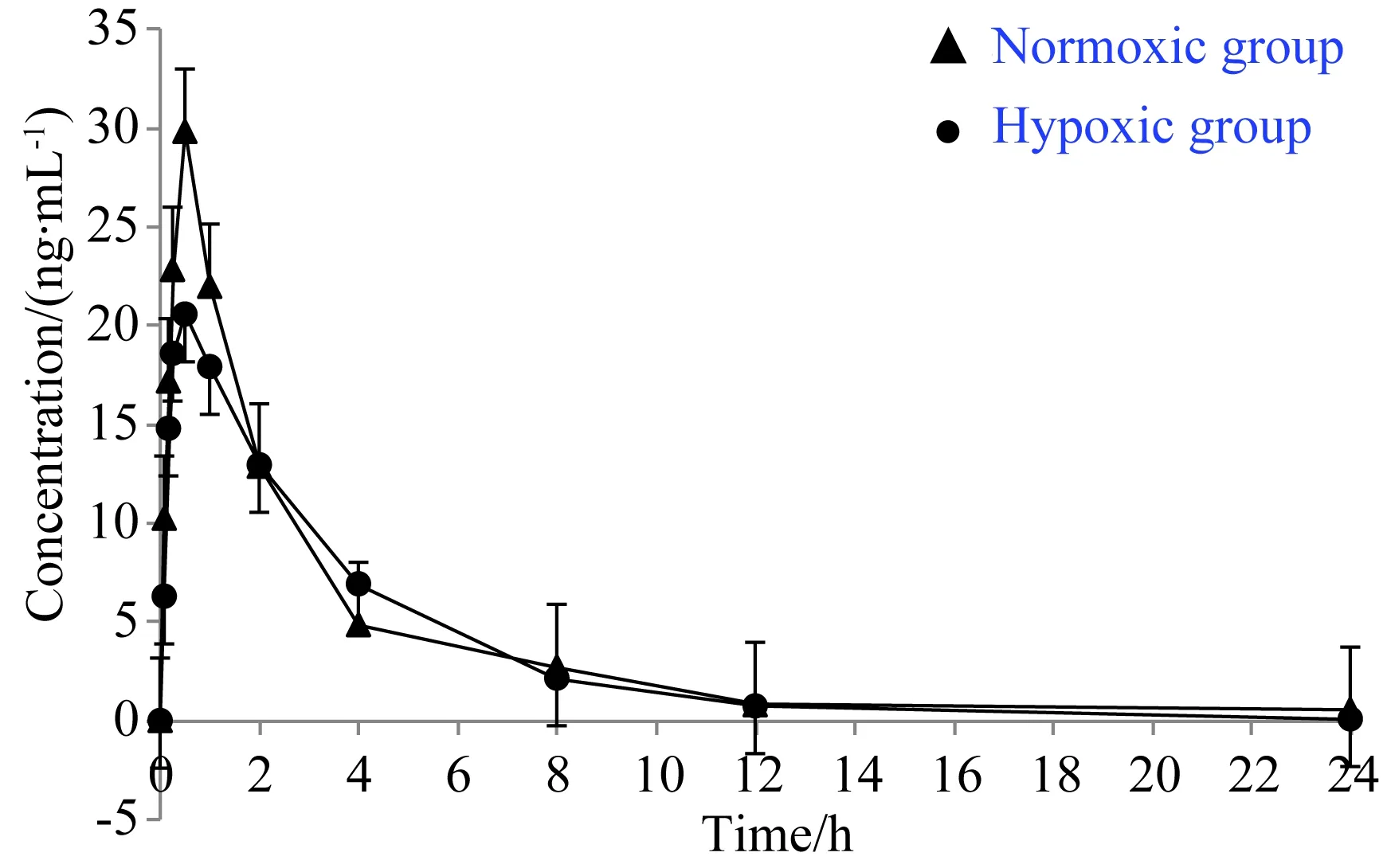
图5 大鼠灌胃给药后吡硫醇(10 mg/kg)在常氧与低氧状态下的血药浓度-时间曲线
使用DAS软件进行数据处理后得到正常条件下与低氧条件下大鼠体内的药代动力学参数,与常氧组相比,低氧组的MRT和Cmax差异有统计学意义(P<0.05),详见表4。

表4 吡硫醇在大鼠体内的主要药动学参数比较
*P<0.05 ,**P<0.01vsnormoxic.
3 讨论
本文参考常用低氧动物模型,采用特制的低氧操作装置,保持9 %(体积分数)氧分压,建立了常压大鼠急性低氧模型。在测定方法方面,以往采用分光光度法[9]或高效薄层色谱-紫外检测,之后使用质谱进一步定性[10]。鉴于临床用药方面,酸碱度对于吡硫醇的稳定性影响很大[11-12],因此建立更加稳定准确的吡硫醇的体内测定方法是进一步确证血药浓度关系的关键。吡硫醇是维生素B6类似物,文献[13-16]报道静脉注射给药后体内代谢迅速,血药浓度较低。因此这些方法在灵敏度方面不能满足科研和临床进一步的需求,采用液质联用方法可以弥补这一点。
从上述实验结果可知,在常氧条件下,吡硫醇在大鼠体内的主要药动学参数为:AUC(0-t)88.257 ng·h·mL-1,MRT(0-t)4.14 h,t1/23.722 h,Cmax(30.12±2.36)ng/mL。表明吡硫醇口服后在大鼠体内的吸收较好,体内存留量适宜。从MRT和t1/2值看出,吡硫醇在体内的消除较慢,在一定时间内可以维持稳定的药物治疗浓度。吡硫醇在低氧条件下的主要药动学参数为:AUC(0-t)80.665 ng·h·mL-1,MRT(0-t)3.67 h,t1/23.138 h,Cmax20.05 ng/mL。表明在低氧环境下,吡硫醇口服后在大鼠体内的体内过程基本类似,显示其吸收较好,体内存留量适宜,体内消除较慢,在一定时间内也可维持稳定的药物治疗浓度。
比较低氧与常氧状态下,吡硫醇的药动学参数发现,低氧时吡硫醇的Cmax和MRT(0-t)明显降低,提示低氧状态下吡硫醇在大鼠体内的吸收和相应的体内平均驻留时间明显下降。而低氧时的其他药动学参数则差异无统计学意义。研究结果表明,低氧降低吡硫醇在大鼠体内的达峰浓度和体内平均驻留时间,进而影响药物的稳态血药浓度和治疗效果和毒性反应,提示在临床缺氧环境使用吡硫醇时,给药剂量需要相应增大。本研究为吡硫醇在低氧环境下的给药方案的调整和优化提供了坚实的实验依据。
[1] Ran R, Xu H, Lu A, et al. Hypoxia preconditioning in thebrain[J]. Dev Neurosci,2005, 27(2-4): 87-92.
[2] 张娟玲, 李向阳. 高原低氧影响药物代谢的研究进展[J]. 药学学报,2015,50(9):1073-1079.
[3] 郑悦,嵇扬. 抗缺氧研究常用动物模型及抗缺氧药物[J]. 解放军药学学报,2010,26(2):170-173.
[4] Zafren K. Prevention of high altitude illness[J]. Travel Med Infec Dis, 2014, 12(1):29-39.
[5] Johnson N J, Luks A M. High-Altitude Medicine[J]. Med Clin North Am,2016,100(2):357-369.
[6] 张健. 盐酸吡硫醇的药理作用与临床应用[J]. 中国热带医学,2005,5(2):394-395.
[7] Jiménez-Andrade G Y,Reyes-García R G,Sereno G,et al. Pyritinol reduces nociception and oxidative stress in diabetic rats[J]. Eur J Pharmacol,2008,590(1-3):170-176.
[8] Alkuraishy H M, Al-Gareeb Al,Albuhadilly A K. Vinpocetine and Pyritinol:a new model for blood rheological modulation in cerebrovascular disorders-a randomized controlled clinical study[J]. Bio Med Res Int,2014,2014: 324307.
[9] 过治军,石灵,冯素玲,等. 邻菲啰啉-Fe(Ⅱ)光度法间接测定盐酸吡硫醇[J]. 分析试验室,2011,30(12):5-7.
[10]Aranda M, Morlock G E. Quantification of Pyritinol in solid pharmaceutical formulation by high-performance thin-layer chromatography-ultraviolet detection and selectivity evaluation by mass spectrometry[J]. J Chromatogr B, 2010,33(7-8):957-971.
[11]孟繁娜,唐星. pH值对盐酸吡硫醇水溶液稳定性的影响[J]. 中国医院药学杂志,2007,27(3):400-403.
[12]何静思,薛大权. 盐酸吡硫醇与硫酸镁在几种输液中的稳定性研究[J]. 数理医药学杂志,2010,23(3):355-357.
[13]秦春雨,周滔,宫雯雯,等. UPLC-MS/MS法测定大鼠血浆中雷公藤内酯醇及其药代动力学[J]. 首都医科大学学报,2015,36(1):121-126.
[14]李鹏飞,王淑民,张茜,等. LC-MS/MS法测定人血浆中氨基葡萄糖的浓度[J]. 首都医科大学学报,2013,34(5):715-719.
[15]李金卓,潘磊,冯佳,等. 盐酸吡硫醇脂质体在大鼠体内药动学研究[J]. 现代药物与临床,2013,28(5):700-703.
[16]徐唯哲,赵妍,秦一,等.低氧与常氧状态下芍药苷在大鼠体内的药代动力学比较[J].国际药学杂志,2016,43(2):336-340.
编辑 孙超渊
Pharmacokinetic comparison of Pyritinol in rats under normoxic and hypoxic condition
Yang Yifan1,2,Qin Yi3,Xu Weizhe4, Xu Pingxiang1,5, Xue Ming1,5*
(1.DepartmentofPharmacology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China;2.NationalDrugChinicalTrialInstitution,BeijingYouanHospital,CapitalMedicalUniversity,Beijing100069,China;3.DepartmentofPharmacy,BeijingChilderen’sHospital,CapitalMedicaluniversity,Beijing100045,China; 4.CivilAviationMedicineCenter,CivilAviationAdministrationofChina(CivilAviationHospital),Beijing100123,China;5.BeijingLaboratoryforBiomedicalDetectionTechnologyandInstrument,CapitalMedicalUniversity,Beijing100069,China)
Objective To determine and compare the pharmacokinetic parameters of Pyritinol in rat plasma under normoxic and hypoxic conditions. Methods An effective and rapid ultra-performance liquid chromatography with tandem mass spectrometry (UPLC-MS/MS) method with positive electrospray ionization source was successfully developed and validated for quantification of Pyritinol in rat plasma. Sprague-Dawley rats were randomly divided into the hypoxia and normoxic groups. Each rat obtained a single dose of Pyritinol through intragastric administration. The plasma samples were drawn through jugular veins to measure the drug concentrations at different times. The pharmacokinetics parameters were processed via the DAS 2.0 software, and the comparison of main pharmacokinetic parameters in rats between normoxic and hypoxic groups was calculated by the SPSS software via an independent sample t test method. Results The main pharmacokinetic parameters of Pyritinol between the hypoxia and the normoxic rats were as follows: the AUC(0-t)(88.26±9.86) ng·h·mL-1and (80.67±8.95)ng·h·mL-1, MRT(0-t)(4.14±0.32)h and (3.67±0.26)h, t1/2(3.72±1.82) h and (3.14±1.42)h, tmax(0.58±0.20)h and (0.67±0.26)h, Cmax(30.12±2.36)ng/mL and (20.05±1.31)ng/mL, respectively. The values of Cmaxand MRT(o-t) for Pyritinol in hypoxic rats were statistically lower than that in normoxic rats, and other main pharmacokinetic parameters did not have significant differences. Conclusion Hypoxia affects drug peak concentration in rats, and furthermore affects the steady-state blood concentrations of drugs, which could interfere the therapeutic effect and toxic reaction.
Pyritinol; pharmacokinetics; hypoxia; normoxia; UPLC-MS/MS
国家自然科学基金(81173121, 81573683)。This study was supported by National Natural Science Foundation of China (81173121, 81573683)
时间:2017-04-13 19∶55
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1955.032.html
10.3969/j.issn.1006-7795.2017.02.016]
R96
2016-09-09)
*Corresponding author, E-mail:xuem@ccmu.edu.cn
