深部脑磁刺激对帕金森病模型大鼠运动症状治疗的安全性评价
2017-04-19刘俊华王颜颜王晓民
刘俊华 王 勇 王颜颜 王晓民*
(1.首都医科大学基础医学院神经生物学系,北京 100069;2.教育部神经变性病重点实验室,北京 100069;3.北京脑重大疾病研究院,北京 100069;4.首都医科大学基础医学院生理学与病理生理学系,北京 100069)
·基础研究 ·
深部脑磁刺激对帕金森病模型大鼠运动症状治疗的安全性评价
刘俊华1,2,3王 勇2,3,4王颜颜1,2,3王晓民1,2,3*
(1.首都医科大学基础医学院神经生物学系,北京 100069;2.教育部神经变性病重点实验室,北京 100069;3.北京脑重大疾病研究院,北京 100069;4.首都医科大学基础医学院生理学与病理生理学系,北京 100069)
目的 评估深部脑磁刺激(deep-brain magnetic stimulation,DMS)对单侧帕金森病(Parkinson’s disease,PD)模型大鼠运动障碍的治疗作用及DMS治疗的安全性。方法 立体定位注射六羟基多巴胺(6-hydroxydopamine,6-OHDA)于大鼠右侧纹状体制备单侧帕金森病模型,假手术对照组(Sham组)依据同样方法注射0.9%(质量分数)氯化钠注射液。利用阿扑吗啡筛选模型后,造模成功的动物采用均衡随机化分组的方式分为模型对照组(Model组)、δ节律DMS治疗组(DMS-δ组)、γ节律DMS治疗组(DMS-γ组),其中两种DMS治疗组行每天40 min、持续4周的DMS治疗。通过碰壁实验检测大鼠运动行为,通过大鼠体质量的测定、外周血淋巴细胞的分类及计数、主要组织器官的苏木精-伊红(Hematoxylin-Eosin staining,HE)染色评价DMS治疗的安全性。结果 ①检测大鼠运动行为显示,DMS-γ治疗组损伤侧的肢体利用率显著高于Model组,差异具有统计学意义(P<0.05),而DMS-δ组相较于Model组差异无统计学意义(P>0.05)。②Sham组、Model组、DMS-δ组、DMS-γ组大鼠体质量差异均无统计学意义(P>0.05)。③Sham组、Model组、DMS-δ组、DMS-γ组大鼠外周血总淋巴细胞与T细胞的数量和比例差异均无统计学意义(P>0.05)。DMS-δ组大鼠的自然杀伤(natural killer,NK)细胞数量和比例相较于Model组有显著改善。④HE染色显示,DMS对大鼠主要器官包括心、肝、脾、肺、肾、胃、小肠、睾丸均未造成明显的组织病理变化。结论 DMS-γ治疗可改善PD大鼠双侧肢体不对称性运动障碍,且DMS对PD大鼠运动行为的治疗中无明显不良反应,表明DMS在对PD大鼠运动症状的治疗中具有很好的安全性。
帕金森病;深部脑磁刺激;运动行为学;不良反应;安全性
帕金森病(Parkinson’s disease, PD)是多发生于中老年期的中枢神经系统退行性疾病。PD的主要病理改变为中脑黑质致密部多巴胺(dopamine, DA)能神经元变性丢失,造成纹状体多巴胺的量下降,引起包括静止性震颤、肌肉僵直、步态不稳与运动迟缓等一系列运动症状;同时伴随路易体的传播和聚集,引起广泛脑区病变[1-2]。目前PD的治疗手段主要包括药物治疗和手术治疗。左旋多巴(levo-dopamine, L-DOPA)类药物是治疗PD的标准用药,但长期使用L-DOPA带来严重的不良反应[3]。深部脑刺激(deep brain stimulation, DBS)作为中晚期PD的有效治疗手段,但仍会伴随运动障碍的产生且需要患者承担昂贵的医疗费用和手术风险,且有效期只能维持数年[4-5]。所以发展新的治疗手段显得十分必要。
近年来,作为一种非药物、非侵入性的治疗手段,重复经颅磁刺激(repetitive transcranial magnetic stimulation, rTMS)已经应用于阿尔兹海默病、抑郁症等神经精神类疾病的治疗[6-7]。但传统rTMS的局限性在于,其主要作用于皮质,而很多神经精神类疾病的病灶位于深部脑区,这就制约了rTMS应用范围的拓展[8];rTMS设备昂贵,一般只能在专业医疗机构才能使用,这也进一步限制了rTMS的普及;另外rTMS的有效刺激频率一般为0.5~10 Hz,且一般不会超过30 Hz,强度都在特斯拉(T)级别,有研究[9-10]报告显示rTMS具有诱发头痛、癫痫发作和不自主运动等的不良反应。由此看来,发展能作用于深脑、小型化且低强度的磁刺激术是更为理想的趋势。深部脑磁刺激(deep-brain magnetic stimulation, DMS)是一种新型的经颅磁刺激治疗脑功能障碍的技术,平行双线圈中间提供强度均等的磁场,可经颅无损地作用于深部脑区[8]。其采用高斯(Gs)级别(10 000 Gs= 1 T)的低强度、高频(1 000 Hz)刺激;并通过对低强度高频单波的串列组合,输出不同节律的有效刺激串。在神经精神类疾病的治疗方面,目前已有报道DMS可促进成年小鼠海马神经元再生和成熟,改善抑郁症状和与应激相关的反应[11]。所以对于病灶位于深部脑区的PD病人来说,DMS能否发挥疗效及其治疗的安全性十分值得研究。
本研究中的DMS治疗仪通过高频低强度单波组合输出的方式,可提供可变节律的刺激参数,这里笔者用到δ节律和γ节律两种不同刺激方式,以期研究DMS对PD病人运动症状的疗效特别是DMS治疗的安全性。
1 材料与方法
1.1 实验动物及模型制备
健康SPF级雄性SD大鼠,体质量200g,购自北京维通利华实验大鼠中心[实验动物许可证号:SYXK(京)2014-0018]。首都医科大学实验动物部饲养,12 h/12 h昼夜亮暗循环,自由进水进食。对实验动物的所有实验方案通过首都医科大学伦理审查委员会批准。本实验应用立体定位注射六羟基多巴胺(6-hydroxydopamine,6-OHDA)于大鼠右侧纹状体制备单侧帕金森病动物模型[12]。术前适应1周并剔除异常旋转大鼠。腹腔注射戊巴比妥钠(40 mg/kg)深度麻醉,头部去毛,碘伏消毒,固定于立体定位仪(美国Kopf公司)。切开大鼠颅顶正中线皮肤,剥离骨膜暴露前后囟,调平。依Paxinos & Watson 图谱确定右纹状体两个注射位点,即前囟前0.8 mm、旁开2.7 mm、硬脑膜下5.2 mm/4.5 mm。按坐标位点钻开颅骨,缓慢下行微量进样针(上海高鸽,10 μL)以0.5 μL/min的速度向每个位点注射10 μg 6-OHDA(5 μg/μL, 美国Sigma公司, H116),每点停针5 min后缓慢退针,缝合头皮,碘伏消毒,放于电热毯上,待动物苏醒后安置于原笼位。Sham组运用相同方法注射0.9%(质量分数)氯化钠注射液。
1.2 动物分组及处理
手术10 d后,以阿扑吗啡诱发旋转实验进行模型筛选[13]。首先将大鼠固定在束缚套中,平静适应5 min,按0.25 mg/kg剂量皮下注射阿扑吗啡(美国Sigma公司, D043)。给药5 min后,用旋转行为记录仪(美国Columbus Instruments公司)统一测定30 min内的旋转情况,过程中保持测定环境的安静与避光。以向左侧(损伤侧肢体)转数减向右侧(健康侧肢体)转数为净转数。以转数超过60者为成功模型。将成功模型采用均衡随机化分组的方式分为Model组、DMS-δ组、DMS-γ组,另纳入Sham组。其中,在DMS-δ组和DMS-γ组中,大鼠放于深部脑磁刺激治疗仪(天津安提斯)的刺激盒中分别给予每天40 min持续4周的DMS治疗(图1)。对于DMS这种磁刺激来说,单波刺激频率达到1 000 Hz,远远超出神经元的反应极限,但把单波组合成串后,每一串可视作一个有效刺激。在DMS-δ组中,动物给予了一种1串/s的磁刺激输出,有效刺激为1 Hz,是一种δ节律的磁刺激输出,而在DMS-γ组中,动物给予了一种30~40串/s的磁刺激输出,有效刺激为30~40 Hz,磁刺激输出在γ范围。Sham组与Model组同样放于刺激盒但不给予治疗。在治疗的第0、1、2、3、4周进行体质量测定及行为学检测。
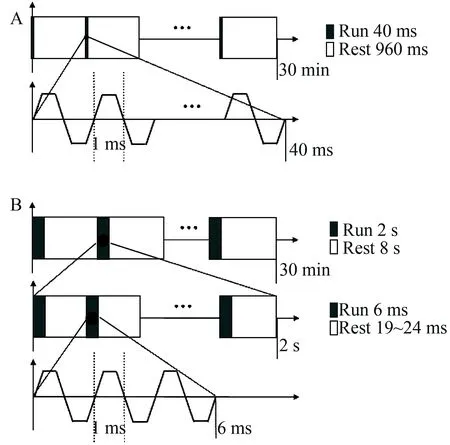
图1 深部脑磁刺激治疗参数
Among each DMS treatment group, 40 minutes trains of DMS were administered daily for 4 weeks. (A)δ rhythm DMS treatment (DMS-δ). (B) γ rhythm DMS treatment (DMS-γ). DMS: deep-brain magnetic stimulation.
1.3 碰壁实验(Cylinder Test)
此实验用来检测大鼠前肢的不对称利用率,契合6-OHDA单侧损毁模型的行为学特点[14],可用于评价DMS的治疗效果。在治疗的第0、1、2、3、4周将大鼠置于直径20 cm,高30 cm的透明有机玻璃圆筒内。用摄像机记录大鼠在圆筒内进行探索性运动的情况,历时5 min。采用盲法计数双侧前肢触碰圆筒壁的次数。损伤侧(即为受损脑半球的对侧)前肢触壁次数用impaired表示,未损伤侧(即为受损脑半球的同侧)前肢触壁次数用unimpaired表示,双侧同时触壁用both表示。损伤侧前肢利用率的计算方式为:
1.4 体质量测定
动物体质量的变化在一定程度上能反映一段时间内动物的体质变化情况[15],进而反映DMS治疗是否对动物的体质产生影响。分别于治疗的第0、1、2、3、4周用电子秤在同一时间对4组大鼠的体质量进行称量。
1.5 外周血淋巴细胞的分类及计数
此实验用来反映动物长时间暴露于磁场是否会引起免疫系统的损伤。在磁刺激治疗4周后于大鼠尾静脉取适量新鲜外周血置于10 g/L EDTA真空采血管内备用。首先检查绝对计数管内计数微球颗粒是否完好且位于计数管金属网下面,标明试剂和样本编号。用移液器采用反式加样法吸取20 μL各个合适抗体试剂加到金属网上方,勿接触到微球颗粒,多种抗体可混合加入。充分混匀抗凝全血,吸取50 μL加到金属网上方管壁上。盖上管盖,轻轻涡旋混合,室温避光孵育15 min。向计数管内加入450 μL的1×溶血素,盖上管盖,轻轻涡旋混合,室温避光孵育15 min。于流式细胞分析仪分析测定。使用BD Cell QuestTM软件获取细胞,调整流式细胞仪通道电压及各荧光颜色补偿,以分离目的细胞群。流式细胞测定所用抗体及试剂耗材见表1。
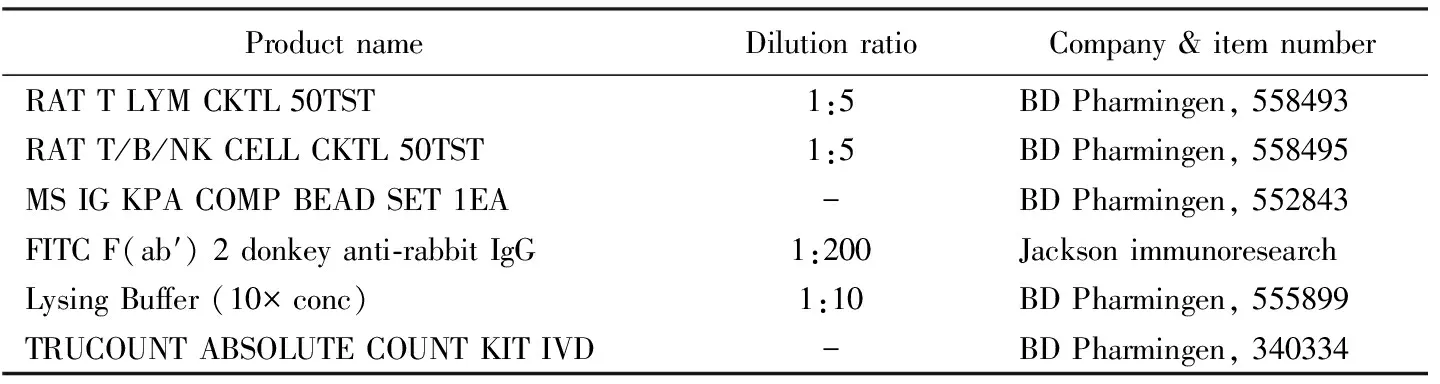
表1 流式细胞术所需试剂耗材
1.6 HE染色
DMS治疗4周后,各组动物按40 mg/kg剂量腹腔注射戊巴比妥钠溶液,待动物深度麻醉后固定在解剖盘内,打开胸腔暴露心脏。输液器针头刺入左心室进入主动脉,快速灌注37 ℃的0.9%(质量分数)氯化钠注射液150 mL,随后灌注4 ℃预冷的4%(质量分数)的多聚甲醛200 mL。待头、尾、四肢僵硬后,停止灌流,取出心、肝、脾、肺、肾、胃、小肠、睾丸,置于4%(质量分数)多聚甲醛中后固定24 h,依次采用20%和30%(质量分数)蔗糖梯度脱水至下沉。取出组织块,OCT包埋,用Leica冰冻切片机于-20 ℃切片,厚度为10 μm,贴于载玻片,可-80 ℃保存待用。先用蒸馏水浸泡切片2 min,用苏木素染液染色5 min,自来水冲洗10 min以除去多余染液,蒸馏水冲洗后用95%(体积分数)乙醇脱水5 s,伊红染色液染色30 s,用95%(体积分数)乙醇脱水2 min,新换95%(体积分数)乙醇再度脱水2 min,二甲苯透明5 min,新换二甲苯再度透明5 min,中性树胶封片。
1.7 统计学方法
2 结果
2.1 阿扑吗啡诱发旋转的运动行为
6-OHDA注射后第10天进行阿扑吗啡诱发大鼠单侧旋转实验,以大于60 r/30 min为成模标准,剔除旋转不达标的动物,Sham组给予同样剂量阿扑吗啡。PD大鼠分为Model组、DMS-δ组、DMS-γ组,3组动物分组较均衡,保证了DMS治疗前疾病的进展基本处于同一水平,详见表2。

表2 动物分组及阿扑吗啡诱发旋转行为
DMS: deep-brain magnetic stimulation; DMS-δ: δ rhythm DMS treatment; DMS-γ: γ rhythm DMS treatment.
2.2 DMS-γ治疗改善了PD大鼠的运动行为
碰壁实验用来测量动物在做探索性运动时左右双前肢的利用率,是反映单侧6-OHDA损伤PD模型双侧肢体不对称运动行为的指标。结果显示,在治疗过程中,Model组大鼠伤侧前肢利用率由20.91%下降到16.13%,而DMS-γ组大鼠伤侧前肢利用率由21.72%增加到36.45%。在治疗的第2、3、4周,DMS-γ组大鼠伤侧前肢利用率相对于Model组显著增高(图2)。使用重复测量数据方差分析显示DMS-γ组和Model组差异具有统计学意义(P= 0.032)。
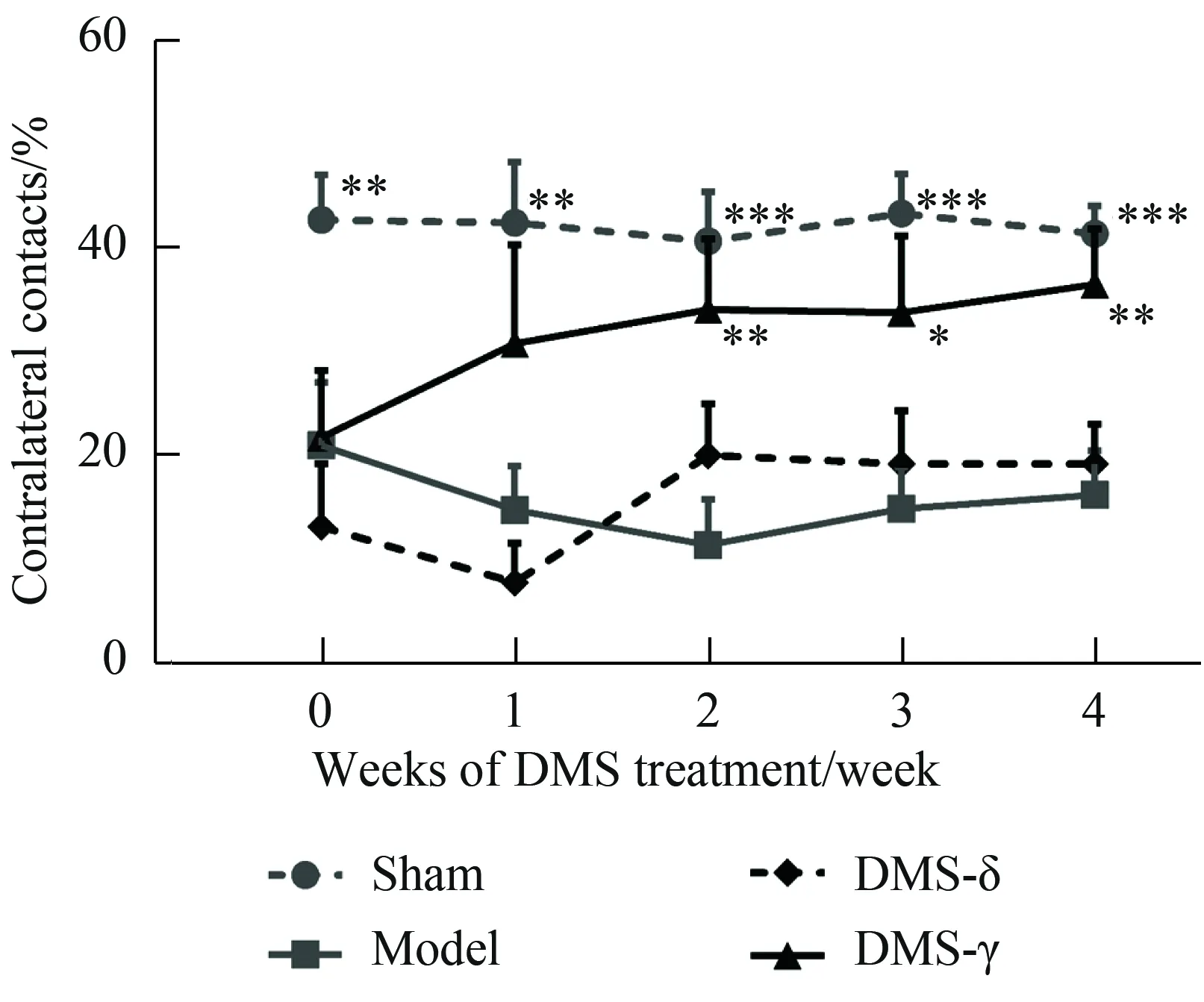
图2 伽马节律深部脑磁刺激改善了6-OHDA大鼠的运动症状
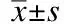
2.3 DMS治疗对大鼠体质量的影响
DMS治疗的第0、1、2、3、4周,各组动物的体质量均逐渐增加(F时间= 665.38,P时间<0.001),但各组间动物体质量差异无统计学意义(F组间=0.93,P组间= 0.44)(图3)。
2.4 DMS治疗对大鼠外周血淋巴细胞亚群计数的影响
DMS治疗4周后,应用流式细胞术进行外周血细胞亚群的分类及数量测定。实验结果显示,各组大鼠外周血总淋巴细胞数占总血细胞数的比例差异无统计学意义(F= 0.56,P= 0.64)(图4A)。各组大鼠总T细胞数占总淋巴细胞数的比例差异无统计学意义(F= 1.60,P= 0.22)(图4A)。DMS-δ组NK细胞计数及占总淋巴细胞比例显著低于Model组(P< 0.05)(图4B),而B细胞计数及占总淋巴细胞比例显著高于Model组(P< 0.05)(图4B)。DMS-γ组与Model组相比NK细胞计数及占总淋巴细胞比例、B细胞计数及占总淋巴细胞比例差异无统计学意义(P>0.05)(图4B)。各组大鼠辅助T细胞计数差异无统计学意义(F= 2.84,P= 0.065),相应地,各组大鼠辅助T细胞占总淋巴细胞数比例差异无统计学意义(F= 0.85,P= 0.49)。各组大鼠杀伤T细胞计数差异无统计学意义(F= 1.27,P= 0.31),杀伤T细胞占总淋巴细胞数比例差异也无统计学意义(F= 0.61,P= 0.62)(图4C)。
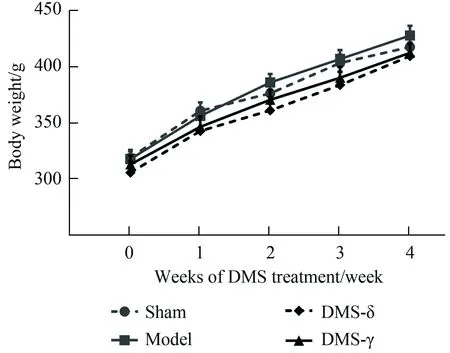
图3 深部脑磁刺激对动物体质量的影响
2.5 DMS治疗未造成动物主要器官的组织病理学改变
DMS治疗4周后,对各组大鼠心、肝、脾、肺、肾、胃、小肠、睾丸进行了HE染色。染色结果显示,各组动物器官均未发现明显组织病理学异常(图5)。

图4 深部脑磁刺激对外周血细胞计数的影响
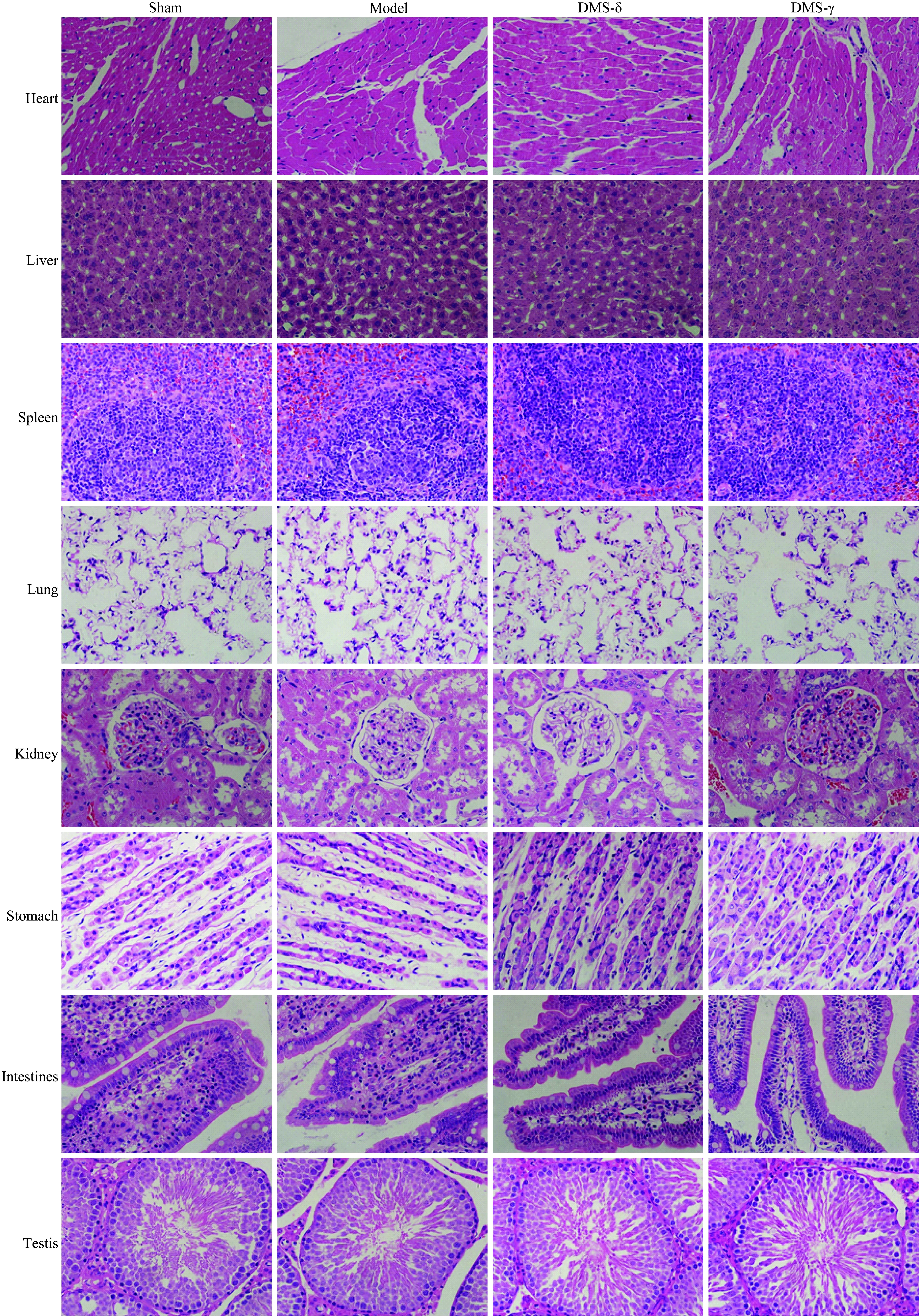
图5 深部脑磁刺激治疗未引起主要器官的组织病理学变化
HE staining for heart, liver, spleen, lung, kidney, stomach, intestines, testis were conducted after 4th week of DMS treatment to detect whether there were side effects on major organs. DMS: deep-brain magnetic stimulation; DMS-δ: δ rhythm DMS treatment; DMS-γ: γ rhythm DMS treatment; HE: hematoxylin-eosin.
3 讨论
笔者在本研究中检测了DMS对PD模型动物运动症状治疗效果的同时,又通过关注DMS治疗中有无一般不良反应来评价DMS治疗的安全性。单侧损毁的帕金森病大鼠表现出身体左右侧运动行为的不对称性。Cylinder test结果表明,相对于Model组,DMS-γ组在接受治疗后表现出很好的恢复趋势,在治疗2周后开始表现出差异有统计学意义且一直持续到治疗结束,而DMS-δ组在治疗过程中相对于Model组未有显著改善,表明DMS-γ对PD运动症状具有治疗效果。
DMS发挥治疗作用的同时,它的安全性得到了重点评估。在本研究中,动物体质量测定[15]、外周血淋巴细胞的分类及计数[16-17]、主要组织器官HE染色[18]都是良好的评价不良反应的指标。结果表明,各组动物的体质量逐渐增加,相对来说Model组大鼠随疾病进展,运动量下降,后期有更明显的增体质量趋势,但各组差异均无统计学意义,表明DMS治疗未对动物的体质量产生影响。除体质量外,笔者关注了经过持续一个月的磁刺激是否能带来外周血淋巴细胞的损害。从淋巴细胞的分类及计数实验结果看出,各组大鼠总淋巴细胞、总T细胞、辅助T细胞、杀伤T细胞计数比例均未表现出差异有统计学意义,相对于正常的Sham组来说,Model组NK细胞的计数及比例显著增加,同时B细胞计数及比例也有降低趋势。表明相对于正常动物来说,PD模型动物的T细胞介导的细胞免疫未有变化,NK细胞介导的天然免疫有增强作用而B细胞介导的体液免疫有减弱的趋势[19-21]。两种DMS治疗均未影响总淋巴细胞、总T细胞、辅助T细胞、杀伤T细胞计数或比例,DMS-γ组也未影响NK细胞、B细胞计数及比例,提示DMS-γ组未表现出对外周血淋巴细胞的影响和损害;而DMS-δ组在未损害淋巴细胞的同时,改善了Model组相对于Sham组NK细胞、B细胞的变化。中枢系统疾病确实可能伴随免疫反应的改变,虽然DMS-δ治疗方式并未改善PD行为学,但在对淋巴细胞的影响方面或许有进一步研究的价值[22]。最后通过HE染色观察了动物主要器官的组织病理学改变,结果显示,此PD动物模型未表现出各主要器官的明显病变,同时两种DMS治疗也未对其产生影响。通过上述动物体质量测定、外周血淋巴细胞亚群数量测定、主要器官HE染色都表明DMS对PD动物运动症状的治疗中没有明显的不良反应,是一种安全的治疗方式。
综上所述,DMS-γ具有改善PD动物运动行为的作用。通过体质量测定、外周血淋巴细胞各亚群计数、主要器官的组织病理学观察,在DMS治疗中均未发现明显不良反应。因此,DMS技术在无创的PD治疗中具有较好的应用前景。
[1] Dauer W, Przedborski S. Parkinson’s disease: mechanisms and models[J]. Neuron, 2003,39(6):889-909.
[2] Braak H, Del Tredici K. Cortico-basal ganglia-cortical circuitry in Parkinson’s disease reconsidered[J]. Exp Neurol,2008, 212(1):226-229.
[3] Obeso J A, Rodriguez-Oroz M C, Goetz C G, et al. Missing pieces in the Parkinson’s disease puzzle[J]. Nat Med,2010,16(6):653-661.
[4] Moldovan A S, Groiss S J, Elben S, et al. The treatment of parkinson’s disease with deep brain stimulation: current issues[J]. Neural Regen Res,2015,10(7):1018-1022.
[5] Baizabal-Carvallo J F, Jankovic J. Movement disorders induced by deep brain stimulation[J]. Parkinsonism Relat Disord,2016(25):1-9.
[6] Fitzgerald P B, Daskalakis Z J. The effects of repetitive transcranial magnetic stimulation in the treatment of depression[J]. Expert Rev Med Devices,2011,8(1):85-95.
[7] Bentwich J, Dobronevsky E, Aichenbaum S, et al. Beneficial effect of repetitive transcranial magnetic stimulation combined with cognitive training for the treatment of Alzheimer’s disease: a proof of concept study[J]. J Neural Transm (Vienna),2011,118(3):463-471.
[8] Deng Z D, Lisanby S H, Peterchev A V. Electric field depth-focality tradeoff in transcranial magnetic stimulation: simulation comparison of 50 coil designs[J]. Brain Stimul,2013,6(1):1-13.
[9] Chen R, Gerloff C, Classen J, et al. Safety of different inter-train intervals for repetitive transcranial magnetic stimulation and recommendations for safe ranges of stimulation parameters[J]. Electroencephalogr Clin Neurophysiol,1997,105(6):415-421.
[10]Wassermann E M. Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the International Workshop on the Safety of Repetitive Transcranial Magnetic Stimulation, June 5-7, 1996[J]. Electroencephalogr Clin Neurophysiol,1998,108(1):1-16.
[11]Zhang Y, Mao R R, Chen Z F, et al. Deep-brain magnetic stimulation promotes adult hippocampal neurogenesis and alleviates stress-related behaviors in mouse models for neuropsychiatric disorders[J]. Mol Brain,2014(7):11.
[12]Blandini F, Armentero M T. Animal models of Parkinson’s disease[J]. FEBS J,2012,279(7):1156-1166.
[13]Ma Y, Zhan M, OuYang L, et al. The effects of unilateral 6-OHDA lesion in medial forebrain bundle on the motor, cognitive dysfunctions and vulnerability of different striatal interneuron types in rats[J]. Behav Brain Res,2014(266):37-45.
[14]Iderberg H, McCreary A C, Varney M A, et al. NLX-112, a novel 5-HT1A receptor agonist for the treatment of L-DOPA-induced dyskinesia: Behavioral and neurochemical profile in rat[J]. Exp Neurol,2015,271:335-350.
[15]Domecq J P, Prutsky G, Leppin A, et al. Clinical review: Drugs commonly associated with weight change: a systematic review and meta-analysis[J]. J Clin Endocrinol Metab,2015,100(2):363-370.
[16]Matsunaga S, Osawa T, Geshi M, et al. Effect of a single intrauterine administration of recombinant bovine interferon-T on day 7 of the estrous cycle on the luteal phase length and blood profile in dairy cows[J]. Res Vet Sci,2012,93(1):381-385.
[17]Zhou S, Zhang B, Liu X, et al. A new natural angelica polysaccharide based colon-specific drug delivery system[J]. J Pharm Sci,2009,98(12):4756-4768.
[18]de Alencar N M, da Silveira Bitencourt F, de Figueiredo I S, et al. Side-Effects of Irinotecan (CPT-11), the Clinically Used Drug for Colon Cancer Therapy, Are Eliminated in Experimental Animals Treated with Latex Proteins from Calotropis procera (Apocynaceae)[J]. Phytother Res,2017,31(2):312-320.
[19]Cooper M D. The early history of B cells[J]. Nat Rev Immunol,2015,15(3):191-197.
[20]Popko K, Gorska E. The role of natural killer cells in pathogenesis of autoimmune diseases[J]. Cent Eur J Immunol,2015,40(4):470-476.
[21]Spitaels J, Roose K, Saelens X. Influenza and memory T cells: how to awake the force[J]. Vaccines (Basel),2016,4(4)Pii: E33.
[22]Shrestha R, Shakya Shrestha S, Millingtona O, et al. Immune responses in neurodegenerative diseases[J]. Kathmandu Univ Med J (KUMJ),2014,12(45):67-76.
编辑 陈瑞芳
Safety evaluation during deep-brain magnetic stimulation (DMS)treating motor symptoms in Parkinsonian rats
Liu Junhua1,2,3, Wang Yong2,3,4, Wang Yanyan1,2,3,, Wang Xiaomin1,2,3*
(1.DepartmentofNeurobiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China; 2.KeyLaboratoryofNeurodegenerativeDisordersoftheMinistryofEducation,Beijing100069,China; 3.BeijingInstituteforBrainDisorders,Beijing100069,China; 4.DepartmentofPhysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
Objective To explore the security via DMS to treat motor symptoms in hemi-parkinsonian rats.Methods Rats were injected with 6-hydroxydopamine (6-OHDA) into right striatum to establish unilateral parkinsonian model. Sham group received the same volume of normal saline by the same procedure. After screened via apomorphine, the successful parkinsonian rats were randomly grouped into model, δ rhythm DMS treatment (DMS-δ) and γ rhythm DMS treatment (DMS-γ). Among each DMS treatment group, 40 minutes trains of DMS were administered daily for 4 weeks. Cylinder tests were conducted to detect motor outcomes. Body weight determination, peripheral blood lymphocytes classification & counting, HE staining were executed to evaluate the security of DMS. Results ①The lesioned side forelimb usage ratio in Sham and DMS-γ groups were significantly higher than that in Model group. ②There was no significant difference of body weight between each group, indicating that DMS had no significant effects on body weight. ③There was no significant difference of the number and percentage of total lymphocytes & T cells between each group, while the natural killer (NK) cells number and percentage in DMS-δ group were significantly higher than that in Model group. ④Results of HE staining for major organs showed no significant histopathological change. Conclusion DMS-γ treatment alleviated bilateral limb asymmetry in PD rats. Meanwhile, DMS treatment showed no significant side effects, indicating that DMS showed satisfactory security in the treatment of motor symptoms in PD rats.
Parkinson’s disease; deep-brain magnetic stimulation; motor behavior; side effects; safety
国家重点基础研究发展计划(“973”计划)(2011CB504100),北京市自然科学基金项目(7082008),北京市科学技术委员会专项资助(Z161100002616007),北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20140514)。This study was supported by National Basic Research Program of China (“973” Fundamental Research) (2011CB504100), Natural Science Foundation of Beijing (7082008),Beijing Municipal Science & Technology Commission (Z161100002616007),The Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140514).
时间:2017-04-13 20∶30
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2030.062.html
10.3969/j.issn.1006-7795.2017.02.020]
R742.5
2017-03-15)
*Corresponding author, E-mail:xmwang@ccmu.edu.cn
