血管紧张素转化酶2减少胰岛细胞的氧化应激及凋亡
2017-04-19史婷婷杨芳远谢荣荣袁明霞杨金奎
史婷婷 杨芳远,2 曹 曦,2 卢 晶,2 谢荣荣,2 袁明霞 杨金奎,2*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
·内分泌与代谢病专题 ·
血管紧张素转化酶2减少胰岛细胞的氧化应激及凋亡
史婷婷1杨芳远1,2曹 曦1,2卢 晶1,2谢荣荣1,2袁明霞1杨金奎1,2*
(1.首都医科大学附属北京同仁医院内分泌科,北京 100730; 2.糖尿病防治研究北京市重点实验室,北京 100730)
目的 探讨血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2) 在胰岛素分泌中的作用及可能的机制。方法提取C57BL/6小鼠的胰岛,用棕榈酸诱导氧化应激及凋亡。用ACE2及对照GFP的腺病毒对胰岛进行感染。ELISA方法检测胰岛素分泌功能。DHE探针检测活性氧(reactive oxygen species,ROS)浓度。蛋白质印记(Western blotting)方法检测糖代谢及凋亡水平。结果 1)ACE2腺病毒感染后,胰岛素分泌增加。2)ACE2腺病毒感染降低了氧化应激水平。3)ACE2 腺病毒感染减低胰岛凋亡。结论 ACE2改善胰岛素分泌功能,其机制可能与ACE2对氧化应激和凋亡的保护作用有关。
肾素血管紧张素系统; 血管紧张素转化酶2; 胰岛素; 氧化应激; 凋亡
肾素-血管紧张素系统(renin-angiotensin system, RAS)是人体内重要的体液调节系统。近年来研究[1-2]表明,RAS 系统参与糖尿病的发展。经典的血管紧张素转化酶-血管紧张素Ⅱ途径增加氧化应激及凋亡,从而造成胰岛功能障碍及糖耐量受损[3-5]。血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)-血管紧张素(1-7)[Ang-(1-7)]-Mas轴作为RAS 系统新的调解轴,可能对2型糖尿病的发展起到一定的保护作用[6-8]。笔者的前期研究[9]表明,ACE2敲除的小鼠表现为糖耐量受损及胰岛素分泌功能障碍。本文将通过体外胰岛培养的方式研究ACE2对胰岛及氧化应激的影响。
1 材料与方法
1.1 动物分组
成年雄性C57BL/6小鼠,体质量18~24 g,购自北京维通利华实验动物公司[实验动物许可证号:SCXK(京)2008-0001]。实验所使用的所有动物均经过首都医科大学附属北京同仁医院动物委员会批准。SPF级别动物房饲养。
1.2 胰岛分离及培养
C57BL/6小鼠处死,打开腹腔,将十二指肠乳头夹闭,在胆总管与胆囊管汇合处匀速注入胶原酶P, 注射过程中观察胰腺膨胀程度,剪下充盈的胰腺放入盛有胶原酶的离心管中。37 ℃ 水浴消化10 min,使胰腺成泥沙状。迅速取出,终止液终止消化,Ficoll 梯度离心,挑取胰岛。将胰岛移入RMPI 1640的培养基[10%(体积分数)胎牛血清,1%(体积分数)谷氨酰胺及1%(体积分数)青霉素链霉素]的培养皿,于37 ℃,5%(体积分数) CO2培养箱中孵育,过夜培养[10]。
1.3 药物处理
用0.1 mol/L 的NaOH 溶液在70 ℃水浴中溶解一定量的棕榈酸(palmitate, PA), 振荡混匀10 min, 然后过滤,配成100 mmol/L的PA 储存液。在55 ℃水浴中用去离子水配制50 g/L的牛血清白蛋白(bovine serum albumin,BSA)溶液, 过滤。然后将上述的PA溶液和BSA 溶液按1∶19的体积比混合配成5 mmol/L PA+50 g/L BSA 复合液。复合液在水浴中振荡10 s后继续水浴10 min, 取出后冷却至室温, 过滤。然后在培养液中稀释至终浓度(0.4 mmol/L)[11]。
1.4 病毒感染
胰岛原代细胞在ACE2腺病毒(5×108pfu/mL)或对照GFP病毒(5×108pfu/mL)孵育24 h,24 h后荧光显微镜观察病毒感染效率。
1.5 实验分组
用棕榈酸处理胰岛原代细胞24 h后,进行ACE2腺病毒(5×108pfu/mL)或对照GFP病毒(5×108pfu/mL)感染24 h。收集胰岛,进行下一步功能实验及蛋白水平检测。
我们不去统计国家对文化事业投入的各项数据,但我们通过在基层的采访和调研,所看到听到的一些现象和声音,应该是最生动的说明。
1.6 葡萄糖刺激的胰岛素分泌试验(glucose stimulated insulin secretion, GSIS)
将每孔15个胰岛种于12孔板,用KRBB缓冲液 [129 mmol/L NaCl, 4.8 mmol/L KCL, 1.2 mmol/L MgSO4, 1.2 mmol/L KH2PO4, 2.5 mmol/L CaCL2, 5 mmol/L NaHCO3, 0.1% (质量分数) BSA, 10 mmol/L HEPES, pH 7.4]洗涤2遍并37 ℃孵箱平衡30 min,分别用2.8 mmol/L葡萄糖的KRBB孵育和含16.7 mmol/L葡萄糖的KRBB在37 ℃孵箱中处理1 h,收集上清,ELISA试剂盒(Millipore, Billerica, MA, 美国)测定胰岛素[12]。
1.7 活性氧(reactive oxygen species, ROS)检测
胰岛细胞用棕榈酸刺激,之后用ACE2腺病毒或GFP病毒处理24 h。二氢乙锭(dihydroethidium,DHE)检测:培养的胰岛用5 μmol/L DHE(Sigma公司,美国)在37 ℃孵箱中孵育40 min,磷酸缓冲盐溶液(phosphate buffered saline, PBS)洗涤2次,读取荧光强度[13]。
1.8 Western blotting
在4 ℃条件下,加入裂解液提取胰岛蛋白。用BCA Protein Assay Kit 测定样品蛋白浓度。每个样本用30~60 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至PVDF上,用含5%(质量分数)脱脂奶粉的TBST溶液封闭4 h,加入一抗于4 ℃孵育过夜。TBST漂洗2次,每次5 min,加入1∶5 000辣根过氧化酶标记的二抗,室温孵育1 h,TBST漂洗6次,每次5 min,肌动蛋白(beta actin)为内参,将膜用化学发光试剂孵育 1 min,于X线胶片上曝光,常规显影、定影。抗体均购自美国Santa Cruz公司。

2 结果
2.1 ACE2过表达改善了胰岛的GSIS功能
在高糖(16.7 mmol/L)刺激下, PA孵育胰岛后胰岛素分泌水平显著下降,但感染ACE2腺病毒后,葡萄糖刺激的胰岛素分泌水平较对照GFP病毒组升高(图1)。该结果提示ACE2可以部分恢复高脂肪酸造成的胰岛素分泌障碍。
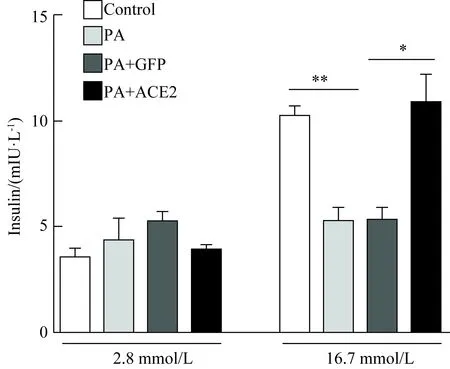
图1 ACE2对胰岛GSIS 功能的影响
*P<0.05;**P<0.01; ACE2: angiotensin converting enzyme 2; GSIS:glucose stimulated insulin secretion;PA:palmitate;GFP: green fluorescent protein;n=5, Data are shown as means ±SE.
2.2 ACE2过表达降低胰岛中活性氧簇(ROS)的产生
用PA干预后胰岛的活性氧簇(ROS)较未干预组明显增高,但ACE2病毒感染后ROS较对照GFP组显著降低(图2)。结果提示,ACE2可以抑制胰岛细胞内ROS的产生及氧化应激。
2.3 ACE2过表达降低了胰岛的凋亡
与对照GFP病毒组相比,ACE2腺病毒感染后降低了caspase 9 及caspase 3 表达(图3),因此提示ACE2抑制了caspase 3凋亡途径。

图2 ACE2对胰岛内ROS浓度的影响
*P<0.05;**P<0.01; Data are shown as means ±SE. ACE2: angiotensin converting enzyme 2; ROS: reactive oxygen species; PA:palmiate; GFP: green fluorescent protein; DHE: dihydroethidium.

图3 ACE2 对胰岛中凋亡通路的影响
*P<0.05;**P<0.01;n=3. Data are shown as means ±SE. ACE2: angiotensin converting enzyme 2; PA:palmiate; GFP: green fluorescent protein.
3 讨论
肾素-血管紧张素系统是人体内重要的体液调节系统。RAS既存在于循环系统中,也存在于胰腺、血管壁、心脏、中枢、肾脏和肾上腺等组织中,共同参与对靶器官的调节。在正常情况下,它对心血管系统的正常发育、心血管功能稳态、电解质和体液平衡的维持以及血压的调节均有重要作用。目前已经有研究[14]表明该系统参与调解糖代谢,阻断RAS可以减少新发糖尿病,对卡托普利预防计划(CAPPP)、心脏转归预防评估(HOPE)等研究的荟萃分析显示,ACEI可以减少27%的新发糖尿病。其确切机制尚不清楚,部分归因于胰岛素抵抗的改善,但随着胰岛局部RAS系统的确立,RAS抑制剂对胰岛细胞的保护作用逐渐受到关注[15]。胰岛局部的AngⅡ可以调节胰岛血流、氧分压、胰岛素合成和氧化应激[16-17]。ACE2是RAS系统中的关键酶,它将血管紧张素Ⅱ分解为血管紧张素1-7,血管紧张素1-7通过与其mas受体结合发挥着拮抗血管紧张素Ⅱ 的作用。笔者前期的研究[9]表明,ACE2敲除的小鼠表现为糖耐量受损及胰岛素分泌功能障碍。腺病毒转染ACE2基因到糖尿病db/db小鼠,检测到胰岛的凋亡减少及胰岛素分泌增加[18]。研究[19]表明,ACE2可以提高胰岛微血管内皮功能从而保护胰岛功能。笔者的研究表明,ACE2腺病毒感染胰岛后可以提高胰岛素分泌能力,该现象可能与减少了胰岛的氧化应激及凋亡有关。
棕榈酸可以诱导细胞中ROS的产生以及细胞氧化应激及凋亡[20]。在正常情况下,机体内ROS的产生和ROS清除系统处于动态平衡状态。由于种种原因,导致ROS产生增多或/和机体清除ROS能力的下降,机体就会出现氧化应激。当机体处于氧化应激状态时,体内组织细胞ROS量相对升高,超过机体的清除能力,可导致机体组织脂质过氧化水平升高,引起细胞凋亡。在细胞凋亡早期ROS浓度升高和线粒体膜电位下降,随后出现caspase-3的激活和DNA断裂产生凋亡。在本研究中,笔者通过在体外棕榈酸孵育,诱导胰岛细胞出现分泌功能障碍及氧化应激。caspase-3 通路是经典的凋亡途径,这个通路的表达上调提示细胞凋亡水平的增加[21-22]。有研究[23]表明血管紧张素Ⅱ 增加caspase-3的表达从而增加凋亡,本研究表明ACE2可以抑制氧化应激的水平及caspase-3的表达从而抑制凋亡的发生,更加明确了ACE2在胰岛中起到的保护作用。
本研究存在以下不足:1)目前的实验结果为体外实验,下一步笔者计划在高脂喂养的小鼠模型上进一步观察ACE2-Ang1-7-MAS轴对胰岛氧化应激和胰岛功能的影响。2)目前,ACE2对氧化应激的影响得到一定的证实,但其具体机制需要进一步探讨,笔者将在线粒体线内质网方面进行进一步的研究。
综上所述,本研究结果表明,ACE2上调可以对胰岛素分泌起到保护作用。这一过程可能是通过减少氧化应激水平来实现的。本研究结果进一步明确了ACE2在糖代谢中的调节作用,并为糖尿病的治疗提供了新的线索。
[1] Hayden M R, Sowers J R. Pancreatic renin-angiotensin-aldosterone system in the cardiometabolic syndrome and type 2 diabetes mellitus[J]. J Cardiometab Syndr, 2008,3(3):129-131.
[2] Bindom S M, Lazartigues E. The sweeter side of ACE2: physiological evidence for a role in diabetes[J]. Mol Cell Endocrinol, 2009,302(2):193-202.
[3] Takayanagi T, Kawai T, Forrester S J, et al. Role of epidermal growth factor receptor and endoplasmic reticulum stress in vascular remodeling induced by angiotensin Ⅱ[J]. Hypertension, 2015,65(6):1349-1355.
[4] Ha T S, Park H Y, Seong S B, et al. Angiotensin Ⅱ induces endoplasmic reticulum stress in podocyte, which would be further augmented by PI3-kinase inhibition[J].Clin Hypertens,2015,21:13.
[5] Wang J, Wen Y, Lv L L. Involvement of endoplasmic reticulum stress in angiotensin Ⅱ-induced NLRP3 inflammasome activation in human renal proximal tubular cells in vitro[J]. Acta Pharmacol Sin,2015, 36(7):821-830.
[6] Murugan D, Lau Y S, Lau C W, et al. Angiotensin 1-7 protects against angiotensin Ⅱ-Induced endoplasmic reticulum stress and endothelialdDysfunction via mas receptor[J]. PLoS One, 2015,10(12):e0145413.
[7] Uhal B D, Nguyen H, Dang M. Abrogation of ER stress-induced apoptosis of alveolar epithelial cells by angiotensin 1-7[J]. Am J Physiol Lung Cell Mol Physiol, 2013,305(1):L33-41.
[8] Singh T, Singh K, Sharma P L. Ameliorative potential of angiotensin1-7/Mas receptor axis in streptozotocin-induced diabetic nephropathy in rats[J]. Methods Find Exp Clin Pharmacol, 2010,32(1):19-25.
[9] Niu M J, Yang J K, Lin S S, et al. Loss of angiotensin-converting enzyme 2 leads to impaired glucose homeostasis in mice[J]. Endocrine, 2008,34(1-3):56-61.
[10]Carter J D, Dula S B, Corbin K L,et al. A practical guide to rodent islet isolation and assessment[J]. Biol Proced Online,2009, 11:3-31.
[11]Cnop M, Abdulkarim B, Bottu G, et al. RNA sequencing identifies dysregulation of the human pancreatic islet transcriptome by the saturated fatty acid palmitate[J]. Diabetes, 2015, 63(6):1978-1993.
[12]McCommis K S, Hodges W T, Bricker D K, et al. An ancestral role for the mitochondrial pyruvate carrier in glucose-stimulated insulin secretion[J]. Mol Metab, 2016, 5(8):602-614.
[13]Zhang F, Liu C, Wang L, et al. Antioxidant effect of angiotensin (17) in the protection of pancreatic β cell function[J]. Mol Med Rep, 2016,14(3):1963-1969.
[14]Liang D L, Li X Y, Wang L, et al. Current status and influence factors of ACEⅡ/ARB application in elderly coronary heart disease outpatients complicated with diabetes mellitus in China[J]. Zhonghua Yi Xue Za Zhi, 2016, 96 (36):2917-2922.
[15]Prentki M, Nolan C J. Islet beta cell failure in type 2 diabetes[J]. J Clin Invest, 2006, 116(7):1802-1812.
[16]Favre G A, Esnault V L, Van Obberghen E. Modulation of glucose metabolism by the renin-angiotensin-aldosterone system[J]. Am J Physiol Endocrinol Metab, 2015,308(6):E435-E449.
[17]Lau Y S, Tian X Y, Mustafa M R, et al. Boldine improves endothelial function in diabetic db/db mice through inhibition of angiotensin Ⅱ-mediated BMP4-oxidative stress cascade[J]. Br J Pharmacol, 2013,170(6):1190-1198.
[18]Bindom S M, Hans C P, Xia H, et al. Angiotensin I-converting enzyme type 2 (ACE2) gene therapy improves glycemic control in diabetic mice[J]. Diabetes, 2010,59(10):2540-2548.
[19]Lu C L, Wang Y, Yuan L, et al. The angiotensin-converting enzyme 2/angiotensin (1-7)/Mas axis protects the function of pancreaticβ cells by improving the function of islet microvascular endothelial cells[J]. Int J Mol Med, 2014,34(5):1293-1300.
[20]Cnop M, Abdulkarim B, Bottu G, et al. RNA sequencing identifies dysregulation of the human pancreatic islet transcriptome by the saturated fatty acid palmitate[J]. Diabetes, 2014,63(6):1978-1993.
[21]Zhu B, Zhang L, Zhang Y Y, et al. DNase I aggravates islet β-cell apoptosis in type 2 diabetes[J]. Mol Med Rep, 2016,13(6):4577-4584.
[22]Yu C, Cui S, Zong C, et al. The orphan nuclear receptor NR4A1 protects pancreatic β-Cells from endoplasmic reticulum (ER) stress-mediated apoptosis[J]. J Biol Chem, 2015,290(34):20687-20699.
[23]李伟,罗振华,付凌云,等. 银杏提取物对血管紧张素Ⅱ 诱导的新生大鼠心肌细胞凋亡的影响[J]. 贵阳医学院学报,2015,40(9):910-918.
编辑 陈瑞芳
Angiotensin converting enzyme 2 improves insulin secretion in islets
Shi Tingting1, Yang Fangyuan1,2, Cao Xi1,2, Lu Jing1,2, Xie Rongrong1,2, Yuan Mingxia1,2, Yang Jinkui1,2*
(1.DepartmentofEndocrinology,BeijingTongrenHospital,CapitalMedicalUniversity,Beijing100730,China; 2.BeijingKeyLaboratoryofDiabetesResearchandCare,Beijing100730,China)
Objective The aim of the study was to identify the roles of angiotensin-converting enzyme 2 (ACE2) in insulin secretion in islets and to characterize the related mechanisms. Methods Islets from C57BL/6 mice were treated with palmitate acid and infected with adenovirus combined ACE2 or GFP. Glucose stimulated insulin secretion was assayed by ELISA kit. Reactive oxygen species (ROS) was measured by dihydroethidium (DHE). The expression of glucose metabolism gene expression and caspase was assayed by Western blotting. Results ①ACE2 over-expression increased insulin secretion. ②ACE2 over-expression down-regulated ROS content in islets. ③ACE2 over-expression down-regulated apoptosis in islets. ConclusionACE2 could be involved in improving insulin secretion via anti-oxidative and anti-apoptotic effects.
rennin-angiotensin system; angiotensin-converting enzyme 2; insulin; oxidative stress; apoptosis
国家自然科学基金(81370946, 81400824, 81300726),北京市自然科学基金(7131005),首都医科大学附属北京同仁医院科研基金(2015-YJJ-ZZL-006 )。This study was supported by National Natural Science Foundation of China (81370946, 81400824, 81300726),Natural Science Foundation of Beijing (7131005), Foundation of Beijing Tongren Hospital, Capital Medical University (2015-YJJ-ZZL-006 )
时间:2017-04-13 19∶30
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1930.002.html
10.3969/j.issn.1006-7795.2017.02.002]
R587.1
2017-01-20)
*Corresponding author, E-mail:jinkui.yang@gmail.com
