采用植入式生理信号无线遥测系统记录清醒大鼠自由活动状态下胃的肌电信号
2017-04-19姚元生郑丽飞朱进霞
姚元生 郑丽飞 朱进霞
(首都医科大学基础医学院生理学与病理生理学系,北京 100069)
·基础研究 ·
采用植入式生理信号无线遥测系统记录清醒大鼠自由活动状态下胃的肌电信号
姚元生 郑丽飞 朱进霞*
(首都医科大学基础医学院生理学与病理生理学系,北京 100069)
目的 为了减少麻醉对胃肌电活动的影响,优化在体胃肌电活动的记录方法,更好地反映自然状态下胃肌电活动状况,减小手术操作对动物的创伤,以及提高术后动物存活率。方法 通过植入式生理信号无线遥测系统,结合优化记录电极植入方式将植入子电极固定在胃窦浆膜层,术后动物恢复7 d后,进行胃肌电信号采集,分别采集了清醒、自由活动状态下大鼠胃的肌电活动信号,并对其消化期与消化间期胃肌电活动的频率、幅度及特点进行了分析。结果 在消化期,可采集到持续、稳定的胃肌电信号,大鼠胃慢波幅度为(14.39±1.12)μV,频率为(4.76±0.09)次/min,快波幅度为(70.76±5.31)μV,每个慢波上的快波数为10.38±1.22;在消化间期,可观测到周期性变化的移行性复合肌电波形,每个周期持续时间为10~12 min,其Ⅲ相胃肌电活动的慢波幅度为(14.75±0.76)μV,频率为(4.90±0.14)次/min,快波幅度为(72.58±3.67)μV,每个慢波上的快波数为12.00±1.35。在消化期,采用促动力药多潘立酮可以增强胃慢波和快波的幅度及快波的频率,其慢波幅度从(16.87±1.05)μV变为(25.77±2.16)μV(P<0.01,n=6),频率从(4.97±0.18)次/min变为(4.85±0.14)次/min(P>0.05,n=6),快波幅度从(72.25±3.65)μV变为(104.00±7.72)μV(P<0.01,n=6),每个慢波上的快波个数从10.50±1.12变为14.00±0.97(P<0.05,n=6)。结论 通过植入式生理信号无线遥测系统可以较好地采集到清醒自由活动状态下大鼠胃的慢波及快波电信号,为研究生理及病理生理状态下胃肌电活动提供了一种新手段。
植入式生理信号无线遥测系统;胃肌电;慢波和快波;多潘立酮
1922年,Alvarez[1]首次在人体表成功地采集到胃肌电活动后,胃电生物现象受到学者们的极大关注和研究。胃肌电信号是指胃平滑肌细胞(smooth muscle cells,SMC)的电活动,近百年来,卡哈尔间质细胞(interstitial cells of Cajal, ICC)被认为是胃肌电的起搏细胞,ICC可自发产生电信号并通过低电阻的缝隙连接传播给SMC,胃SMC可发生节律性的去极化及复极化,形成慢波电位(即慢波),也称基本电节律。消化道平滑肌的动作电位是在慢波电位的基础上产生的锋电位[2](即快波);胃肌电信号的产生是胃收缩活动的基础,当胃肌电节律出现异常时将会引起胃收缩活动紊乱,例如,临床上糖尿病、帕金森病人出现胃电信号异常时伴有胃轻瘫症状[3-4]。由于在人体表记录的胃肌电信号值大幅度衰减及很不稳定,所以基于动物的胃肌电信号记录方法应运而生。传统的动物胃肌电记录方法有离体胃电记录[5]和活体胃电记录[6]。其中离体胃电记录是在去除外来神经、体液及食物因素的条件下探究胃SMC电活动的手段,适用于单纯的机制研究;活体胃电记录方法可以更准确地反映动物在自然状态下的电生理活动,但是传统的活体胃肌电记录方法存在导线束缚、手术操作对动物创伤较大,术后动物存活率低等不足之处。因此改进或创新一种胃肌电采集方法显得尤为重要。本研究采用先进的植入式生理信号无线遥测系统,并对其记录电极进行了改良,来记录SD大鼠在清醒自由活动状态下的胃肌电活动,观察消化期和消化间期胃肌电活动的特点,并观察促动力药物D2受体拮抗剂多潘立酮对胃肌电活动的作用。
1 材料与方法
1.1 实验动物
选取15只SPF级雄性Sprague Dawley(SD)大鼠(首都医科大学实验动物部提供),体质量为200~250 g,采用数字表法将其随机分组为5笼,每笼3只,严格按照实验动物福利委员会许可,实验动物许可证号:SCXK(京)2012-0001,动物在室温,每隔12 h更替光照,24 h自由饮食水的条件下进行饲养。
1.2 实验药品与仪器
多潘立酮(货号D122,Sigma公司,美国),小动物吸入式麻醉机(型号VMR,Matrx公司,美国),电生理屏蔽柜(型号QD6203,JINGYIN公司,嘉兴市民建机械厂),植入式生理信号无线遥测系统包括植入子(型号TA10CA-F40,DSI公司,美国),改进方式:(将两个自制直径为0.3 cm的圆形纯银片分别与植入子的两电极焊接在一起,并用硅橡胶固定,两电极间的距离为10 mm)、接收板(型号RPC-1,DSI公司,美国)、信号转换器(型号DEM6430,DSI公司,美国)和台式计算机(型号Inspiron 620S,Dell公司,美国)。
1.3 实验方法
动物在手术前自由摄食饮水,用装有异氟烷液体的小动物吸入式气体麻醉机麻醉动物,首先将动物放入诱导麻醉箱内把麻药蒸发器打开至最大,待动物进入深度麻醉状态后,将动物取出,罩上与麻醉机相连的呼吸面罩并仰卧于手术台上,同时调剂潮气量旋钮使潮气量值满足手术需要。手术台面提前用75%(体积分数)乙醇消毒,恒温加热板置于动物背部下面以维持体温在37 ℃左右;固定大鼠,用剃刀除去其腹部毛发,碘伏消毒腹部皮肤,75%(体积分数)乙醇脱碘一次;沿腹正中线于剑突下1 cm处切开皮肤约2 cm。用浸过0.9%(质量分数)氯化钠注射液的消毒棉棒轻轻地将胃拉出腹腔;将改良过的植入子的两电极通过缝合的方法固定在前壁胃窦浆膜层,轻轻地将胃放回原位,将植入子缝在内层肌层(腹腔内),缝合皮肤,术后动物恢复7 d。记录消化间期胃肌电活动时,提前将动物过夜禁食12 h;记录消化期胃肌电活动时,动物自由摄食饮水。将清醒、自由活动状态下的大鼠放入单独的鼠笼中,自由摄食饮水,鼠笼放在接收板上,置于电生理屏蔽柜中。植入子可采集到胃肌电信号,通过无线传播方式将电信号传送给接收板,与接收板相连的模数转换器将电信号值转为数字信号,“DSI Acqusition”软件将数字信号转换成图形后,呈现在显示器上。通过调节滤波参数滤出胃肌电的慢波和快波,慢波参数:低通滤波0.1 Hz,快波参数:带通滤波10~50 Hz。
1.4 统计学方法
2 结果
2.1 SD大鼠消化期的胃肌电信号
在消化期,大鼠胃肌电图清晰可辨,慢波成正弦图形。其中慢波幅度为(14.39±1.12)μV,频率为(4.76±0.09)次/min,快波幅度为(70.76±5.31)μV,每个慢波上的快波个数为10.38±1.22(图1A)。将慢波对应的快波展开后,呈现不规律的、高度不同的快波(图1B)。再将单个快波展开后,成尖峰状,时程为(38.25±2.52)ms(图1C)。n=8。

图1 消化期胃肌电信号-快波与慢波
A:gastric myoelectric activity under digestive stage;B:expanded fast wave tracings on a slow wave from the part of“A” marked by a gray short line; C:two single fast wave tracings from the part of “B” marked by a gray short line; SP:spike potential; SW: slow wave.
2.2 SD大鼠消化间期的胃肌电信号
在空腹时(禁食12 h),大鼠出现一种周期性变化的胃肌电图形,称为移行性复合肌电,分为4个时相。Ⅰ相无快波,Ⅱ相出现少量的快波,Ⅲ相快波数量最多,收缩力最强,Ⅳ相为Ⅲ相向Ⅰ相的过渡期(图2)。其中Ⅲ相胃肌电活动的慢波幅度为(14.75±0.76)μV,频率为(4.90±0.14)次/min,快波幅度为(72.58±3.67)μV,每个慢波上的快波个数为12.00±1.35。详见图3,n=8。
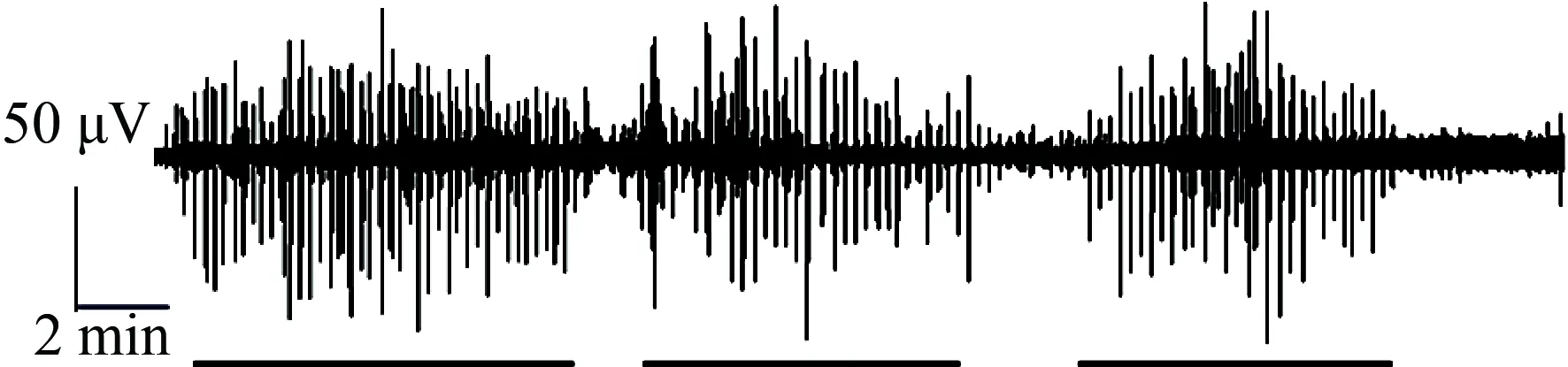
图2 消化间期移行性复合肌电的原始记录图
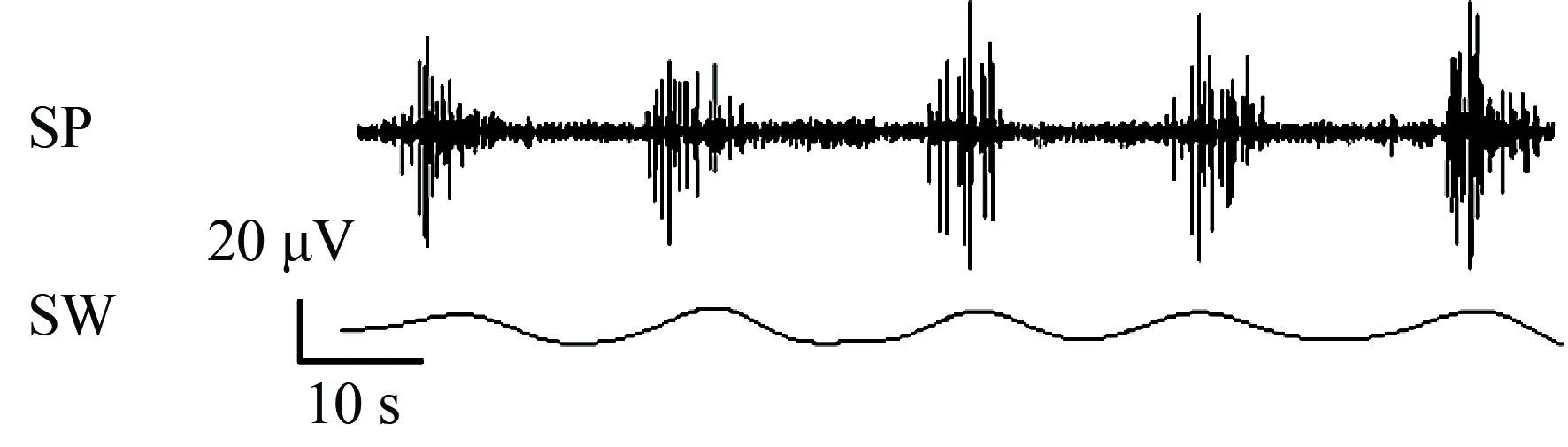
图3 移行性复合肌电Ⅲ相胃肌电信号-快波与慢波
SP:spike potential;SW:slow wave.
2.3 多潘立酮对消化期胃肌电活动的影响
在消化期,慢波幅度为(16.87±1.05)μV,频率为(4.97±0.18)次/min,快波幅度为(72.25±3.65)μV,每个慢波上的快波个数为10.50±1.12,当灌胃1 mg/kg多潘立酮后,慢波幅度变为(25.77±2.16)μV(t=3.70,P<0.01),频率变为(4.85±0.14)次/min(t=0.51,P>0.05),快波幅度变为(104.0±7.72)μV(t=3.37,P<0.01),每个慢波上的快波个数变为14.00±0.97(t=2.37,P<0.05)。详见图4,n=6。
3 讨论
由于传统的活体胃肌电记录方法存在一定的弊端,为了改良活体胃肌电的记录方法,本研究应用先进的DSI植入式生理信号无线遥测系统,并对其记录电极进行了改进,能较好地排除心电干扰,减小了手术操作对动物的创伤并提高术后动物存活率。本实验方法在大鼠完全清醒、自由活动、自由摄食饮水情况下记录到了活体胃肌电信号。本研究方法为研究胃肌电活动提供了一种更有效的新手段。
据报道人的正常慢波节律为3次/min[7],关于SD大鼠的正常胃慢波节律的报道略有差异,为3~5次/min[8]或4~6次/min[9]。在本实验中应用植入式生理信号无线遥测系统记录到的SD大鼠胃慢波节律为(4.76±0.09)次/min,与先前报道[8-9]基本一致。同时本实验记录到的快波时程为(38.25±2.52)ms,与研究[10]显示的峰电位时程10~50 ms相一致。而记录到的快波幅度不均一现象,可能是由于采集到的SMC的数量不同或在相同时间内兴奋性的SMC数量不一样引起的。以上实验结果说明通过本实验方法采集到的清醒、自由活动状态下大鼠胃肌电信号真实可靠。

图4 多潘立酮对胃肌电活动的影响
A:effect of domperidone on gastric slow wave or fast wave; B:domperidone enhanced the amplitude of slow wave and fast wave amplitude,**P<0.01vspre-domperidone,n=6; C:domperidone increased the number of fast wave on each slow wave, but had no effect on the frequency of slow wave,*P<0.05vspre-domperidonen=6;cpm:counts per minute, cps:counts per slow wave; SP:spike potential; SW:slow wave.
胃节律异常有3种,胃动过缓(节律低于2.5次/min),胃动过速(节律高于3.6次/ min)和胃节律失常(时快时慢且波形不规则[11]。胃电节律异常会导致胃动力障碍疾病,所以采集胃肌电信号是诊断胃节律异常的一种手段。活体胃肌电信号记录能很好地反映自然状态下胃的生理状况,对临床诊断及进一步地治疗胃电紊乱疾病具有实用价值。但是活体胃肌电容易受到呼吸节律和心电及骨骼肌电的干扰[12],限制了其应用前景。在本实验中,本课题组通过改良记录电极,将原本的钢丝电极换成银片电极,其电阻值低,具有良好的导电性能,并将电极埋置方向垂直于心电轴,以便放大胃电信号和减少心电的干扰。由于本实验是在大鼠清醒、自由活动状态下,通过无线信号方式采集胃肌电,所以也容易受到人为噪音、外界电信号的干扰。为了减少这些干扰,实验过程中全程将大鼠放在专用电生理屏蔽柜中,禁止无关人员的介入。尽管不能排除大鼠自由活动时,骨骼肌电和胃的小幅移动对胃肌电信号的影响,但可以通过动物活动引起的信号强度基线的波动进行判断,为后期记录结果的分析提供了帮助。总体来说,与传统活体胃肌电信号记录方法相比,植入式生理信号无线遥测系统采集到的胃肌电信号较稳定、噪音较低,可以有效地记录到胃肌电信号。
ICC产生慢波是通过钙激活的氯离子通道,产生大幅度的内向电流,引起邻近的SMC去极化[13];同时去极化达到或超过电阈值时,激活L型钙通道,促使钙离子内流,产生动作电位,可使SMC收缩[2]。近些年来,也有研究血小板源生长因子受体α(platelet derived growth factor receptor α, PDGFR α)阳性的间质细胞超级化后,通过缝隙连接可使SMC超极化引起舒张[14]。SMC、ICC和PDGFR之间存在缝隙连接,三种细胞合称为SIP合胞体[15-17]。肠神经纤维与ICC及PDGFR密切联系,肠神经通过影响SIP合胞体来调控胃肌电活动。多潘立酮为D2受体拮抗剂,是一种促胃动力药,临床上常用于胃动力不足病人的治疗[18]。本课题组前期研究[19]显示,多潘立酮可增强SD大鼠胃的收缩活动,在本实验中通过给大鼠胃饲多潘立酮(1 mg/kg),发现其胃的肌电活动显著增强,主要表现为增强大鼠胃慢波和快波的幅度以及快波的频率,但慢波频率无明显变化。与胃收缩活动作用效果相一致,说明这种记录方法是可行并有效的。至于多潘立酮对胃肌电活动的作用是通过直接影响SIP合胞体的功能,还是先通过影响肠神经系统进而间接地影响SIP合胞体尚不明确,有待进行进一步的研究。
综上所述,本研究通过植入式生理信号无线遥测系统,可记录清醒、自由活动状态下大鼠胃肌电信号。消化期大鼠胃肌电信号持续且稳定,消化间期大鼠表现出复合胃肌电活动。这种活体记录胃肌电方法将为胃肌电活动的基础研究提供一种新型更有效的实验手段。
[1] Alvarez W C. The electrogastrogram and what it shows [J].JAMA, 1922, 78(1): 1116-1119.
[2] Sanders K M. A case for interstitial cells of cajal as pacemakers and mediators of neurotransmission in the gastrointestinal tract[J].Gastroenterology, 1996, 111(2): 492-515.
[3] Angeli T R, Cheng L K, Du P, et al. Loss of interstitial cells of cajal and patterns of gastric dysrhythmia in patients with chronic unexplained nausea and vomiting[J].Gastroenterology, 2015, 149(1): 56-66 .
[4] Kaneoke Y, Koike Y, Sakurai N, et al. Gastrointestinal dysfunction in parkinson’s disease detected by electrogastroenterography[J].J Auton Nerv Syst, 1995, 50(3): 275-281.
[5] 金永丸, 李在琉. 大鼠离体胃电的吸附电极记录法[J].延边医学院报, 1996, 19(2): 79-84.
[6] 张彤彦, 袁申元, 王雁,等. 实验性糖尿病大鼠胃窦运动功能、胃电活动及NOS的改变[J].首都医科大学学报, 2001, 22(1): 42-44.
[7] Sallam H S,Oliveira H M, Liu S, et al. Mechanisms of burn-induced impairment in gastric slow waves and emptying in rats[J].Am J Physiol Regulatory Integr Comp Physiol,2010,299(1):298-305.
[9] Sallam H S, Oliveira H M, Liu S H, et al. Mechanisms of burn-induced impairment in gastric slow waves and emptying in rats[J].Am J Physiol Regul Integr Comp Physiol,2010,299(1):298-305.
[10]周吕, 柯美云,李在琉.胃肠动力学:基础与临床[M].北京:科学出版社,1999: 183-184.
[11]O’Grady G, Abell T L. Gastric arrhythmias in gastroparesis: low and high resolution mapping of gastric electrical activity[J].Gastroenterol Clin North Am, 2015, 44(1): 169-184.
[12]Chang F Y. Electrogastrography: basic knowledge, recording, processing and its clinical applications[J]. J Gastroenterol Hepatol, 2005, 20(4): 502-516.
[13]Zhu M H, Sung T S, O’Driscoll K,et al. Intracellular Ca2+release from endoplasmic reticulum regulates slow wave currents and pacemaker activity of interstitial cells of Cajal[J].Am J Physiol Cell Physiol, 2015, 308(8):C608-C620.
[14]Kurahashi M, Zheng H, Dwyer L,et al. A functional role for the ‘fibroblast-like cells’ in gastrointestinal smooth muscles[J].J Physiol,2011, 589(Pt3): 697-710.
[15]Blair P J, Bayguinov Y, Sanders K M,et al. Relationship between enteric neurons and interstitial cells in the primate gastrointestinal tract[J].Neurogastroenterol Motil,2012, 24(9): e437-e449.
[16]Horiguchi K, Komuro T. Ultrastructural observations of fibroblast-like cells forming gap junctions in the W/W(nu) mouse small intestine[J].J Auton Nerv Syst, 2000, 80(3): 142-147.
[17]Peri L E, Sanders K M, Mutafova-Yambolieva V N. Differential expression of genes related to purinergic signaling in smooth muscle cells, PDGFRα-positive cells and interstitial cells of Cajal in the murine colon[J].Neurogastroenterol Motil, 2013, 25(9): e609-e620.
[18]闫志辉,崔立红,浦江,等. 不同方法治疗海军部队人员功能性消化不良临床分析[J]. 解放军医药杂志,2014,26(6):102-105.
[19]Zheng L F, Song J, Fan R F,et al. The role of the vagal pathway and gastric dopamine in the gastroparesis of rats after a 6-hydroxydopamine microinjection in the substantia nigra[J].Acta Physiol(Oxf), 2014, 211(2): 434-446.
编辑 孙超渊
Study on the gastric myoelectric signal recording by implantable radiotelemetry in conscious rats with free movement
Yao Yuansheng, Zheng Lifei, Zhu Jinxia*
(DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
Objective To optimize the recording method on the gastric myoelectric activity, reduce operation trauma to animals and improve the animal survival rate after surgery. Methods The optimized recording electrodes were implanted into the serosal layer of gastric antrum. 7 days after surgery, the gastric myoelectricity signals were collected from conscious and unrestrained rats through the implantable physiological signal wireless telemetry system. The frequency, amplitude and characteristics of gastric electromyography in digestive and interdigestive phase were analyzed. Results In digestive stage, sustainable and stable gastric myoelectricity signals were recorded. The amplitude and frequency of gastric slow wave (SW) is (14.39±1.12)μV and (4.76±0.09)cpm, respectively; amplitude of gastric spike potentials (SP) is (70.76±5.31)μV and the mean number of SP on each SW is (10.38±1.22). In interdigestive phase, each cycle duration is 10-12 min, the third period of gastric migrating myoelectric/motor complex (MMC) is strongest. The amplitude and frequency of gastric SW is (14.75±0.76)μV and (4.90±0.14)cpm, respectively; amplitude of gastric SP is (72.58±3.67)μV, the mean number of SP on each SW is 12.00±1.35. In the digestion period, the use of prokinetic drug, domperidone (1mg/kg) increased the amplitude (16.87±1.05)μV to (25.77±2.16)μV (P<0.01,n=6) and frequency (4.97±0.18) cmp to (4.85±0.14)cmp (P>0.05,n=6) of SW and amplitude (72.25±3.65)μV to (104.00±7.72)μV (P<0.01,n=6) and frequency (10.50±1.12) to (14.00±0.97) (P<0.05,n=6) of SP. Conclusion Using implantable radiotelemetry, we successfully acquired rat gastric myoelectricity signals in digestive and interdigestive phase under physiological state, which provided a more accurate and effective experimental technique/method for exploring gastric myoelectric activity and then the function of gastric motility under physiologic and pathophysiologic state.
implantable radiotelemetry system; gastric myoelectricity; slow wave and spike potentials; domperidone
国家自然科学基金(31400991,81370482,81570695)。 This study was supported by National Natural Science Foundation of China (31400991, 81370482, 81570695).
时间:2017-04-13 20∶05
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2005.054.html
10.3969/j.issn.1006-7795.2017.02.015]
Q43
2016-09-23)
*Corresponding author, E-mail:zhu_jx@ccmu.edu.cn
