清醒小鼠脑部神经元急性细胞外记录
2017-04-19王秋实雷慧萌
王秋实 雷慧萌
(首都医科大学基础医学院神经生物学系,北京 100069)
·基础研究 ·
清醒小鼠脑部神经元急性细胞外记录
王秋实 雷慧萌*
(首都医科大学基础医学院神经生物学系,北京 100069)
目的 介绍对清醒小鼠脑部进行急性在体细胞外电生理记录的方法及一些基本的数据处理方法。 方法 采用多通道硅电极及清醒小鼠头部固定系统在小鼠清醒状态下对其脑部神经元做急性细胞外记录。首先,在小鼠的颅骨表面粘贴一个不锈钢头板,术后小鼠恢复一周后,将不锈钢头板与清醒小鼠头部固定系统相连使小鼠的头部得以固定,其四肢踩在一个漂浮的泡沫球上可以自由的活动,对小鼠进行连续3 d的适应性训练,每天的训练时间递增,使之能够逐渐熟悉并适应电生理记录的环境,然后,将多通道急性硅电极插入小鼠脑内,应用多通道电生理记录系统,记录神经元的动作电位(spike)及局部场电位(local field potential, LFP),并应用Offline Sorter软件对单个神经元(Single Unit)进行划分以及应用NeuroExplore软件对LFP通过滤波的方法划分出4种震荡成分Delta、Theta、Beta和Gamma震荡。 结果 在清醒小鼠脑内成功记录到了神经元的动作电位及LFP,并通过软件划分出了Single Unit和Delta、Theta、Beta和Gamma 4种震荡成分。结论 应用清醒小鼠神经元急性细胞外记录的方法,能够很好的记录到动作电位及LFP。
清醒;急性;在体;细胞外;电生理
通过在体细胞外电生理记录的方法对神经元的活动进行记录是研究神经元电生理特性及活动情况的一项基本方法[1-4]。以往的细胞外电生理记录方法主要是将电极植入到动物脑内,进行神经元电活动的观察,由于电极植入后位置便固定,因此很难实现在短时间内在较大深度跨度的脑区进行神经元电活动的监测。而近些年来通过硅电极结合清醒动物头部固定技术则可以展开对清醒动物脑部神经元进行急性的电生理监测,其不但可以实现在短时间内在较大深度跨度的脑区内进行电信号的记录,在寻找单个神经元的动作电位(即Single Unit)方面,以及对动物实施某些特定的行为学操控的便利性等方面,亦有着较大的优点。因此,清醒动物急性细胞外记录在研究神经活动方面有着较重要的应用价值。
1 材料与方法
1.1 实验动物
C57BL/6J SPF级小鼠,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2015-0001,所有实验小鼠均饲养于首都医科大学SPF级动物房。
1.2 材料及试剂
清醒小鼠头部固定系统、小鼠头部立体定位仪、小鼠头部固定用不锈钢头板(千奥星科生物科技有限公司);微操纵器(Siskiyou 公司,美国);16通道急性细胞外电生理记录硅电极(NeuroNexus公司,美国);多通道电生理记录系统(BlackRock公司,美国);C&B-Metabond(Parkell公司,美国);DiI(Molecular Probes公司,美国);手术显微镜(World Precision Instruments公司,美国);电钻(韩国世新公司,韩国);银线(A-M Systems, 美国);不锈钢眼镜螺丝;数显焊台(益诚达电子设备厂);焊锡丝(玺力,中国);蠕动泵(兰格恒流泵有限公司,中国);冰冻切片机(Leica公司, 德国);正置荧光显微镜(尼康公司,日本);Offline Sorter软件、NeuroExplore软件(Plexon公司,美国);Matlab软件(Mathworks公司,美国);水合氯醛(天津市光复精细化工研究所);多聚甲醛(天津市福晨化学试剂厂)。
1.3 实验方法
1.3.1 多通道电生理记录装置的连接
多通道电生理记录系统包括以下设备,并按下图红色箭头所指的顺序连接在一起(图1)。实验所采用的急性多通道记录电极由2部分组成,上方的连接包和下方的电极阵列,电极阵列由硅制作,上有多个电极记录位点,而连接包内则包含有各个电极位点所连接的传输线路以及与电极适配器的连接接口。电极阵列是电极下入脑组织的部分,为了减小电极的插入对脑组织造成的损伤,电极阵列制作的非常细非常薄,本实验采用的16通道急性记录电极的电极阵列部分宽度为30~200 μm(上宽下窄),厚度15 μm,从上到下等距分布有16个电极点,因此电极阵列特别容易折断,使用时应注意防止触碰到外力因素(图1A)。电极适配器是直接与电极相连接,其通过夹持杆固定于微操纵器,因此可通过微操纵器控制电极的前后、左右和上下3个方向的移动(图1B);Headstage的一端与电极适配器相连,另一端连于数字集线器,其作用主要是模数转换、信号放大以及对一些噪音信号的过滤,其将电极采集到的模拟信号转换为数字信号,并通过内置的放大器将信号进行放大(图1B);数字集线器有多个连接通道,可以同时和多个Headstage相连,得以同时记录多个脑区的电信号,此外其将输入的电信号转换为光信号,通过光纤向神经信号处理器进行长距离高保真的信号传输(图1C);神经信号处理器可以实现高分辨率数据的采集,以及对电生理信号采集软件的诸多指令得以实施,比如采样率及采样频率范围的控制、电极电阻值的测定等,此外,尚可以和第三方的软硬件实现同步化记录,比如行为学系统、刺激系统以及视频系统等(图1D)。电生理信号采集软件则是实现对电生理信号采集的条件的设定以及波形等界面的呈现等(图1E)。

图1 多通道电生理记录装置的连接
A:16-channnel acute silicon electrode and enlarged view of recording sites, each white dot represents a recording site, the upper part (a) of the electrode is “connector package”, the bottom part (b) is ”electrode array ”which is made of silicon; B:electrode adaptor and headstage; C:digital hub; D:neural signal processor; E:neural signal recording software.
1.3.2 小鼠头部粘贴不锈钢头板
6%(质量分数)水合氯醛 6 mL/kg腹腔注射将小鼠麻醉,用手术剪剪去头部被毛;将麻醉后小鼠的头部固定于小鼠头部立体定位仪,在手术显微镜下减掉头皮,暴露颅骨,清除颅骨表面的结缔组织(图2A)。
根据小鼠脑图谱[5],查找待记录脑区坐标值。本实验选取的记录位置为内侧纹状体区域(Bregma前方620 μm,旁开1 500 μm),通过微操纵器进行定位,并在颅骨上做标记点。
磨薄标记点处颅骨(图2A、B),以方便做电生理记录时易于揭去颅骨并暴露脑组织,并可以保护其下方脑组织,防止在做记录前被小鼠挠破以及感染等。以标记点处为中心,用电钻轻轻将标记点处颅骨磨薄至一薄层骨片,打磨范围直径约1 000 μm。注意在磨薄颅骨的过程中将电钻调至比较慢的转速档位,同时在打磨的过程中手法亦要轻,防止将颅骨磨穿暴露脑组织。
配制C&B-Metabond,粘贴不锈钢头板。C&B-Metabond是一种受温度感应的速干粘接剂。将配制好的C&B-Metabond涂抹于小鼠颅骨的表面及头板的一面,然后将头板粘在小鼠颅骨表面,使标记点处于头板中部的圆形空窗内(图2B),该圆形的空窗,可以使待记录的脑区位于其内,在头板两端有两个半开放的小孔,用于和清醒小鼠头部固定系统相连接(图2C)。然后在头板的周围均涂抹上C&B-Metabond使头板能够和颅骨粘结紧密。
脑组织接地装置。在头板后方的颅骨上钻一个小孔,钻通颅骨并暴露脑组织表面,将已焊接上银线的眼镜螺丝(图2D)钻入小孔内使之与脑组织相连(图2A),在做电生理记录时再将焊接在电极适配器地线位点上的银线与眼镜螺丝上的银线通过焊锡连接在一起(图2F),这样便可以使脑组织得以接地。
1.3.3 小鼠术后恢复及适应性训练
贴头板术后小鼠单笼饲养,休息一周使其身体状态能得到较为充分的恢复;将小鼠固定在清醒小鼠头部固定系统(图2E)上进行适应性训练,使之能够习惯和适应该环境,以减轻其恐惧情绪,使记录时更接近于自然的状态。
清醒小鼠头部固定系统主要由以下5个部分组成:(1)头部固定架:用于和小鼠颅骨的头板相连使小鼠的头部得以固定(图2F,绿色箭头 );(2)悬浮球:一个由泡沫材质制成的球,在其后方相连着一个送风装置,通过送风可以使泡沫球悬浮在空气中。该球的作用是小鼠的四肢可以踩在球上得以自由的活动(图2F,蓝色箭头 );(3)运动轨迹探测器:通过两个运动轨迹探测器可以从三维的方向上记录悬浮球运动的速度,便于数据分析时区分不同的运动状态以控制数据质量的精确性(图2E,红色箭头 );(4)身体固定架:罩在小鼠身体的上方,防止其身体随悬浮球的运动而过于扭曲(图2F,红色箭头 );(5)微操纵器固定架:用于将微操纵器安装于其上,实现对电极的移动(图2E,绿色箭头 )。
将小鼠放在清醒小鼠头部固定系统上,小鼠的头部通过头板与清醒小鼠头部固定系统的头板固定架相连接而使其头部得以固定,小鼠的脚下踩着一个悬浮的泡沫球,其四肢可以在浮球上自由的活动,这样得以制造一个虚拟的现实环境[6-7]。将小鼠放在清醒小鼠记录系统上对小鼠进行连续3 d的适应性训练,第1天训练2 h,第2天4 h,第3天6 h,3 d的训练结束后小鼠休息1 d,使其体力得到恢复,次日便可进行电生理记录。
1.3.4 电生理信号的采集
将小鼠固定于清醒小鼠头部固定系统上(图2E);揭开之前在待记录脑区处磨薄后的残余骨片,撕掉硬脑膜,暴露脑组织;事先使电极表面附着DiI[8]。DiI是一种亲脂性的荧光染料,可被激发光激发显示出红色荧光。将电极在DiI溶液中重复性的连续浸蘸10次,每2次浸蘸之间停留约5 s以上使其在空气中干燥,这样便可使电极表面附着有DiI,当电极下入脑组织后,附着在电极上的DiI能与神经元细胞膜内的脂分子相结合而使得电极经过脑组织的路径得以显示,可以在脑切片上观察记录的目标位置是否正确;将电极适配器上的银线与连于小鼠脑内的眼镜螺丝上的银线焊接在一起使脑组织接地(图2F);最后将电极插到电极适配器上,并下入脑组织内,打开数字集线器及信号处理器的开关,并打开电脑上的电生理采集软件Central,便可对神经元的电生理信号进行采集和记录。

图2 小鼠颅骨贴头板手术及清醒小鼠急性电生理记录
A:Spectacle screw (with a silver wire welded on the head of it, the red arrow) was turned through the burr hole to make it connect to the brain tissue, the black arrow indicates the recording area; B:The head-plate adhered onto the skull, let the recording area inside the circle window of head-plate, the black arrow indicates the recording area;C:stainless steel head-plate; D:spectacle screw with the silver wire welded on the head of it; E:Awake mouse head-fixed system, the red arrow indicates the motion detector, the green arrow indicates the micromanipulator supporting structure; F:The silver wire of electrode adaptor and the silver wire of spectacle screw were weld together so as to make the brain tissue ground, the white arrow indicates the welding point of these two silver wires, the red arrow indicates the body-holder, the green arrow indicates the head-plate holder, the blue arrow indicates the floating ball.
1.3.5 数据的采集与处理
包括对动作电位及局部场电位(local field potential, LFP)的采集与处理,每一个电极位点均可同时进行动作电位及LFP的采集。在电脑采集软件Central上,采集条件设置为:动作电位的采集选取高通滤波250 Hz(HP 250 Hz);LFP的采集选取低通滤波250 Hz(LP 250 Hz),采样率为1 kS/s(即 1 000 samples/s)。
动作电位的采集与处理:在下电极的过程中,如果发现信噪比比较高的动作电位,通过微调电极进入脑组织的深度找到其距神经元最近的位置,也即波幅最大的位置,来达到记到质量较高的Single Unit。
通过Offline Sorter软件将Single Unit划分出来。
LFP的采集与处理:笔者选取了以下4个震荡成分来进行分析,分别为δ震荡:1.5~4 Hz;θ震荡:4~9 Hz;β震荡:11~30 Hz;γ震荡:30~55 Hz。
1.3.6 验证电极记录位置
所有用于实验的小鼠在电生理记录结束后均立刻用0.9%(质量分数)氯化钠注射液及4%(质量分数)多聚甲醛溶液灌注取脑,30%(质量分数)蔗糖溶液过夜,待脑组织沉底后进行冰冻切片,通过荧光显微镜观察电极在脑组织中经过的痕迹对电极记录的位置进行验证。
2 结果
2.1 动作电位的记录与划分
图3为记录到的一个单个的神经元的动作电位的集合,即一个Single Unit,采用Offline Sorter软件中的3D Clusters 窗口(图3A)将该Single Unit划分出来。Offline Sorter软件中的3D Clusters 窗口是Offline Sorter软件自带的一个划分Single Unit的软件,其采用主成分分析的聚类算法,在一个三维的坐标轴里划分Single Unit,图中的每一个点代表一个动作电位或一个噪音信号,在该图中动作电位的诸点能够聚成一个团并和背景噪音(Basic noise)信号聚成的团在空间上分离的较远,代表的是一个信噪比较高的Single Unit。
图3B为动作电位波形的叠加图,其中黄色的波形叠加部分代表的是一个Single Unit,灰色的部分为背景噪音;图3A和图3B相对应,图3A中每一个黄色的点代表一个动作电位,对应于图3B中的一条黄色的波形,而灰色的点代表的是背景噪音,对应于图3B中灰色的背景噪音部分。从3D Clusters图(图3A)上可以看到,该Single Unit和背景噪音在空间上有着较明显的分离,从波形叠加图(图3B)上可以看到,该Single Unit和背景噪音在振幅上有着较大的差别;均说明了该Single Unit有着较高的信噪比,反映该Single Unit是一个质量比较高的Single Unit,几乎没有混入背景噪音等成分。
2.2 LFP的记录并对其进行滤波分析
图4为通过NeuroExplore软件对记录到的一个电极位点周围的LFP及对其进行滤波后分出的4种震荡成分。
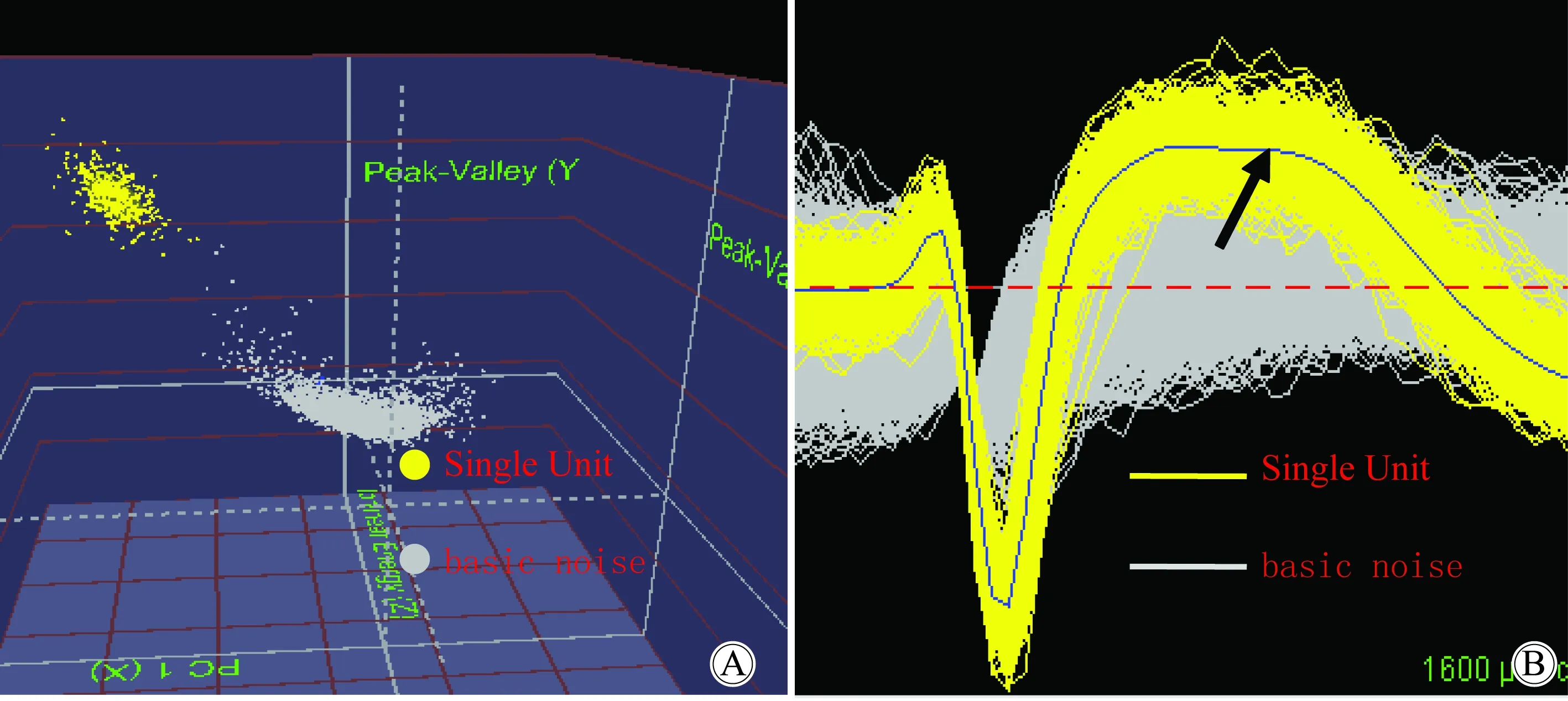
图3 单个神经元的划分及其重叠的波形图
A:isolation of a Single Unit by “3D Clusters” window in Offline Sorter software; B:The overlapped waveforms of the Single Unit, the single blue waveform (black arrow) among the yellow overlapped waveform is the average waveform of this Single Unit.

图4 局部场电位和4种震荡成分
From top to bottom respectively the waveform of LFP, Delta oscillation, Theta oscillation, Beta oscillation, and Gamma oscillation in 5 seconds;LFP:local field potential.
3 讨论
神经元电信号的记录方法主要有3种,即细胞外记录、细胞内记录以及膜片钳记录。细胞外记录是指电极记录位点位于神经元外侧附近,不插入神经元内部,当神经元发放动作电位时,在电极处就会记录到电位的变化。细胞内记录是将电极插入神经元内,记录神经元细胞膜内外侧之间的电位差。膜片钳则是对电极尖端吸附的细胞膜片段进行电生理记录的方法,主要用于对离子通道的研究,但膜片钳中的全细胞记录则和细胞内记录相类似。相比较而言,细胞外记录的主要优点是可以通过多通道记录的方法同时记录多个神经元的电活动,而细胞内记录则一次只能记录一个神经元。但是细胞外记录不能记录静息电位,也无法进行细胞膜特性的研究,而这些则是细胞内记录可以实现的[9]。
目前细胞外记录的方法主要有急性细胞外记录和慢性细胞外记录,急性细胞外记录主要通过硅电极来实现,可以实时操控电极的移动,可以在短时间内记录到较大范围脑区的电信号,但由于在记录过程中要保持动物头部的固定,因此以往的急性细胞外记录主要是在麻醉动物上开展,但是对麻醉动物进行记录的缺点是动物并非处于自然的生理活动状态。近些年来发展起来的清醒动物头部固定技术,则可以在动物清醒状态下使其头部得到固定,从而实现在清醒状态下对脑部进行急性细胞外记录。同时,动物的肢体活动并不受到限制,可以进行自由的活动。而慢性细胞外记录则是要将电极预先植入脑组织内,手术后应使动物进行一段时间的恢复后再对电信号进行采集,记录的位置比较固定,即电极植入之处,如果需要记录更深位置脑区的神经元的电活动,则要通过特殊的装置使电极往下深入一定的距离。
通过硅电极结合清醒动物头部固定技术进行的急性细胞外记录和通过植入式电极进行的慢性细胞外记录方法的优缺点比较如下:1)急性记录实验可以在一次的记录过程中实现较大深度跨度空间的电信号采集,即可以在一次记录过程中通过不断地增加电极进入脑组织的深度而记录到不同深度的多个神经元的动作电位。慢性实验则仅能采集电极植入处的神经元的电信号,如果要采集其更深位置的神经元的电生理信号,则要通过特殊的装置使电极往下深入一定的距离。因此相比较而言,急性记录实验在这方面更易于操作。2)急性记录实验方便寻找Single Unit,因其可以即时操控,当发现电极位点附近可能存在Single Unit时,可以通过不断地在上下方向微调电极下入脑组织的深度来找到记录该Single Unit的最佳位置,即信噪比最高的位置。3)急性记录实验可以实现一些植入式电极不易操控的行为学实验。脑部植入电极的动物完全处于自由活动的状态下,某些人为的行为学刺激不方便给予,而头部固定动物,则方便给予某些特定的行为学操控,从而观察特定脑区的神经元反应。4)急性记录实验的缺点在于虽然是在动物清醒的状态下进行的记录,但其所处的环境仍然是一个人为安排下的环境,动物并非完全处于自然放松的条件下,慢性电生理记录则可以在动物完全处于自然放松的状态下进行电信号的记录。
前面介绍的对记录到的电生理信号进行数据处理的方法只是一些基本的数据处理方法,包括对Single Unit的划分和对LFP的滤波分析,Single Unit对研究具体的神经元的活动情况及神经环路有着很重要的意义及说服力[10]。但是在记录Single Unit的过程中同时会记录到电极点周围的基础噪音和别的神经元发放的动作电位,因此如果要记录到质量比较高的Single Unit,就必须要保证该Single Unit有比较高的信噪比,即其波幅与背景噪音及别的神经元动作电位的波幅相差要比较大,这样才能使其单独被挑出而不混有背景噪音信号和来自于别的神经元发放的动作电位的信号[11]。LFP是一种重要的神经信号,其反映的是电极位点周围所有神经元低频电活动的总和[12-13]。LFP参与了多种脑功能活动,LFP的异常和多种疾病密切相关,在不同的生理状态下同一脑区的LFP亦有差别[14-16]。LFP内部包含多种不同的震荡成分,不同的震荡成分亦和不同的行为、状态等相关[17-19]。对LFP进行量化分析通常选取的指标是功率谱密度(power spectral densities, PSD),通过分别计算每一种震荡成分的功率值来对实验数据进行分析和比较。可根据需要借助一些分析软件如Offline Sorter、NeuroExplore、Matlab等对这些数据进行更深入的处理,比如放电频率的分析、爆发式电活动的分析、LFP中各震荡成分的功率谱密度值的计算、任务态相关的电活动的分析、动作电位和LFP之间的相关性的分析等。
通过在动物清醒的状态下进行急性的神经元的动作电位及LFP的记录,是研究神经元活动的一种基本的方法,对研究神经元的活动情况及神经环路等有着重要的作用。
[1] Buzsáki G. Large-scale recording of neuronal ensembles[J]. Nat Neurosci, 2004, 7(5):446-451.
[2] Gold C, Henze D A, Koch C, et al. On the origin of the extracellular action potential waveform: a modeling study[J]. J Neurophysiol, 2006, 95(5):3113-3128.
[3] Henze D A, Borhegyi Z, Csicsvari J, et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo[J]. J Neurophysiol, 2000, 84(1):390-400.
[4] Lyons-Warren A M, Kohashi T, Mennerick S, et al. Retrograde fluorescent labeling allows for targeted extracellular single-unit recording from identified neurons in vivo[J]. J Vis Exp, 2013 (76).doi: 10.3791/3921.
[5] Paxinos G, Franklin K B J. The mouse brain in stereotaxic coordinates(second edition )[M]. San Diego: Acadimic Press, 1997.
[6] Sofroniew N J, Cohen J D, Lee A K, et al. Natural whisker-guided behavior by head-fixed mice in tactile virtual reality[J]. J Neurosci, 2014,34(29):9537-9550.
[7] Kislin M, Mugantseva E, Molotkov D, et al. Flat-floored air-lifted platform: a new method for combining behavior with microscopy or electrophysiology on awake freely moving rodents[J]. J Vis Exp, 2014(88):e51869.
[8] DiCarlo J J, Lane J W, Hsiao S S, et al. Marking microelectrode penetrations with fluorescent dyes[J]. J Neurosci Methods, 1996,64(1):75-81.
[9] 寿天德.神经生物学[M].2版. 北京:高等教育出版社, 2006: 23-26.
[10]White J J, Lin T, Brown A M, et al. An optimized surgical approach for obtaining stable extracellular single-unit recordings from the cerebellum of head-fixed behaving mice[J]. J Neurosci Methods, 2016,262:21-31.
[11]Schmitzer-Torbert N, Jackson J, Henze D, et al. Quantitative measures of cluster quality for use in extracellular recordings[J]. Neuroscience, 2005,131(1):1-11.
[12]Ness T V, Remme M W, Einevoll G T.Active subthreshold dendritic conductances shape the local field potential[J]. J Physiol, 2016, 594(13):3809-3825.
[13]Berens P, Keliris G A, Ecker A S, et al. Feature selectivity of the gamma-band of the local field potential in primate primary visual cortex[J]. Front Neurosci, 2008, 2(2): 199-207.
[14]Thompson J A, Lanctin D, Ince N F, et al. Clinical implications of local field potentials for understanding and treating movement disorders[J]. Stereotact Funct Neurosurg, 2014, 92(4):251-263.
[15]Airaksinen A M, Niskanen J P, Chamberlain R, et al. Simultaneous fMRI and local field potential measurements during epileptic seizures in medetomidine-sedated rats using raser pulse sequence[J]. Magn Reson Med, 2010, 64(4):1191-1199.
[17]Martin C, Ravel N. Beta and gamma oscillatory activities associated with olfactory memory tasks: different rhythms for different functional networks?[J]. Front Behav Neurosci, 2014, 8:218.
[18]Bender F, Gorbati M, Cadavieco M C, et al. Theta oscillations regulate the speed of locomotion via a hippocampus to lateral septum pathway[J]. Nat Commun, 2015, 6:8521.
[19]Vandecasteele M, Varga V, Berényi A, et al. Optogenetic activation of septal cholinergic neurons suppresses sharp wave ripples and enhances theta oscillations in the hippocampus[J]. Proc Natl Acad Sci U S A, 2014, 111(37):13535-13540.
编辑 陈瑞芳
Acute neuronal extracellular recording of brain in awake mice
Wang Qiushi, Lei Huimeng*
(DepartmentofNeurobiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
Objective Introduction to the method of acute extracellular recording of the brain of awake miceinvivoand some basic data analysis methods. Methods We applied multi-channel silicon electrode and awake mouse head-fixed system to perform acute electrophysiological recording in the awake mice. First, a head-plate adhered to the skull of the mouse, after surgery, one week’s rest was given, the mouse was then mounted to the head-fixed system by screwed together the head-plate of the mouse and the head-plate holder of the head-fixed system. The limbs of the mouse could freely move in a floating ball of the head-fixed system. Three consecutive days adaptive training were performed in order to habituate the mice of the recording background, then performed the acute electrophysiological recording by use of multi-channel electrode and multi-channel electrophysiological recording system, to record the spikes and local field potentials (LFP) in neurons of awake mice, and applied Offline Sorter software to isolate the Single Unit as well as NeuroExplore software to separated the Delta, Theta, Beta and Gamma oscillations from the LFP by means of filtering. Results We successfully recorded the spikes and LFPs in neurons of awake mice, and isolated the single units as well as separated the Delta, Theta, Beta and Gamma oscillations from LFP by the analysis software. Conclusion Application of acute extracellular electrophysiological recording methods can successfully record the spikes and LFPs in neurons of awake mice.
awake; acute;invivo; extracellular; electrophysiology
国家自然科学基金(31171051,31371108),北京市自然科学基金(5132007,5112008),北京市教委科技发展计划(KM201110025001)。This study was supported by National Natural Science Foundation of China (31171051, 31371108), Natural Science Foundation of Beijing (5132007,5112008), the General Program of Science and Technology Development Project of Beijing Municipal Education Commission(KM201110025001).
时间:2017-04-13 19∶43
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1943.022.html
10.3969/j.issn.1006-7795.2017.02.012]
R338
2016-12-06)
*Corresponding author, E-mail: leihm@ccmu.edu.cn
