四川猕猴桃软腐病防治初步研究
2017-04-13胡容平石军林立金叶慧丽姚琳周游
胡容平,石军,林立金,叶慧丽*,姚琳,周游
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川成都610066;2.绵阳市农业科学研究院,四川绵阳621023;3.四川农业大学果蔬研究所,四川成都611130)
四川猕猴桃软腐病防治初步研究
胡容平1,石军2,林立金3,叶慧丽1*,姚琳1,周游3
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川成都610066;2.绵阳市农业科学研究院,四川绵阳621023;3.四川农业大学果蔬研究所,四川成都611130)
本试验以木霉菌(Trichoderma spp.)为生防筛选材料,针对猕猴桃软腐病(葡萄座腔菌Botryosphaeria dothidea),通过对峙培养、难挥发性代谢产物的拮抗试验以及5种杀菌剂对病原菌的毒力测定,为猕猴桃软腐病生物、化学防治提供参考的理论依据。结果表明,菌株T156-37对葡萄座腔菌的拮抗效果最好,抑制率达到66.11%。木霉菌株T163-8的难挥发性代谢产物对葡萄座腔菌的抑制作用最好,抑制率达到63.26%。25%咪鲜胺在室内生测试验效果显著,其次是30%苯醚甲环唑.丙环唑,EC50(μg/ mL)分别是0.3825和10.2351。
猕猴桃;软腐病;木霉;生物防治;毒力测定
猕猴桃素有“维C之王”的美誉,深受广大消费者喜爱[1]。四川生态条件适宜栽植猕猴桃,栽培面积已近4万hm2,是四川省具有重要经济价值的水果之一,为提高农民收入,增加社会、经济效益做出了巨大贡献[3]。但随着猕猴桃种植面积的扩大和种植时间的延长,病虫害问题日益突出,特别是采后病害对猕猴桃产业的发展影响很大,其中猕猴桃软腐病是贮藏期的重要病害[4-5],采后发病率通常在10%左右,严重者可达20%以上,大大降低了猕猴桃的商品性,给猕猴桃生产造成了重大损失[6]。
1985年Pennycook在新西兰于首次报道猕猴桃软腐病以来[7],其防治方法就一直受到重视,但大都采用传统单一的化学防治方法,既污染环境,又增加农残,长期使用还产生了抗药性,难以达到理想防治效果[8-9]。随着绿色植保理念的不断深入,运用生物防治手段控制植物病害已越来越受到世界各国的重视[10-11]。在植物真菌病害生物防治中,木霉(Trichoderma spp.)是一种重要的生防因子,具有广阔的生防应用前景。木霉在20世纪30年代就被确认具有生防能力,并且在国内外研究中,利用木霉防治植物病害特别是真菌引起的腐烂病害报道较多[12-14]。本研究结合筛选生防木霉菌与高效低毒化学药剂的综合防治方法,为猕猴桃软腐病的有效防治提供参考。
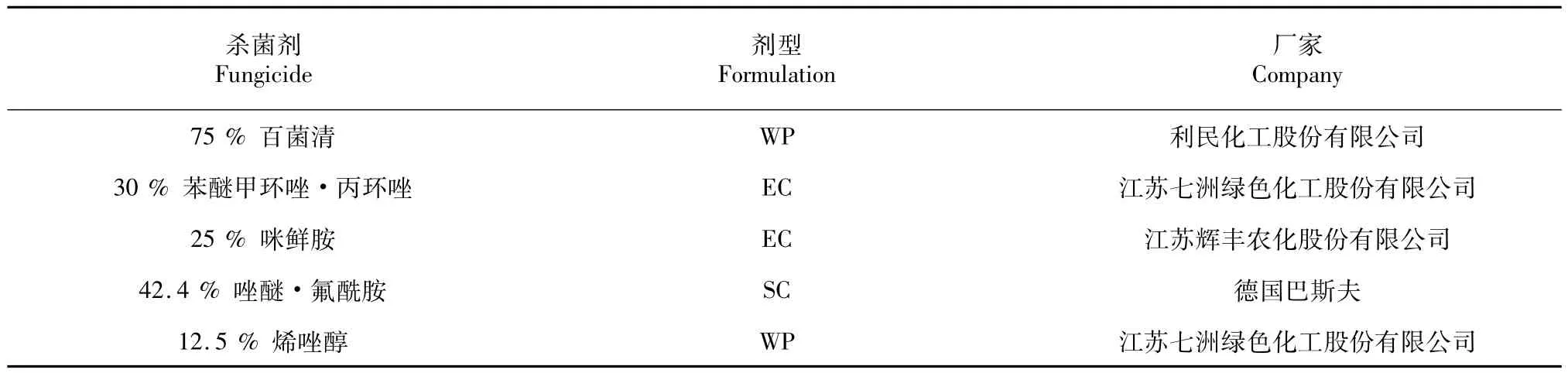
表1 供试药剂Table 1 Tested pesticides
1 材料与方法
1.1 供试材料
病原菌:葡萄座腔菌(Botryosphaeria dothidea),猕猴桃产区采样分离、鉴定所得。供试生防菌株:共20株木霉(Trichoderma spp.),于产区采集猕猴桃植株根际土样,分离纯化所得,部分菌株由四川农业大学植病系提供。培养基:PDA(马铃薯葡萄糖固体培养基)。供试药剂见表1。
1.2 试验方法
1.2.1 木霉对葡萄座腔菌的对峙培养菌块的制备:取分离获得的葡萄座腔菌和木霉,分别接种于PDA平板培养基上,于25℃培养箱中培养3 d,然后用直径5 mm的已经灭菌的打孔器在菌落边缘打取菌块备用。对峙培养:在直径9 cm的PDA平板培养基上,在相距3 cm处分别接入上述制备好的木霉菌块和葡萄座腔菌块,将两菌株菌片同时接种到PDA平板上,以单独接种各供试菌的菌块为对照,置于培养箱中25℃黑暗培养3 d。每处理设3个重复,定期观察葡萄座腔菌的生长情况,记录生长直径[15]。

1.2.2 木霉难挥发性代谢产物对葡萄座腔菌的拮抗作用圆盘滤膜法测定:铺无菌玻璃纸于PDA平板上,在玻璃纸中央接种直径为5 mm的木霉菌块,28℃恒温培养。设置3个重复。待木霉菌丝长满玻璃纸前,将玻璃纸移去。在平板中央接种已活化的葡萄座腔菌块,28℃下恒温培养。以不接木霉菌块的PDA平板接种葡萄座腔菌作对照。培养到预定时间后,取出培养皿测量菌落直径,每个菌落用十字交叉法测量直径2次,取平均值。
1.2.3 5种杀菌剂对葡萄座腔菌的毒力测定采用杀菌剂室内生长速率法测定。将PDA培养基加热融化,待其冷却至40~45℃,添加链霉素(浓度1 %)3.3 mL/L后分别配置药剂的母液,母液分别用定量无菌水稀释成所需浓度,加入到冷却的培养基中,制成含不同浓度药剂的含药培养基,充分摇匀后倒入培养皿(培养皿直径为9 cm)。加入等体无菌水的PDA平板为对照。培养基凝固后,用打孔器(5 mm)制取已活化的菌饼,菌丝面朝下接种于含药培养基中央,每种农药稀释成5个浓度梯度,每个处理3次重复,置于25℃恒温培养箱内光照培养,5 d后十字交叉测量供试病菌在含不同药剂的培养基上的菌落直径,与对照比较计算各药剂处理对菌落扩展的生长抑制率。
1.2.4 毒力方程的计算将药剂对菌丝的抑制率转换成机率值(Y),药剂各浓度(μg/mL)转换成对数值(X),然后进行线性回归分析,求出毒力回归方程Y=A+BX和相关系数,最后计算出各药剂对病菌菌丝生长的抑制中浓度(EC50)。分析比较不同杀菌剂对供试病菌菌丝生长速率的影响。
2 结果与分析
2.1 木霉对葡萄座腔菌的抑制作用
从表2可看出,供试的20株木霉对葡萄座腔菌菌丝生长均有一定的抑制作用,此批菌株抑制率50 %以上的占90%,其中菌株T156-37的抑制率极显著大于其他菌株,达到66.11%,抑制效果最差的是菌株T143-12,其抑制率为44.56%。
2.2 木霉难挥发性代谢产物对葡萄座腔菌的抑制作用
从表3可看出,供试的20株木霉产生的难挥发性代谢产物对葡萄座腔菌菌丝生长均有一定抑制作用。抑制率50%以上的菌株占35%,其中木霉菌株T163-8抑制率极显著高于其它菌株,达到63.82 %,菌株T7-17抑制效果最差,抑制率只有28.75%。比较对峙培养,代谢产物对病原菌的抑制效果不尽相同,存在明显差异。
在简东亮的眼里,李若什么都好,长得漂亮,性格开朗,工作也很努力上进。只是有一点让简东亮不理解,那就是李若对鞋子有着狂热的嗜好,她可以忍饿挨冻,但鞋子不能不买。
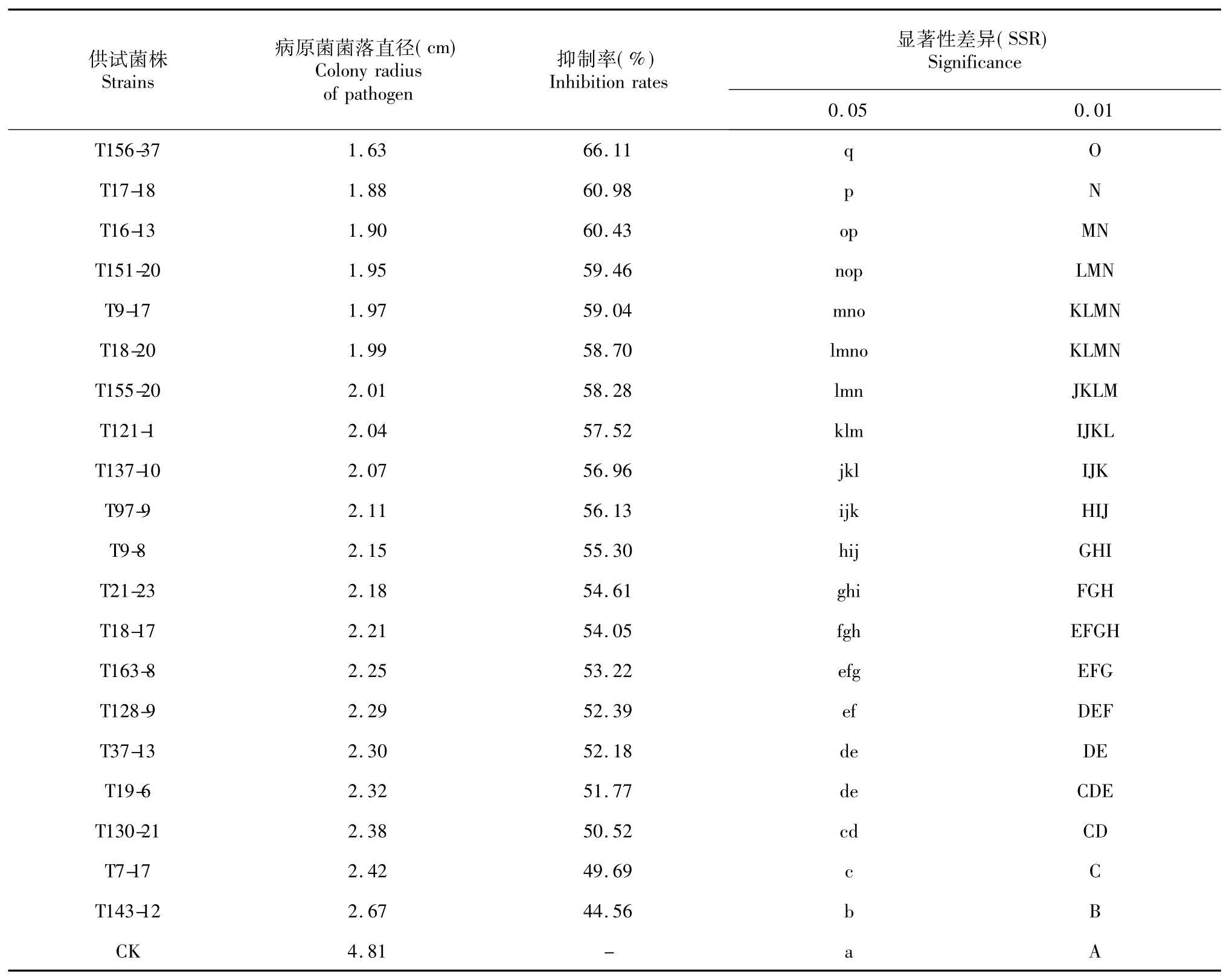
表2 木霉对葡萄座腔菌(Botryosphaeria dothidea)的抑制率Table 2 Inhibition rate of Trichoderma on Botryosphaeria dothidea
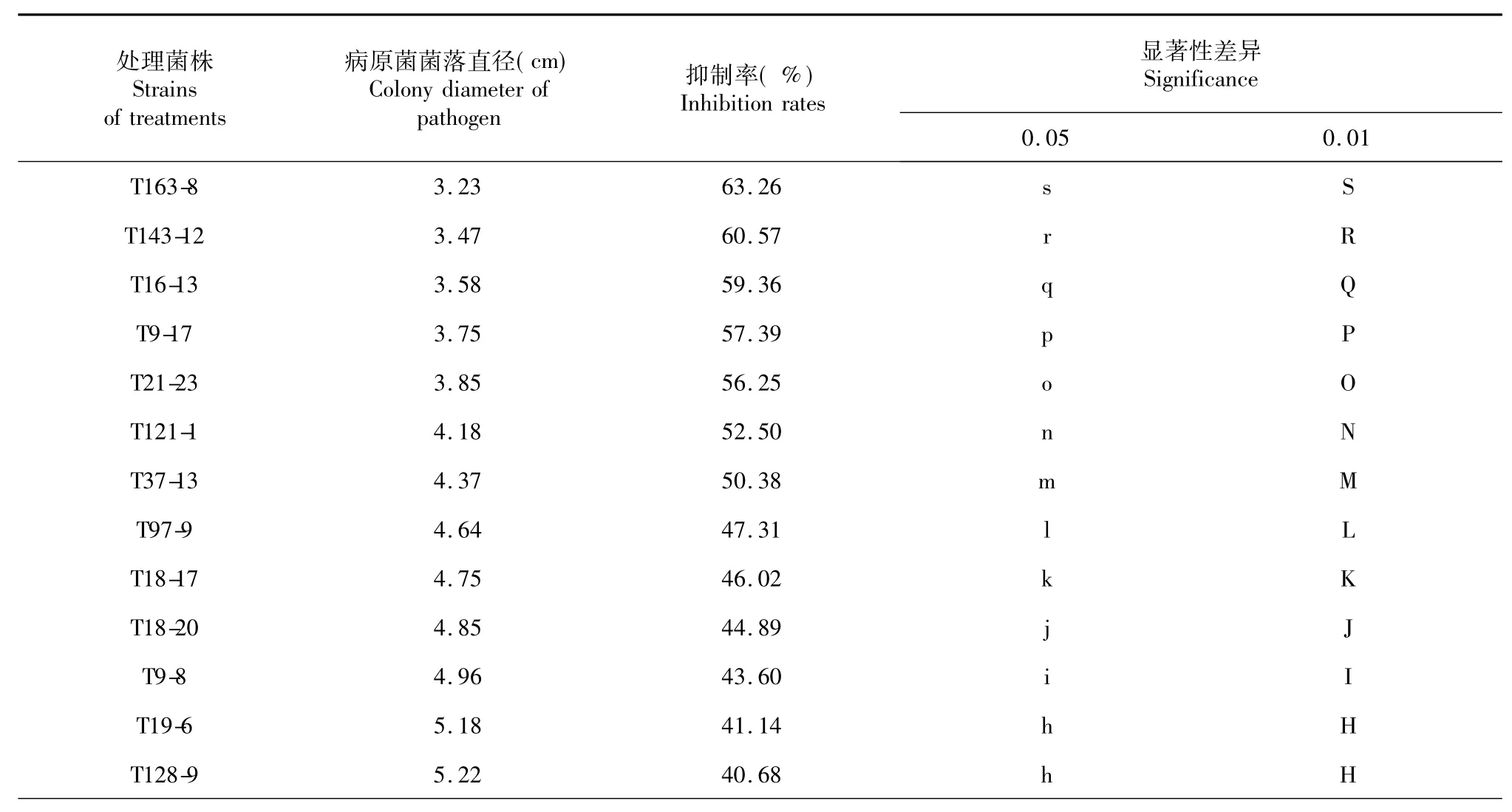
表3 木霉难挥发性代谢产物对葡萄座腔菌(Botryosphaeria dothidea)的抑制率Table 3 Inhibition rate of Trichoderma difficult volatilemetabolites on Botryosphaeria dothidea
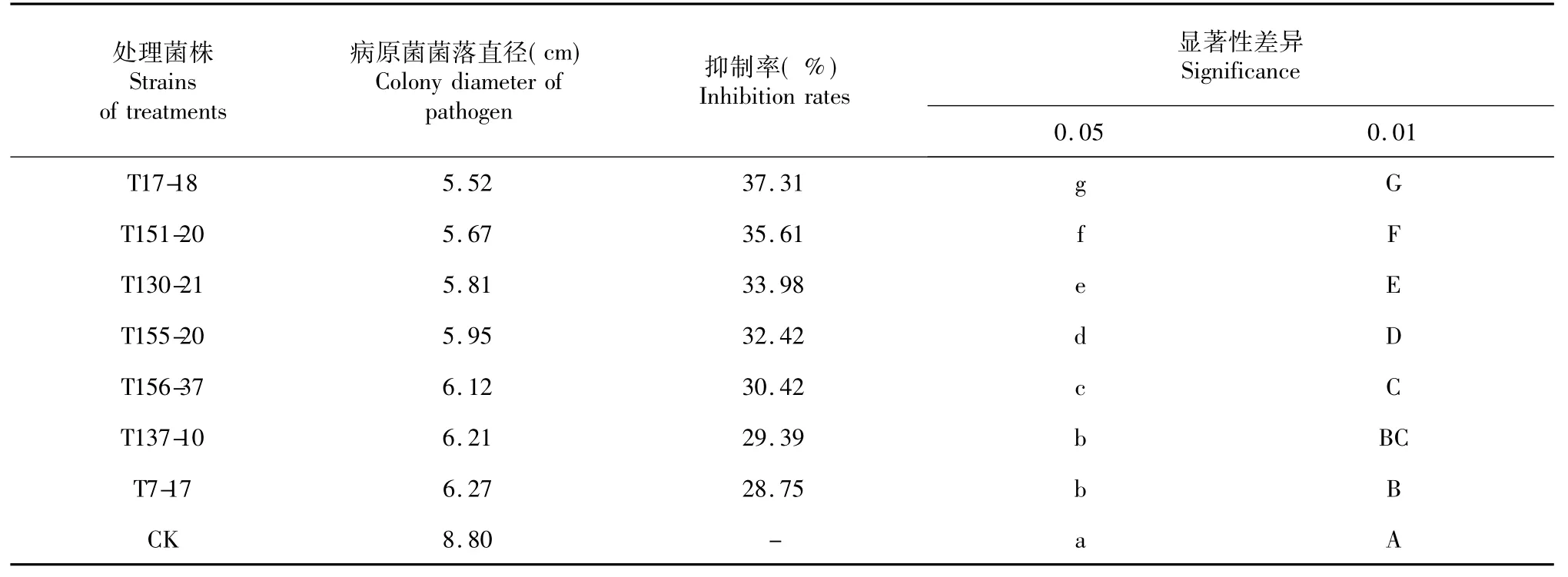
续表2 Continued table 2

表4 5种杀菌剂对葡萄座腔菌(Botryosphaeria dothidea)的毒力测定Table 4 Virulence of tested 5 kinds of fungicides to pathogen of Botryosphaeria dothidea
2.3 种杀菌剂对葡萄座腔菌的毒力测定
供试药剂对葡萄座腔菌菌丝生长均具有不同程度的抑制作用。药剂EC50的大小是衡量药剂毒力大小的指标,药剂EC50越小说明该药剂的毒力越强。对葡萄座腔菌杀菌能力最强的是25%咪鲜胺EC,其EC50为0.3825μg/mL,其次是30%苯醚甲环唑.丙环唑EC,EC50为10.2351μg/mL,42.4%唑醚.氟酰胺SC的杀菌效果最差,75%百菌清WP和12.5%烯唑醇WP杀菌效果一般。
3 结论与讨论
3.1 木霉对葡萄座腔菌的拮抗作用
通过木霉与葡萄座腔菌对峙培养试验结果表明菌株T156-37对葡萄座腔菌的抑制效果最好,抑制率达到66.11%。此批试验菌株系经过初筛后的菌株,均有一定的抑制效果,但不同木霉菌株对同一葡萄座腔菌株生防效果也存在显著性差异,一定程度上可以说明木霉菌寄生专化性。因此,在木霉菌的生物防治应用中,须针对不同的病原菌采用不同的木霉菌株。相关研究报道[16],木霉的存在多种拮抗机制,并且几种作用方式或是协同或是单一,但就哪种作用方式占主导地位,还需通过后续试验研究论证,以找到准确的抗性机制,为研制有效木霉菌生防菌提供依据。
3.2 木霉难挥发性代谢产物对葡萄座腔菌的抑制作用
木霉在生命活动中能够产生抗真菌的代谢产物。木霉菌株T163-8的代谢产物对葡萄座腔菌的抑制作用最好,抑制率达到63.26%。不同木霉菌株间的防治效果有显著性差异,可能是由于不同木霉菌株的代谢产物含量、成分存在差异,或者由于木霉菌存在不同的生理小种而产生不同作用性质的代谢物,从而引起抑制效果呈显著性差异。此次试验还发现有些木霉菌株及其难挥发性代谢物对葡萄座腔菌的抑制效果都比较好,而有些菌株与其产生的代谢产物抑制效果呈负相关,说明生防菌株及其代谢产生之间的关系值得进一步研究。
3.3 杀菌剂对葡萄座腔菌的毒力测定
参考文献:
[1]王瑞玲.红阳猕猴桃采后病害生理及其臭氧保鲜技术研究[D].四川农业大学,2010.
[2]黄炎.姚志武.猕猴桃病虫害的发生与防治[J].现代农业,2007(3):45-29.
[3]周游.猕猴桃软腐病病原鉴定及其毒素获取方法研究[C].北京:中国农业科学技术出版社,2012.
[4]余桂萍.猕猴桃软腐病的发生规律与防治初探[J].资源开发与市场,2009,25(5):392-292.
[5]金玲莉,陈东元,涂娟,等.猕猴桃主要病害及其综合防控技术[J].现代园艺,2013(1):157-159.
[6]褚福林.猕猴桃软腐病防治技术[J].科学种植,1996(5):23-26.
[7]Katumoto K.Two new species of Eudarluca hyperparastitic to Botryosphaeria[J].Transactions of the Mycologucal Society of Japan,1986,27(1):11-16.
[8]Morehart A L.The occurrence of calatisoirium parasiticum on isolates of Botryosphaeria qurecuum from oak trees in Delaware[J].Plant Disease,1994,78:98-101.
[9]M.A.Manning,X.Meier,T.L.Olsen,et al.Fungi associated with fruit rots of Actinidia chinensis’Hort16A’in New Zealand,New Zealand[J].Journal of Crop and Horticultural Science,2003,31: 315-324.
[10]De Gara L,de Pinto M C,Tommasi F.The antioxidant systems visà-vis reactive oxygen species during plantpathogen interaction[J].Plant Physiology Biochemisity,2003,41(10):863-870.
[11]T.Thomidis,E.Exadaktylou.First Report of Botryosphaeria dothidea Causing Shoot Blight of Kiwifruit(Actinidia deliciosa)in Greece[J].Plant Disease,2010(94)12:1053.
[12]杜戈.猕猴桃果实软腐病的防治[J].河南林业,2000(4): 67-70.
[13]向玉英.杨树重要病害生物防治探讨[J].植物病理学报,1984,14(1):8.
[14]徐同,钟静萍,李德葆.木霉对土传病原真菌的拮抗作用[J].植物病理学报,1993,23(1):36-37.
[15]方中达.植病研究方法[M].北京:中国农业出版社,1988.
[16]王芊.木霉菌在生物防治上的应用及拮抗机制[J].黑龙江农业科学,2001(1):41-43.
[17]李诚,蒋军喜,冷建华,等.6种杀菌剂对猕猴桃主要腐烂病菌的室内毒力测定[J].中国南方果树,2012,41(1):27-29.
(责任编辑 陈虹)
Prelim inary Study on Control Efficiency against Soft Rot Disease of K iw ifruit in Sichuan
HU Rong-ping1,SHI Jun2,LIN Li-jin3,YE Hui-li1*,YAO Lin1,ZHOU You3
(1.Institute of Plant Protection,Sichuan Academy of Agricultural Sciences/Key Laboratory of Integrated Pest Management on Crops in Southwest,Ministry of Agriculture,Sichuan Chengdu 610066,China;2.Mianyang Academy of Agricultural Sciences,Sichuan Mianyang 621023,China;3.Institute of Pomology and Olericulture,Sichuan Agricultural University,Sichuan Chengdu 611130,China)
Trichoderma spp.,as the biocontrol selectionmaterial,wasused to focuson the biocontrol of kiwifruit soft rot(Botryosphaeria dothidea)in thisexperiment,the confrontation culture of T.spp.and itsantagonistic testson non-volatilemetaboliteswere conducted,and the virulence of five kinds of fungicides to pathogen were determined to provide a reference for the biochemical and chemical control of kiwifruit soft rot.The results showed that the strain T156-37 had the best antagonistic effects on B.dothidea,and the inhibition rate reached 66.11 %.The inhibition rate of non-volatilemetabolites in Trichoderma strain T163-8 was63.26%.The 25%prochloraz in the indoor test resultswere significant,followed by the30%difenoconazoleyl.propiconazole,which EC50(μg/mL)were0.3825 and 10.2351,respectively.
Kiwifruit;Soft rot disease;Trichoderma spp.;Biocontrol control;Toxicity assay
S436.634
A
1001-4829(2017)2-0366-05
10.16213/j.cnki.scjas.2017.2.021
2016-01-30
四川省应用基础项目“猕猴桃软腐病菌遗传多样性及致病力、抗性评价体系研究”(2013JY0115);四川省科技支撑项目“利用荧光定量PCR技术建立猕猴桃软腐病检测预测体系”(2015NZ0036);四川省创新能力提升工程项目“四川猕猴桃储藏期病害主要种类、发生特点及防治技术研究”(2014CXSF-018)
胡容平(1980-),男,四川营山人,硕士,助理研究员,主要从事植物病害的研究,*为通讯作者,E-mail:44573780 @qq.com。
