应用正交试验优化猪细小病毒N株在IBRS-2细胞转瓶培养
2017-04-13卢冰霞何颖赵武梁家幸段群棚蒋冬福卢敬专闭炳芬周英宁秦毅斌李斌苏乾莲陈忠伟
卢冰霞,何颖,赵武,梁家幸,段群棚,蒋冬福,卢敬专,闭炳芬,周英宁,秦毅斌,李斌,苏乾莲,陈忠伟
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁530001)
应用正交试验优化猪细小病毒N株在IBRS-2细胞转瓶培养
卢冰霞,何颖,赵武,梁家幸,段群棚,蒋冬福,卢敬专,闭炳芬,周英宁,秦毅斌,李斌,苏乾莲,陈忠伟*
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁530001)
利用正交试验对猪细小病毒(PPV)N株在IBRS-2细胞转瓶培养中的培养条件进行优化,为PPV N株弱毒疫苗的大量培养工艺提供参考。设细胞培养液pH值(7.0、7.2和7.4)、接毒时间(0、24和48 h)、接毒剂量(0.10%、1.00%和10.00%)、收毒时间(48、72和96 h)等因子和水平。结果表明,PPV N株转瓶培养的最佳培养条件组合为细胞培养液pH值7.2,采用同步接毒,接毒剂量为0.10%,收毒时间为接毒后96 h。其中收毒时间是影响PPV N株毒价的最主要因素。
猪细小病毒;转瓶培养;优化;正交试验
猪细小病毒(Porcine parvovirus,PPV)是细小病毒科细小病毒属的成员,属于自主复制型病毒,是引起母猪繁殖障碍性疾病的最重要病原之一[1]。PPV直接导致感染母猪流产、早产、产死胎、木乃伊胎、早期胚胎死亡、不育以及新生仔猪的大量死亡、仔猪的皮炎和腹泻[2]。1967年PPV感染首发于英国,随后世界各个国家均有流行和报道。目前,我国PPV感染十分严重,抗体阳性率高达90%以上。PPV主要通过消化道、呼吸道和生殖道传播感染,猪是本病唯一的易感动物[3]。由于PPV分布非常广泛,且对热稳定,因此对大部分消毒剂不敏感,污染的圈舍至少在4个月内仍具感染性,难于根除[4]。PPV一旦传入阴性猪场,几乎3个月内100%的猪只均会受到感染,且发生该病后猪场可能连续几年都会不断地出现母猪繁殖失败[5-6]。近年来,该病的发病率呈上升趋势,不仅造成养殖户的巨大经济损失,甚至严重影响养猪产业发展。PPV N株是广西兽医研究所从广西初产母猪所产死胎脏器中分离到自然弱毒株并研发成免疫疫苗毒株,用该毒株免疫怀孕母猪,不产生病毒血症,并能抵抗强毒的攻击[7]。有关研究结果表明,该疫苗株能使猪产生良好的抗体反应,且对母猪安全无害[8]。PPV N株是PPV弱毒疫苗理想的候选毒株之一。本研究从细胞培养液pH值、接毒时间、接毒剂量、收毒时间入手,研究四个因素对于PPV N株毒价影响的主次关系,进一步优化转瓶培养工艺、提高PPV N株毒价,以期筛选到最佳工艺组合,为PPV N弱毒疫苗的大量培养工艺提供参考性数据。

表1 PPV N株培养工艺优化正交试验设计Table 1 Optimization of orthogonal experiment design for cultivation of PPV N strain
1 材料与方法
1.1 试验材料
供试IBRS-2细胞,购于中国典型培养物保藏中心,已在广西兽医生物技术重点实验室进行扩增冻存。PPV N株由广西兽医研究所病毒室保存,毒价为104.4TCID50/mL。MEM培养基购自美国Gibco公司,小牛血清购自杭州四季青公司。
1.2 试验方法
根据前期预试验的结果,选取对PPV N株毒价影响较大的4个因素:培养液pH值(A)、接毒时间(B)、接毒剂量(C)、收毒时间(D)进行4因素3水平的正交试验,试验设计见表1。具体方法如下:选取IBRS-2细胞长至较密单层的10 000 mL转瓶6个,按照1∶3的比例均匀传至18个10 000 mL转瓶中。将18个转瓶IBRS-2细胞随机分组,按照正交试验表分组接毒,共分为9组,每组2个重复。接毒后逐日观察细胞病变(CPE)情况,按照试验设计方案分别收毒,冻融2次,取样,用于毒价的测定。
1.3 病毒毒价的测定
优化PPV N株在IBRS-2细胞转瓶培养条件,并收获PPV N株病毒液进行2次毒价测定,最后取毒价指数的平均值,作为该样品的毒价。
毒价测定方法如下:按照常规方法培养IBRS-2细胞,将消化后的细胞铺于5块96孔细胞培养板上,长满单层后弃去培养液,稀释至10-3~10-8倍后,取经维持液稀释好的病毒样品,加入上述96孔板,每个稀释度8个重复,每孔100μl,置于5% CO2培养箱培养96 h,逐日观察CPE,计算TCID50。
1.4 数据分析
利用极差分析方法,对培养液不同pH值、不同接毒时间、不同接毒剂量和不同收毒时间等组合的累加毒价、平均毒价进行计算,从而计算各组内平均毒价的最大差距,即极差数值(R),根据各组间极差的大小,判断出各因素对毒价的影响程度。利用SPSS软件进行方差分析,了解四因素对试验结果有无显著性影响,从而得出PPV N株在IBRS-2细胞转瓶培养最佳条件组合。
1.5 重复性试验
以正交试验确定的最佳培养条件组合,对PPV N株在IBRS-2细胞上进行转瓶培养,收获病毒液进行毒价测定,试验重复3次。
2 结果与分析
2.1 正交试验结果与直观分析
从正交试验结果(表2)分析可知,4种因素的影响程度分别为收毒时间(R值=0.62)>接毒时间(R值=0.11)>接毒剂量(R值=0.07)=培养液pH值(R值=0.07)。因此,对毒价影响的主次因素依次为收毒时间、接毒剂量、接毒时间和培养液pH值。
另外通过对比各因素下各水平下的PPV N株毒价均值可知,直观最佳组合条件为A2B1C1D3,即培养液pH值为7.2,接毒时间为0 h(也称为同步接毒),接毒剂量为0.10%,收毒时间为96 h。
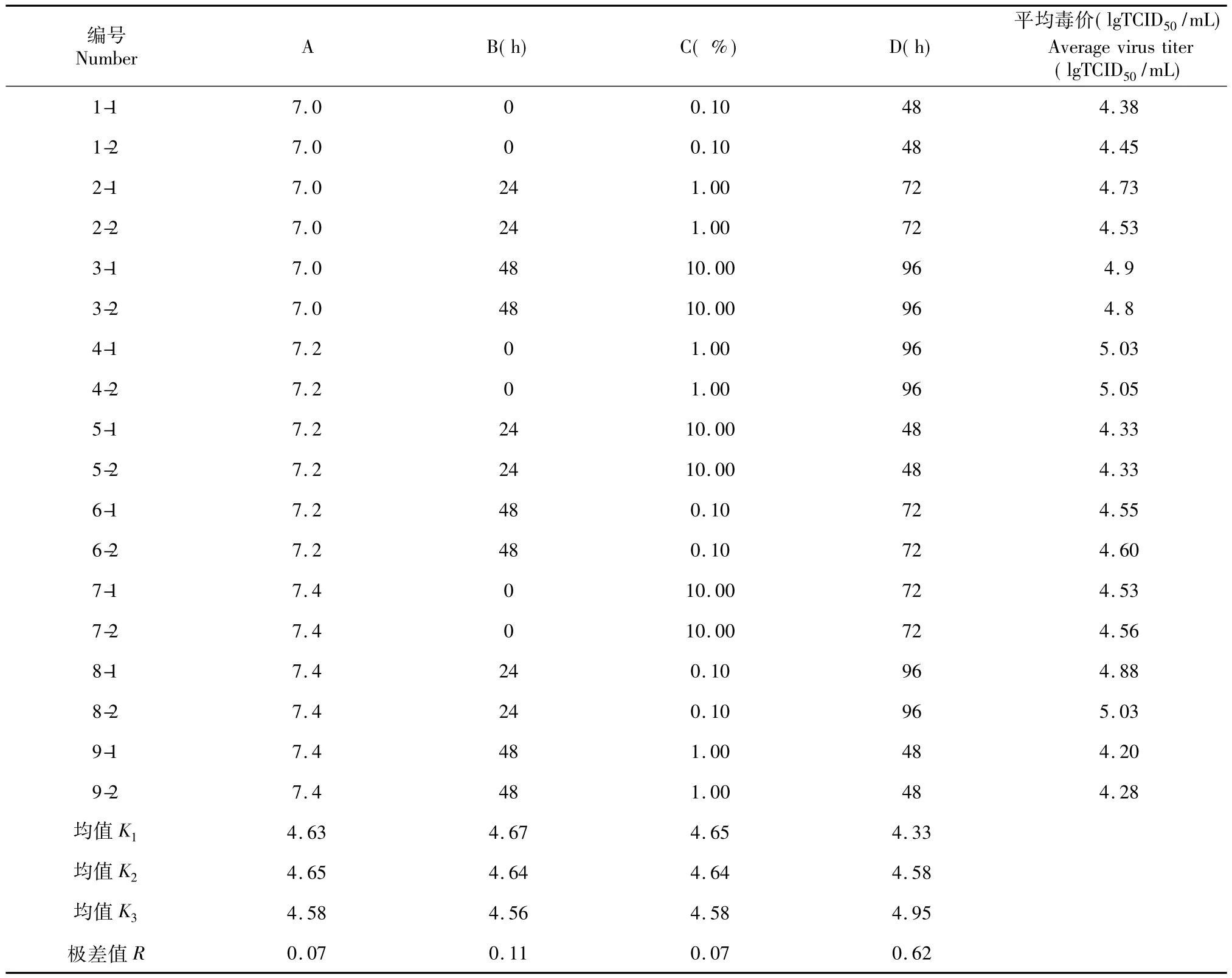
表2 正交试验结果Table 2 The results of orthogonal experiment
2.2 方差分析
从方差分析结果(表3)可知上述四因素P值均大于0.05,对试验结果均无显著性影响,因此确定直观最佳条件组合A2B1C1D3即培养液pH值为7.2,接毒时间为0 h(也称为同步接毒),接毒剂量为0.10%,收毒时间为96 h为理论最佳条件组合。
2.3 重复性试验结果
根据理论最佳条件组合A2B1C1D3即培养液pH值为7.2,接毒时间为0 h(也称为同步接毒),接毒剂量为0.10%,收毒时间为96 h进行3次重复试验。试验结果(表4)可知,3次试验的病毒滴度分别为5.08、5.10、5.03 lgTICID50/mL,滴度平均值为5.07 lgTICID50/mL,变异系数为0.71%,说明优化的试验条件具有较好的重复性。
3 讨论
有关研究表明,PPV的复制须依靠细胞有丝分裂时期的一些酶的辅助,所以接种PPV要求在细胞进行传代的同时,或者细胞长到1/3的时候接种,但最迟不能晚于生长到2/3时进行接种[9]。多数研究者采取同步接毒的方法进行PPV培养,均得到较好的增殖效果。但倪娇等用同步接种和待细胞约长至1/3时的分步接种法比较PPV(长春株)在PK15细胞中的增殖时,发现分步接种法比同步接种法获得的病毒血凝效价和TCID50均稍微偏高[10]。本研究将PPV N株以同步接种、传代后24 h接毒和传代后48 h接毒3种接毒条件进行对比,结果表明同步接种方式收获病毒液的病毒含量高于其他两种,与其他多数研究者的研究结果相符。分析这可能与PPV增殖时需要利用细胞S期DNA聚合酶有关[11]。
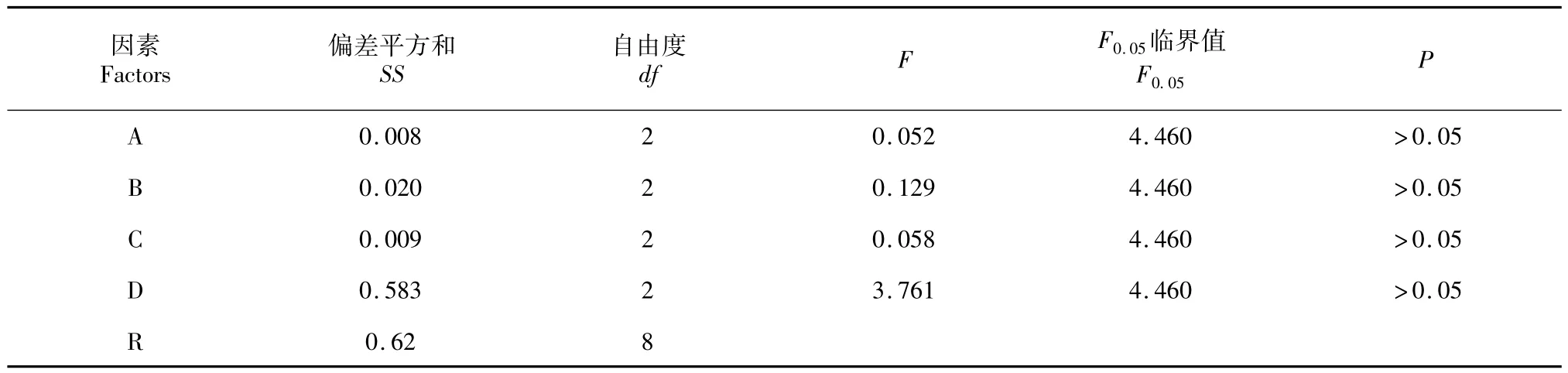
表3 方差分析Table 3 Analysis of variance

表4 重复性试验Table 4 Reproducibility test
本研究对比分析3种不同的接毒剂量对PPV N株增殖的影响,结果表明以0.10%的接毒剂量接毒时,收获病毒液中的病毒含量最高。分析可能是由于接毒剂量高时,病毒液中含有较多的细胞的代谢产物、挥发性产物,反而不利于细胞生长和病毒增殖。
PPV病毒培养中,获得高含量病毒液的关键因素之一是病毒收获时间的确定。收毒时间过早,病毒增殖不够充分;收毒过晚而使部分病毒衰灭,从而导致收获病毒的含量降低。本研究比较了病毒接毒后48、72和96 h3种不同的收毒时间条件下,收获的病毒液中病毒含量的高低。结果表明,接毒后96 h收获的病毒液中病毒含量明显高于其他两个收毒时间。
本研究应用正交试验获得了PPV N株在IBRS-2细胞上的转瓶培养的最佳条件组合,将病毒毒价从104.4TCID50/mL提高到105.07TCID50/mL左右,提高了病毒的增值效率,且具有较好的重复性,为PPV弱毒疫苗的开发提供了可参考性数据。
4 结论
研究结果表明,PPV N株在IBRS-2细胞上转瓶培养的最佳条件组合为:细胞培养液pH值为7.2,采用同步接毒,接毒剂量为0.10%,收毒时间为接毒后96 h。其中收毒时间是影响PPV毒价的最主要因素。
[1]Ellis JA,Bratanich A,Clark E,etal.Coinfection by porcine circoviruses and porcine parvovirus in pigswith naturally acquired postweaningmultisystemic wasting syndrome[J].JVet Diag Invest,2000,12 (1):21-27.
[2]Opriessnig T,Fenaux M,Yu S,etal.Effectof porcine parvovirus vaccination on the developmentof PMWS in segregated earlyweaned pigs coinfected with type2 porcine circovirusand porcine parvovirus[J].Vet Microbiol,2004,98(3-4):209-220.
[3]阮景军.重新评估猪细小病毒的危害性[J].畜牧兽医杂志,2007,26(4):54-56.
[4]张超范,崔尚金,戚亭,等.猪细小病毒细胞适应株的培育及鉴定[J].中国预防兽医学报,2008,30(5):362-366.
[5]Bican J,Svoboda S,Drabek J.Porcine parvovirus infection in boars in the czech republic[J].Acta Veterinaria Brno,2002,71(1):45-49.
[6]Shackelton L A,Hoelzer K,Parrish C R,et al.Comparative analysis reveals frequent recombination in the parvoviruses[J].The Journal of General Virology,2007,88(Pt12):3294-330.
[7]蒋玉雯,黄安国,郑儒标,等.猪细小病毒N株的生物学和免疫学特性研究[J].畜牧兽医学报,1992,23(1):73-79.
[8]白安斌,杜坚,姚瑞英,等.猪细小病毒N株弱毒苗田间试验[J].广西畜牧兽医,2006,22(6):248-250.
[9]殷华平,郭万柱,徐志文,等.猪细小病毒(PPV)SC1株的分离鉴定[J].黑龙江畜牧兽医,2006(7):63-65.
[10]倪娇,赵建增,刘长辉,等.猪细小病毒在PK15细胞中增殖规律的研究[J].中国兽药杂志,2009,43(1):21-24.
[11]姚龙涛.猪病毒病[M].上海:上海科学技术出版社,2000:216-217.
(责任编辑 汪羽宁)
Optim ization of IBRS-2 Cells Culturing Condition for Cultivation of Porcine Parvovirus N Strain Using Roller Bottle
LU Bing-xia,HE Ying,ZHAOWu,LIANG Jia-xing,DUAN Qun-peng,JIANG Dong-fu,LU Jing-zhuan,BIBing-fen,ZHOU Ying-ning,QIN Yi-bin,LIBin,SU Qian-lian,CHEN Zhong-wei*
(Guangxi Veterinary Research Institute/Guangxi Key Laboratory of Veterinary Biotechnology,Guangxi Nanning 530001,China)
The orthogonal design was used to optimize the culture conditions,of PPV N strain in IBRS-2 cell cultivated in roller bottles to provide reference for themass culture of PPV N attenuated vaccine.Affected factorswere as follows:the pH value(7.0,7.2,7.4),the time of inoculation(0,24,48h),the dose of toxin(0.10%,1.00%,10.00%)and the time of harvesting(48,72,96 h).Results showed that the best culture conditions of PPV N strain IBRS-2 cells cultivated in roller bottleswere as follows:pH=7.2,synchronization inoculation,0.10%inoculation dose,harvesting the virus solution 96 h after inoculation.Virus solution harvest time is themost important factor affecting the virus titer of PPV N strain.
Porcine parvovirus;Cells culture using roller bottle;Optimize;Orthogonal experiment
S855.3
A
1001-4829(2017)2-0470-04
10.16213/j.cnki.scjas.2017.2.038
2016-12-05
广西公益性科研院所基本科研业务费专项项目(桂科专项15-2,桂科专项16-2);广西水产畜牧科技项目(桂渔牧科201528030,201633034)
卢冰霞(1986-),女,广西桂平人,硕士,助理研究员,主要从事动物病毒学研究工作,E-mail:lubingxia13@163.com,*为通讯作者,E-mail:chen zhong-wei@163.com。
