KAP16基因对细毛羊重要经济性状的遗传效应分析
2017-04-13何军敏黄锡霞田可川赵冰茹柏妍田月珍徐新明付雪峰
何军敏,黄锡霞,田可川,赵冰茹,柏妍,田月珍,徐新明,付雪峰
(1.新疆农业大学动物科学学院,新疆乌鲁木齐830052;2.新疆畜牧科学院畜牧研究所,分子遗传重点实验室,新疆乌鲁木齐830011)
KAP16基因对细毛羊重要经济性状的遗传效应分析
何军敏1,2,黄锡霞1*,田可川2*,赵冰茹1,柏妍2,田月珍1,徐新明2,付雪峰2
(1.新疆农业大学动物科学学院,新疆乌鲁木齐830052;2.新疆畜牧科学院畜牧研究所,分子遗传重点实验室,新疆乌鲁木齐830011)
为了分析KAP16基因的遗传多态性,获取相关毛性状的DNA标记,为细毛羊在分子育种上提供依据,采用重测序技术和PCR-SSCP技术,验证KAP16候选基因的2个SNPs在中国美利奴(新疆型)群体中的遗传多态性。同时,运用SAS 8.1软件进行最小二乘方差分析方法,研究其与毛性状的关联性。结果表明,C41006938T突变点得到3种基因型为AA、AB和BB型,该群体中C41006938T突变点基因型频率为0.22、0.47和0.31;A和B等位基因频率为0.46和0.54,其中B等位基因为优势等位基因。T41007938C基因位点AA和AB基因型频率为0.77和0.23;A和B等位基因频率分别为0.89和0.11,A基因为优势等位基因。χ2检验表明,C41006938T和T41007938C位点均处于哈代温伯格平衡状态(P>0.05)。C41006938T和T41007938C突变位点的多态信息含量分别为0.37和0.18,所以中国美利奴(新疆型)群体在该基因的遗传变异处在中等水平。C41006938T不同基因型对体格大小和鉴定时体重有显著影响(P<0.05);T41007938C不同基因型对纤维直径纤维直径变异系数有极显著影响(P<0.01),对剪毛量和弯曲有显著影响(P<0.05);C41006938T和T41007938C组合基因型对剪毛量有极显著影响(P<0.01),对纤维直径纤维直径变异系数有显著影响(P<0.05)。
KAP16基因;SNPs;细毛羊;关联性分析
我国是世界纺织业发达国家之一,尤其对羊毛加工的需求量很大,而细羊毛是主要的精纺原料,尽管其他天然纤维以及随着工业发展涌现出的许多新型合成的纤维分享了细羊毛市场,但细羊毛因其绝缘性、吸湿性、弹性、抗静电、抗皱性等方面的特色优势,始终作为理想精纺加工的首选原料,占纺织原料的17%[1]。
目前,角蛋白和角蛋白相关蛋白是模式生物中主要的结构蛋白,它确定了绒毛的基本性质,如细度、长度、强度、颜色和光泽等。在毛发的形成过程中,一系列的角蛋白和角蛋白关联蛋白还决定了毛囊细胞的分化过程[2]。一个显著的特征是角蛋白基因按家系聚类在染色体结构中并紧密连接在一起,这种紧密的遗传连锁可能是共同作用调控它们表达的结果。羊毛生产性状在品种间、品种内和不同品系间的差异明显受到遗传的影响[3]。本文通过分析KAP16基因的遗传多态性和遗传效应,旨在获取相关毛性状的DNA标记,为细毛羊的育种在分子育种学上提供理论依据。为细毛羊的育种在分子育种学上提供理论依据。冯静、艾买提和玛依拉等人分别研究了绵羊KAP基因和KRT基因多态性与毛性状的相关性[4-8],赵志东、于辉和赵苗等对KAP基因遗传变异与基因性状及其对羊绒性状的影响都有深入研究[9-11]。获取与绵羊相关毛性状的DNA分子标记,并为细毛羊的育种在分子育种学上提供理论依据。羊毛纤维具有高度组织结构,其中毛纤维的90%是由角蛋白中间丝(KRT-RF)和角蛋白关联蛋白(KAPs)构成,这两种蛋白类型通过高度组织分化的方式形成规则的晶状结构,其中KIF蛋白形成纤维丝镶嵌在KAP蛋白基质中,这种规则的晶状结构需要高度协调的遗传调控,然而,这种调控机理还不完全清楚。
1 材料与方法
1.1 试验材料
试验动物为新疆巩乃斯种羊场提供的中国美利奴羊(新疆型),采取416只周岁母羊的毛样与血样。其中鉴定时体重、毛弯曲评分、油汗、体格大小、剪毛后体重、剪毛量等数据由新疆巩乃斯种羊场提供。毛样在羊毛分析实验室检测羊毛的纤维直径、纤维直径变异系数、毛长、细度、弯曲和弯曲数,通过整理共得到832条有效数据。静脉采血3~5 mL,用EDTA抗凝并冷冻保存备用,用于提取DNA,并筛选有羊毛性状鉴定记录的个体样本进行试验。
1.2 试验方法
1.2.1 重测序技术及引物的合成取所测纤维细度数值中的两端极值各15个样本,建立2个DNA池(粗池和细池),由诺禾致源生物公司运用Illunima HiSeqTM2000/MiseqTM软件进行质控分析。引物来自NCBI提供的绵羊基因序列并结合重测序结果,采用Primer Premier 5.0软件设计,由上海生工生物工程有限公司合成,引物序列如表1。
1.2.2 PCR扩增程序的设定见表2。
1.2.3 PCR产物测序经过普通PCR扩增和2%琼脂糖凝胶电泳检测将合格的PCR产物送到上海生工生物工程有限公司进行测序。
1.3 数据统计与分析
对数据进行χ2独立性检验,多态信息含量(PIC),遗传纯合度(Ho),杂合度(He)和有效等位基因数(Ne)的计算
1.4 关联分析模型
通过整理共得到有效数据832条,并对毛性状进行遗传效应分析。运用SAS 8.1统计软件检测不同基因型与毛性状的关联性,并估计最小二乘均值。最小二乘方差分析数学模型:Yijk=u+αi+βj+eijk,式中,Yijk:个体表型记录;μ:群体性状均值;αi:标记基因型效应或标记组合基因型效应;βj:群别效应,eijk:随机误差。
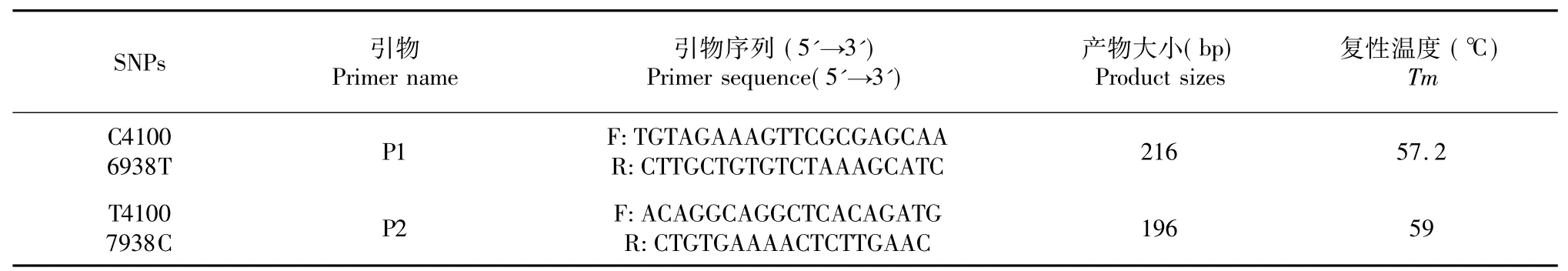
表1 PCR扩增的引物序列Table 1 PCR amplification primer sequence
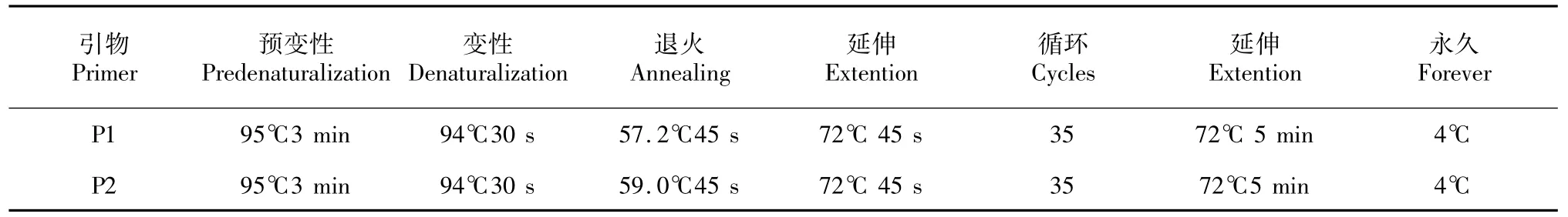
表2 PCR扩增条件Table 2 PCR amplification conditions
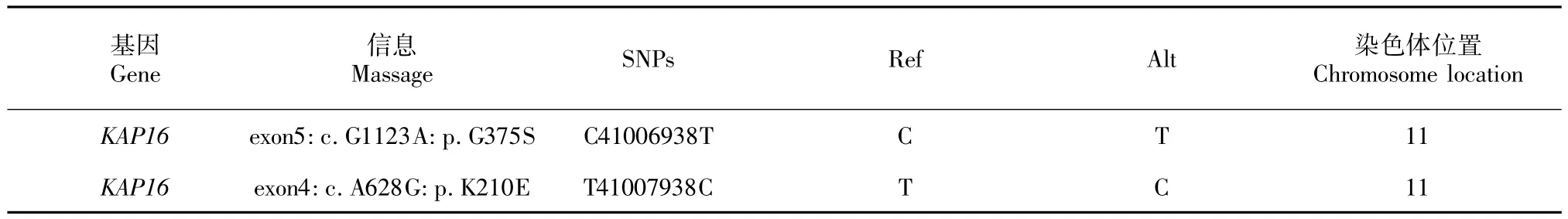
表3 KAP16的重测序结果Table 3 KAP16 sequencing result

图1 DNA的结果Fig.1 Results of DNA

图2 P1的PCR产物Fig.2 PCR products of P1
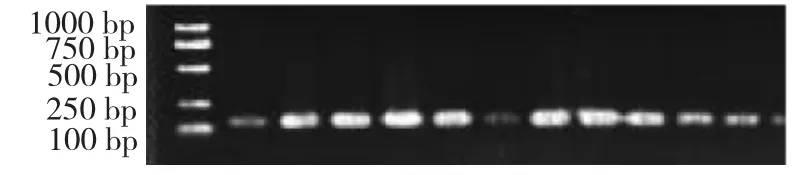
图3 P2的PCR产物Fig.3 PCR products of P2
2 结果与分析
2.1 KAP16的重测序结果
由表3可知,KAP16基因的C41006938T和T41007938C突变位点分别位于11号染色体的第5和4外显子上。
2.2 DNA完整性检测结果
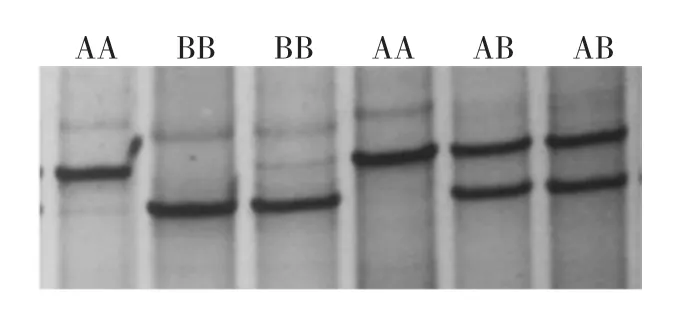
图4 P1的SSCP产物Fig.4 SSCP products of P1
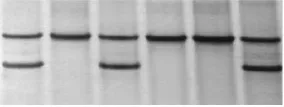
图5 P2的SSCP产物Fig.5 SSCP products of P2
提取基因组DNA模板用1%琼脂糖凝胶电泳检测(图1),实验提取的基因组DNA模板质量良好、纯度高、不需要纯化,可直接用作模板DNA。
2.3 KAP16基因的PCR扩增结果
如图2~3所示,PCR产物经2.0%的琼脂糖凝胶电泳检测,可知KAP16基因P1、P2引物的PCR产物长度为216、196 bp与生物公司提供片段符合。结果表明,KAP16扩增特异性良好,片段长度一致,引物的片段长度符合预期大小,可直接用于PCRSSCP的分析。
2.4 KAP16基因的PCR-SSCP多态性检测结果
如图4~5所示,P1位点存在3种不同的带型,将其命名为AA、BB和AB型;P2位点存在,2种基因型,命名为AA、AB型。
2.5 KAP16基因位点多序列比
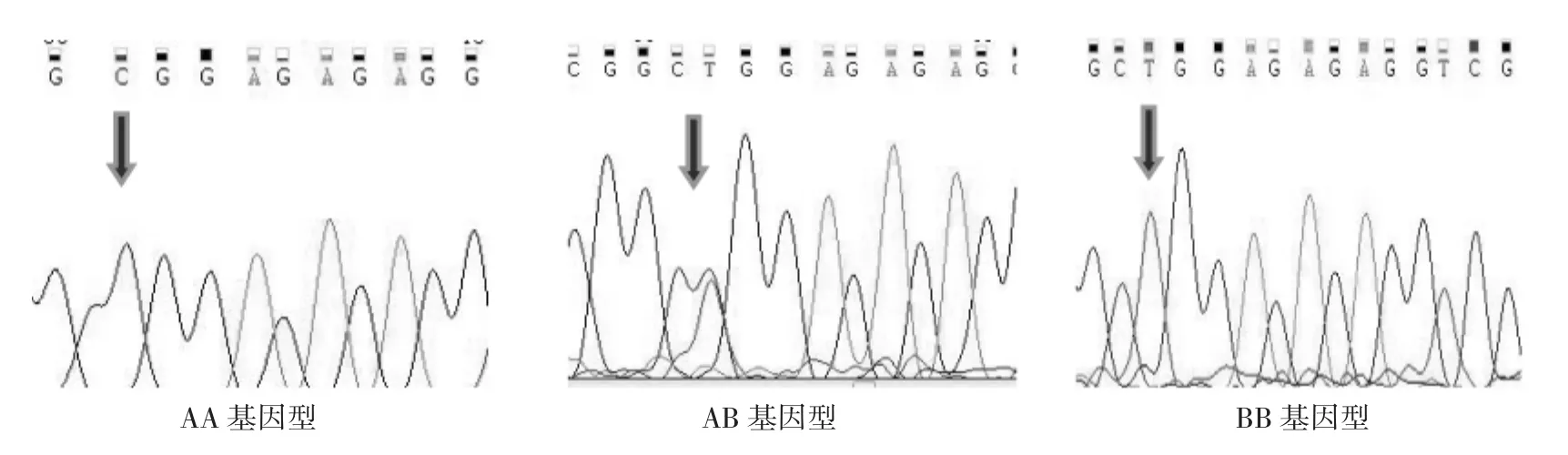
图6 P1突变点不同基因型测序峰图Fig.6 P1 mutation point of different genotype sequencing peak figure
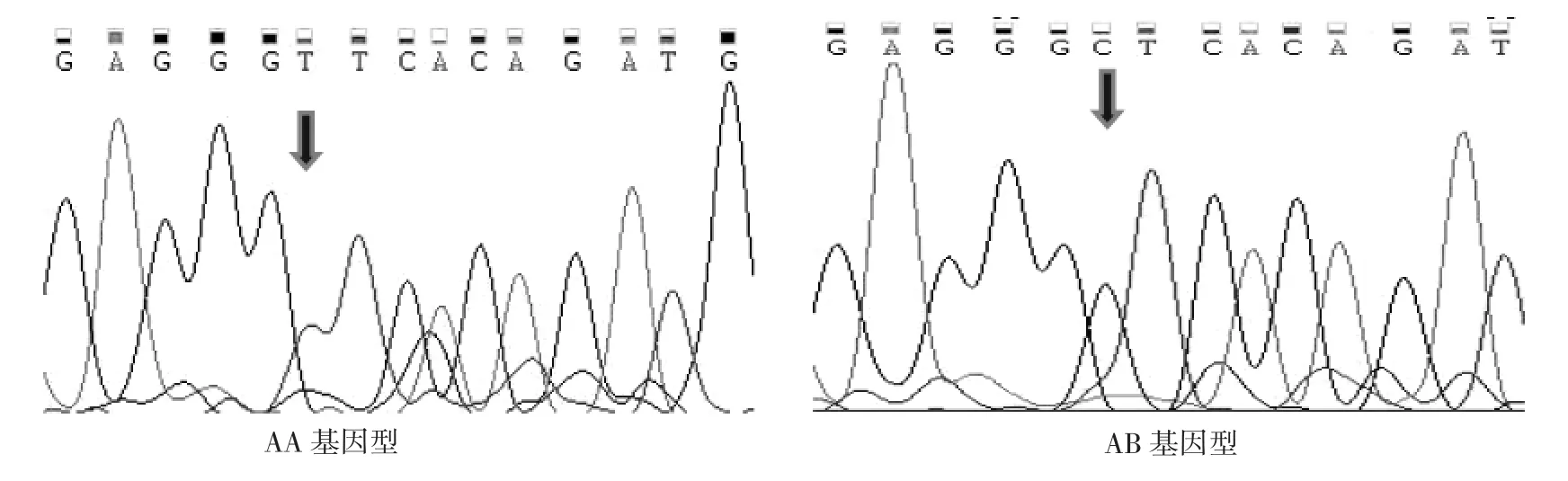
图7 P2突变点不同基因型测序峰图Fig.7 P2 mutation point of different genotype sequencing peak figure
2.5.1 P1位点多序列比对比由图6可知,在中国美利奴羊(新疆型)群体中发现此序列在第5外显子编码区第31 bp发生突变。通过对氨基酸序列的分析发现,其C31T突变点为非同义突变,由Arg (精氨酸)突变为Trp(色氨酸)。
2.5.2 P2位点多序列比对结果及峰图由图7可知,在中国美利奴羊(新疆型)群体中发现该序列在第四外显子处存在编码区第38 bp发生了突变。突变位点为T38C,通过对氨基酸序列的分析发现,其突变点由Val(缬氨酸)突变为Ala(丙氨酸)。
2.6 KAP16的遗传多态性分析
由表4可知,该群体中C41006938T突变点的AB基因型为优势基因型,B基因是优势等位基因; T41007938C基因的AA基因型是优势基因型,A基因是优势等位基因。卡方检验表明,C41006938T和T41007938C位点均处Hardy-Weinberg平衡状态(P>0.05)。中国美利奴(新疆型)群体中C41006938T和T41007938C突变点的PIC为0.37,0.18均属于中度多态,因此中国美利奴(新疆型)群体的遗传变异居于中等水平。
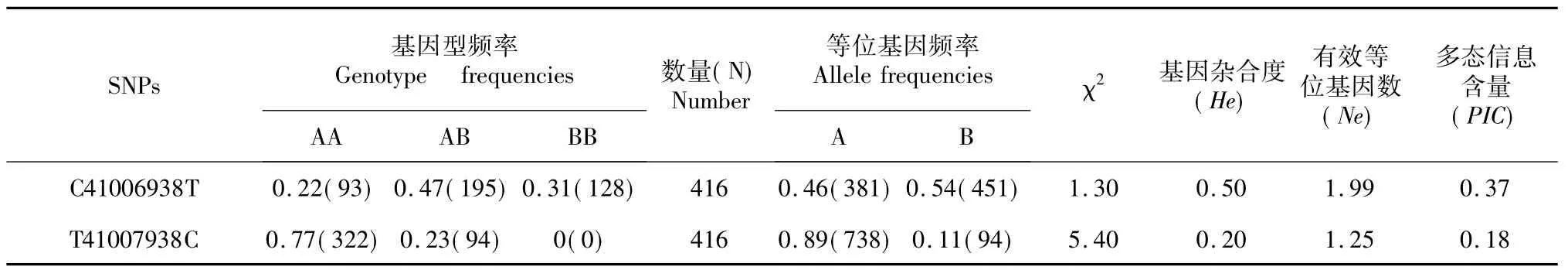
表4 基因频率和基因型频率的分布以及Hardy-Weinberg平衡的卡方检验Table 4 Distribution of gene frequency and genotype frequency and Hardy-Weinberg equilibrium card square test
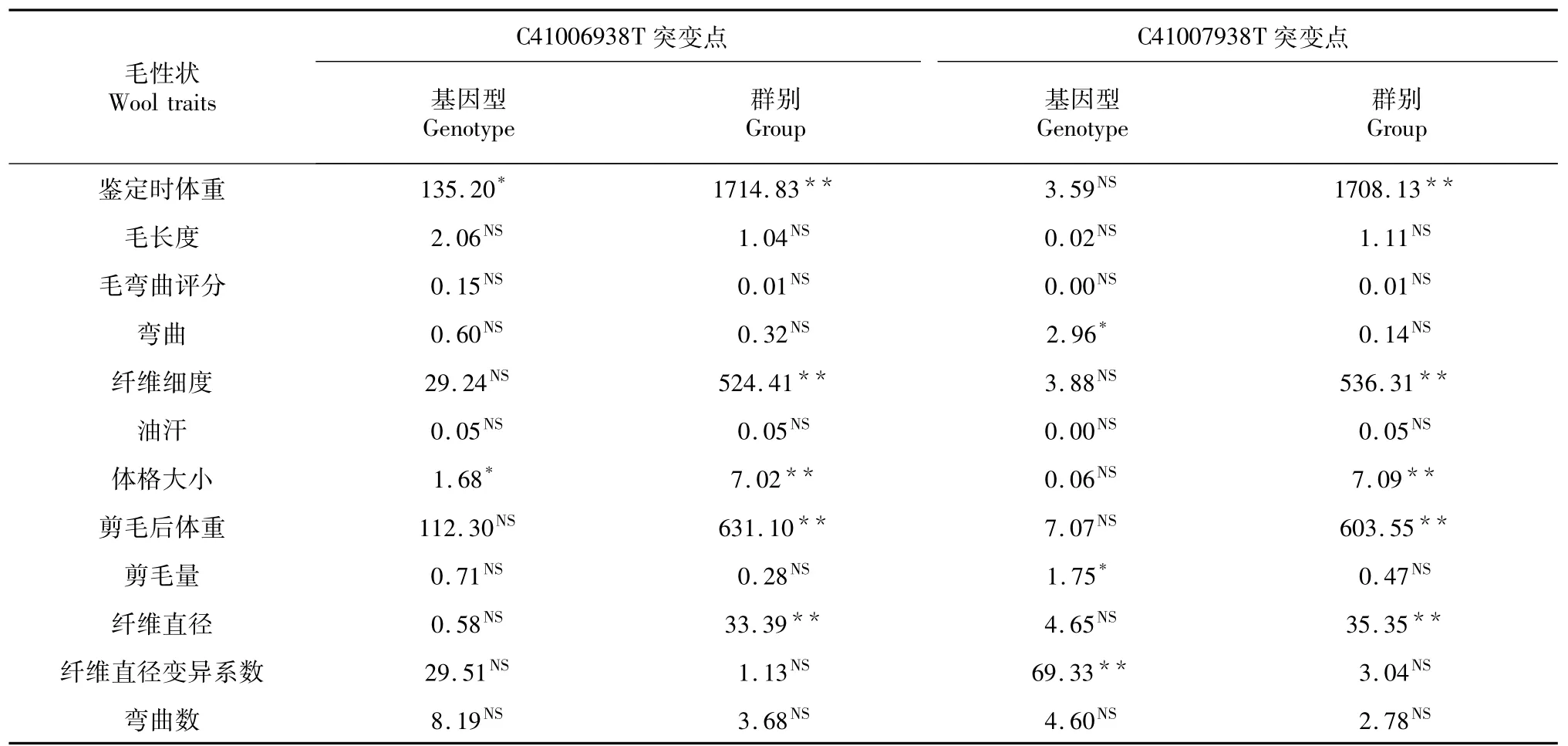
表5 C41006938T和T41007938C基因型和群别对毛性状的影响Table 5 The effect of C41006938T and T41007938C genotype and group on wool traits

表6 C41006938T和T41007938C不同基因型与毛性状间的关系Table 6 C41006938T and T41007938C relationship between different genotypes and wool traits
2.7 KAP16基因位点与羊毛性状的关联性分析
2.7.1 KAP16基因位点不同基因型的最小二乘方差分析由表5可知,C41006938T不同基因型对体格大小和鉴定时体重有显著影响(P<0.05)。群别对鉴定时体重、纤维细度、体格大小和纤维直径有极显著影响(P<0.01)。T41007938C不同基因型对中国美利奴(新疆型)的纤维直径变异系数有极显著影响(P<0.01);对剪毛量和弯曲有显著影响(P<0.05);不同群别对中国美利奴(新疆型)鉴定是体重、纤维细度、体格大小和纤维直径有极显著影响(P<0.01)。
2.7.2 KAP16基因位点不同基因型与毛性状的关联性分析由表6可见,C41006938T位点BB基因型对AA和AB基因型鉴定时体重和体格大小差异显著(P<0.05);T41007938C位点AB基因型对AA基因型纤维直径变异系数差异极显著(P<0.01),对剪毛量和弯曲差异显著(P<0.05)。
2.8 KAP16基因位点不同基因型组合效应与羊毛性状的关联性
2.8.1 KAP16不同基因型组合效应最小二乘方差分析由表7可知,C41006938T和T41007938C对剪毛量有极显著影响(P<0.01);对纤维直径变异系数有显著影响(P<0.05);不同群别对鉴定时体重、纤维细度、体格大小、剪毛后体重、纤维直径有极显著影响(P<0.01)。
2.8.2 KAP16不同基因型组合效应由表8可知,KAP16组合基因AABB型对剪毛量差异极显著(P<0.01);AABB基因型、ABAA基因型和ABBB基因型对纤维直径变异系数差异显著(P<0.05)。
3 讨论
3.1 KAP基因的多态性分析
Mclaren等[12]通过连锁分析已经将KAP1.1、KAP1.2、KAP1.3、KAP3.2定位到绵羊的21号染色体上。研究人员针对KAP基因家族的多态性做了许多研究,Parsons等[13]以KRTAP6和KRTAP8为候选基因,证实这两个基因位点和羊毛产量及纤维直径存在明显的相关性,推测在KAP6和KAP8同一区域可能存在控制羊毛直径的主基因。Henry等[14]利用超细的美利奴羊和罗姆尼羊的回交群体,测定了包括周岁体重、羊毛产量、平均纤维直径在内的多个性状,同时用216个微卫星标记进行了基因组扫描,找到了一个与羊毛纤维直径相关的位点。Itenge-Mweza[15]在澳洲美利奴羊中报道KAP1.3 (B2C)基因存在9个独特的SSCP带型,序列分析显示这9个带型代表8个新的KAP1.3等位基因,在KAP1.3基因c.240G>A突变位点的3种基因型分别为GG、AA和AG,在KAP1.3基因c.312G>A突变位点的GG、AA和AG等3种基因型。KRT和KAP多态性位点可能导致基因部分改变的从而导致羊毛特征的变化,这些识别标记可用于在羊毛产业的基因分子标记辅助选择。刘桂芬[16]选择21号染色体上高硫蛋白家族中KAP1.1、KAP1.3中的部分序列和1号染色体高甘氨酸-酪氨酸蛋白KAP6.1的外显子进行研究,结果发现KAP1.1、KAP1.3所在区域中位点W08667与羊毛细度显著相关。张亚妮[17]应用PCR-SSCP技术分析了内蒙古白绒山羊和辽宁绒山羊KAP基因与经济性状的关系,KAP1.3基因S4位点AB基因型与辽宁绒山羊产绒量相关,KAP1.3基因S3位点AA基因型与内蒙古白绒山羊体重相关,KAP1.3基因S2位点BB基因型与辽宁绒山羊体重相关。冯静等[3]应用PCR-RFLP方法分析绵羊KAP1.3基因遗传多态性,结果表明KAP1.3基因存在2个SNP位点。王春昕[18]应用PCR-SSCP技术对羊毛纤维组成蛋白中的KAP1.3基因部分序列进行多态性分析,结果表明KAP1.3基因与产毛量和拉伸长度相关。

表7 C41006938T和T41007938C不同组合基因型对毛性状的影响Table 7 Effect of C41006938T and T41007938C different combination genotype on wool traits
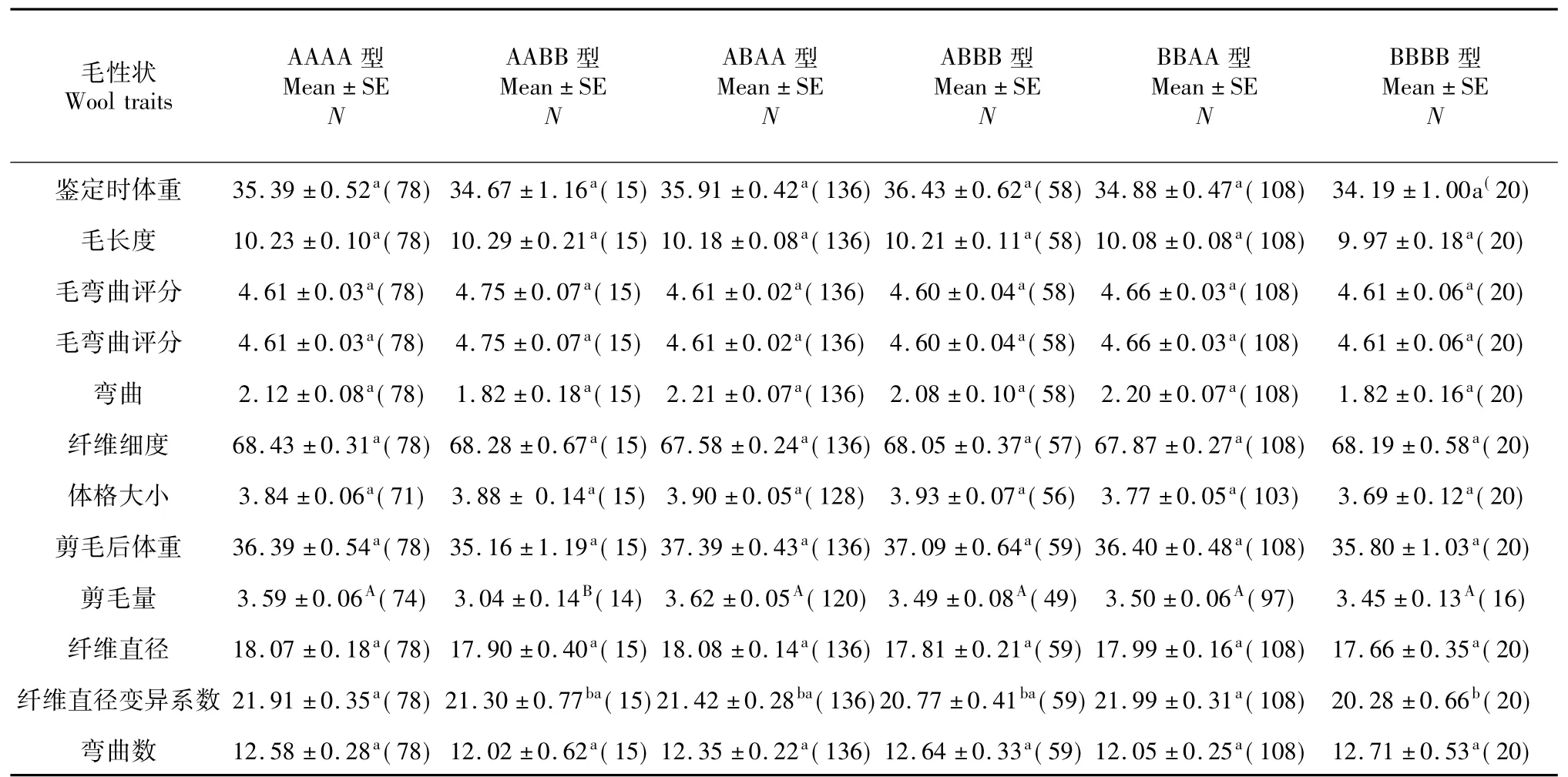
表8 KAP16不同组合基因型与毛性状间的关系Table 8 KAP16 and different combination of relationship between genotype and wool traits
3.2 国内外对绵羊KAP基因家族的相关研究
目前,该领域的研究热点之一是关于羊毛细度决定位点或相关基因的研究Mclaren等[12]通过连锁分析已经将角蛋白辅助蛋白KAP6.1,KAP7和KAP8定位到绵羊的第1号染色体上。Ponz等[19]通过片段定位方法寻找控制羊毛性状的QTL,利用法国的合成品系INR401对40个微卫星标记进行了分析,结果发现了在3号、7号、25号染色体上有控制毛长(SL)的QTL,在6号染色体上有控制毛纤维直径(WFD)的QTL,在7号染色体上有控制毛纤维直径纤维直径变异系数的QTL。Cockett N E[20]认为KAP6.n和羊毛直径有关。Chen等[21]研究表明KAP8.1和KAP1.3基因表达模式相似,在羊皮肤中KAP1.3高度表达,KAP8.1表达较弱。此外,KAP8.1和KAP1.3的位点多态性与纤维直径差异显著。KAP8.1中BC基因型对纤维直径有极显著的影响,KAP1.3中AA基因型对纤维直径有极显著的影响。此外,KAP8.1与KAP1.3基因的最优组合基因型为BC-AA组合基因型。
3.3 KAP16基因与中国美利奴羊(新疆型)毛性状的关连分析
羊毛性状是细毛羊重要的经济性状之一,分子标记成为研究重要表型的方法之一,并被广泛用于动物的遗传研究中。KAP16基因通过全基因组测序攻击获得8个SNPs突变位点,本文研究了其中的两个突变点对中国美利奴(新疆型)的遗传效应分析,将继续研究其他位点对中国美利奴(新疆型)的遗传效应。
C41006938T不同基因型对体格大小和鉴定时体重有显著影响。群别对鉴定时体重、纤维细度、体格大小和纤维直径有极显著影响。C41006938T基因位点对鉴定时体重和体格大小差异显著; T41007938C不同基因型对中国美利奴(新疆型)的纤维直径变异系数有极显著影响;对剪毛量和弯曲有显著影响;不同群别对中国美利奴(新疆型)鉴定是体重、纤维细度、体格大小和纤维直径有极显著影响。T41007938C基因型对中国美利奴羊(新疆型)纤维直径变异系数差异极显著;对剪毛量和弯曲差异显著。C41006938T和T41007938C对剪毛量有极显著影响;对纤维直径变异系数有显著影响;不同群别对鉴定时体重、纤维细度、体格大小、剪毛后体重、纤维直径有极显著影响。KAP16组合基因型对中国美利奴(新疆型)剪毛量差异极显著;对纤维直径变异系数差异显著。
在所研究的绵羊群体中,KAP16基因的2个突变位点均呈现出中度多态性,说明在这些位点处中国美利奴(新疆型)群体遗传变异处于中等水平,变异程度相似,没有太大的差异,同时也说明在上述各群体的培育改良中可以加强人工选择的强度。
4 结论
本试验首次通过重测序技术,发现KAP16基因在染色体11上第4外显子SNP突变点为T41007938C,第5外显子SNP突变点为C41006938T。通过分析可知,C41006938T不同基因型对体格大小和鉴定时体重有显著影响; T41007938C不同基因型对纤维直径纤维直径变异系数有极显著影响,对剪毛量和弯曲有显著影响; C41006938T和T41007938C组合基因型对剪毛量有极显著影响,对纤维直径纤维直径变异系数有显著影响。
[1]田月珍.中国美利奴羊(新疆型)母羊羊毛细度相关候选基因的筛选及其关联性分析[D].乌鲁木齐:新疆农业大学,2012.
[2]汪玲.KAP7.1、KAP8.2基因在辽宁新品系绒山羊兴盛期毛囊中的表达及分析[D].大连:辽宁师范大学,2010.
[3]冯静,宋天增,杨华,等.绵羊KAP1.3基因遗传多态性分析[J].西南农业学报,2010,23(6):2074-2078.
[4]冯静,杨华,宋天增,等.绵羊KAP1.1基因克隆与单核苷酸多态性分析[J].西南农业学报,2010,23(5):1720-1724.
[5]冯静,宋天增,杨华,等.绵羊KAP6.1基因的遗传多态性分析[J].西南农业学报,2012,25(1):276-278.
[6]玛依拉.6个KRT基因的遗传多态性及其与中国美利奴羊(新疆型)毛性状的关联性分析[D].乌鲁木齐:新疆农业大学,2013.
[7]艾买提.5个KAP基因在中国美利奴羊(新疆型)的多态性及其与毛性的关联性分析[D].乌鲁木齐:新疆农业大学,2013.
[8]Cheng C T,Kuo C Y,David K A.KAPtain in charge ofmultiplemissions:Emerging rolesof KAP1[J].World Journal of Biological Chemistry,2014,8.26,5(3):308-320.
[9]赵志东.KAP9.2基因的群体遗传变异及羊绒生长期和休止期基因的表达研究[D].咸阳:西北农林科技大学,2012.
[10]于辉.绒山羊KAP基因家族与Hoxc13基因遗传变异及其对产绒性状的影响[D].咸阳:西北农林科技大学,2009.
[11]赵苗.绒山羊6个候选基因遗传变异及其与经济性状关系研究[D].咸阳:西北农林科技大学,2008.
[12]Mclaren R J,Rogers G R,Davies K P,et al.Linkage mapping of wool keratin and keratin-associated protein genes in sheep[J].Mammali-an Genome,1997(8):938-940.
[13]Parsons Y M,Cooper DW,Piper L R.Evidence of linkage between high-glycine-tyrosine keratin gene loci and wool fibre diameter in a merino half-sib family[J].Anim Genet,1994,25:105-108.
[14]Henry H M.A genome screen for QTL forwool traits in a Merino X Romney backcross flock[J].Mammalian Genome,1998(8):938-940.
[15]Itenge M,Weza TQ,ForrestR H,etal.Polymorphism of the KAP1.1,KAP1.3 and K33 genes in Merino sheep[J].Mol Cell Probes,2007,21(5-6):338-342.
[16]刘桂芬.新疆优质细毛羊遗传多样性及羊毛细度候选基因的分析[D].乌鲁木齐:新疆农业大学,2005.
[17]张亚妮.两个绒山羊品种微卫星多态性与产绒性能的分子标记研究[D].咸阳:西北农林科技大学,2005.
[18]王春昕,张金新,金海国,等.KAP1.3基因与绵羊产毛性能的相关分析[J].吉林畜牧兽医,2009,30(4):5-6.
[19]Ponz R,Moreno C,Daniel A,et al.Assessment of genetic variation explained bymarkers for wool traits in sheep via a segmentmapping approach[J].Mammalian Genome,2001,12:569-572.
[20]Cockett N E.Analysis of the sheep genome[J].Physiol Genomics,2001(7):69-81.
[21]Chen H Y,Zeng X C,HuiW Q,et al.Developmental expression patterns and association analysisof sheep KAP8.1 and KAP1.3 genes in Chinese Merino sheep[J].Indian Journal of Animal Sciences,2011,81(4):391-96.
(责任编辑 李洁)
Analysis of Genetic Effects of KAP16 Gene w ith M ain Econom ic Traits in Fine W ool Sheep
HE Jun-min1,HUANG Xi-xia1*,TIAN Ke-chuan2*,ZHAO Bing-ru1,BAIYan2,TIAN Yue-zhen1,XU Xin-ming2,FU Xue-feng2
(1.Animal Science of Xinjiang Agricultural University,Xinjiang Urumqi 830052,China;2.Xinjiang Academy of Animal Husbandry and Animal Husbandry Institute Laboratory of Molecular Genetics,Xinjiang Urumqi830011,China)
The genetics of KAP16 genewas analyzed to find out the polymorphisms and obtain DNA markers that associated with wool traits,to providemolecular bases formolecular breeding on fine wool sheep.In the research,re-sequencing and PCR-SSCPmethodswere used to analyze the genetic variations of2 SNPsmutation points in KAP16 gene and genetic polymorphism in Chinese Merino(Xinjiang type)population.At the same time,the SAS 8.1 least-squares analysis technique was used to study correlation with wool traits.The results showed that,C41006938Tmutation pointswere observed(named as AA,AB and BB,respectively),the frequency of genotypeswere0.22,0.47 and 0.31,respectively;correspondingly,frequenciesofallele A and Bwere0.46 and 0.54,among them,B allelewas dominantallele.The frequency of genotypes of AA and AB at T41007938Cmutation pointswere0.77 and 0.23,respectively;frequenciesof allele A and Bwere 0.89 and 0.11,A allelewas dominantallele.χ2 test raveled that the C41006938T and T41007938C pointwere in the Hardy-Weinberg disequilibrium(P>0.05).The polymorphic information content of C41006938T and T41007938C gene points were 0.37 and 0.18;therefore,Chinese Merino(Xinjiang type)population was reached themoderate level in genetic variation of the gene.Different genotypes on the physical size and identification has obvious effect on body weight(P<0.05)on C41006938T;different genotype has a significant effect on fiber diameter variation coefficient(P<0.01)on T41007938C,There is a significant quantity of shearing and bending effect(P<0.05);C41006938T and T41007938C combination genotype has a significant effect on shearing quantity(P<0.01)and fiber diameter variation coefficient(P<0.05).
KAP16 gene;SNPs;Fine wool sheep;Correlation analysis
S814.8
A
1001-4829(2017)2-0458-08
10.16213/j.cnki.scjas.2017.2.036
2016-04-07
国家自然科学基金(31360543,31460593);农业部体系项目(CARS-40);新疆农业大学产学研联合培养研究生示范基地项目(xjaucxy-yjs-20152011)
何军敏(1991-),女,新疆乌苏人,硕士研究生,主要从事动物遗传育种的研究,E-mail:1415230131@qq.com,Tel: 15299126423,*为通讯作者:黄锡霞(1963-),教授,研究方向为动物遗传育种,E-mail:au-huangxixia@163.com,田可川(1963-),研究员,研究方向为动物遗传育种,E-mail:tiankechuan@ 163.com。
