PK-15细胞在微载体悬浮放大培养及PCV2增殖工艺研究
2017-04-13华涛冯磊张雪花唐波常晨刘国阳吴培培陈丽张道华侯继波
华涛,冯磊,张雪花,唐波,常晨,刘国阳,吴培培,陈丽,张道华*,侯继波*
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心,农业部兽用生物制品工程技术重点实验室,江苏南京210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
PK-15细胞在微载体悬浮放大培养及PCV2增殖工艺研究
华涛1,2,冯磊1,2,张雪花1,2,唐波1,2,常晨1,2,刘国阳1,2,吴培培1,2,陈丽1,2,张道华1,2*,侯继波1,2*
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心,农业部兽用生物制品工程技术重点实验室,江苏南京210014;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
为建立在生物反应器内微载体逐级放大培养PK-15细胞和增殖PCV2技术。采用分批式培养方法,研究了PK-15细胞在微载体胰酶消化放大悬浮培养及猪圆环病毒2型(PCV2)增殖工艺。结果表明,5 g/L的微载体和高糖DMEM下,采用4.0×105cells/mL的初始接种密度及培养至第2天进行换液操作工艺可以获得最佳的PK-15细胞生长效能。胰酶消化转移将PK-15细胞从1 L反应器放大至3 L反应器,微载体上细胞贴附均匀、生长旺盛,培养3 d细胞密度可达34.3×105cells/mL。采用感染复数为0.1的接毒比例,细胞接毒后在微载体上传至第3代收获毒液可获得最高的PCV2增殖效价107.25TCID50/mL。为PCV2疫苗的生物反应器规模化生产奠定了基础。
PK-15细胞;微载体;消化放大;猪圆环病毒2型;悬浮培养
猪圆环病毒(PCV)发现于1974年,作为PK-15细胞的污染被命名为猪圆环病毒1型(PCV1),动物试验证明其没有致病性[1]。自20世纪90年代初,由猪圆环病毒2型(PCV2)引起的断奶仔猪多系统衰竭综合症(PMWS)发现以来,PCV2给世界养猪业带来了巨大的损失,各国政府和养猪企业加大了对猪圆环相关疾病(PCVAD)防治的关注和投入[2]。疫苗免疫是预防PCVAD最有效的手段,国内外PCVAD的商品化疫苗主要有3类:全病毒灭活疫苗、重组毒灭活疫苗和亚单位疫苗[3-4]。由于全病毒灭活疫苗生产成本相对较低,并具有优良免疫效果,在我国市场上使用较广,且国内厂家主要生产灭活疫苗,但多数厂家PCV2的增殖滴度较低[5]。PCV感染宿主细胞后,病毒采用滚环复制模式进行复制,在细胞生长的S期复制效率较高,随宿主细胞复制而复制,因此PCV2的复制周期比其他病毒长,这为研制高效的PCV2疫苗带来了障碍[6-7]。PCV2灭活疫苗生产方式依然延用了传统的实验室大方瓶或滚瓶连续传代培养方式,占地面积大,工序操作繁琐,瓶与瓶之间病毒增殖滴度的不稳定。在生物反应器中以持续搅拌的方式进行动物细胞的微载体悬浮培养,微载体提供了更大的细胞贴壁表面积,而且反应器能自动监控细胞生长或病毒繁殖时的最适生化条件,其营养物质、气体及热量的传递更加充分均匀,为细胞生长及病毒增殖提供相对优质、恒定的培养环境,整个生物过程控制精确,易于重复,保证了疫苗产品批次间质量的一致性,并具备规模放大的可能性[8-9]。国内众多疫苗厂家进行了微载体扩增PCV2研究,主要集中在多聚糖球形和纸片微载体培养,培养工艺均采用滚瓶或方瓶到反应器的一次性放大工艺[10-11]。虽获得了较高的病毒滴度,但前期所需滚瓶量非常大,才能在反应器上进行一次性高密度放大,且没有进行微载体传代培养的报道,无法在反应器内进行无毒细胞-接毒-多次传代-收毒的工业放大,使其在密闭的反应器内进行。由于PK-15细胞耗能比较大,如何选用营养成分较高的培养基,以及如何换液补料成为制约PK-15细胞高效增殖的主要障碍;另外由于PCV2复制效率较低,需要PK-15细胞带毒传代,而细胞带毒后易产生凋亡现象,较高的接毒强度反而不利于细胞的有效复制,无法达到较高的病毒滴度。因此如何为PK-15细胞提供适宜生长条件,以及多大的接毒剂量,成为无毒细胞扩增-接毒-多次传代-收毒的工业放大过程中的关键问题。本研究建立了微载体逐级放大培养工艺培养PCV2,为在反应器内进行无毒细胞扩增-接毒-传代-收毒的工业放大提供试验依据和理论基础。
1 材料与方法
1.1 细胞与病毒
PCV2-DBN-SX07(Genbank No.:FJ660968)由国家兽用生物制品工程中心保存[12];PK-15细胞由本实验室保存。
1.2 材料
Cytodex 1购自GE公司。首先称取一定量的Cytodex 1置于二甲基二氯硅烷硅化的瓶子内,加入PBS(pH 7.2)水化,比例约为80~150 mL/g Cytodex 1,约3 h后将PBS倾去,加入新的PBS,高压灭菌121℃,30 min,冷却后倾去PBS,用培养基洗漆1次后倾去,重新加入新鲜培养基置4℃备用。
细胞培养液MEM、高塘DMEM和新生牛血清购自GIBICO公司。配制含有10%新生牛血清的MEM和DMEM培养液,含100 IU/mL青霉素和100 g/mL链霉素,经无菌0.22μm滤膜过滤除菌,置4℃备用。胰蛋白酶购自GIBICO公司,用无Ca2+、Mg2+离子磷酸盐缓冲液配制成0.25%浓度胰蛋白酶溶液,调整pH至7.5~8.0,经无菌0.22μm滤膜过滤除菌,置4℃备用。
1.3 设备
滚瓶设备购自瑞士IBS公司,培养体积为250 mL。1和3 L动物细胞反应器购自荷兰Applicon,121℃高压灭菌30 min用于PK-15细胞微载体悬浮培养,反应器培养体积0.8和2.4 L,具有溶氧、pH、温度、转速及四气(N2、O2、CO2及空气)控制系统。
1.4 试验方法
1.4.1 培养基对细胞生长的影响微载体浓度在3 mg/mL条件下,PK-15细胞接种密度为2.0×105cells/mL接种1 L动物细胞反应器,转速均为40 r/ min,溶氧饱和度为50%,温度37℃,pH 7.0,观察含10%血清高糖DMEM和MEM培养基对细胞生长的影响
1.4.2 细胞接种量对细胞生长的影响在优化培养基的基础上,不同初始细胞密度2.0×105、4.0× 105和6.0×105cells/mL的PK-15细胞分别接种于1 L动物细胞反应器中,微载体用量分别为3 g/L,观察不同初始密度对细胞生长的影响,确定最佳接种细胞密度。
1.4.3 微载体浓度对细胞生长的影响在优化细胞接种密度的基础上,在含10%血清高糖DMEM,接种细胞密度4.0×105cells/mL条件下,观察3、5、7 mg/mL微载体浓度对细胞生长的影响。
1.4.4 微载体消化状态条件的确定PK-15细胞增殖3 d后,Cytodex 1微载体上细胞生长成单层时,进行在位消化转移放大,首先停止搅拌,待微载体完全沉降将培养基排出,37℃温浴的PBS以约100 mL/g微载体清洗3次,去除残留的培养基。加入37℃温浴的胰酶,50 mL/g微载体,在37℃消化,在5、10、15 min取样0.2 mL,加入0.2 mL培养基进行中止,在显微镜下观察消化情况。消化完全后,接种细胞密度4.0×105cells/mL到下一级生物反应器内继续培养,补加微载体至5 mg/mL,补加原有培养基体积后进行培养,培养2 d换掉培养基一半,观察细胞生长情况。
1.4.5 不同接毒量在微载体上消化放大培养根据摸索的培养工艺,PK-15细胞在反应器中验证其放大培养PCV2工艺的可行性。细胞培养罐安装完毕后,微载体为4 g/L,初始细胞密度4.0×105cells/mL,转速为40 r/min。第一级生物反应器中培养24 h后,PCV2以不同感染复数(MOI)接入含有相同PK-15细胞密度微载体培养物中,MOI为0.5、0.1和0.05。接毒后2 d,进行带毒细胞传代,每代取样测定PCV2效价,确定最佳接毒MOI和最佳收货时间。微载体上的细胞传代培养方式:用胰酶消化完全后,接种细胞密度4.0×105cells/mL到下一级生物反应器内继续培养,补加微载体至5 mg/mL,加入培养基进入下一级生物反应器内培养,工作体积为0.8 L,在培养第2天换掉一半培养基。以上生物反应器培养参数均为:pH 7.0,溶氧饱和度为50 %,温度37℃,搅拌速度40 r/min。
1.5 细胞技术和计算方法
细胞密度测定:均匀吸取微载体培养样品,离心去除上清,用PBS洗3遍,0.25%胰酶溶液于37℃消化10 min获得游离细胞。进行台盼蓝染色,血球计数板计算活、死细胞数,计算细胞存活率和细胞密度。每天取样测定,绘制PK-15细胞生长曲线。
1.6 葡萄糖、乳酸、谷氨酰胺和氨测定
葡萄糖、乳酸、谷氨酰胺和氨的浓度测定均采用Nova 400全自动生化分析仪进行测定。方法为:收取微载体培养样品,10 000 r/min离心取上清,在Nova 400全自动生化分析仪测定以上细胞基本代谢情况。
1.7 PCV2滴度测定
含10%血清正常培养的PK-15细胞在96孔板上长至单层时,接入连续10倍稀释的病毒样品,每个稀释度接入8个孔,每孔200μl,接毒后4 d进行间接免疫荧光。PK-15细胞无水乙醇固定1 h,0.5‰Tween-20的PBS(PBST)洗涤后加入PCV2阳性猪血清(1∶200),37℃孵育1 h,PBST洗涤5次,每次5 min。加入FITC-SPA荧光二抗(1∶200),37℃孵育l h,PBST洗涤5次,每次5 min,于荧光显微镜下观察阳性细胞孔数。按Karber方法计算病毒滴度,结果以1 mL中半数细胞培养物感染量(TCID50/mL)表示。
1.8 统计学分析
应用SPSS软件对数据进行统计分析,采用Duncan’s多重分析,比较各组差异,以不同字母表示差异显著(P<0.05)。
2 结果与分析
2.1 不同培养基对PK-15细胞生长的影响
在3 g/L微载体浓度条件下,初始细胞接种密度为2.0×105cells/mL,采用高糖DMEM和MEM培养基培养的PK-15细胞,如图1所示。高糖DMEM培养基所获得细胞密度为18.2×105个/ mL,是MEM培养基的1.42倍,高糖DMEM培养效果优于MEM培养基。且在细胞生长后期MEM培养基所获得的细胞存活率显著低于高糖DMEM。
2.2 不同PK-15细胞接种密度对其在微载体上生长影响
微载体浓度为3 g/L时,初始细胞接种密度为2.0×105、4.0×105和6.0×105cells/mL,使PK-15细胞在微载体上生长曲线呈现差异性变化(图2)。低初始细胞密度2.0×105cells/mL使PK-15细胞生长延迟,细胞生长缺乏初始密度,造成微载体上细胞分布较少,同时还存在很多空的微载体(图3A)。6.0×105cells/mL的高初始细胞密度可使PK-15细胞快速进入生长期,但细胞存活率相对较低,这可能是细胞密度较大导致细胞聚团,或单个微载体分配细胞较多导致游离细胞不粘附的现象,不能提供有效生长表面(图3C)。4.0×105cells/mL相对适中的初始细胞密度接种与微载体上培养时,PK-15细胞既能均匀的贴附于微载体表面,使细胞快速生长,同时为后续生长的细胞预留充裕的生长表面积,获得较高的细胞密度(22.3×105cells/mL)和细胞存活率(图3B)。

图1 不同培养基对PK-15细胞的生长曲线和细胞存活率比较Fig.1 Comparison of growth curve and viability of PK-15 cells with differentmedia

图2 不同PK-15细胞初始密度的生长曲线和细胞存活率比较Fig.2 Comparison of growth curve and viability of PK-15 cells with different initial densities of cells
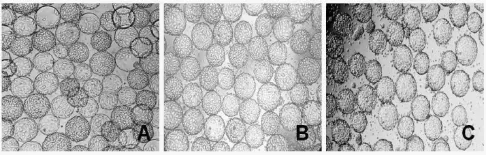
图3 不同初始密度的PK-15细胞培养3 d时的增殖形态Fig.3 Morphology of PK-15 cells with different initial densities of cells for 3-d suspension culture
2.3 不同微载体浓度对PK-15细胞生长的影响
由图4可知,在含10%血清高糖DMEM培养基培养条件下,PK-15细胞的接种密度4.0×105个/mL条件下,随着微载体浓度提高,细胞密度也相应提高。用相同的细胞密度接种3、5、7 mg/mL微载体浓度所能达到的最高细胞密度分别为22.2× 105、26.1×105、26.4×105个/mL。其中5和7 mg/ mL微载体中培养效果相似,其细胞浓度较高,5 mg/ mL微载体浓度经济较好,各组细胞存活率均相似。2.4 PK-15细胞培养过程中的基本代谢

图4 不同微载体浓度的PK-15细胞生长曲线和细胞存活率比较Fig.4 Comparison of growth curve and viability of PK-15 cells with differentmicrocarrier concentration
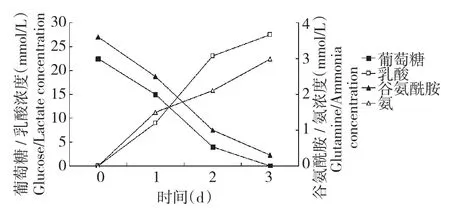
图5 PK-15细胞微载体悬浮培养过程中葡萄糖、乳酸、谷氨酰胺及氨的浓度Fig.5 Glucose,lactate,glutamine and ammonia concentrations in microcarrier suspension culture system for PK-15 cells
接种细胞密度4.0×105cells/mL条件下,微载体浓度提高5 mg/mL以上细胞培养密度不再提高,推测为10%血清高糖DMEM培养基无法支持细胞高密度生长。在接种细胞密度4.0×105个/mL、微载体浓度5 mg/mL条件下,在1 L反应器对葡萄糖、谷氨酰胺、乳酸及氨基本代谢进行检测,如图5所示。在培养至第1天葡萄糖和谷氨酰胺浓度变为14.8和2.4 mmol/L,为原浓度的64%和62%。培养至第2天葡萄糖和谷氨酰胺浓度下降至4.8和1.2 mmol/L,仅为原浓度的21%和35%,乳酸和氨代谢副产物浓度的累积达到23.7和2.1 mmol/L。第3天葡萄糖为0.6 mmol/L,几乎消耗完全,谷氨酰胺为0.4 mmol/L,仅为原浓度的11%,乳酸和氨代谢副产物浓度进一步提高。细胞培养至第2天后,培养基已无法支持细胞迅速生长。
2.5 不同补料方式对PK-15细胞生长的影响
根据微载体悬培养过程中营养成分及代谢产物浓度的变化,在第2天时开始补料或将其培养基换掉一半的培养方式进行比较。如图6所示,通过换液或补料均可提高细胞的密度,均好于普通培养。补料式操作在培养的第2天补加葡萄糖和谷氨酰胺使其浓度分别为12和2 mmol/L,为细胞增加了充足的营养,但代谢产物的积累同样更高,培养至第3天氨和乳酸的浓度分别为4.6和35.3 mmol/L,高于普通培养测定的结果,影响细胞的增殖,最大细胞密度30.8×105cells/mL。在第2天进行换液操作,停止搅拌发酵罐,附着细胞的微载体自动沉降后去除一半原培养液,更换为新鲜培养液。去除了一半前2 d积累的代谢副产物,同时补充了充足的营养更有利于细胞增殖,最大细胞密度达到34.7×105个/mL,显示最好的生长性能。
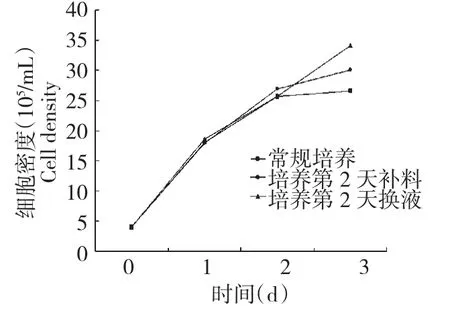
图6 不同培养方式对PK-15细胞在微载体上生长的影响Fig.6 Effects of different culture modes on growth curve of PK-15 cells onmicrocarriers
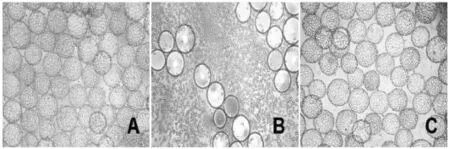
图7 PK-15细胞在反应器内微载体上消化转移放大Fig.7 Scale-up of PK-15 cells cultured on Ctytodex 1 by transfer of tripsin digest in bioreator

图8 PK-15细胞感染PCV2(MOI=0.01)传至第3代病毒滴度为107.5TCID50/m LFig.8 Virus titer being107.5TCID50/mL at the 3rdpassage of PK-15 cells infected with PCV2(MOI=0.01)
2.6 PK-15细胞在微载体上消化转移放大培养
PK-15细胞在微载体上培养3 d,待细胞生长成单层时,进行在位消化转移放大,首先停止搅拌,静置20 min左右待微载体完全沉降,将培养基排出,37℃温浴的PBS以约100 mL PBS/g微载体清洗3次,去除残留的培养基。向微载体内加入37℃预热的胰酶,搅拌混匀。在5、10、15min取样0.2mL,加入0.2 mL培养基进行中止,当胰酶消化10 min后细胞全部脱落(图7)。接种细胞密度4.0×105个/ mL到下一级生物反应器内继续培养,补加微载体至5 mg/mL,补加原有培养基体积后进行培养。培养2 d换掉培养基一半,3 d后细胞贴附于微载体上生长良好(图7),细胞密度为34.3×105个/mL。采用此方法PK-15细胞能在微载体上进行多次传代,且细胞密度为30×105个/mL以上。

表1 不同感染复数(MOI)对PCV2增殖效价的影响Table 1 Effects of differentmultiples of infection(MOI)on PCV2 propagation titers
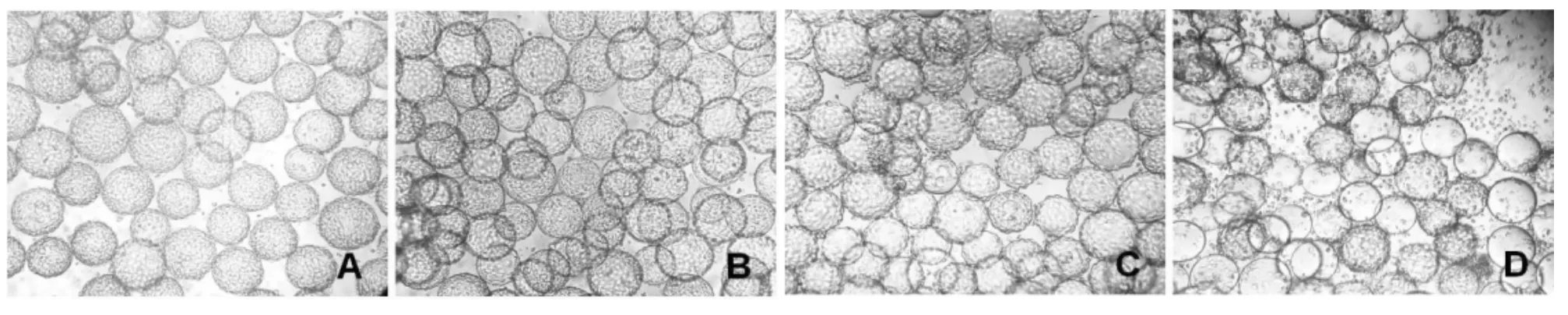
图9 反应器微载体上PK-15细胞感染PCV2(MOI=0.01)细胞形态变化Fig.9 Pathological changes of PK-15cells infected with PCV2(MOI=0.01)
2.7 PCV2不同接毒量对病毒收获得影响
过高或过低的感染复数(MOI=0.5或0.05)均导致较低的PCV2增殖效价(表1),说明接毒剂量直接影响病毒的增殖效率。MOI=0.1时可以收获最高的PCV2增殖效价,第3代时达到最高107.25TCID50/mL(图8),第4代时细胞无法贴附于微载体生长(图9)。MOI=0.05接毒剂量,PK-15细胞第3代病毒滴度达到最高的106.75TCID50/mL,第4代时细胞开始脱落;MOI=0.5时病毒滴度在第2代为106.65TCID50/mL,细胞第3代时就无法贴附于微载体生长。以上各组试验结果显示,PCV2接毒剂量为MOI=0.1时,PK-15细胞感染后第3代为最佳收毒时间。
3 讨论
本研究比较了MEM和高糖DMEM培养基对细胞生长的影响,结果发现采用DMEM培养基培养PK-15细胞所能达到最终细胞密度为18.2×105个/ mL,是MEM培养基的1.42倍。在反应器内,高通氧条件下高糖DMEM培养基含有葡萄糖4500 mg/ L,更适合于生长较快肿瘤细胞。高糖培养环境中代谢过程中所多余的葡萄糖生成乳酸是其他培养液的5倍,因此在长时间培养时,应采用间歇换液的方式,以消除代谢产物给细胞生长带来的不利影响[13]。本研究在进行细胞代谢检测时同样发现乳酸蓄积量较高,培养第2天以后细胞增殖明显降低,在培养第2天时进行换液可以更进步提供细胞密度。
在反应器中微载体悬浮培养细胞初期,微载体与细胞的黏附完全是一种物理性碰撞的过程,符合泊松分布规则,选择合适的细胞初始密度和微载体用量比例可以达到较好的培养效果[14]。本研究中,PK-15细胞初始密度4×105个/mL在5 g/L的Cytodex 1微载体上获得较为均匀的细胞分布效果,细胞黏附充分,细胞增殖密度和细胞存活率均获得最好的水平。计算其细胞与微载体的比例为5 mg微载体4×105个细胞,根据说明书1g Cytodex 1粉末在PBS中的溶胀后可形成4.3×106微载体,可近似确定每个微载体上获得17个左右初始细胞为最佳接种比例。细胞比例过高时,高浓度微载体的表面积未能充分被利用,且培养基无法支撑更高密度的细胞生长。但该比例应用于不同动物细胞时应有所改变,可能与不同细胞在微载体展开生长的速率及生长形态大小不同有关[15]。
PK-15细胞在微载体上充分黏附、展开生长后,为其提供营养物质、氧及低副产物积累的生长环境是获得高密度培养的关键。适时的换液可以提供充足的营养并去除代谢副产物的积累,是最佳的培养方式。生物反应器的换液操作相对方便,微载体自然沉降即可有效分离培养上清与培养物,在较短时间内完成换液全过程。本研究显示,PK-15生长速率较快,培养第2天葡萄糖即下降为原浓度的21 %,换液操作操作可显著改善细胞第3天的生长性能,效果优于不换液和补料。
PCV2整个基因组仅有1700多个碱基,编码5种蛋白:Cap、Rep、Rep`、ORF3和ORF4蛋白,仅有Rep、Rep`参与基因组的复制,需要细胞内各种复制蛋白酶等因素作用下将病毒基因组环状单股DNA转换成双股环状DNA,并启动病毒的复制,病毒的复制模式为滚环复制[6]。普遍观点是PCV复制是随宿主细胞复制而复制,在细胞生长的S期复制效率较高,因此PCV2的复制周期比其他病毒长,这为研制高效的PCV2疫苗带来了障碍[7]。PCV2效价最高峰的出现时间因各毒株的增殖速率的不同而异,疫苗生产采用滚瓶传代的方式进行生长。根据PCV2感染及增殖特点,本研究中0.1的感染复数最为匹配PCV2感染及增殖过程的要求,病毒在微载体上传至第3代可获得较高滴度。试验结果表明过高或过低的接毒量均不利于的增殖,过高时细胞在接毒第3代时就无法有效贴附于微载体生长,过低病毒生长周期延长,病毒所获得的最高滴度也较低。
4 结论
微载体悬浮培养技术是目前细胞培养中日趋成熟的一种技术,已应用于多种疫苗的生产过程中,如流感疫苗、黄热病毒疫苗和狂犬病疫苗等[16-18]。国外疫苗生产企业的微载体培养技术已经能够达到连续放大至6顿反应器,且生产过程全程在密闭管道中自动化控制。国内微载体培养技术应用于人用或兽用疫苗的生产才刚刚起步,培养工艺、培养规模均远远落后于国外。本试验对PK-15细胞的微载体悬浮消化放大培养、PCV2增殖等工艺进行了初步探索,在动物细胞反应器中PK-15细胞接毒后能够连续3代传毒。本试验为建立工艺放大至实验室中试水平,以及在反应器内进行无毒细胞扩增-接毒-传代-收毒的工业放大提供试验依据和理论基础。
[1]Allan GM,McNeilly F,Kennedy S,etal.Isolation of porcine circovirus-like viruses from pigs with a wasting disease in the USA and Europe[J].JVet Diagn Invest,1998,10(1):3-10.
[2]Opriessnig T,Meng X J,Halbur PG.Porcine circovirus type 2 associated disease:update on current terminology,clinicalmanifestations,pathogenesis,diagnosis,and intervention strategies[J].JVet Diagn Invest,2007,19(6):591-615.
[3]Kerkarainen T,Mccullough K,Fort M,et al.Immune responses and vaccine-induced immunity against porcine circovirus type2[J].Vaccine,2010,136(3-4):185-193.
[4]Beach N M,Meng X J.Efficacy and future prospects of commercially available and experimental vaccinesagainst porcine type2[J].Virus Res,2012,164(1-2):33-42.
[5]王一平,郭龙军,唐青海,等.猪圆环病毒2型疫苗的研究进展[J].畜牧兽医学报,2012,43(9):1337-1345.
[6]Cheung A K.Detection of template strand switching during initiation and termination of DNA replication of porcine circovirus[J].Journal of Virology,2004,78(8):4268-4277.
[7]Tischer I,Peters D,Rasch,et al.Replication of porcine circovirus: induction by glucosamine and cell cycle dependence[J].ArchVirol,1987,96:39-57.
[8]Paillet C,Forno G,Kratje R,et al.Suspension-Vero cell cultures as a platform for viral vaccine production[J].Vaccine,2009,27(46): 6464-6467.
[9]Soons Z I,Vanden IJ,Van Der Pol L A,et al.Scaling-up vaccine production:implementation aspects of a biomass growthobserver and controller[J].Bioprocess Biosyst Eng,2009,32(3):289-299.
[10]张许科,孙进忠,乔荣岑,等.一种猪圆环并怒II型疫苗制备:中国,CN101773667A[P].2013-09-25.
[11]徐宏军,丁光星,任丽,等.猪圆环病毒2型细胞悬浮培养生产方法:中国,CN102690790B[P].2013-09-25.
[12]王贵华,陈义锋,汤波,等.猪圆环病毒2型毒株分离鉴定和体外增殖特性研究[J].中国畜牧兽医,2012,39(1):17-22.
[13]Ray N G,Karkare S B,Runstadler PW.Cultivation of hybri-doma cell in continuous:kinetics of growth and product formation[J].Biotechnol Bioeng,1989,33(6):724-730.
[14]Bock A,Sann H,Schulze-Horsel J,et al.Growth behavior of number distributed adherentMDCK cells for optimization inmicrocarrier cultures[J].Biotechnol Prog,2009,25(6):1717-1731.
[15]Chun B H,Chung S I.Attachment characteristics of normal human cells and virus-infected cells on microcarriers[J].Cyto-technology,2001,37(1):1-12.
[16]Rourous S,Van Derark A,Majoul S,et al.A novel animal-component-freemedium for rabies virus production in Vero cells grownon Cytodex 1 microcarriers in a stirred bioreactor[J].Appl Microbiol Biotechnol,2009,85(1):53-63.
[17]Bock A,Schulze-Horsel J,Schwarzer J,et al.High-densitymicrocarrier cell cultures for influenza virus production[J].Biotechnol Prog,2011,27(1):241-250.
[18]Souza M C,Freire M S,Schulze E A,et al.Production ofyellow fever virus in microcarrier-basedVero cell cultures[J].Vaccine,2009,27 (46):6420-6423.
(责任编辑 李山云)
Scale-up Process of M icrocarrier Suspension Culture of PK-15 Cells and Propagation of PCV2
HUA Tao1,2,FENG Lei1,2,ZHANG Xue-hua1,2,TANG Bo1,2,CHANG Chen1,2,LIU Guo-yang1,2,WU Pei-pei1,2,CHEN Li1,2,ZHANG Dao-hua1,2*,HOU Ji-bo1,2*
(1.National Research Center of Engineering and Technology for Veterinary Biologicals;Key Laboratory of Engineering and Technology for Veterinary Blologicals,Ministry of Agriculture,Jiangsu Academy of Agricultural Sciences,Jiangsu Nanjing 210014,China;2.Jiangsu Coinnovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses,Jiangsu Yangzhou 225009,China)
In order to develop a technique for scale-up ofmicrocarrier suspension culture of PK-15 cells and propagation of PCV2 in bioreactor,batch-wise suspension culture of PK-15 cells onmicrocarriers(cytodex 1)using scale-up of tripsin digestand propagation of porcine circovirus type 2(PCV2)were investigated.The results showed that the optimal growth efficiency could be achieved by 4.0×105cells per 1 mL inoculation on 5 g/L microcarriers concentration,DMEM medium with high glucose and media replacement after 2-day culture.The highest PCV2 titerwas achieved 107.25TCID50/mL at the3rdpassage of PK-15 cells infected with 0.1multiple of infection(MOI)of PCV2.The optimal processes achieved in this study laid the experimental foundation formass production of PCV2 vaccines in bioreactor scale.
PK-15 cells;Microcarrie;Scale-up of digest;PCV2;Suspension culture
S52.651
A
1001-4829(2017)2-0474-07
10.16213/j.cnki.scjas.2017.2.039
2016-04-01
江苏省农业自主创新项目[CX(14)5044];农业部公益性行业(农业)科研专项经费项目(201303046);江苏省农业支撑计划(BE2012370)
华涛(1981-),男,江苏连云港人,博士,从事兽用生物制品工程技术和疫苗研究,E-mail:huatao541121@163.com,Tel:15951948013,*为通讯作者:张道华,E-mail:zhangdh2005@163.com,侯继波,E-mail:houjibo@jaas.ac.cn。
