家蚕不同龄期感染菜粉蝶微孢子虫的差异性分析
2017-04-13陈世良肖圣燕杨荣贵高建华高翔朱峰张永红廖鹏飞
陈世良,肖圣燕,杨荣贵,高建华,高翔,朱峰,张永红,廖鹏飞
(云南省农业科学院蚕桑蜜蜂研究所,云南蒙自661101)
家蚕不同龄期感染菜粉蝶微孢子虫的差异性分析
陈世良,肖圣燕,杨荣贵,高建华,高翔,朱峰,张永红,廖鹏飞*
(云南省农业科学院蚕桑蜜蜂研究所,云南蒙自661101)
为分析菜粉蝶微孢子虫对家蚕不同龄期的感染力差异,利用在云南省蒙自市收集的菜粉蝶,对其体内的微孢子虫进行分离、纯化与鉴定。通过叶面添食的方法,先后将菜粉蝶微孢子虫(约1.21×108粒)分别添给2、3、4、5龄起蚕各160头食用,随后正常饲养至上蔟结茧、化蛹、羽化。检验死蚕、不结茧蚕、死笼茧及蛾子中菜粉蝶微孢子虫的感染情况。综合统计分析菜粉蝶微孢子虫对各龄期家蚕的危害性和感染的差异性。结果表明:菜粉蝶微孢子虫对家蚕不同龄期的感染力存在显著性差异,随着家蚕龄期的增加,菜粉蝶微孢子虫的感染力逐渐降低。
家蚕;菜粉蝶微孢子虫;感染;研究
家蚕属鳞翅目家养经济昆虫,野外患微粒子病的昆虫是家蚕微粒子病的重要来源,尤其是菜粉蝶,它作为十字花科作物的主要害虫,具有虫口基数大、分布范围广、虫体微孢子虫检出率高的特点。患微粒子病菜粉蝶与家蚕之间存在紧密的交叉感染关系,因此,对菜粉蝶微孢子虫的致病性进行研究,具有一定的代表性和实用性。国内的科技工作者对菜粉蝶微孢子虫的形态特征及对家蚕的病原性也曾开展了大量的工作[1-6],但对家蚕不同龄期的感染率差异未见报道。笔者从野外菜粉蝶(菜青虫的成虫)体内分离到一种微孢子虫,文章利用该菜粉蝶微孢子虫对家蚕各龄期进行添食试验研究,以了解菜粉蝶微孢子虫对家蚕各龄期的危害性和感染的差异性。这将有助于蚕种生产者认识家蚕病原性微孢子虫,为防止野外昆虫对家蚕的交叉感染与各级蚕种检疫、生产提供防治依据和安全保障。
1 材料与方法
1.1 供试蚕品种
经母蛾检验无微粒子病的家蚕原种“青松”,云南省农业科学院蚕桑蜜蜂研究所提供。
1.2 菜粉蝶微孢子虫的收集
于2015年2月在云南蒙自地区捕捉到的野外菜粉蝶,通过研磨,点板镜检,确定患微粒子病的菜粉蝶,将其收集后经过滤、离心等工序对体内的微孢子虫进行分离、提纯、保存于4℃下待用。
1.3 菜粉蝶微孢子虫的分子生物学鉴定
参照碱发芽抽提法(TEK法)[7],进行基因组的提取。利用正向引物18f:CACCAGGTTGATTCTGCC与反向引物1537r:TTATGATCCTGCTAATGGTTC进行该微孢子虫核糖体小亚基基因(SSU rRNA)的克隆与测序。将测序获得的结果进行BlAST分析并下载相似序列,随后用ClustalX1.83软件对所获得的菜粉蝶微孢子虫序列和NCBI数据库中的序列进行比对分析。用MEGA 5.0软件的邻位相连法(neighbor joining,NJ)进行系统发育树作图,选用鳗鱼微孢子虫(Heterosporis anguillarum)作为外群,进行1000次bootstrap校正。
1.4 感染率调查
先进行添食微孢子虫样液的配制,使各龄起蚕添食菜粉蝶微孢子虫数目大致相同,约为1.21× 108粒(浓度为6.06×107粒/mL的孢子液2 mL)。
将家蚕原种“青松”催青孵化后收蚁蚕1 g进行饲养,至2龄饷食时,把蚕分为5个组,每组约160头。分别为2、3、4、5龄饷食时添食及不添食的对照。添食是一次性的,将添食样液用排笔均匀涂抹在桑叶上,待稍凉干后给原蚕食用,待添食桑叶吃完后按常规条件进行饲养,饲喂的桑叶进行全程清洗,以确保饲育过程中桑叶不被微孢子虫污染。
各处理家蚕添食后,及时观察并镜检各区病死蚕感染菜粉蝶微孢子虫情况。上蔟结茧后第7天削茧并进行蚕蛹性别区分,将雌雄蛹分开放置。对不结茧蚕、死笼茧中的病死个体进行镜检,确定其感染菜粉蝶微孢子虫的情况。各处理化蛾后在自然温度下放4 d后再烘烤和镜检,观察记载各处理蚕蛾感染菜粉蝶微孢子虫的情况,计算综合感染的结果,并用方差分析不同龄期家蚕添食菜粉蝶微孢子虫感染后对蛾子产生的影响及其雌雄蛾之间的差异性。
1.5 统计分析方法
对试验结果的统计采用EXCEL 2003数据处理软件和“组内只有单个观察值的两向分组资料的方差分析”的方法[8],对4个龄期感染菜粉蝶微孢子虫的情况进行方差分析,在存在显著性差异的前提下,应用LSR法进行多重比较。
2 结果与分析
2.1 菜粉蝶微孢子虫的分子鉴定
该菜粉蝶微孢子虫(Nosema sp.Mpr-Yunnan)核糖体小亚基基因(SSU rRNA)长1245 bp,序列比对分析发现其与Chen等[9]报道的菜粉蝶微孢子虫(Nosema sp.Mpr)SSU rRNA基因序列相似性为100 %。系统发育树分析结果(图1)显示从云南地区分离到的菜粉蝶微孢子虫与Nosema sp.Mpr处于同一进化分支,表明它们很可能是同一物种,至少具有非常近的亲缘关系。因此,暂定名为Nosema sp.Mpr-Yunnan。
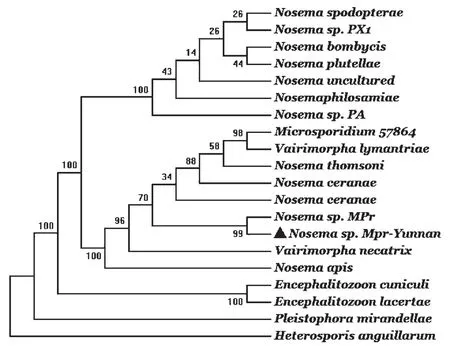
图1 用邻位相连法构建的菜粉蝶微孢子虫核糖体小亚基基因的系统发育树Fig.1 Phylogenetic tree of SSU rRNA gene sequence of Nosema sp.Mpr-Yunnan constructed by the neighbor joiningmethod
2.2 对各龄试验组病死蚕、不结茧蚕、死笼茧微孢子虫的检验
从表1看出,2、3龄期添食菜粉蝶微孢子虫感染的家蚕在幼虫期有死蚕现象发生,4龄期5龄期添食感染的家蚕在幼虫期则没有发生死蚕,都能正常上蔟结茧。幼虫期只有2龄试验组有1头死亡的家蚕感染了菜粉蝶微孢子虫,但3龄试验组在不结茧蚕和死笼茧中、4龄试验组在死笼茧中可检验到部分感染了微孢子虫的死亡个体,而5龄试验组和对照组则没有因微孢子虫的感染而死亡的幼虫。说明添食感染时间越早,不结茧蚕、死笼茧增多,相应感染了菜粉蝶微孢子虫的头数也随之增多。总之,随着添食龄期的增加,死亡的个体中微孢子虫感染率逐渐升高,2龄试验组感染率高达85.1%,3龄4龄试验组感染率逐渐下降,5龄试验组感染率则为零。
2.3 对各试验组家蚕雌雄蛾感染菜粉蝶微孢子虫的检验
从表2看出,各处理装袋家蚕雌雄蚕蛾各50头,分别检验100头,同一试验组雌雄蛾感染菜粉蝶微孢子虫数量差异不明显。5龄试验组感染率雌雄平均只有33%,2龄试验组蚕蛾的平均感染率高达100%,全部蚕蛾被菜粉蝶微孢子虫感染。即添食龄期越小,感染率越高,蚕蛾体内菜粉蝶微孢子虫数目越大,每视野中看到的微孢子虫数量越多。
2.4 各试验组家蚕感染菜粉蝶微孢子虫检验综合情况结果
各试验组家蚕感染菜粉蝶微孢子检验综合结果如图1所示,综合感染率随着龄期的增加而下降,由2龄试验组的95.24%逐渐下降至5龄试验组的28.95%,对照为0。
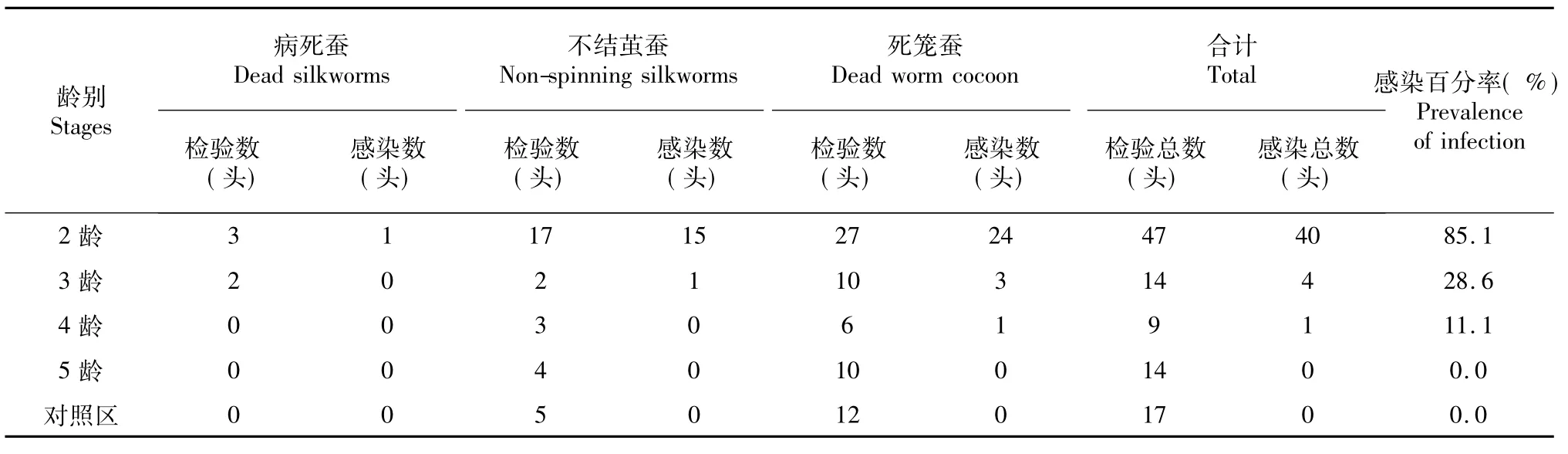
表1 各龄试验组病死蚕、不结茧蚕、死笼茧中感染微孢子虫的情况Table 1 The infection situation of dead silkworms,non-spinning silkworms and dead worm in cocoon bymicrosporidia
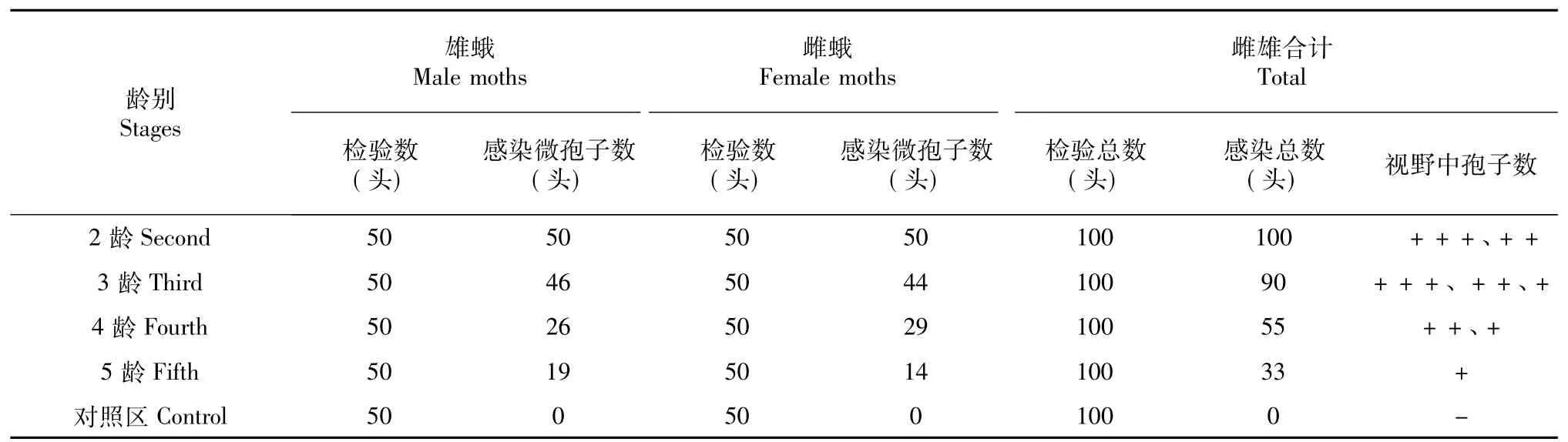
表2 各试验组家蚕雌雄蛾感染菜粉蝶微孢子虫的情况Table2 The infection situation of female silkworm moths and male silkworm moths bymicrosporida
2.5 方差分析雌雄蛾之间、各龄期之间感染菜粉蝶微孢子虫的差异性
由表3所得,龄期间F=85,大于v1=3,v2=3的F0.01=29.46,推断各龄期间有极显著差异,需进一步做差异显著性比较。而雌雄蛾间F=0.35<1,即F值小于v1=1,v2=3的F0.05=10.13,推断雌雄间无显著差异,不需作多重比较。龄期间比较分析如下:SE=1.68,按v=3,查表得p=2,3,4,5时的SSR0.05和SSR0.01值,并按LSRa=SE×SSRa计算可得到P时的LSR0.05和LSR0.01的值见表4。4个龄期间添食后蛾子感染的差异显著性见表5。
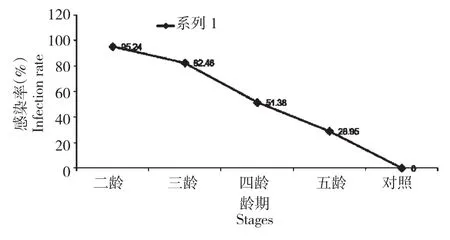
图1 各试验组家蚕感染菜粉蝶微孢子虫综合情况Fig.1 Comprehensive situation of silkworms infected bymicrosporidia from every experimental group
通过家蚕4个龄期的添食试验,比较感染蛾子的差别,2龄与3龄间无显著差异,2龄、3龄与4龄、5龄间感染差异达1%极显著水平,4龄与5龄间感染差异达1%极显著水平。
3 讨论
根据试验分析,幼虫期死亡的,除2龄、3龄试验组均有外(因菜粉蝶微孢子虫感染而死亡的概率极低),4龄、5龄试验组和对照组则没有死亡的个体。添食时间越早,不结茧蚕、死笼茧会越多,感染菜粉蝶微孢子虫的头数也越多,2龄试验组的感染率高达85.1%,随着龄期增加,死亡个体中感染菜粉蝶微孢子虫的概率逐渐下降,5龄试验组的菜粉蝶微孢子虫检出率为零。通过镜检蚕蛾,发现各试验组菜粉蝶微孢子虫的感染率随着龄期的增加而下降,2龄试验组雌雄蚕蛾平均感染率高达100%,而5龄试验组雌雄蚕蛾的平均感染率为33%。综合看,2龄试验组感染率为95.24%,3龄试验组感染率为82.46%,四龄试验组感染率为51.38%,5龄试验组感染率为28.95%,对照则无感染。添食越早,感染率越高,每镜检视野中微孢子数量越多,相互污染的机会也越多,给蚕种生产和检疫工作带来的不利因素也越大。方差分析认为,菜粉蝶微孢子虫给家蚕添食后对雌雄蚕蛾的感染率没有差异性,而添食后对家蚕各龄期之间的感染率除2龄与3龄间无显著差异外,其余各龄期间都有显著差异。

表3 各龄期蛾子之间、雌蛾雄蛾之间感染菜粉蝶微孢子虫的差异性方差分析Table 3 Variance analysis of themoths of different instar,female and malemoths infected bymicrosporidia

表4 各龄期的LSR值Table 4 The LSR values of different instar
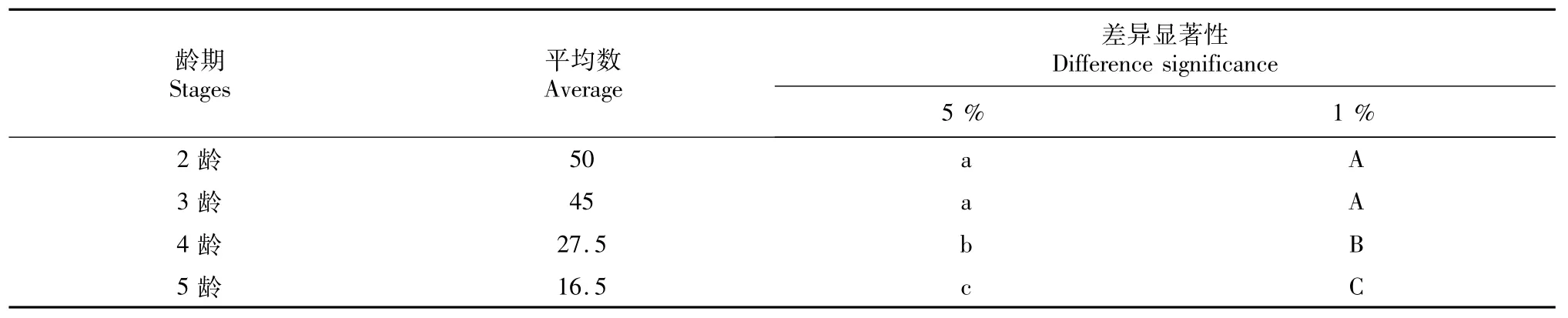
表5 各龄期蛾子感染菜粉蝶微孢子虫的显著差异性分析Table 5 Analysis of the difference significance for themoths of different instar larvae infected bymicrosporidia
通过试验,基本明确了菜粉蝶微孢子虫对家蚕的感染性和致病性。如果在蚕的幼虫阶段食下菜粉蝶微孢子虫,家蚕能正常生长、发育,完成其生活世代[9]。添食相同数量的菜粉蝶微孢子虫,蚕龄期越小,蚕体对菜粉蝶微孢子虫感染的抵抗力越弱,感染率越高,蚕龄期越大,蚕体对菜粉蝶微孢子虫感染的抵抗力越强,感染率下降。家蚕感染菜粉蝶微孢子虫的时期早与迟,对丝茧育的产茧量影响不大,但对种茧育影响很大,这给各级蚕种生产对母蛾检验中的微孢子虫鉴别带来了难度[10],给病害管理及蚕种检验后的合格判定带来了困难,母蛾微粒子病的检出率上升,就会增加蚕种淘汰的风险率[11]。因此,在蚕种繁育过程中,各种茧育的生产基地,要避免野外昆虫的交叉感染,尤其要阻止以菜粉蝶为代表的微孢子虫对家蚕的危害。
[1]万水继.从种茧养蚕分离的具有形态差异的N,bombycis类微孢子虫的研究[J].四川蚕业,1988(3):11-13.
[2]郑祥明,杨琼,方定坚,等.广东省昆虫微孢子虫资源调查及交叉感染的研究[J].蚕业科学,2003,29(4):380-383.
[3]廖模祥,刘吉平,张国平,等.野外昆虫来源微孢子虫与家蚕微粒子病发生的相关性研究[J].中国蚕业,2011(1):17-20.
[4]潘敏慧,崔红娟,万永继,等.菜粉蝶微孢子虫的多态性及对家蚕感染性的初步研究[J].四川蚕业,1999(3):10-11.
[5]杨琼.粉蝶属昆虫四种微孢子虫及对家蚕病原性研究[D].广州:华南农业大学,1999.
[6]郑祥明,杨琼,黄炳辉,等.菜粉蝶分离的微孢子虫对家蚕的病原性研究[J].广东蚕业,1997,31(2):41-44.
[7]Chen D R,Shen Z y,Zhu F,et al.Phylogenetic characterization of amicrosporidium(Nosema sp.MPr)isolated from the Pieris rapae[J]Parasitology Research,2012,111(1):263-269.
[8]马育华.田间试验和统计方法(第2版)[M].北京:农业出版社,1993.
[9]陈世良,杨荣贵,高建华,等.菜粉蝶微孢子虫对家蚕胚种传染性与蚕桑质量影响研究[J].江苏农业科学,2015,43(8):241-243.
[10]刘吉平,曾玲.微孢子虫生物多样性研究的评述[J].昆虫知识,2006,43(2):153-158.
[11]陈世良,高翔,张金祥,等.云南菜粉蝶微孢子虫感染家蚕的病原性研究[J].西南农业学报,2015,29(2):913-917.
(责任编辑 王家银)
Difference Analysis of Silkworm Larvae w ith Different Instars Infected by M icrosporidia Isolated from Pieris rapae L.
CHEN Shi-liang,XIAO Sheng-yan,YANG Rong-gui,GAO Jian-hua,GAO Xiang,ZHU Feng,ZHANG Yong-hong,LIAO Peng-fei*
(Institute of Sericulture and Apiculture,Yunnan Academy of Agricultural Sciences,Yunnan Mengzi661101,China)
In order to explore the diversity of infectivity of the silkworm larvaewith different instars infected by themicrosporidia isolated from Pieris rapae L,the cabbage butterfly were collected from Mengzi,Yunnan province.Themicrosporidian spores were isolated from the cabbage butterfly,purified and identified.The second,third,fourth,and fifth instar silkworm larvae(160 larvae/group)were respectively fed with themulberry leaveswhich was treated with themicrosporidian spores(approximately 1.21×108spores).Then the silkwormswere normally fed with the clean mulberry leaves until to cocooning,pupating and eclosion.The infection situation of dead silkworms,non-spinning silkworms,dead worm in cocoon and silkworm moth was researched.The diversity of infectivity of the silkworm larvae with different instars infected by themicrosporidiawas analyzed according to the statistical results.The results indicated that therewas significant difference of the infection rate among the silkworm larvae with different instars infected by microsporidia isolated from Pieris rapae L.The infection rate of silkworm infected bymicrosporidia was gradually decreased with the increase of age.
Silkworm larvae with different instars;Microsporidia isolated from Pieris rapae L.;Infection;Research
S884.72
A
1001-4829(2017)2-0481-04
10.16213/j.cnki.scjas.2017.2.040
2016-04-15
陈世良(1964-),男,云南陆良人,本科,副研究员,主要从事蚕种质量监督检验检疫研究工作,E-mail:chenshl123 @163.com,*为通讯作者,E-mail:liaolpf@126.com。
