人参茎叶总皂苷对顺铂致小鼠肾损伤的保护作用及机制
2017-04-10韩欣月孙印石许兴月李慧萍
韩欣月,王 梓,李 伟,孙印石,许兴月,唐 姗,李慧萍
(1.吉林农业大学中药材学院,吉林长春 130118;2.中国农业科学院特产研究所,吉林长春 130112)
人参茎叶总皂苷对顺铂致小鼠肾损伤的保护作用及机制
韩欣月1,王 梓1,李 伟1,孙印石2,许兴月1,唐 姗1,李慧萍1
(1.吉林农业大学中药材学院,吉林长春 130118;2.中国农业科学院特产研究所,吉林长春 130112)
目的 观察人参茎叶总皂苷(GSLS)对顺铂(CDDP)诱导肾损伤小鼠的保护作用,并探讨其可能机制。方法 32只雄性ICR小鼠随机分为正常对照组、CDDP模型组(一次性ip给予CDDP 20 mg·kg-1诱导小鼠肾损伤)、CDDP+GSLS 150和300 mg·kg-1给药组。给药组连续给予GSLS 7 d,末次给药1 h后,一次性ip给予CDDP 20 mg·kg-1诱导小鼠肾损伤,继续给予GSLS 150和300 mg·kg-13 d,分别采用脲酶法和肌氨酸氧化酶法检测小鼠血尿素氮(BUN)和肌酐(CRE)水平,评价肾功能的变化;分别采用可见光法和微量酶标法检测肾组织中过氧化氢酶(CAT)和还原型谷胱甘肽(GSH)水平,评价小鼠肾组织中氧化应激的水平;采用生物素双抗体夹心酶联免疫吸附法检测肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β),评价肾组织中炎症水平;HE和PAS染色法观察肾组织病理变化;TUNEL和Hoechst33258染色法观察细胞凋亡。结果与正常对照组比较,CDDP组小鼠体质量显著下降(P<0.05),肾指数和血清中CRE,BUN,TNF-α和IL-1β水平显著升高(P<0.05,P<0.01),其中CRE和BUN分别升高了1倍和3倍,肾组织CAT和GSH显著下降(P<0.05);CDDP组肾组织中出现肾小球肿胀、肾小管扩张、肾小球上皮细胞坏死,管腔内出现透明管型,细胞核固缩或消失,肾间质水肿和炎症细胞浸润,大量糖原沉积,此外还有大量的TUNEL阳性细胞和Hoechst33258阳性细胞表达;与CDDP组比较,GSLS各治疗组小鼠血清中CRE和BUN水平明显降低(P<0.05,P<0.01),肾组织糖原沉积减少,肾小管上皮细胞凋亡减少(P<0.05);CDDP+GSLS 300 mg·kg-1组TNF-α和IL-1β显著降低(P<0.05),CAT和GSH显著升高(P<0.05),肾组织坏死程度减轻(P<0.05)。结论GSLS对CDDP诱导的小鼠肾损伤具有保护作用,其机制可能与改善氧化应激、减少炎症反应及抗细胞凋亡有关。
皂苷;顺铂;肾损伤;氧化应激;炎症
顺铂全名为顺式-1,2-二氯二氨合铂(CDDP),是当前临床上最有效和最常用的抗肿瘤药物之一,广泛用于卵巢癌、前列腺癌、肺癌、鼻咽癌、恶性淋巴癌、乳腺癌、甲状腺癌及成骨肉瘤等多种实体肿瘤的治疗。目前,在美国和加拿大治疗头颈部癌、睾丸癌和卵巢癌等18种癌症的推荐药物中,CDDP被推荐为首选药物[1]。有研究发现,CDDP的疗效随着给药剂量的增加而增加,其对机体产生的毒副作用亦会随着剂量的增加而增加,如肾毒性、耳毒性、神经毒性及胃肠道反应等,其中肾毒性最为严重,使其临床应用受到限制[2-4]。
CDDP所致肾损伤一般是可逆的,但在大剂量或连续给药时,可使肾小管损伤表现为不可逆性[5]。据统计,临床用CDDP化疗所致肾损伤发生率约为30%[6]。CDDP所致肾毒性的机制尚不十分清楚[7]。当前,国内外学者致力于减轻CDDP肾毒性的研究工作,但在临床上可应用的药物迄今为止甚少[8]。临床上采用水方法或渗透性利尿药可减少CDDP毒性,但其肾毒性的发生率仍然>30%[9]。因此,如何减轻CDDP肾毒性仍是当前的研究热点。
血肌酐(creatinine,CRE)和尿素氮(blood urea nitroge,BUN)是机体蛋白质的代谢产物,反映氮的分解和肾的排泄功能,因此二者常被作为肾组织损伤程度的指标[10]。近年来研究表明,CDDP所致肾损伤与氧化应激和抑制肾皮质清除自由基的能力有关[11-12]。过氧化氢(H2O2)是一种代谢过程中产生的废物,它会对机体造成损害,而过氧化氢酶(catalase,CAT)能有效催化过H2O2分解。还原型谷胱甘肽(glutathione,GSH)是一种非酶抗氧化剂,可与某些药物、毒素等结合而具有整合解毒作用,对CDDP所致肾损伤起保护作用[13]。研究表明,肾GSH的减少可大大增加CDDP的毒性和肾对化学氧化损伤的敏感性。机体在氧化应激状态下,大量产生的氧自由基如不能及时清除,诱发生物膜中不饱和脂肪酸的脂质过氧化反应,结果导致脂肪酸链和细胞膜完整性的破坏[14]。肾是机体中主要的代谢器官,易受各种应激刺激的影响。研究确认氧化应激促发肾组织脂质过氧化的链式反应,损伤肾组织细胞。
肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)是参与炎症反应和免疫应答的主要细胞因子,其含量与病情的发展具有相关性[15],可作为炎症过程中具有标志的因子。
人参为五加科人参属植物人参(Panax gin⁃seng C.A.Meyer)的干燥根及根茎,是药用历史悠久的名贵中药,始载于《神农本草经》,列为上品[16]。人参的主要活性成分为人参皂苷[17],为了综合利用人参的地上部分,人们开始对人参茎叶的化学成分进行研究,发现人参茎叶含有大量的茎叶皂苷(约7%~16%),其药理活性与人参根类似[18]。
人参茎叶总皂苷(total saponins from stems and leaves of P.ginseng,GSLS)是2015年版《中国药典》收载的品种,由于其富含人参皂苷并具有显著的生理活性,一直是国内外学者研究的热点,研究发现人参皂苷具有抗高脂血症及清除氧自由基的作用[19],但尚未见其对顺铂诱导小鼠肾损伤保护作用的相关研究报道。本研究探讨GSLS对CDDP诱导小鼠肾损伤的保护作用及其可能机制,为深入开发皂苷类成分的肾损伤保护治疗剂提供理论参考。
1 材料与方法
1.1 实验动物、药品、试剂和仪器
SPF级雄性ICR小鼠32只,体质量22~25g,(长春市亿斯实验动物技术有限责任公司),合格证号:SCXK(吉)2011-0004。动物饲养条件符合实验动物福利伦理委员会的要求,小鼠自由摄食和饮水,室温(23.0~25.0)℃,湿度55%~65%,明暗交替12 h的环境中适应性饲养,饲养1周后开始实验。
GSLS(纯度>80%,紫外线法),(抚松县安东参业有限公司);CDDP(规格1g,99.0%Pt.>64.5%,批号:C02150206)(上海思域化工科技有限公司);苏木素-伊红染液(HE),CRE,BUN,CAT,GSH试剂盒(南京建成生物工程研究所);TNF-α和 IL-1β ELISA试剂盒(美国 R&D公司);Hoechst33258染色液(上海碧云天生物技术有限公司);PAS染色液(北京雷根生物技术有限公司);其余试剂均为分析纯。
PL303电子天平(上海梅特勒-托利多仪器有限公司);HC-2517高速离心机(安徽中科中佳科学仪器有限公司);T10高速组织匀浆机(德国IKA);SPECTRO star Nano全波长扫描式酶标仪(德国BMG LABTECH公司);显微镜Leica DM 500和Leica DM 2500荧光显微镜(德国徕卡)。
1.2 实验分组及处理
ICR小鼠适应性饲养1周后,随机分为4组,正常对照组(ig给予同样剂量的生理盐水)、CDDP模型组(一次性ip CDDP 20 mg·kg-1)、CDDP+ GSLS 150,300 mg·kg-1给药组(ig给予GSLS),每组8只。给药组连续给药7 d,末次给药1 h后,一次性ip给予CDDP 20 mg·kg-1诱导小鼠肾损伤,继续给予GSLS 150和300 mg·kg-13 d。所有小鼠在ip给予CDDP 72 h后眼眶静脉丛取血,全血离心(3500×g,4℃)2次,每次5 min,收集血清。解剖前12 h禁食不禁水,解剖后取肾组织,左肾置于-80℃保存,用于生化指标检测;右肾固定在10%甲醛中用于组织病理学分析。
1.3 体质量和脏器系数的测定
计算实验前后小鼠体质量的差值,记为体质量变化值。连续给药10 d,处死小鼠,称取肝、脾和肾质量,计算脏器系数,脏器系数=脏器质量(g)/体质重(g)×100[20]。
1.4 试剂盒测定血清中CRE,BUN和肾组织中GSH,CAT的含量
采用肌氨酸氧化酶法和脲酶法试剂盒测定血清中CRE和BUN水平。取冻存的肾组织,制备组织匀浆,取上清液,采用二硫代对硝基苯法和钼酸铵法试剂盒测定GSH和CAT的水平,按照试剂盒说明书进行操作,采用酶标仪在405 nm波长处测定各自的吸光度(A405nm)值,根据说明书要求计算含量。
1.5 ELISA法检测血清TNF-α 和IL-1β 含量
采用ELISA法测定血清中炎症因子TNF-α和IL-1β的水平,按照试剂盒说明书进行操作,采用酶标仪在450 nm波长处测定A450nm值,根据标准曲线计算含量。
1.6 HE和PAS染色法检测肾组织病理变化
1.6.1 HE染色
取小鼠肾组织,经过固定、透明、脱水、浸蜡和包埋,制作常规病理切片,切片厚度5 μm。每组取4张切片,通过二甲苯进行常规脱蜡,梯度乙醇脱水至水化,苏木素对细胞核进行染色,自来水返蓝,伊红对细胞质进行染色,常规脱水和透明,最后用中性树胶封片。通过光学显微镜对肾组织结构病变情况进行观察。病理标本进行编号,每组选取3个标本在光学显微镜400倍视野下随机选取8个视野,根据肾小管损伤程度进行评分[22]。0:无损伤;1:肾小管上皮肿胀,出现炎性细胞浸润;2:肾小管出现大面积炎性细胞浸润,管腔扩张;3:肾小管上皮细胞核染色消失,管腔明显扩张;4:肾小管结构破坏,上皮细胞无核着色。利用Ridit分析[23]HE染色结果。
1.6.2 PAS染色
每组随机取4个样本,每个样本选3张片子进行常规石蜡切片,切片厚度5 μm,石蜡切片脱蜡和水化,PAS染液进行染色,脱水和透明,最后中性树胶封片封存。光学显微镜下观察肾组织变化。
1.7 Hoechst33258和TUNEL染色法检测肾小管细胞凋亡
1.7.1 Hoechst33258染色
取厚度5 μm的切片,用Hoechst33258进行染色。首先进行常规脱蜡和水化,染色,逐级常规乙醇脱水,二甲苯透明,最后封片。在荧光显微镜下观察肾组织细胞核变化以及凋亡状态。细胞核亮度增强的为阳性表达,显微镜下随机选取3个高倍视野,计算肾小管阳性细胞数和肾小管细胞总数[21]。肾小管细胞凋亡率(%)=肾小管阳性细胞数/肾小管细胞总数×100%
1.7.2 TUNEL染色
取厚度5 μm的石蜡切片,进行TUNEL染色。光学显微镜下观察肾组织细胞核变化及凋亡。细胞核染成棕色为阳性表达,计算肾小管细胞凋亡率。
1.8 统计学方法
2 结果
2.1 GSLS对CDDP致肾损伤小鼠体质量及脏器系数的影响
正常对照组小鼠生长情况良好,毛顺色亮,体质量增加。表1结果显示,与正常对照组相比,CDDP组毛色成缕,且无光,体质量减轻,但并无小鼠死亡,脾系数显著降低(P<0.01),肾系数显著升高(P<0.05),表明小鼠肾和脾受到损伤。与CDDP组相比,CDDP+GSLS 300 mg·kg-1组,小鼠毛色明显好转,体质量下降得到缓解,CDDP+GSLS 150 mg·kg-1组脾系数降低以及CDDP+GSLS 300 mg·kg-1组肾系数升高的幅度都得到明显改善(P<0.05)。各组肝系数均无明显变化。
2.2 GSLS对CDDP致肾损伤小鼠血清BUN,CRE水平及肾组织GSH和CAT水平的影响
与正常对照组相比,CDDP组小鼠血清中的CRE和BUN水平显著升高(P<0.01),表明肾组织受到损害,顺铂肾损伤造模成功;与模型组比较,CDDP+ GSLS和300 mg·kg-1组血清中CRE和BUN水平显著降低(P<0.05,P<0.01)(图1)。
与正常对照组相比,CDDP组小鼠肾组织匀浆中GSH和CAT的水平均显著降低(P<0.05);与模型组相比,CDDP+GSLS 150 mg·kg-1组组织匀浆中GSH和CAT水平无明显变化;CDDP+GSLS 300 mg·kg-1组GSH和CAT水平均显著升高(P<0.05)。表明GSLS 300 mg·kg-1能够通过调节GSH和CAT的氧化应激水平,从而起到肾保护作用(图1)。

Tab.1 Effect of total saponins from stems and leaves of P.Ginseng(GSLS)on body mass,and indices of liver,spleen and kidney in cisplatin(CDDP)-induced acute kidney injury mice

Fig.1 Effect of GSLS on creatinine(CRE)and blood urea nitroge(BUN)in serum,and glutathione(GSH)and catalase(CAT)levels in kidney tissue of CDDP-induced acute kidney injury mice.See Tab.1 for mouse treatment.,n=8.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with CDDP group.
2.3 GSLS对CDDP致肾损伤小鼠血清中TNF-α和IL-1β水平的影响
与正常对照组比,CDDP组小鼠血清中TNF-α和IL-1β的水平显著升高(P<0.05);与CDDP组相比,CDDP+GSLS 150mg·kg-1组血清中TNF-α和IL-1β水平变无明显变化;CDDP+GSLS300mg·kg-1组血清中TNF-α和IL-1β的水平显著降低(P<0.05)。表明GSLS 300 mg·kg-1能通过抑制炎症反应从而发挥肾保护作用(图2)。
2.4 GSLS对CDDP致肾损伤小鼠组织形态的影响
2.4.1 HE染色
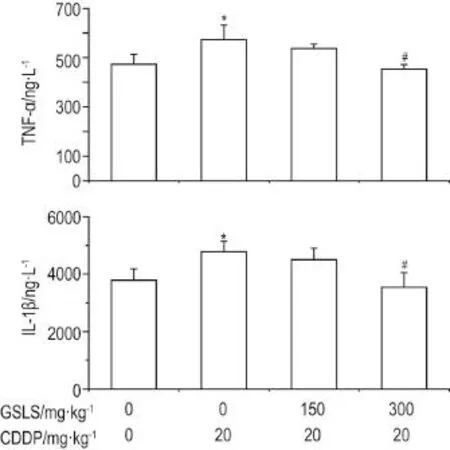
Fig.2 Effect of GSLS on levels of tumor necrosis factor α(TNF-α )and interleukin-1β (IL-1β )of CDDP-induced acute kidney injury mice.See Tab.1 for mouse treatment.,n=8.*P<0.05,compared with normal control group;#P<0.05,compared with CDDP group.
根据HE染色结果(图3),正常对照组肾组织中,肾小球及其周围肾小管结构正常且清晰,细胞外基质分布均匀,无病变现象;而CDDP组中肾小球肿胀,体积明显增大,囊腔模糊,肾小管扩张,肾小管上皮细胞部分坏死,管腔内出现透明管型,细胞核固缩或消失,肾间充质水肿,间质内炎性细胞浸润;CDDP+GSLS 150 mg·kg-1组与CDDP组比较,肾小管上皮细胞坏死程度减轻,细胞核固缩和消失现象减少;CDDP+GSLS 300 mg·kg-1组肾小球囊腔内结构清晰,肾小管上皮细胞坏死明显减少,透明管型现象减少,间充质内水肿及中性粒细胞浸润减少,细胞形态基本恢复正常。根据Ridit分析可知,CDDP组与正常对照组比较出现更高的肾小管坏死等级,同时GSLS 300 mg·kg-1+CDDP组与CDDP组相比,坏死等级降低(P<0.05)(表2)。
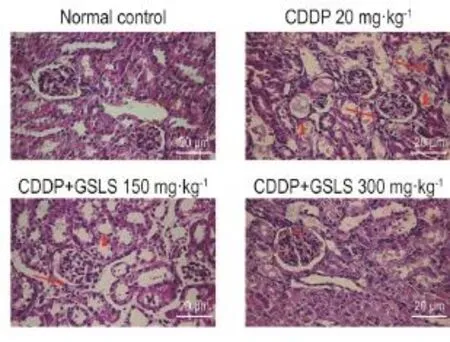
Fig.3 Effect of GSLS on pathological changes of acute kidney injury mice induced by CDDP(HE staining).See Tab.1 for mouse treatment.The arrows show renal pathological changes including renal tubular epithelial cell necrosis,cell structure collapse and inflammatory infiltration.
2.4.1 PAS染色
根据PAS染色结果(图4),正常对照组小鼠肾小球和肾小管较少糖原沉积,着色较淡,未见病理变化;CDDP组肾小球基底膜增厚,系膜基质增生,大量糖原沉积,部分肾小管轻度萎缩或管腔扩张,上皮细胞坏死,细胞核消失;CDDP+GSLS 150 mg·kg-1组肾小球和肾小管细胞内糖原沉积减少;CDDP+GSLS 300 mg·kg-1组细胞形态基本恢复正常。
2.5 GSLS对CDDP致肾损伤小鼠细胞凋亡的影响
2.5.1 Hoechst33258染色
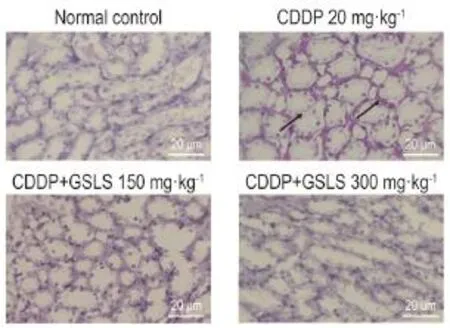
Fig.4 Effect of GSLS on pathological changes in acute kidney injury mice induced by CDDP(PAS staining).See Tab.1 for mouse treatment.The arrows show the glycogen deposition.

Tab.2 Effect of GSLS on pathological changes of acute kidney injury mice induced by CDDP analyzed by renal tubular necrosis grade

Fig.5 Effect of GSLS on CDDP-induced apoptosis by Hoechst33258 staining(A)and TUNEL staining(B).See Tab.1 for mouse treatment.The arrows show renal tubular epithelial cell apoptosis.A2 and B2 was semi-quatitative results of A1 and B1,respectively.*P<0.05,compared with normal control group;#P<0.05,compared with CDDP group.
根据Hoechst33258染色结果(图5A1),正常对照组未见蓝色荧光细胞核,说明无细胞凋亡;CDDP组出现大量分布均匀的蓝色荧光细胞核,细胞核结构破碎,且荧光强度较强;CDDP+GSLS 150和300 mg·kg-1组蓝色荧光细胞核减少,说明GSLS能够显著抑制细胞凋亡。由图5A2可知,CDDP组细胞凋亡率升高(P<0.01),给予GSLS治疗后,CDDP+ GSLS150和300mg·kg-1组细胞凋亡率降低(P<0.05)。
2.5.2 TUNEL染色
根据TUNEL染色结果(图5B1),正常对照组小鼠正常细胞结构清晰可见,无病理变化;CDDP组肾小管上皮细胞核呈棕色,且阳性表达较多,同时可见细胞核不同程度裂解。CDDP+GSLS 150和300 mg·kg-1组损伤有不同程度的缓解。由图5B2可知,CDDP组与正常对照组相比,细胞凋亡率增加(P<0.01),在给予GSLS治疗后,CDDP+GSLS 150和300 mg·kg-1组与CDDP组相比细胞凋亡率均降低(P<0.05)。
3 讨论
本研究结果表明,CDDP 20 mg·kg-1诱导小鼠血清CRE和BUN水平显著升高的同时,肾组织中的GSH和CAT水平显著降低。GSLS给药组,血清CRE和BUN水平降低,GSH和CAT水平升高,CDDP所致小鼠肾功能损伤得到不同程度的恢复。应用CDDP腹腔注射诱导急性肾损伤,结果显示,顺铂注射后小鼠血清中TNF-α和IL-1β的水平明显升高,而CDDP+GSLS 150和300 mg·kg-1组TNF-α和IL-1β水平均不同程度地降低,表明GSLS能够通过抑制炎症反应发挥肾保护作用。
HE染色中苏木素使细胞核呈紫蓝色,细胞浆呈红色,因此组织成分与病变的一般形态结构特点均可显示出来;PAS染色可观察到组织中的糖原以及肾小球基底膜的着色,进而观察组织病理变化。本研究同时进行了HE染色和PAS染色。对肾组织进行病理学检测。两种结果同时表明,GSLS对CDDP诱导的肾组织损伤具有治疗效果。
Hoechst33258为特异性DNA染料,与A-T键结合,这种染料对死细胞立即染色,而活细胞的着色是渐进的,在荧光显微镜下,活细胞呈弥散均匀荧光,出现凋亡时,细胞核或细胞质内可见浓染的颗粒状荧光;TUNEL染色是对组织细胞凋亡早期过程中细胞核DNA断裂情况的检测,与断裂DNA的3′-OH端特异性结合,出现凋亡时呈深棕色。为了进一步佐证Hoechst33258染色结论,本研究又进行了TUNEL染色。研究结果表明,GSLS各组凋亡现象明显减少,说明GSLS通过抗凋亡作用发挥肾保护作用。
肾小管上皮细胞过度损伤是急性肾功能异常的重要机制。当损伤程度相对较轻时导致细胞凋亡,较重时致使细胞死亡,可通过药物治疗降低细胞损伤,从而达到治疗疾病的目的[24]。
本研究结果表明GSLS对顺铂诱导肾损伤小鼠的保护作用,其可能的机制包括抑制氧化应激,减少炎症反应及抑制细胞凋亡。GSLS主要包括二醇型皂苷(Rb1,Rb2,Rc和Rd)和三醇型皂苷(Rg1和Re),而具体何种皂苷发挥肾保护作用将是以后研究重点。
综上所述,GSLS通过改善氧化应激水平,减少炎性反应,以及抗细胞凋亡途径,减轻CDDP诱导的小鼠肾损伤。
[1]Dasari S,Tchounwou PB.Cisplatin in cancer ther⁃apy:molecular mechanisms of action[J].Eur J Pharmacol,2014,740:364-378.
[2]Xue Y,Li QX,Li S.Protective effects of ligustrazine on cisplatin-induced oxidative injury of kidneys in rats[J].Her Med(医药导报),2012,31(2):150-152.
[3]Zhang L,Liu FY,Peng YM,Li DW,Zeng N,Wu R,et al.The effect of vitamin E on cisplatin induced nephrotoxicity in mice and its mechanism[J].Antitumor Pharm(肿瘤药学),2012,2(5):343-346,350.
[4]Miller RP,Tadagavadi RK,Ramesh G,Reeves WB. Mechanisms of cisplatin nephrotoxicity[J].Toxins(Basel),2010,2(11):2490-2518.
[5]Harmers FP,Gispen WH,Neijt JP.Neurotoxic side-effects of cisplatin[J].Eur J Cancer,1991,27(3):372-376.
[6]Teng ZY,Cheng XL,Cai XT,Yang Y,Sun XY,Xu JD,et al.Ancient Chinese formula Qiong-Yu-gao protects against cisplatin-induced nephrotoxicity without reducing anti-tumor activity[J].Sci Rep,2015,5:15592.
[7]Jung K,Lee D,Yu JS,Namgung H,Kang KS,Kim KH,et al.Protective effect and mechanism of action of saponins isolated from the seeds of gac(Momordica cochinchinensis Spreng.)against cisplatin-induced damage in LLC-PK1 kidney cells[J]. Bioorg Med Chem Lett,2016,26(5):1466-1470.
[8]Guo PP,Ma XY,Gao LP.Preventive effects of Rhodiola on cisplatin-induced nephrotoxicity in mouse[J].Lishizhen Med Mater Med Res(时珍国医国药),2013,24(5):1122-1123.
[9]Ramesh G,Reeves WB.Salicylate reduces cisplatin nephrotoxicity by inhibition of tumor necrosis factoralpha[J].Kidney Int,2004,65(2):490-499.
[10]Hermida J,Romero R,Tutor JC.Relationship between serum cystatin C and creatinine in kidney and liver transplant patients[J].Clin Chim Acta,2002,316(1-2):165-170.
[11]Chirino YI,Pedraza-Chaverri J.Role of oxidative and nitrosative stress in cisplatin-induced nephrotoxicity[J].Exp Toxicol Pathol,2009,61(3):223-242.
[12]Xu H,Chang LL,Ma TJ,Lou XY,Ren L.Effects of breviscapine on renal cell apoptosis and expression of apoptosis-related proteins in mice with cispl⁃atin-induced nephrotoxicity[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2013,19(6):260-263.
[13]Chen J,Mei Q,Xu YC,Du J,Wei Y,Xu ZM. Effects of matrine injection on T-lymphocyte subsets of patients with malignant tumor after gamma knife radiosurgery[J].J Chin Integr Med(中西医结合学报),2006,4(1):78-79.
[14]Yousef MI,Hussien HM.Cisplatin-induced renal toxicity via tumor necrosis factor-α,interleukin 6,tumor suppressor P53,DNA damage,xanthine oxidase,histological changes,oxidative stress and nitric oxide in rats:protective effect of ginseng[J].Food Chem Toxicol,2015,78:17-25.
[15] Sabry A,Elbasyouni SR,Sheashaa HA,Alhusseini AA,Mahmoud K,George SK,et al.Correlation between levels of TNF-alpha and IL-6 and hemato⁃logical involvement in SLE Egyptian patients with lupus nephritis[J].Int Urol Nephrol,2006,38(3-4):731-737.
[16]Gao WB,Mi J,Qin QJ,Sun JH,Wu W,Wang SM, et al.Anti-fatigue effects of ginseng and its processed products[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(19):210-213.
[17]Li Y,Zhang TJ,Liu SX,Chen CQ.Research progress on chemical constituents and pharmaco⁃logical activities of Panax Gin Seng[J].Chin Tradit Herb Drugs(中草药), 2009,40(1):164,A1-A2.
[18]Li FL.Research progress is pharmacology effect about ginsenosides from stems and leaves of Panax ginseng[J].Guizhou Agric Sci(贵州农业科学),2013,41(2):54-57.
[19]Song Q,Zhang XW,Xu ZW,Chen JW,Tang FT. Protective effects of preconditioning with ginseng stem and leave saponin against myocardium isch⁃emia and reperfusion injury in spontaneously hypertensive rats[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2008,22(1):42-48.
[20]Liao YJ,Jin YP,Tang H.Combined effects of agents against nephrotoxicity induced by cisplatin in mice[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2009,23(3):219-224.
[21]Li G,Zhang HX,Wang YP,Zhang J,Hong K,Tian XJ,et al.Protective effect of phloroglucinol on renal ischemia and reperfusion injury[J].J Peking Univ(Health Sci),北京大学学报(医学版),2015,47(5):743-748.
[22]Gao Q.Protective effect of flavonoids extracted from Semen Ziziphi spi on the renal injury of diabetes nephropathy rats[J].J Anhui Agri Sci(安徽农业科学),2013,41(6):2355-2357.
[23]Wang JY,Wang LL,Li B,Liu FF,Sun CB,Zhang J. Effect of velvet antler on human embryonic kidney cell injury induced by cisplatin[J].J Jilin Agri Univ(吉林农业大学学报),2015,37(6):694-697,714.
Protective effect of total saponins from stems and leaves of Panax ginseng on cisplatin-induced kidney damage in mice and its mechanism
HAN Xin-yue1,WANG Zi1,LI Wei1,SUN Yin-shi2,XU Xin-yue2,TANG Shan1,LI Hui-ping1
(1.College of Chinese Medicinal Materials,Jilin Agricultural University,Changchun 130118,China; 2.Institute of Special Wild Economic Animals and Plants,Chinese Academy of Agricultural Sciences,Changchun 132109,China)
OBJECTIVE To investigate the protective effect of total saponins from stems and leaves of Panax ginseng(GSLS)on cisplatin(CDDP)-induced kidney damage in mice and its possible mechanism.METHODS Thirty-two male ICR mice were randomly divided into normal control group,CDDP group,and GSLS(150 and 300)+CDDP groups.GSLS was administered to mice by oral gavage once a day for 7 d.On the 7thday,a single injection of CDDP 20 mg·kg-1was given 1 h after GSLS 150 and 300 mg·kg-1before GSLS 150 and 300 mg·kg-1continued to be given for 3 d.Blood urea nitrogen (BUN)and creatinine(CRE),catalase(CAT)in renal tissue,reduced glutathione(GSH),tumor necrosis factor α(TNF-α)and interleukin 1β(IL-1β)of cisplatin induced mice were detected after 72 h.HE and PAS staining were used to observe the renal histopathological changes;While TUNEL and Hoechst33258 staining were employed to observe apoptosis in kidney tissues.RESULTS Compared with normal control group,CDDP group had a significant reduction in relative body mass(P<0.05),and the level of GSH and CAT in kidney tissues(P<0.05).The level of CRE,BUN,TNF-α,and IL-1β in serum and renal indexes significantly increased(P<0.05,P<0.01),especially BUN and CRE that respectively doubled and quadrupled. CDDP group developed glomerulus swelling,renal tubular expansion and epithelial cell necrosis.Trans⁃parent tube type of tube cavity appeared,the nucleus pycnosis disappeared,but renal interstitial edema and inflammatory cell infiltration appeared.There was a large amount of glycogen deposition and high expressions of TUNEL positive cells and Hoechst33258 positive cells.Compared with CDDP group,the levels of BUN and CRE in GSLS treatment group significantly decreased(P<0.05,P<0.01)in serum, glycogen deposition was reducted and apoptosis of renal tubular epithelial cells decreased in kidney tissues (P<0.05).The level of TNF-α,IL-1β(P<0.05)and the degree of renal tissue necrosis were significantly reduced(P<0.05)in CDDP+GSLS 300 group,but there was a significant increase in the level of CAT and GSH(P<0.05).CONCLUSION GSLS can protect against mouse kidney injury induced by cisplatin.The mechanism may be related to oxidation,reduced inflammation reaction and resistance to apoptosis.
saponins;cisplatin;kidney damage;oxidative stress;inflammation
LI Wei,E-mail:liwei7727@126.com
R285
A
1000-3002-(2017)02-0151-08
10.3867/j.issn.1000-3002.2017.02.05
Foundation item:The project supported by National Natural Science Foundation of China(31201331);Jilin Province Study Abroad Retumees Start-Up Fund(20130303096YY);Ginseng Industry Technology System(20130311);Jilin Province Research Start Funds Returned People;and The First Youth Top Creative Talents Support Program of Jilin Agricultural University
2016-03-30 接受日期:2017-01-23)
(本文编辑:贺云霞)
国家自然科学基金(31201331);吉林省留学归国人员启动基金(20130303096YY);人参产业技术体系(201303111);吉林省留学回国人员科研启动基金;吉林农业大学首批青年拔尖创新人才支持计划
韩欣月,女,硕士研究生,主要从事天然产物化学与生物活性研究;李 伟,男,医学博士,教授,硕士生导师,主要从事药用植物资源开发与利用研究。
李 伟,E-mail:liwei7727@126.com
