对氨基水杨酸钠对铅诱导体外培养PC12细胞凋亡的影响
2017-04-10何胜男秦文霞卢艳红罗旖旎袁宗祥蒋秀丽莫玉焕李文杰姜岳明
何胜男,秦文霞,卢艳红,李 康,罗旖旎,袁宗祥,蒋秀丽,莫玉焕,李文杰,姜岳明
(广西医科大学公共卫生学院卫生毒理学教研室,广西南宁 530021)
对氨基水杨酸钠对铅诱导体外培养PC12细胞凋亡的影响
何胜男,秦文霞,卢艳红,李 康,罗旖旎,袁宗祥,蒋秀丽,莫玉焕,李文杰,姜岳明
(广西医科大学公共卫生学院卫生毒理学教研室,广西南宁 530021)
目的 探讨对氨基水杨酸钠(PAS-Na)对铅诱导PC12细胞凋亡的影响。方法 PC12细胞培养至其对数生长期后,正常对照组和正常+PAS-Na 500 μmol·L-1组细胞于正常培养液中培养24 h后弃培养液,前者加入正常培养液、后者加入PAS-Na继续培养24 h。醋酸铅模型组及醋酸铅+PAS-Na 20,100和500 μmol·L-1组先与醋酸铅(终浓度10 μmol·L-1)共培养24 h后弃培养液,再加入相应浓度PAS-Na继续培养24 h。用MTT法测定细胞存活率,试剂盒方法测定细胞内还原型谷胱甘肽(GSH)含量,Hoechst33342荧光染色检测凋亡率,AnnexinⅤ/PI双染流式细胞术检测PC12细胞早期凋亡率,Western蛋白质印迹法检测Bcl-2、Bax和P53蛋白水平。结果 与正常对照组比较,醋酸铅模型组细胞存活率降低(P<0.05),细胞凋亡形态变化典型,细胞早期凋亡率增高(P<0.05),细胞内GSH含量降低(P<0.01),P53蛋白水平升高(P<0.01),Bax/Bcl-2比值升高(P<0.01);正常+PAS-Na 500 μmol·L-1组上述指标未见明显变化。与醋酸铅模型组比较,醋酸铅+PAS-Na组细胞存活率增高(P<0.05),细胞凋亡率和早期凋亡率均降低(P<0.05),细胞内GSH含量增高(P<0.01),P53蛋白水平和Bax/Bcl-2比值降低(P<0.05)。结论 PAS-Na对铅致PC12细胞凋亡有一定的拮抗作用,其机制可能与PAS-Na抗脂质过氧化损伤和降低Bax/Bcl-2比值有关。
铅;对氨基水杨酸钠;PC12细胞;细胞凋亡
铅是一种常见的环境污染物,过量铅暴露对神经系统有直接的损害作用,引起神经功能紊乱、出现学习和记忆能力降低等[1]。铅主要选择性地蓄积在脉络丛和海马,可对海马神经元等产生不良影响,如抑制神经元增殖、分化及诱导凋亡等[2]。铅可通过血脑屏障并在脑内蓄积,可通过引起氧化应激反应直接或间接产生脂质过氧化物引起细胞氧化损伤,诱导神经元和胶质细胞发生凋亡[3-4]。此外,铅可上调或下调某些基因的表达,诱导细胞凋亡[5]。对氨基水杨酸钠(sodium para-aminosalicylic acid,PAS-Na)是一种含水杨酸基团的非类固醇类抗炎药物,20世纪70年代以来,国内外学者在用其治疗锰中毒的动物实验和临床研究方面都取得较好的效果[6]。PAS-Na有相对分子质量低、空间障碍少及能迅速接近作用部位等特点。体内外研究均显示,PAS-Na对锰引起的神经毒性具有一定的拮抗作用[7-8]。本研究室研究发现,PAS-Na对铅致海马超微结构损伤也有一定的拮抗作用[9]。但目前尚未见PAS-Na对体外染铅致海马神经元凋亡的研究报道。因此,本研究选择神经元模式细胞大鼠肾上腺嗜铬细胞瘤PC12细胞作为实验对象,用醋酸铅诱导PC12细胞损伤,探讨PAS-Na是否对铅致神经元凋亡有保护作用,进一步阐明PAS-Na对铅致神经毒性的干预作用机制。
1 材料与方法
1.1 主要试剂和仪器
醋酸铅(天津博迪化工股份有限公司);PASNa(哈药集团制药总厂);胎牛血清(fetal bovine serum,FBS)和DMEM/高糖(美国HyClone公司);0.25%胰蛋白酶EDTA混合液(美国Gibco公司);100 kU·L-1青、链霉素混合液(北京索莱宝科技有限公司);Hoechst33342和碘化丙啶双染检测试剂盒(南京KGA-212凯基公司);AnnexinⅤFITC凋亡检测试剂盒(美国BD公司);BCA蛋白测定试剂盒(北京碧云天公司);微量还原型谷胱甘肽(glutathione,GSH)含量测试盒(南京建成公司);辣根过氧化物酶标记山羊抗大鼠IgG抗体和山羊抗兔IgG抗体、小鼠抗大鼠P53单克隆抗体(美国CST公司);兔抗大鼠Bax多克隆抗体和兔抗大鼠Bcl-2多克隆抗体(美国ABclonal公司);兔抗大鼠GAPDH单克隆抗体(英国Abcam公司);其余试剂均为国产分析纯。PVDF膜,Millipore超纯水器(德国密理博公司);Cyto FLEX流式细胞仪(美国Beck⁃man公司);Multiskan GO酶标仪,371型CO2培养箱(美国Thermo公司);SW-CJ-2F超净工作台(苏州安泰公司);TiS倒置荧光显微镜(日本尼康公司)。
1.2 PC12细胞体外培养和实验分组
PC12细胞于含10%FBS和1%青、链霉素混合液(100 kU·L-1)的DMEM/高糖培养基中,置37℃、5%CO2、饱和湿度条件下常规培养。处于对数生长期的PC12细胞随机分为正常对照组、正常+ PAS-Na 500 μmol·L-1组、醋酸铅模型组及醋酸铅+PAS-Na 20,100和500 μmol·L-1组。正常对照组和正常+PAS-Na 500 μmol·L-1组PC12细胞给予正常培养液培养24 h后弃培养液,前者加入正常培养液继续培养24 h,后者加入PAS-Na(终浓度500 μmol·L-1)继续培养24 h。醋酸铅模型组及醋酸铅+PAS-Na 20,100和500 μmol·L-1组先与醋酸铅(终浓度10 μmol·L-1)共培养24 h后,弃培养液,再加入正常培养液或相应浓度PAS-Na继续培养24 h。
1.3 MTT比色法测定细胞存活率
实验步骤参照文献[10]及说明书,用酶联免疫检测仪在492 nm波长处测定各孔吸光度(A492nm)值,以正常对照组PC12细胞存活率为100%计算各组细胞存活率。细胞存活率(%)=用药组A492nm/正常对照组A492nm×100%。每组设5复孔,铺板密度为每孔1×103~1×104个细胞。
1.4 Hoechst33342荧光染色法观察细胞凋亡
Hoechst33342是一种可透过细胞膜进行DNA染色的细胞核染色试剂,它在嵌入双链DNA后能释放蓝色荧光。采用荧光Hoechst33342和20%PI双染检测试剂盒检测细胞凋亡,实验步骤参考说明书,所用染色剂临用时现配。染色后用荧光显微镜观察,正常细胞为浅蓝色,凋亡细胞为深蓝色,坏死细胞为深红色。每组分别选取3个视野,每个视野计数200个细胞,计算凋亡率,凋亡率(%)=视野凋亡细胞数/视野细胞计数×100%。
1.5 流式细胞术(flowcytometry,FCM)检测细胞凋亡
采用AnnexinⅤFITC凋亡检测试剂盒,按照说明书步骤进行操作。每组设3个平行样品,在流式细胞仪上检测各组早期凋亡率。
1.6 细胞内GSH含量测定
将收集好的细胞用PBS清洗2遍后,低速离心,再加入0.1 mol·L-1等渗PBS缓冲液(pH 7.4)0.3 mL悬浮细胞,超声破碎细胞后待测。BCA法测定细胞内蛋白含量,按照试剂盒说明书测定GSH含量,每组3个平行样品。
1.7 Western蛋白质印迹法检测凋亡相关蛋白表达水平
用细胞刮刀收集细胞,按6孔板每孔100 μL加入细胞裂解液,冰上裂解30 min后,4℃,16 000×g离心20 min,取上清,用BCA法测定蛋白浓度,调整各组蛋白浓度为5 g·L-1。取10 μL上述稀释好的组织液,加入5×SDS加样缓冲液,混匀,100℃水浴5 min,然后等电压电泳,使用5%浓缩胶在80 V电压下电泳30 min,再使用12%分离胶在120 V电压下电泳100 min。电泳结束再以等电流200 mA转膜90 min。抗体稀释浓度为P53(1∶1000),Bcl-2(1∶500),Bax(1∶500)和GAPDH(1∶3000),抗体用5%脱脂牛奶稀释。将结合有目的蛋白的PVDF膜在5%脱脂牛奶中封闭2 h,以消除抗体的非特异性结合,之后在各蛋白单克隆抗体中孵育过夜(4℃)。孵育结束后用TBST洗膜5次,每次5 min。之后在室温下加入各目的蛋白单克隆抗体相应的HRP-IgG(1∶2000)孵育2 h,TBST洗膜3次,每次5 min,之后加入ECL发光剂于暗室中显影。目标蛋白与GAPDH条带积分吸光度值(integrated absorbance,IA)的比值表示蛋白相对表达量。
1.8 统计学分析
2 结果
2.1 PAS-Na对铅暴露PC12细胞存活率的影响
MTT法检测结果显示(图1),与正常对照组比较,正常+PAS-Na 500 μmol·L-1组细胞存活率无显著变化,醋酸铅模型组PC12细胞存活率约降低25%(P<0.05)。醋酸铅+PAS-Na 100和500 μmol·L-1组PC12细胞存活率较醋酸铅组显著增高(P<0.05)。
2.2 PAS-Na对铅暴露PC12细胞凋亡的影响
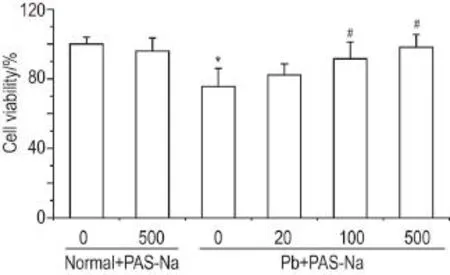
Fig.1 Effect of sodium para-aminosalicylic acid(PASNa)on viability of PC12 cells exposed to lead acetate(Pb)detected by MTT assay.The PC12 cells to normal control and normal+PAS-Na 500 μmol·L-1groups were cultured in normal medium for 24 h,then continually cultured with normal medium and PAS-Na,respectively,for 24 h.The PC12 cells in Pb model and Pb+PAS-Na 20,100,500 μmol·L-1groups were cultured with Pb(10 μmol·L-1)for 24 h,then continually cultured with PAS-Na for another 24 h except Pb model group.,n=6.*P<0.05,compared with normal control group;#P<0.05,com⁃pared with Pb model group.

Fig.2 Effect of PAS-Na on apoptosis of PC12 cells ex⁃posed in Pb detected by Hoechst33342 staining.See Fig.1 for the cell treatment.A:Hoechst33342 staining.The ar⁃rows show that apoptotic nuclei contain condensed or fragmented DNA;B:the quantitative results of A.,n=3.**P<0.01,com⁃pared with normal control group;#P<0.05,##P<0.01,compared with Pb model group.
Hoechst33342荧光染色结果显示(图2A),正常对照组和正常+PAS-Na 500 μmol·L-1组PC12细胞核形态规则完整,核淡染为主;醋酸铅模型组细胞核出现损伤变化,如皱缩、分裂和崩解,细胞核深染变亮。醋酸铅+PAS-Na 20,100和500 μmol·L-1组细胞崩解、皱缩程度有所减轻。与正常对照组相比,正常+PAS-Na 500 μmol·L-1组细胞凋亡率无明显变化,醋酸铅模型组细胞凋亡率明显增高(P<0.05);与醋酸铅模型组比较,醋酸铅+PAS-Na 100和500 μmol·L-1组细胞凋亡率明显降低(P<0.05)如图2B所示。
流式细胞仪定量结果显示(图3),与正常对照组相比,正常+PAS-Na 500 μmol·L-1组PC12细胞凋亡率无明显变化,醋酸铅模型组早期凋亡率明显增高(P<0.05);与醋酸铅模型组比较,醋酸铅+ PAS-Na 500 μmol·L-1组细胞早期凋亡率明显降低(P<0.01)。

Fig.3 Effect of PAS-Na on early apoptosis of PC12 cells exposured to Pb detected by flow cytometry. See Fig.1 for the cell treatment.A:Photograph from flow cy⁃tometry;B:the quantitative results of A.,n=3.*P<0.05,compared with normal control group;##P<0.01,compared with Pb model group.
2.3 PAS-Na对铅暴露PC12细胞内GSH含量的影响
细胞内GSH含量检测结果表明(图4),与正常对照组相比,正常+PAS-Na 500 μmol·L-1组GSH含量无明显变化,醋酸铅模型组细胞内GSH含量明显降低(P<0.01);与醋酸铅模型组比较,醋酸铅+ PAS-Na 20,100和500 μmol·L-1组细胞内GSH含量明显升高(P<0.01)。
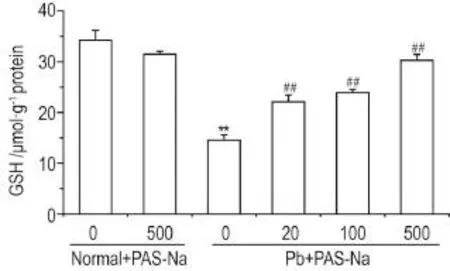
Fig.4 Effect of PAS-Na on intracellular glutathione(GSH)content of PC12 cells exposed to Pb.See Fig.1 for the cell treatment.,n=3-4.**P<0.01,compared with nor⁃mal control group;##P<0.01,compared with Pb model group.
2.4 PAS-Na对铅暴露PC12细胞内P53,Bax和Bcl-2蛋白水平的影响

Fig.5 Effect of PAS-Na on P53,Bax and Bcl-2 protein expression of PC12 cells exposed to Pb detected by Western blotting.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.IA:integrated absorbance.,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with Pb model group.
Western蛋白印迹法实验结果表明(图5),与正常对照组相比,正常+PAS-Na 500 μmol·L-1组P53蛋白表达水平和Bax/Bcl-2比值无明显变化,醋酸铅模型组P53蛋白水平显著升高(P<0.05),Bax蛋白水平升高,Bcl-2蛋白水平下降,Bax/Bcl-2比值显著升高(P<0.01);与醋酸铅模型组比较,醋酸铅+PAS-Na 20,100和500 μmol·L-1组P53蛋白水平和Bax/Bcl-2比值均显著降低(P<0.05,P<0.01)。
3 讨论
细胞凋亡是由基因调控的细胞程序化死亡,在机体稳态的维持、某些疾病的发生发展、神经系统的正常发育等方面中有重要意义[11]。在新生SD大鼠脑海马神经元的培养中,用不同浓度醋酸铅(0.1和1 μmol·L-1)可引起神经元出芽延迟,突起长度缩短,细胞存活率下降,随浓度增加和时间延长,毒性作用越加严重[12]。断乳的Wistar大鼠ig给予醋酸铅至60 d,电镜可见该组海马组织出现空泡,细胞质溶解,染色质凝聚成块,突触数量减少,提示铅使海马受损[13]。电镜下可见铅1 μmol·L-1暴露小鼠大脑神经元退化、染色质凝聚和核膜碎片主要集中在尾状核、丘脑、大脑皮质和扣带回,提示铅暴露可引起脑神经细胞凋亡[12,14]。本研究结果表明,用醋酸铅10 μmol·L-1对PC12细胞染毒24 h,细胞存活率为53%~60%;参考近3年的文献[4,15-16],醋酸铅10 μmol·L-1可引起细胞凋亡,因而选择醋酸铅10 μmol·L-1进行细胞染毒。
神经系统含有丰富的可被氧化的基质,铅可能通过减少抗氧化物质和降低抗氧化酶类活性,增加活性氧自由基来介导细胞凋亡[4]。染铅后脂质过氧化作用增强,与染铅量呈正相关;以神经元抗氧化能力标志超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性下降,膜乙酰胆碱酯酶活性明显下降,且与染铅量呈负相关;推测铅可能通过对神经细胞的过氧化损伤而发挥其神经毒性作用[17]。GSH是机体内最重要的抗氧化物之一,具有清除自由基、解毒、维持红细胞膜完整性、细胞正常生长发育及细胞免疫等多种功能。GSH含量是衡量机体抗氧化能力的重要因素之一。GSH富含巯基,在铅暴露影响下可快速与进入机体的铅离子结合而降低其毒性[15]。本研究发现,醋酸铅模型组细胞内GSH含量低于正常对照组,提示铅暴露降低细胞抗氧化能力。而PAS-Na干预可使染铅细胞内GSH含量明显升高,说明PAS-Na对铅引起的抗氧化能力降低有一定的拮抗作用。
铅可以引起机体内一些凋亡相关蛋白如P53、Bcl-2和Bax蛋白表达的改变[5]。Bcl-2家族是调节凋亡的关键元件,其主要成员Bcl-2主要通过抑制胱天蛋白酶而使细胞存活。Bcl-2和Bax是一对正负凋亡调节因子,Bcl-2可与Bax蛋白形成异源二聚体,从而使Bcl-2蛋白失活,降低Bcl-2对凋亡的抑制作用,Bax/Bcl-2比值降低,易引起细胞凋亡[16]。P53蛋白是重要的细胞周期和细胞凋亡调控因子。Bax的启动子中有P53的结合位点,所以P53能促进Bax的表达,从而导致Bax/Bcl-2比值升高而使细胞凋亡[18]。本研究结果表明,当PC12细胞暴露于醋酸铅10 μmol·L-124 h后,P53蛋白显著升高,Bax水平显著上升,Bcl-2水平下降,Bax/Bcl-2比值明显上升。提示醋酸铅可能通过影响Bax和Bcl-2水平而诱导线粒体凋亡因子的释放和胱天蛋白酶的级联激活,以至发生凋亡。经PAS-Na 20,100和500 μmol·L-1干预24 h后,Bax/Bcl-2比值均较醋酸铅模型组低,且PAS-Na 500 μmol·L-1组P53蛋白水平也降低,表明PAS-Na可通过下调Bax和P53蛋白表达水平,上调Bcl-2水平,降低Bax/Bcl-2比值抑制细胞凋亡。
综上,PAS-Na对铅诱导的PC12细胞凋亡有一定的保护作用,其作用机制可能与PAS-Na抗脂质过氧化和降低Bax/Bcl-2比值有关。
[1]Liu J,Liu X,Wang W,McCauley L,Pinto-Martin J,Wang Y,et al.Blood lead concentrations and chil⁃dren's behavioral and emotional problems:a cohort study[J].JAMA Pediatr,2014,168(8):737-745.
[2]Wei DL,Fu X,Jiang YM,Zheng W.Lead expo⁃sure and Alzheimer′s disease[J].Ind Hlth Occup Dis(工业卫生与职业病),2006,32(6):379-382.
[3]Dribben WH,Creeley CE, Farber N.Low-level lead exposure triggers neuronal apoptosis in the developing mouse brain[J].Neurotoxicol Teratol,2011,33(4):473-480.
[4]Guo S,Zhou J,Chen X,Yu Y,Ren M,Hu G,et al.Bystander effects of PC12 cells treated with Pb2+depend on ROS-mitochondria-dependent apoptotic signaling via gap-junctional intercellular communi⁃cation[J].Toxicol Lett,2014,229(1):150-157.
[5]He L,Perkins GA,Poblenz AT,Harris JB,Hung M,Ellisman MH,et al.Bcl-xL overexpression blocks bax-mediated mitochondrial contact site formation and apoptosis in rod photoreceptors ofleadexposed mice[J].Proc Natl Acad Sci USA,2003,100(3):1022-1027.
[6]Jiang YM,Mo XA,Du FQ,Fu X,Zhu XY,Gao HY,et al.Effective treatment of manganese-induced occupational parkinsonism with p-aminosalicylic acid:a case of 17-year follow-up study[J].J Occup Environ Med,2006,48(6):644-649.
[7]Li SJ,Li Y,Chen JW,Yuan ZX,Mo YH,Lu GD,et al.Sodium para-aminosalicylic acid protected primary cultured basal ganglia neurons of rat from manganese-induced oxidative impairmentand changes of amino acid neurotransmitters[J].Biol Trace Elem Res,2016,170(2):357-365.
[8]Tandon SK,Chandra SV,Singh J,Husain R,Seth PK.Chelation in metal intoxication.Ⅰ.In vivo effect of chelating agents on liver and testis of manganese administered rats[J].Environ Res,1975,9(1):18-25.
[9]Deng XF,Ou SY,Jiang YM,Chen HB,Deng X,Lu S,et al.Effects of sodium para-aminosalicylic acid on hippocampal ultramicro-structure of sub⁃chronic lead-exposed rats[J].J Toxicol(毒理学杂志),2009,23(3):213-216.
[10]Maddirala Y,Tobwala S,Ercal N.N-acetylcyste⁃ineamide protects against manganese-induced toxicity in SHSY5Y cell line[J].Brain Res,2015,1608:157-166.
[11]Basha R,Reddy GR.Developmental exposure to lead and late life abnormalities of nervous system[J].Indian J Exp Biol,2010,48(7):636-641.
[12]Hu F,Xu L,Liu ZH,Ge MM,Ruan DY,Wang HL. Developmental lead exposure alters synaptogenesis through inhibiting canonical Wnt pathway in vivo and in vitro[J].PLoS One,2014,9(7):e101894.
[13]Ma W,Wang F,Wu WL,Yin JP,Hang H,Xue S. Effect of low-dose lead and Chinese herbal medi⁃cine interfering on the behavior and hippocampus ultrastructure in Wistar rat[J].CJCHC(中国儿童保健杂志),2007,15(4):378-381.
[14]Barkur RR,Bairy LK.Histological study on hippo⁃campus,amygdala and cerebellum following low lead exposure during prenatal and postnatal brain development in rats[J].Toxicol Ind Health,2016,32(6):1052-1063.
[15]Kumar V,Tripathi VK,Jahan S,Agrawal M,Pandey A,Khanna VK,et al.Lead intoxication synergies of the ethanol-induced toxic responses in neuronal cells-PC12[J].Mol Neurobiol,2015,52(3):1504-1520.
[16]Deng Z,Fu H,Xiao Y,Zhang B,Sun G,Wei Q,et al.Effects of selenium on lead-induced alterations in Aβ production and Bcl-2 family proteins[J].Environ Toxicol Pharmacol,2015,39(1):221-228.
[17]Sanders T,Liu Y,Buchner V,Tchounwou PB. Neurotoxic effects and biomarkers of lead expo⁃sure:a review[J].Rev Environ Health,2009,24(1):15-45.
[18]Tripathi A,Chaube SK.Roscovitine inhibits extru⁃sion of second polar body and induces apoptosis in rat eggs cultured in vitro[J].Pharmacol Rep,2015,67(5):866-874.
Effect of sodium para-aminosalicylic acid on apoptosis of PC12 cells induced by lead-exposure
HE Sheng-nan,QIN Wen-xia,LU Yan-hong,LI Kang,LUO Yi-ni,YUAN Zong-xiang,JIANG Xiu-li, MO Yu-huan,LI Wen-jie,JIANG Yue-ming
(Department of Health Toxicology,Guangxi Medical University,Nanning 530021,China)
OBJECTIVE To explore the effects of sodium para-aminosalicylate acid(PAS-Na)on apoptosis of PC12 cells induced by lead-exposure.METHODS PC12 cells were cultured to their logarithmic growth phase before cells in normal control group and normal+PAS-Na 500 μmol·L-1group were with normal medium for 24 h.The former were cultured with the normal medium,and the latter with 500 μmol·L-1PAS-Na medium for another 24 h.Lead acetate model group and lead acetate+PAS-Na 20,100, 500 μmol·L-1intervention groups were incubated with medium containing lead acetate(the final concen⁃tration of 10 μmol·L-1)for 24 h,and were added with a corresponding concentration of PAS-Na for another 24 h after the culture solution was removed.Subsequently,MTT assay was used to observe the viability of PC12 cells,whereas intracellular glutathione(GSH)content was estimated by assay kit.Apop⁃tosis of PC12 was detected by Hoechst33342 fluorescence staining and AnnexinⅤ/PI double staining flow cytometry.Western blotting was performed to detect levels of Bcl-2,Bax and P53 proteins.RESULTS Compared with the normal control group,the survival rate of cells and the content of intracellular GSH decreased in Pb model group(P<0.05).Typical morphological characteristics were found by Hoch⁃est33342 staining,and apoptosis rate increased(P<0.05).Western blotting showed that the level of Bcl-2 protein decreased,while levels of Bax and p53 protein increased,and the Bax/Bcl-2 ratio increased signifi⁃cantly in lead acetate group(P<0.05).In normal+PAS-Na 500 μmol·L-1group,the above indexes did not change significantly.Compared with the lead acetate group,the survival rate of PC12 cells and intracel⁃lular GSH content were increased in lead acetate+PAS-Na intervention group(P<0.05),while the Bax/ Bcl-2 ratio and level of p53 protein were decreased(P<0.05).CONCLUSION Intervention with PAS-Na can protect PC12 cells from apoptosis induced by lead exposure,which may be related to anti-lipid peroxidation damage and decrease in the Bax/Bcl-2 ratio.
lead;sodium para-aminosalicylic acid;PC12 cells;apoptosis
JIANG Yue-ming,E-mail:790965788@qq.com
R995
A
1000-3002-(2017)02-0159-06
10.3867/j.issn.1000-3002.2017.02.06
Foundation item:The project supported by National Basic Research Program of China(973 Program)(2012CB525001)
2016-08-02 接受日期:2017-01-18)
(本文编辑:沈海南 齐春会)
国家重点基础研究发展计划(973计划)(2012-CB525001)
何胜男,硕士研究生,主要从事神经毒理学研究;姜岳明,教授,博士生导师,主要从事神经毒理学研究。
姜岳明,E-mail:790965788@qq.com
