对乙酰氨基酚通过过氧化物酶体增殖物激活受体γ共激活因子1α信号通路影响HepaRG细胞线粒体新生
2017-04-10张廷芬郭家彬袁海涛彭双清
张廷芬,郭家彬,彭 辉,张 丽,袁海涛,殷 健,崔 岚,赵 君,彭双清
(军事医学科学院疾病预防控制所毒理学评价研究中心,北京 100071)
对乙酰氨基酚通过过氧化物酶体增殖物激活受体γ共激活因子1α信号通路影响HepaRG细胞线粒体新生
张廷芬,郭家彬,彭 辉,张 丽,袁海涛,殷 健,崔 岚,赵 君,彭双清
(军事医学科学院疾病预防控制所毒理学评价研究中心,北京 100071)
目的 探讨对乙酰氨基酚(APAP)对HepaRG细胞过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)信号通路介导的线粒体新生的影响。方法 接种HepaRG细胞并给予生长培养基,待细胞长满后,替换为分化培养基进行诱导分化,每天观察细胞形态并拍照。APAP(0.125,0.25,0.5,1,2,4,8和12 mmol·L-1)处理诱导分化后的HepaRG细胞24和48 h,MTT法测定细胞存活率。Western蛋白印迹法检测细胞线粒体新生相关蛋白PGC-1α、核呼吸因子2(NRF-2)和线粒体转录因子A(TFAM),以及线粒体构成蛋白NADH脱氢酶亚基1(ND-1)的表达。结果 诱导分化后显微镜下可见肝细胞样和胆管细胞样2种形态的细胞。与正常对照组相比,APAP作用24和48 h后,随APAP浓度的增加,细胞存活率不断降低,其IC50分别5.64和2.65 mmol·L-1。与正常对照组相比,APAP作用24 h,0.5,1,2和4 mmol·L-1组PGC-1α表达水平显著增加(P<0.01),8 mmol·L-1组显著降低(P<0.01);0.5 mmol·L-1组NRF-2表达水平显著增加(P<0.05),2,4和8 mmol·L-1组显著降低(P<0.01);1 mmol·L-1组TFAM表达水平显著增加(P<0.05),4和8 mmol·L-1组显著降低(P<0.01);0.5,1,2和4 mmol·L-1组ND-1表达水平显著增加(P<0.01),8 mmol·L-1组显著降低(P<0.01)。结论 APAP可诱导或抑制HepaRG细胞的线粒体新生,其机制可能与PGC-1α通路蛋白表达有关。
对乙酰氨基酚;线粒体;HepaRG细胞;过氧化物酶体增殖物激活受体γ;共激活因子1α;肝毒性
对乙酰氨基酚(acetaminophen,APAP)是一种在临床上广泛使用的解热镇痛非甾体抗炎药。在治疗剂量时较为安全,但过量使用,则有可能引起急性肝功能衰竭(acute liver injury,AILD),甚至死亡[1]。目前的研究显示,线粒体是APAP引起肝毒性的重要靶标之一,其毒性机制是APAP经细胞色素P450(cytochrome P450,CYP450)酶代谢产生有毒的中间代谢产物N-乙酰-对苯醌亚胺(N-acetyl-p-benzoquinone imine,NAPQI)。正常情况下,NAPQI可被谷胱甘肽(glutathione,GSH)脱毒,但当NAPQI过量GSH被消耗殆尽后,NAPQI将与细胞的蛋白质结合,包括多种线粒体蛋白,从而扰乱线粒体功能,引起细胞毒性[2]。
线粒体新生,又称线粒体生物合成,过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator activated receptor-γ coactivator 1α,PGC-1α)是该过程的主要调节因子,可与下游核呼吸因子1/2(nuclear respiratory factor-1/2,NRF-1/ 2)结合,然后共激活线粒体转录因子A(mitochon⁃drial transcription factor A,TFAM),从而介导线粒体新生[3]。PGC-1α主要分布在能量需求大的组织或器官。正常生理状态下,生理性地调控线粒体的数量或形态;而在外界刺激下,线粒体新生可能会被激发,对线粒体损伤进行修复,或对线粒体丢失(例如线粒体自噬)进行数量补充,从而减轻外界因素引起的线粒体功能障碍[4]。PGC-1α介导的线粒体新生在骨骼肌、心和肝组织均有报道[5-6]。
HepaRG细胞是从肝癌患者的非瘤肝组织分离而得的细胞株。诱导分化后的HepaRG细胞,具有成熟肝细胞的表型,含有丰富的CYP450酶系,包括CYP1A2,CYP2B6,CPY2C,CPY2D6,CYP3A4和二相代谢酶以及肝细胞的特异性蛋白,这些特征都类似原代肝细胞[7--8]。因此,具有原代人肝细胞特征的HepaRG细胞是目前极受关注的肝细胞模型之一。
有研究显示,高剂量APAP会引起线粒体功能损伤,线粒体自噬虽然可清除受损的线粒体,但是会导致线粒体数量减少,整体的线粒体功能损耗[9]。因此,我们推测PGC-1α介导的线粒体新生可能在此过程中发挥作用,弥补丢失的线粒体数量以及丧失的线粒体功能。Pesce等[10]研究发现,乙酰基肉毒碱可能通过PGC-1α调控线粒体新生,清除因老龄化引起的大鼠肝细胞内功能障碍的线粒体,另外还能降低氧化应激反应,表明线粒体新生在肝细胞中是可以被介导的。因此,本研究以Hep⁃aRG细胞为模型观察不同浓度的APAP作用下,线粒体新生信号通路和线粒体呼吸链蛋白的表达水平,进而分析APAP对PGC-1α信号通路和线粒体新生的影响,探讨PGC-1α在APAP引起的肝细胞线粒体毒性中的可能作用。
1 材料与方法
1.1 试剂和仪器
HepaRG细胞及基础培养液(MIL700)、生长添加剂(ADD710)和分化添加剂(ADD720)(法国Biopredic公司)。MTT(美国Sigma-Aldrich)。一抗包括PGC-1α(1∶200)和NRF-2(美国Santa Cruz,1:250),β肌动蛋白(英国Abcam,1∶3000),TFAM(1∶3000),NADH脱氢酶亚基1(NADH de⁃hydrogenase subunit 1,ND-1)(美国Proteintech Group,1∶1000),HRP标记的二抗羊抗兔或羊抗小鼠(Abcam,1∶5000)。RIPA细胞裂解液、蛋白酶抑制剂cocktail、蛋白质定量试剂盒、超敏发光液(北京普利莱有限公司)。配制蛋白电泳缓冲液和转移缓冲液的试剂(国药集团化学试剂有限公司和Sigma公司),配制各种液体所用的水均为纯水仪(美国Milipore,MilliQ)过滤的超纯水。电泳仪(美国Bio-Rad),化学发光成像系统(上海天能科技有限公司,Tanon-5200),5417R台式冷冻离心机(德国Ep⁃pendorf),CR3i高速冷冻离心机(美国Thermo),CKX41倒置显微镜(日本Olympus),JJT-1300超净工作台(北京亚泰科隆仪器技术有限公司),MCO-18AIC细胞培养箱(日本Sanyo),MK3多功能酶标仪(美国Thermo)。
1.2 HepaRG细胞的诱导分化
根据Biopredic公司提供的细胞培养手册,在基础培养基中分别加入ADD710和ADD720配制成生长培养基和分化培养基。按手册建议以5×108L-1密度接种于75 cm2培养瓶进行传代HepaRG细胞,培养于生长培养基中,2~3 d换液1次,2周后待细胞长满培养瓶底时,将生长培养基更换为生长培养基与分化培养基按比例1∶1混合的培养基进行过渡性培养3 d,之后更换为分化培养基,2~3 d换液1次,继续培养2周,细胞可完成分化。分化后的细胞包含2种形态,直接传代使用,不进行分离。HepaRG细胞接种后,在倒置显微镜下每天观察1次,并进行拍照。
1.3 MTT法检测HepaRG细胞存活率
将分化后的HepaRG细胞以2×107L-1的密度接种于96孔板内,培养至细胞融合度达70%~80%,弃旧培养液,分别加入不同浓度的APAP(0.125,0.25,0.5,1,2,4,8和12 mmol·L-1),每孔加入0.2 mL,同时设空白对照组(不接种细胞,只加等体积培养基)和细胞对照组(接种细胞不加APAP),每组设3个复孔,分别作用24和48 h后,吸出APAP染毒液,每孔加入0.1 mL含15%MTT(5 g·L-1)的培养液,作用3 h后吸出培养基,每孔加入0.15 mL DMSO,酶标仪检测492 nm处每孔吸光度(A),重复3次。细胞存活率(%)=(药物组A492nm-空白对照组A492nm)/(细胞对照组A492nm-空白对照组A492nm)×100%。用SPSS 17.0软件“Probit regression”法计算半数抑制浓度值(IC50)。
1.4 Western蛋白印迹法检测蛋白PGC-1α,NRF-2,TFAM和ND-1表达
将分化后的细胞接种于25 cm2培养瓶,贴壁24 h后暴露于不同浓度的APAP作用24 h。收集细胞,加入RIPA裂解液,并按1∶50加入蛋白酶抑制剂cocktail,收集上清,BCA法测定蛋白浓度。取蛋白样品30 μg经SDS-PAGE电泳、转印和封闭后,加入不同抗体后置于4℃过夜反应,洗膜后,与二抗在室温下反应1 h,再次洗膜后,滴超敏发光液并置于Tanan化学发光成像系统检测并采集图像。利用Image J 6.0软件分析各条带积分吸光度值(integrated absorbance,IA),以β肌动蛋白条带IA作参照,进行半定量分析。
1.5 统计学分析
2 结果
2.1 HepaRG细胞的诱导分化
HepaRG细胞增殖周期比一般细胞系长,经历特定的生长期和分化期后,细胞形态发生显著变化。第2天镜下观察细胞呈细长梭形,约7 d后细胞长满瓶底,细胞形态逐渐变得饱满,仍呈梭形,第11天细胞长得十分拥挤,细胞形态呈多样性。接种14 d后开始诱导分化,分化后第2天,细胞形态并无明显变化,分化后第6天视野下出现2种形态的细胞,一种体积较小呈圆形为肝细胞样细胞,一种体积较大呈梭形为胆管样细胞,分化后第11天,圆形细胞数量增多(图1)。
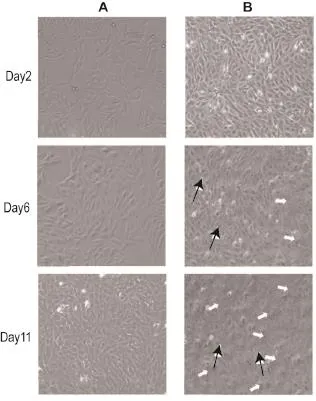
Fig.1 Cell morphology of proliferation stage(A)and differentiation stage(B)of HepaRG at different time points(200×).Cell morphology changed significanthy and finally the bottom became confluent(A).Cells became more crowded and differentiated into two types of cells:hepatocyte-like(⇨ )and biliary-like( → )cells(B).
2.2 APAP对HepaRG细胞存活率的影响
APAP(0.125,0.25,0.5,1,2,4,8和12 mmol·L-1)作用于HepaRG细胞24 h后,随着浓度的升高,细胞存活率从1 mmol·L-1开始出现降低,并呈浓度依赖性降低(r=0.9717,P<0.05,P<0.01),IC50为5.64 mmol·L-1;作用48 h后,细胞存活率从0.25 mmol·L-1开始出现降低,并呈浓度依赖性降低(r=0.9512,P<0.01),IC50为2.65 mmol·L-1(图2)。
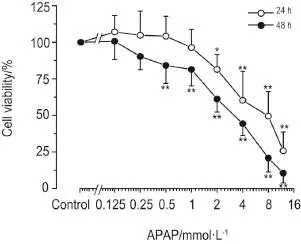
Fig.2 Effect of acetaminophen(APAP)on viability of HepaRG cells by MTT assay.,n=3.*P<0.05,**P<0.01,compared with corresponding control(0 mmol·L-1)group.
2.3 APAP对HepaRG细胞PGC-1α,NRF-2和TFAM蛋白表达的影响
与正常对照组相比,APAP作用24 h后,0.5,1,2和4 mmol·L-1组PGC-1α的蛋白表达均显著增加(P<0.01),8 mmol·L-1组显著降低(P<0.01)。0.5 mmol·L-1组NRF-2的蛋白表达显著升高(P<0.05),2,4和8 mmol·L-1组显著降低(P<0.01)。1 mmol·L-1组TFAM的蛋白表达显著升高(P<0.05),4和8 mmol·L-1组显著降低(P<0.01)。APAP作用下,PGC-1α信号通路3个蛋白的表达变化总体趋势一致,在相对低浓度时蛋白表达升高,在相对高浓度时蛋白表达降低。结果提示,APAP能诱导或抑制PGC-1α信号通路蛋白的表达(图3)。
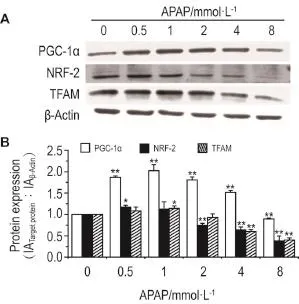
Fig.3 Effect of APAP on protein expression of peroxisome proliferator activated receptor-γ coactivator 1α(PGC-1α),nuclear respiratory factor 2(NRF-2)and mitochondrial transcription factor A(TFAM)by Western blotting.HepaRG cells were exposed to APAP for 24 h.B was the semi-quantitative result of A.IA:integrated absorbance.,n=3.*P<0.01**P<0.01,compared with corresponding control(0 mmol·L-1)group.
2.4 APAP对HepaRG细胞ND-1蛋白表达的影响
与正常对照组相比,APAP 0.5,1,2和4 mmol·L-1组ND-1蛋白表达均显著升高(P<0.01),并随APAP浓度的升高ND-1蛋白表达的增加逐渐减少,8 mmol·L-1组ND-1蛋白表达显著降低(P<0.01)。提示相对低浓度APAP可促进ND-1蛋白的表达,有助于线粒体呼吸功能的加强;而相对高浓度APAP对ND-1的表达有明显的抑制作用,对线粒体呼吸作用有抑制作用(图4)。
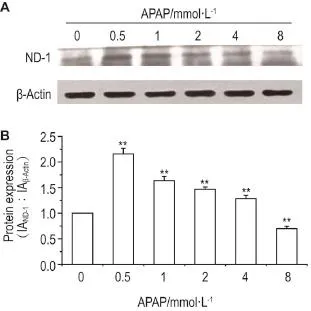
Fig.4 Effect of APAP on NADH dehydrogenase sub⁃unit-1(ND-1)protein expression in HepaRG cells by Western blotting.Cells were exposed to APAP for 24 h. B was the semi-quantitative result of A.,n=3.**P<0.01,compared with control(0 mmol·L-1)group.
3 讨论
本研究结果显示,HepaRG细胞自然生长时的最初形态呈细长梭形,随着密度的增长,细胞形态逐渐变圆,仍然保持梭形。当细胞完全长满培养瓶底后,细胞形态因挤压呈现多样性。细胞完全融合7 d后,加入诱导剂分化,在分化后的第6天即可清晰出现2种不同形态的细胞,且有立体感,说明分化成功,而且随着分化时间的延长,2种细胞的数量逐步达到平衡。与常用的HepG2细胞和Fa2N-4细胞相比[7],分化后的HepaRG细胞保持了许多原代人肝细胞的重要特征,在化合物代谢、毒性评价很多方面都显示了突出的优点。由于APAP在CYP450酶的作用下才能代谢成为有毒代谢产物NAPQI,进而与细胞或线粒体蛋白结合,干扰细胞功能,产生毒性作用。本研究选择诱导分化后的HepaRG细胞作为细胞模型,发现相对低浓度的APAP对Hep⁃aRG细胞的存活率并没有显著影响,而相对高浓度APAP则可引起HepaRG细胞死亡,与临床上过量APAP引起急性肝细胞坏死相似。
PGC-1α是目前公认的介导线粒体新生的一个关键的核转录共激活因子,可与NRF-1/2结合,并一同激活TFAM,促进mtDNA的复制和转录,调控线粒体的新生。在相对低浓度APAP作用下该通路3种的蛋白表达均升高,提示有线粒体新生的发生。在NRF-2和TFAM出现显著降低时PGC-1α蛋白表达仍显著升高,这可能是因为PGC-1α转录共激活的下游靶标不仅仅是NRF-2,还有其他核蛋白。在此,PGC-1α不仅参与调控线粒体新生,可能还参与调解其他的应激反应。有文献报道,PGC-1α可能与NRF2结合,参与调控氧化还原反应,控制APAP引起的氧化应激[11]。NRF-1/2是核呼吸因子,又是转录因子,能作用于核基因,负责转录线粒体呼吸链或是mtDNA复制和翻译需要的蛋白[12],例如细胞色素c亚单位和ATP合酶γ亚单位、ATP合酶β亚单位。本研究结果显示,NRF-2对APAP的毒性作用最为敏感,在1 mmol·L-1时,其蛋白表达便开始下降,但是TFAM的蛋白表达是从2 mmol·L-1开始下降的,可能是因为这个过程中PGC-1α和NRF-1/2共激活TFAM,而本研究仅检测了NRF-2,TFAM的蛋白表达可能更多受NRF-1调控。
ND-1是呼吸链复合物I(NADH脱氢酶)11个亚单位之一,是由mtDNA编码的蛋白,呼吸链复合物I主要是负责催化酶和呼吸链质子泵酶的活性[13]。本研究结果显示,在相对低浓度时,ND-1蛋白表达升高,提示APAP对线粒体呼吸功能有影响,ND-1蛋白表达量变化间接反映了线粒体新生的发生,而ND-1蛋白水平变化趋势与PGC-1α信号通路的蛋白水平变化趋势一致,从侧面进一步证明了PGC-1α确实参与了线粒体新生。
本研究结果显示,在相对低浓度APAP作用下线粒体新生被激发,呈适应性反应,通过线粒体的新生为细胞提供更多能量,从而防御APAP可能产生的线粒体毒性作用,而不是我们推测的线粒体新生可能会发生在过量APAP引起线粒体损伤后发挥修复作用,通过线粒体新生补充线粒体数量从而减轻APAP的毒性作用。与我们的假设不一致,在相对高浓度时线粒体新生是被抑制的,猜测线粒体可能通过其他方式维持线粒体功能,如线粒体分裂,但需要进一步证明。
本研究成功地完成了对新引入的HepaRG细胞的培养、传代和分化。APAP能诱导或抑制Hep⁃aRG细胞的线粒体新生,PGC-1α信号通路在此过程中发挥了关键的调控作用,可能成为干预APAP所致肝细胞线粒体毒性的一个潜在作用靶点。
[1]Jaeschke H,McGill MR,Ramachandran A.Oxidant stress,mitochondria,and cell death mechanisms in drug-induced liver injury:lessons learned from acetaminophenhepatotoxicity[J].DrugMetab Rev,2012,44(1):88-106.
[2]McGill MR,Williams CD,Xie Y,Ramachandran A,Jaeschke H.Acetaminophen-induced liver injury in rats and mice:comparison of protein adducts,mitochondrial dysfunction,and oxidative stress in the mechanism of toxicity[J].Toxicol Appl Phar⁃macol,2012,264(3):387-394.
[3]Wareski P,Vaarmann A,Choubey V,Safiulina D,Liiv J,Kuum M,Kaasik A.PGC-1α And PGC-1β regulate mitochondrial density in neurons[J].J Biol Chem,2009,284(32):21379-21385.
[4]Venditti P,Bari A,Di Stefano L,Cardone A,Della Ragione F,D′Esposito M,et al.Involvement of PGC-1,NRF-1,and NRF-2 in metabolic response by rat liver to hormonal and environmental signals[J].Mol Cell Endocrinol,2009,305(1-2):22-29.
[5]Lehman JJ,Barger PM,Kovacs A,Saffitz JE,Medeiros DM,Kelly DP.Peroxisome proliferatoractivated receptor gamma coactivator-1 promotes cardiac mitochondrial biogenesis[J].J Clin Invest,2000,106(7):847-856.
[6]Wright DC,Han DH,Garcia-Roves PM,Geiger PC,Jones TE,Holloszy JO.Exercise-induced mitochondrial biogenesis begins before the increase in muscle PGC-1 alpha expression[J].J Biol Chem,2007,282(1):194-199.
[7]McGinnity DF,Zhang G,Kenny JR,Hamilton GA, Otmani S,Stams KR,et al.Evaluation of multiple in vitro systems for assessment of CYP3A4 induc⁃tion in drug discovery:human hepatocytes,preg⁃nane X receptor reporter gene,and Fa2N-4 and HepaRG cells[J].Drug Metab Dispos,2009,37(6):1259-1268.
[8]Anthérieu S,Chesné C,Li R,Camus S,Lahoz A,Picazo L,et al.Stable expression,activity,and in⁃ducibility of cytochromes P450 in differentiated HepaRG cells[J].Drug Metab Dispos,2010,38(3):516-525.
[9]Ni HM,Bockus A,Boggess N,Jaeschke H,Ding WX.Activation of autophagy protects against acetaminophen-induced hepatotoxicity[J].Hepa⁃tology,2012,55(1):222-232.
[10] Pesce V,Nicassio L,Fracasso F,Musicco C,Cantatore P,Gadaleta MN.Acetyl-L-carnitine acti⁃vates the peroxisome proliferator-activated recep⁃tor-γ coactivators PGC-1α/PGC-1β-dependent sig⁃naling cascade of mitochondrial biogenesis and decreases the oxidized peroxiredoxins content in old rat liver[J].Rejuvenation Res,2012,15(2):136-139.
[11] Clark J,Simon DK.Transcribe to survive:tran⁃scriptional control of antioxidant defense programs for neuroprotection in Parkinson′s disease[J]. Antioxid Redox Signal,2009,11(3):509-528.
[12] Vercauteren K,Gleyzer N,Scarpulla RC.PGC-1-Related coactivator complexes with HCF-1 and NRF-2beta in mediating NRF-2(GABP)-depen⁃dentrespiratory gene expression[J].J Biol Chem,2008,283(18):12102-12111.
[13]Anderson S,Bankier AT,Barrell BG,de Bruijn MH,Coulson AR,Drouin J,et al.Sequence and orga⁃nization of the human mitochondrial genome[J]. Nature,1981,290(5806):457-465.
Effect of acetaminophen on mitochondrial biogenesis via PGC-1α pathway in HepaRG cells
ZHANG Ting-fen,GUO Jia-bin,PENG Hui,ZHANG Li,YUAN Hai-tao,YIN Jian, CUI Lan,ZHAO Jun,PENG Shuang-qing
(Evaluation and Research Center for Toxicology,Institute of Disease Prevention and Control, Academy of Military Medical Sciences,Beijing 100071,China)
OBJECTIVE To observe the effect of acetaminophen(APAP)on mitochondrial biogenesis regulated by peroxisome proliferator activated receptor-γ coactivator 1α(PGC-1α)pathway in HepaRGcells.METHODS HepaRG cells were seeded and cultured with growth medium,which was replaced by differential medium after confluence.The morphology of cells was daily observed and photographed. Cell viability was tested using MTT method after cells were exposed to APAP 0.125,0.25,0.5,1,2,4,8 and 12 mmol·L-1for 24 and 48 h,respectively.Protein expression of PGC-1α,nuclear respiratory factor-2 (NRF-2),mitochondrial transcription factor A(TFAM)pathway and subunit NADH dehydrogenase subunit1(ND-1)of mitochondrial respiratory chain complexⅠwas detected by Western blotting after exposure at different concentrations for 24 h.RESULTS Two types of cells,hepatocyte-like and biliarylike cells,were observed by microscopy.Compared with normal control,cell viability at 24 h and 48 h was inhibited in a concentration-dependent manner.IC50was 5.64 and 2.65 mmol·L-1,respectively.After 24 h exposure,protein expression of PGC-1α increased significantly(P<0.01)in APAP 0.5,1,2 and 4 mmol·L-1groups,but decreased significantly(P<0.01)in 8 mmol·L-1group.Protein expression of NRF-2 increased significantly(P<0.05)in 0.5 mmol·L-1groups but decreased significantly(P<0.01)in 2,4 and 8 mmol·L-1groups.Protein expression of TFAM increased significantly(P<0.05)in 1 mmol·L-1group,but decreased significantly(P<0.01)in 4 and 8 mmol·L-1groups.Protein expression of ND-1 increased significantly(P<0.01)in 0.5,1,2 and 4 mmol·L-1groups but decreased significantly(P<0.01) in 8 mmol·L-1group.CONCLUSION APAP can induce or inhibit mitochondrial biogenesis,which is possibly regulated by PGC-1α pathway in successfully differentiated HepaRG cells.
acetaminophen;mitochondrial;HepaRG cells;peroxisome proliferator activated recep⁃tor-γ;coactivator 1α;hepatotoxicity
PENG Shuang-qing,E-mail:pengsq@hotmail.com,Tel:(010)66948462
R966
A
1000-3002-(2017)02-0145-06
10.3867/j.issn.1000-3002.2017.02.04
Foundation item:The project supported by National Natural Science Foundation of China(81302864);and Unilever International Collaborative Support(CH-2011-1318)
2016-03-03 接受日期:2017-01-16)
(本文编辑:沈海南 乔 虹)
国家自然科学基金青年科学基金(81302864);联合利华国际合作项目(CH-2011-1318)
张廷芬,女,硕士,助理研究员,从事药物毒理与安全性评价;彭双清,男,博士,研究员,博士生导师,主要从事食品与药品的安全性评价。
彭双清,E-mail:pengsq@hotmail.com,Tel:(010)66948462
