碲化镉量子点对血管平滑肌细胞的损伤作用
2017-04-10刘珂舟孙永红
严 明,张 云,刘珂舟,孙永红
(1.杭州电子科技大学生命信息与仪器工程学院,浙江杭州 310018;2.绍兴文理学院基础医学院,浙江绍兴 312000;3.浙江大学生物医学工程与仪器科学学院,浙江省心脑血管检测技术与药效评价重点实验室,浙江杭州 310027)
碲化镉量子点对血管平滑肌细胞的损伤作用
严 明1,张 云2,刘珂舟1,孙永红3
(1.杭州电子科技大学生命信息与仪器工程学院,浙江杭州 310018;2.绍兴文理学院基础医学院,浙江绍兴 312000;3.浙江大学生物医学工程与仪器科学学院,浙江省心脑血管检测技术与药效评价重点实验室,浙江杭州 310027)
目的 观察碲化镉量子点(CdTe QD)在体外对大鼠血管平滑肌细胞(VSMC)的损伤作用。方法CdTe QD(0.01~100 mg·L-1)与原代培养的大鼠胸/腹主动脉平滑肌细胞共孵育24 h,MTT法检测CdTe QD对细胞存活的抑制;钙黄绿素乙酰甲酯(calcein-AM)荧光染色观察CdTe QD对VSMC细胞活性的影响;DCFH-DA和JC-1染色、流式细胞术检测CdTe QD作用后细胞内活性氧(ROS)含量和线粒体膜电位的变化;流式细胞术检测细胞凋亡;Western蛋白印迹法检测BCL-2和BAX蛋白表达变化。结果 MTT结果显示,CdTe QD 0.01~100 mg·L-1作用VSMC细胞24 h,细胞存活率降低(P<0.01),24 h IC50值为25.60 mg·L-1。Calcein-AM荧光检测发现,CdTe QD 0.1~25 mg·L-1作用后,VSMC细胞活性下降。DCFH-DA染色结果显示,CdTe QD 0.1~25 mg·L-1使细胞内ROS逐渐增加(P<0.05,P<0.01);JC-1染色结果表明,VSMC线粒体膜电位呈浓度依赖性降低(r=0.903,P<0.01)。Western蛋白印迹结果表明,CdTe QD诱导抗凋亡蛋白BCL-2表达显著降低(P<0.01),促凋亡蛋白BAX表达显著上升(P<0.01);流式细胞术FITC-AnnexinⅤ染色结果显示,CdTe QD 0.1~25 mg·L-1作用24 h能显著促进VSMC细胞凋亡(P<0.05,P<0.01)。结论CdTe QD可诱导VSMC细胞凋亡,其机制可能与胞内ROS含量上升和线粒体介导的凋亡通路激活相关。
碲化镉量子点;血管平滑肌细胞;活性氧;线粒体膜电位;凋亡
半导体纳米量子点(quantum dots,QD)是一类由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成的纳米颗粒。QD具有激发光谱宽且连续,发射光谱窄且对称的特点,它的发射光谱还可通过改变其尺寸大小来控制,可方便地实现单激发、多发射的多色荧光标记。同时,QD还具有光稳定性好、抗淬灭能力强等一系列显著优于传统有机荧光染料的特性,因此,QD显示出巨大的生物医学应用前景。1998年,QD首次被用于活细胞体系荧光标记[1]。迄今大量研究显示QD在从分子到细胞乃至组织的体外或在体标记,以及药物追踪、基因技术等众多领域都有着不俗的表现[2]。尽管如此,伴随着QD生物标记技术的迅速发展,人们与QD的接触日益增多,尤其是用于生物成像时,QD会直接进入血液循环系统,这引发了科研工作者关于QD对人体健康尤其是心血管系统健康影响的担忧。
血管平滑肌细胞(vascular smooth muscle cells,VSMC)是构成血管中膜组织结构的主要细胞成分,也是维持血管张力的物质基础,对血管壁完整性和血管紧张性调节起重要作用。而VSMC的结构及功能改变是导致高血压、动脉粥样硬化(ath⁃erosclerosis,AS)和血管成形术后再狭窄等多种心血管病的细胞病理学基础[3]。研究表明,多种促AS的病理刺激均能导致VSMC胞内活性氧(reactive oxygen species,ROS)含量上升,进而诱导VSMC凋亡[4]。我们前期利用水热法合成了巯基丁二酸(mercaptosuccinic acid,MSA)修饰的碲化镉QD(CdTe QD),并对该QD的理化性质进行了系统表征,结果显示该CdTe QD具备良好的光学特性和稳定性[5-6],可满足作为生物医学荧光探针的基本要求。而前期的细胞毒性研究结果揭示,该CdTe QD会造成血管腔内表面的血管内皮细胞(vascular en⁃dothelial cells,VEC)的氧化损伤并诱导EC凋亡[5],但上述CdTe QD是否对VSMC具有类似的损伤作用,目前尚未见报道。本研究拟采用体外培养大鼠胸/腹主动脉VSMC,研究CdTe QD对其的损伤作用及机制。
1 材料与方法
1.1 动物、试剂和仪器
体质量180~250g的雄性Sprague-Dawley大鼠(浙江省医学科学院实验动物中心)。水热法合成的CdTe QD(浙江大学秦海燕副教授馈赠)。低糖DMEM培养基和胎牛血清,线粒体膜电位荧光染料JC-1(美国Thermo Scientific公司),胰酶细胞消化液和活性氧检测试剂盒(上海碧云天生物技术有限公司),四甲基偶氮唑蓝(MTT,美国Sigma公司),Annexin-Ⅴ/PI凋亡试剂盒,RIPA均细胞裂解液,蛋白浓度测定试剂盒(BCA法)(联科生物科技有限公司),BCL-2和BAX多克隆抗体(美国Santa Cruz公司)。
电子分析天平(德国梅特勒-托利多公司),恒温二氧化碳细胞培养箱(美国Thermo Scientific公司),高速台式冷冻离心机(德国Hermle公司),酶标仪(美国Molecular Devices公司),FACS Calibur流式细胞仪(美国BD公司),电泳仪、转膜仪及凝胶成像分析系统均(美国Bio-Rad公司)。
1.2 CdTe QD细胞染毒液制备
用电子分析天平称取10 mg CdTe QD,在超净台内将CdTe QD采用1 mL PBS复溶,得到10 g·L-1母液。上述母液采用0.22 μm滤膜过滤除菌消毒后4℃存储备用。细胞染毒时采用将10 g·L-1的QD储存液用PBS准确稀释至1~1000 mg·L-1的工作液,使用时稀释10倍作用于细胞。
1.3 VSMC培养及分组处理
取体质量约200 g SD大鼠处死后,无菌条件下分离出胸主动脉,采用含10%胎牛血清的低糖DMEM培养基和组织块贴壁法进行VSMC原代培养[7],48 h后换液,此后每隔2~3 d换液1次,至细胞90%融合时传代,取3~5代VSMC进行实验。
将VSMC随机分成正常对照组和不同浓度CdTe QD损伤组:正常对照细胞每孔加入1/10体积的PBS,CdTe QD不同剂量组分别加入1/10体积相应浓度CdTe QD,使其终浓度分别为0.1~100 mg·L-1,孵育24 h后取细胞进行实验。
1.4 MTT法检测细胞存活率
将处于对数生长期的VSMC细胞接种于96孔培养板中,待细胞生长至基本融合后每孔加入180 μL低糖DMEM培养基和20μLCdTeQD染毒液,使各组CdTe QD终浓度分别为0.1~100 mg·L-1。37℃,5%CO2孵育24 h后,加入20 μL MTT 5 g·L-1,继续孵育4 h后,弃上清液,并加入150 μL DMSO溶解蓝紫色甲瓒结晶。酶标仪在490 nm处检测吸光度值(A490nm),细胞存活率(%)=处理组A490nm/对照组A490nm×100%。每组6个复孔,实验至少重复3次。
1.5 钙黄绿素乙酰甲酯(calcein-AM)染色检测细胞活性
Calcein-AM是一种低毒性、易透过细胞膜的活细胞荧光染料。只有在进入到细胞质后,才会被水解为calcein并发出强绿色荧光。研究表明,使用Calcein-AM进行细胞活性检测的结果与金标准51Cr-释放法的结果具有良好一致性[8]。因此,本研究通过calcein-AM染色实验观察CdTe QD对VSMC细胞活性的影响。将处于对数生长期的VSMC细胞接种于玻璃底培养皿,待细胞生长到90%融合后,随机分为正常对照组和CdTe QD处理组。按1.3处理细胞24 h后,移除上清液,PBS洗2次后加入100 μL的calcein-AM染色液,避光孵育20 min,然后用激光共聚焦显微镜检测细胞活性。检测过程中,激光功率及检测器电压放大倍数、增益等参数保持不变。
1.6 流式细胞术检测线粒体膜电位、凋亡率和细胞内ROS含量变化
VSMC细胞接种于24孔板中,按1.3处理细胞24 h,胰酶消化并离心收集细胞(400×g,5 min),将收集到的细胞重悬于适量PBS中,制成单细胞悬液,分别加入JC-1染料(终浓度5 mg·L-1),FITCAnnexinⅤ(5 μL)或DCFH-DA(终浓度10 μmol·L-1),避光孵育15~30 min后上流式细胞仪检测[9]。每组设4个复孔,实验至少重复3次。
1.7 Western蛋白印迹法检测BCL-2和BAX蛋白表达
VSMC细胞接种于6孔板中,按1.3处理细胞24 h,PBS清洗细胞后,用胰酶消化并离心收集细胞(400×g,5 min)。弃上清,加入RIPA裂解液冰上获取细胞总蛋白。采用BCA法测定各组总蛋白量。每组各取50 μg蛋白经SDS-PAGE凝胶电泳、转膜、封闭、一抗孵育过夜(兔抗大鼠BCL-2和BAX 1∶1000,大鼠抗人β肌动蛋白1∶1000),辣根过氧化物酶偶联二抗孵育1 h(1∶2500)后按ECL显色试剂盒说明书,加入显色液于凝胶成像系统中拍照[10]。用Quantity One软件分析蛋白条带,以目标条带与内参的积分吸光度比值表示各蛋白的表达水平。
1.8 统计学分析
2 结果
2.1 CdTe QD对VSMC细胞存活率的影响
MTT检测结果显示(图1),与正常对照组相比,CdTe QD 0.01~100 mg·L-1作用24 h后VSMC细胞存活率下降(P<0.01),分别为正常对照组的(83.7±6.2)%,(82.2±1.7)%,(79.7±2.1)%,(75.3±3.6)%,(65.1±0.8)%,(39.0±2.5)%和(18.7±1.8)%,提示CdTe QD对VSMC具有明显的细胞毒性。经计算,CdTe QD作用24 h,VSMC的IC50值为25.60 mg·L-1。

Fig.1 Effect of CdTe quantum dots(CdTe QD)on vascular smooth muscle cell(VSMC)survival by MTT. VSCM cells were treated with CdTe QD 0.01-100 mg·L-1for 24 h.,n=3.*P<0.05,**P<0.01,compared with normal control group.
2.2 CdTe QD对VSMC细胞活性的影响
正常对照组的VSMC细胞呈现强烈绿色荧光;0.1和CdTe QD 1 mg·L-1均使VSMC细胞内的calcein荧光强度有所下降。CdTe QD 10和25 mg·L-1对VSMC的细胞活性抑制效应更加明显(图2)。
2.3 CdTe QD对VSMC细胞内活性氧含量的影响

Fig.2 Effect of CdTe QD on cell viability of VSMC by calcein-AM staining.See Fig.1 for the cell treatment
DCFH-DA标记法检测CdTe QD对VSMC胞内ROS含量的影响结果(图3)所示,CdTe QD 0.1 mg·L-1作用24 h后VSMC细胞内的DCFH-DA的平均荧光强度为14.9±0.8,与正常对照组的平均荧光强度值13.8±2.6相比无显著变化。而CdTe QD 1~25 mg·L-1与VSMC共孵育24 h后细胞内的DCFH-DA荧光强度上升(P<0.05,P<0.01),分别为17.4±0.6,34.8±2.8和63.5±2.1,表明CdTe QD能导致VSMC细胞内ROS含量上升、诱导细胞发生氧化应激。
2.4 CdTe QD对VSMC细胞线粒体膜电位的影响
在0.1 mg·L-1的CdTe QD处理组,R1区域所包含的线粒体膜电位较低的VSMC比例为(8.6± 0.8)%,与正常对照组的(7.9±1.0)%相比无显著差异。而QD浓度上升引起了VSMC细胞线粒体膜电位明显下降(P<0.01),在CdTe QD 1,10和25 mg·L-1作用下,线粒体膜电位较低的VSMC细胞的比例分别上升至(12.2±0.6)%,(33.7±1.0)%和(42.5±1.4)%(图4)。
2.5 CdTeQD对VSMC细胞BCL-2和BAX蛋白表达的影响

Fig.3 Effect of CdTe QD on intracellular reactive oxygen species(ROS)in VSMC by flow cytometry.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.,n=3.*P<0.05,**P<0.01,compared with normal control group.
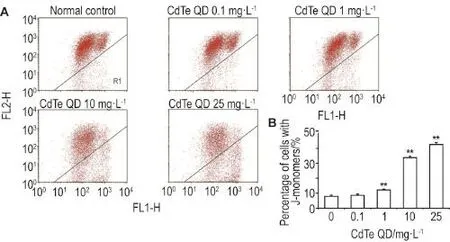
Fig.4 Effect of CdTe QD on mitochondrial membrane potential(MMP)of VSMC by flow cytometry.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.,n=3.**P<0.01,compared with normal control group.
Western蛋白印迹法(图5)结果显示,与正常对照组相比,0.1~25 mg·L-1的CdTe QD处理组VSMC的抗凋亡蛋白BCL-2水平显著下调(P<0.01),促凋亡蛋白BAX水平显著上升(P<0.01)。BCL-2/β肌动蛋白比值分别从0.56±0.09下降至0.41±0.06,0.38±0.08,0.18±0.05和0.11±0.04;BAX/β肌动蛋白比值分别从0.34±0.13上升至0.42±0.18,0.64±0.19,0.86±0.13和0.95±0.11。结果表明,随CdTe QD浓度的上升,BCL-2蛋白表达逐渐减弱,BAX蛋白的表达逐渐增加。
2.6 CdTeQD对VSMC细胞凋亡率的影响
正常对照组细胞仅有少量细胞呈现AnnexinⅤ阳性(即R4框内的细胞),这是由于正常细胞不断衰老,机体通过凋亡清除衰老细胞;而各QD处理组AnnexinⅤ阳性细胞的数量明显上升(P<0.05,P<0.01):AnnexinⅤ阳性细胞的百分比分别从正常对照组的(1.28±0.24)%上升至(2.42±0.44)%,(2.90± 0.76)%,(18.75±1.77)%以及(33.90±1.02)%,提示CdTe QD能诱导VSMC细胞凋亡(图6)

Fig.5 Effect of CdTe QD on protein expression of BCL-2(A)and BAX(B)in VSMC by Western blot⁃ting.See Fig.1 for the cell treatment.C was the semi-quantitative result of A and B.IA:integrated absorbance.,n=3.**P<0.01,compared with respective normal control group.

Fig.6 Effect of CdTe QD on apoptosis in VSMC by flow cytometry.See Fig.1 for the cell treatment.B was the semi-quantitative result of A.,n=3.*P<0.05,**P<0.01,com⁃pared with normal control group.
3 讨论
本研究发现,CdTe QD对VSMC细胞的存活率和细胞活性具有抑制作用,且存活率和细胞活性随QD浓度增加而下降,表明CdTe QD对VSMC细胞具有明显的细胞毒性作用。根据MTT的结果,计算得到CdTe QD对VSMC细胞的IC50值为25.60 mg·L-1,该浓度约为CdTe QD对人脐静脉内皮细IC50值的2.42倍[5],但远低于CdTe QD对HONE1,PC12和PNAC等永生化细胞株的IC50值[11-13]。据此推测,血管内皮细胞和VSMC细胞可能对CdTe QD造成的损伤更为敏感。此外,根据上述IC50值,在后续实验中,本研究采用较为接近IC50的25 mg·L-1作为研究CdTe QD对VSMC细胞毒性的最高浓度。
QD是一类光电特性优异的纳米晶体,具有良好的的生物医学应用前景,尤其是基于QD的荧光标记技术可用于体外或在体生物标记和药物示踪等领域[14]。然而,实际使用过程中QD可能通过静脉注射[14]或皮肤接触[15]等途径暴露于人体并因此对人体皮肤和血管系统带来潜在伤害。有研究表明,QD能被人表皮角质细胞(human epidermal keratinocytes,HEK)摄取,并导致HEK细胞活性下降和炎症反应[15];QD还能造成内皮细胞胞内ROS过度上升,进而造成多种细胞器损伤,并最终诱导细胞凋亡[5-6]。但关于QD对VSMC细胞的毒性研究国内外鲜有报道。
本研究结果表明,CdTe QD影响了VSMC的线粒体凋亡调节蛋白BCL-2和BAX表达量的变化,并诱导VSMC凋亡。细胞凋亡作为一种主动的、受到多种基因严格调控的程序性死亡,在细胞维持内环境稳定及个体发育方面起着极为重要的作用。然而许多因素能诱导细胞过度凋亡,进而诱导各种疾病的发生。例如,氧化低密度脂蛋白能诱导VSMC细胞凋亡,而上述VSMC细胞凋亡参与AS及再狭窄的发生发展[16]。因此,QD能导致VSMC细胞凋亡意味着其存在触发AS的风险,对于QD的临床应用是不利的。这要求QD的制备者必须使用于临床的QD具有更佳的光学性能来降低其使用浓度,或使其具有更好的生物相容性来降低对细胞的损伤。研究表明,外源性毒性物质导致的细胞内ROS过量蓄积可能对细胞器及细胞功能造成严重的氧化损伤[17]。目前公认,线粒体通过氧化磷酸化作用合成ATP,从而为细胞生命活动提供能量,是胞内最重要的细胞器之一。而病理刺激或毒性物质导致的细胞内ROS上升和氧化应激将引发线粒体代谢状态的改变和线粒体膜电位崩解;后者常被视为细胞凋亡的早期事件之一[18]。本研究显示,CdTe QD作用24 h能造成VSMC线粒体膜电位呈剂量依赖性下降,这与以往在巨噬细胞、血管内皮细胞等所观察到的QD毒性研究结果大体一致[5,19]。此外,由于线粒体还是内源性凋亡通路信号的汇聚和传输中心,病理或毒性因素除了影响线粒体的能量供给,还会进一步造成线粒体膜通透性的改变,释放BCL-2和BAX等凋亡相关蛋白、激活下游家族蛋白并最终诱导细胞凋亡[20]。
本研究结果提示,进入血液的QD具有显著的VSMC细胞毒性,是一种潜在的、致心血管疾病发生的危险因素。研究结果为了解QD的血管毒性提供了一定的实验依据,也可有利于QD的安全使用和设计。
参考文献:
[1]Chan WC,Nie S.Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science,1998,281(5385):2016-2018.
[2]Cai W,Shin DW,Chen K,Gheysens O,Cao Q,Wang SX, et al.Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects[J].Nano Lett,2006,6(4):669-676.[3]Wen JK,Han M.Vascular Smooth Mmuscle Cells(血管平滑肌细胞)[M].Beijing:Chinese Science Publishing&Media Ltd.,2005,1-5.
[4]Hsieh CC,Yen MH,Yen CH,Lau YT.Oxidized low density lipoprotein induces apoptosis via gen⁃eration of reactive oxygen species in vascular smooth muscle cells[J].Cardiovasc Res,2001,49(1):135-145.
[5]Yan M,Zhang Y,Xu K,Fu T,Qin H,Zheng X. An in vitro study of vascular endothelial toxicity of CdTe quantum dots[J].Toxicology,2011,282(3):94-103.
[6]Yan M,Zhang Y,Qin H,Liu K,Guo M,Ge Y,et al.Cytotoxicity of CdTe quantum dots in human umbilical vein endothelial cells:the involvement of cellular uptake and induction of pro-apoptotic endo⁃plasmic reticulum stress[J].Int J Nanomed,2016,11:529-542.
[7]Xu KD,Yan M,Wang YP,Yang Y,Zheng XX.Free cholesterol overloading induced smooth muscle cells death and activated both ER-and mitochondrialdependentdeath pathway[J].Atherosclerosis,2009,207(1):123-130.
[8]Bratosin D,Mitrofan L,Palii C,Estaquier J,Montreuil J.Novel fluorescence assay using calcein-AM for the determination of human erythrocyte viability and aging[J].Cytometry A,2005,66(1):78-84.
[9]Guo JM,Chen Y,Zhou Y,Han Z,Yang W.Induc⁃tion of furanodiene on apoptosis of human gastric adenocarcinoma MGC-803 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2016,30(3):215-220.
[10]Li SY,Guo M,Wang Y,Yu Y,Liu SB,Xu Y. Autophagy and endoplasmic reticulum stress of primary vascular smooth muscle cells triggered by hydrogen peroxide[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(6):899-904.
[11]Lovri c′J,Cho SJ,Winnik FM,Maysinger D. Unmodified cadmium telluride quantum dots in⁃duce reactive oxygen species formation leading to multiple organelle damage and cell death[J]. Chem Biol,2005,12(11):1227-1234.
[12]Chang SQ,Dai YD,Kang B,Han W,Mao L,Chen D.UV-Enhanced cytotoxicity of thiol-capped CdTe quantum dots in human pancreatic carcinoma cells[J].Toxicol Lett,2009,188(2):104-111.
[13]Chen JY,Lee YM,Zhao D,Mak NK,Wong RN,Chan WH,et al.Quantum dot-mediated photopro⁃duction of reactive oxygen species for cancer cell annihilation[J].Photochem Photobiol,2010,86(2):431-437.
[14]Hu R,Yong KT,Roy I,Ding H,Law WC,Cai H,et al.Functionalized near-infrared quantum dots for in vivo tumor vasculature imaging[J].Nano⁃technology,2010,21(14):145105.
[15]Ryman-Rasmussen JP,Riviere JE,Monteiro-Riv⁃iere NA.Penetration of intact skin by quantum dots with diverse physicochemical properties[J].Toxi⁃col Sci,2006,91(1):159-165.
[16] Larroque-Cardoso P,Swiader A,Ingueneau C,Nègre-Salvayre A,Elbaz M,Reyland ME,et al. Role of protein kinase Cδ in ER stress and apopto⁃sis induced by oxidized LDL in human vascular smooth muscle cells[J].Cell Death Dis,2013,28(4):e520.
[17]Love SA,Maurer-Jones MA,Thompson JW,Lin YS,Haynes CL.Assessing nanoparticle toxicity[J].Annu Rev Anal Chem(Palo Alto Calif),2012,5:181-205.
[18]Suski JM,Lebiedzinska M,Bonora M,Pinton P,Duszynski J,Wieckowski MR.Relation between mitochondrial membrane potential and ROS forma⁃tion[J].Methods Mol Biol,2012,810:183-205.
[19]Yin HR,Tang M,Xia T,Lu MY,Yang Y,Tao T,et al.Effect of quantum dots on apoptosis and mito⁃chondrial membrane potential in mruine peritoneal macrophage[J].Acta Sci Nat Univ Nankaiensis(Sci Ed)〔南开大学学报(自然科学版)〕,2008,41(3):5-9.
[20]Sinha K,Das J,Pal PB,Sil PC.Oxidative stress:the mitochondria-dependent and mitochondria-inde⁃pendent pathways of apoptosis[J].Arch Toxicol,2013,87(7):1157-1180.
CdTe quantum dots induced impairment in primary vascular smooth muscle cells
YAN Ming1,ZHANG Yun2,LIU Ke-zhou1,SUN Yong-hong3
(1.Department of Biomedical Engineering,College of Life Information Science and Instrument Engineering,Hangzhou Dianzi University,Hangzhou 310018,China;2.College of Medicine, Shaoxing Academy,Shaoxing 312000,China;3.Zhejiang Provincial Key Laboratory of Cardio-Cerebral Vascular Detection Technology and Medical Effectiveness Appraisal, Department of Biomedical Engineering,College of Biomedical Engineering and Instrument Science,Zhejiang University,Hangzhou 310027,China)
OBJECTIVE To study the effect of CdTe quantum dots(QD)induced injuries in vascular smooth muscle cells(VSMCs)and the potential mechanism.METHODS The rat thoracic/abdominal aorta VSMCs were treated with 0.01-100 mg·L-1CdTe QD for 24 h.The cell survival of CdTe QD-treated VSMCs was detected with MTT assay.The cell viability of VSMCs was measured by calcein-AM staining.Then,the CdTe QD-treated VSMCs were labeled with DCFH-DA and JC-1 probes. The intracellular ROS and mitochondrial membrane potential(MMP)were examined by flow cytometry.The cellular apoptosis in VSMCs was also examined in a flow cytometer after being labeled with FITC-AnnexinⅤ.Finally,the level of mitochondrial apoptosis pathways proteins including BCL-2 and BAX was observed by Western blotting.RESULTS MTT data showed that CdTe QD(0.01-100 mg·L-1) inhibited the cell survival(r=0.957,P<0.01),and that IC50was 25.6 mg·L-1at 24 h.The results of calcein-AM staining showed that the cell viability was gradually decreased.DCFH-DA staining results showed that 1-25 mg·L-1CdTe QD induced an increase in intracellular ROS levels(P<0.05,P<0.01).The results of JC-1 data showed a concentration-dependent disruption of MMP(r=0.903,P<0.01).Moreover,the results of Western blotting suggested that CdTe QD significantly increased the expression of BCL-2 and decrease the expression of BAX in VSMCs(P<0.01).The flow cytometry results from FITC-AnnexinⅤassay showed 0.1-25 mg·L-1CdTe QD significantly increased the apoptosis of VSMCS.CONCULSION CdTe QD induces apoptotic cell death in VSMCs,which is possibly related to the up-regulation of intra⁃cellular ROS and activation of mitochondria-mediated apoptosis pathways.
CdTe quantum dot;vascular smooth muscle cells;reactive oxygen species;mitochon⁃drial membrane potential;apoptosis.
YAN Ming,E-mail:yanming@hdu.edu.cn,Tel:(0571)86878667
R995
A
1000-3002-(2017)02-0165-07
10.3867/j.issn.1000-3002.2017.02.07
Foundation item:The project supported by Zhejiang Provincial Natural Science Foundation of China(LY15H180012); Zhejiang Provincial Natural Science Foundation of China(LY17H060043);Zhejiang Provincial Natural Science Foundation of China(LY14C100004);and National Natural Science Foundation of China(31401008)
2016-07-12 接受日期:2017-01-18)
(本文编辑:贺云霞)
浙江省自然科学基金(LY15H180012);浙江省自然科学基金(LY17H060043);浙江省自然科学基金(LY14C100004);国家自然科学基金(31401008)
严 明,女,博士,讲师,主要从事生物制造和微纳米材料生物相容性研究。
严 明,Email:yanming@hdu.eud.cn,Tel:(0571)86878667
