姜黄素对Aβ1-42诱导的细胞损伤和线粒体途径细胞凋亡的抑制作用
2017-04-10路书彦戴雪伶姜招峰黄汉昌
路书彦,杨 丽,戴雪伶,常 平,姜招峰,黄汉昌
(北京联合大学1.功能食品科学技术研究院,2.生物活性物质与功能食品北京市重点实验室,北京 100191)
·论著·
姜黄素对Aβ1-42诱导的细胞损伤和线粒体途径细胞凋亡的抑制作用
路书彦1,2,杨 丽1,2,戴雪伶1,2,常平1,2,姜招峰1,2,黄汉昌1,2
(北京联合大学1.功能食品科学技术研究院,2.生物活性物质与功能食品北京市重点实验室,北京 100191)
目的 探讨姜黄素对Aβ1-42诱导的细胞损伤和凋亡的抑制作用。方法 采用体外培养的人神经母细胞瘤SH-SY5Y细胞,分为溶剂对照组、Aβ1-4210 μmol·L-1损伤组、Aβ1-4210 μmol·L-1+姜黄素1,5和10 μmol·L-1保护组及姜黄素10 μmol·L-1对照组;噻唑蓝(MTT)法测定细胞存活率,酶活性法检测细胞培养液中乳酸脱氢酶(LDH)的含量以考察细胞损伤程度;AnnexinⅤ-FITC/PI染色法测定细胞凋亡;JC-1染色法检测线粒体膜电位变化;比色法测定胱天蛋白酶9和胱天蛋白酶3的活性;Western蛋白印迹法检测胱天蛋白酶3表达。结果与溶剂对照组比,Aβ1-4210 μmol·L-1损伤组细胞存活率显著降低(P<0.01)。与Aβ1-4210 μmol·L-1损伤组比较,姜黄素5和10 μmol·L-1缓解了Aβ1-42诱导的细胞存活率下降(P<0.05),降低了Aβ1-42诱导的乳酸脱氢酶释放水平(P<0.01)和细胞早期及晚期凋亡率(P<0.01)。姜黄素抑制了Aβ1-42诱导的细胞线粒体膜电位去极化作用(P<0.01);姜黄素1~10 μmol·L-1抑制了Aβ1-42诱导的胱天蛋白酶9及胱天蛋白酶3级联激活作用,且呈浓度依赖性(r=0.990,P<0.01;r=0.996,P<0.01)。姜黄素10 μmol·L-1对照组以上指标与溶剂对照组无明显差异。结论 姜黄素可能通过升高线粒体膜电位、降低胱天蛋白酶活性抑制Aβ1-42诱导的细胞损伤和线粒体途径细胞凋亡。
阿尔茨海默病;姜黄素;β-淀粉样蛋白;线粒体膜电位;细胞凋亡
阿尔茨海默病(Alzheimer disease,AD)是一种随人口老龄化加剧而呈现高发态势的神经退行性疾病。AD典型的病理特征主要表现为胞外淀粉样蛋白沉积形成老年斑、胞内Tau蛋白高度磷酸化形成神经原纤维缠结以及神经元大量凋亡[1-3]。β-淀粉样蛋白(β-amyloid protein,Aβ)是老年斑中的主要成分,Aβ是由淀粉样前体蛋白(amyloid-β precursor protein,APP)经β和γ-分泌酶水解的含39~42个氨基酸残基的多肽。Aβ主要以Aβ1-40和Aβ1-42两种形式存在,其中Aβ1-42更倾向于形成纤维状聚集物,被认为具有更高的神经毒性[4]。
“Aβ级联假说”是目前最为广泛研究的AD发病机制学说,该假说认为Aβ是引发AD的始发因素[5]。研究表明,Aβ寡聚体可以诱发Tau蛋白高度磷酸化,神经元突触丢失,以及神经元凋亡[6-7]。但Aβ导致神经元大量凋亡的机制还有待深入研究,有效预防或治疗AD的药物还有待开发。姜黄素是一种多酚类化合物,被广泛地用作天然色素及食品添加剂。姜黄素具有较好的生理活性作用,其毒性低,化学稳定性好,具有抗炎、降血脂、抗肿瘤和抑制血管增生等药理作用[8]。体外实验研究表明,姜黄素具有很强的自由基清除能力[9]。另外,姜黄素可增强核转录因子NF-E2相关因子2(NF-E2-re⁃lated factor 2,Nrf2)/抗氧化物反应元件(antioxi⁃dant response element,ARE)细胞内源性抗氧化通路活性的作用[10]。我们前期从细胞能量代谢和促凋亡因子释放的角度研究了姜黄素抑制Aβ1-40诱导的细胞线粒体损伤的作用[11-12]。本研究以Aβ1-42诱导的神经母细胞瘤细胞为模型,研究姜黄素对细胞损伤及凋亡的抑制作用。
1 材料与方法
1.1细胞、试剂和主要仪器
SH-SY5Y细胞(中国医学科学院)。姜黄素(纯度95%,高效液相色谱法鉴定)临用时用二甲亚砜(dimethyl sulfoxide,DMSO)溶解成10 mmol·L-1储备液。Aβ1-42〔吉尔生化(上海)有限公司〕临用时将2.0 mg冻干粉用一定体积的六氟异丙醇溶解,挥干成膜,加入20 μl DMSO溶解后,取420 μL再加入1 mmol·L-1无菌HCL溶液,于37℃孵育48 h。PRMI 1640培养基和胎牛血清(美国Gibco公司),链霉素-青霉素和四甲基偶氮唑盐〔(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)〕染料(Invitrogen公司),细胞裂解液(含蛋白酶抑制剂)、乳酸脱氢酶(lactate dehydrogenase,LDH)含量检测试剂盒、胱天蛋白酶3和胱天蛋白酶9活性检测试剂盒(碧云天公司),Annexin V-FITC细胞凋亡检测试剂盒(同仁化学研究所),胱天蛋白酶3和HRP标记山羊抗兔IgG抗体(美国Cell Signal Technology公司),L-LDH(9.3 g·L-1,北京世纪奥科生物技术有限公司);其余试剂为分析纯。Imag⁃ine Quant LAS凝胶成像分析仪(美国通用电气医疗公司),Varioskan Flash多功能酶标仪(美国赛默飞世尔科技公司),FACS Calibur流式细胞仪(美国BD公司),低温高速离心机(德国Eppendorf公司)。
1.2 SH-SY5Y细胞培养及药物处理
SH-SY5Y细胞复苏后置于37℃含5%CO2培养箱中传代培养(PRMI 1640培养基+10%胎牛血清+1%链霉素-青霉素溶液),每3~4 d传代1次,加药时换成不含血清的培养液。
药物处理及分组:溶剂对照组(加含0.1% DMSO的培养液);Aβ1-421,5,10和20 μmol·L-1损伤组,作用24 h;姜黄素保护组:先加入姜黄素1,5和10 μmol·L-1,作用4 h后再加Aβ1-4210 μmol·L-1的培养液继续作用至24 h;姜黄素对照组:加姜黄素10 μmol·L-1,作用24 h。
1.3 MTT法检测细胞存活
按每孔1×104个细胞接种96孔板,按1.2分组加药处理24 h后,加入MTT溶液(终浓度为0.5 g·L-1),于37℃,5%CO2的培养箱中继续培养4 h。4℃,800×g,离心10 min。弃上清,加150 μL DMSO,用移液器轻轻吹打,充分溶解结晶。在酶标仪上选定波长570 nm(参比波长630 nm),测定吸光度值(A)。相对存活率(%)=实验组(A570nm-A630nm)/溶剂对照组(A570nm-A630nm)×100%。Aβ1-42实验浓度采用Aβ1-42损伤后活细胞数为溶剂对照组60%~80%的浓度。
1.4培养液中乳酸脱氢酶含量检测
按每孔1×104个细胞接种96孔板中,按1.2分组加药处理24 h后,测定细胞培养液中LDH含量。取细胞培养液120 μL,加入60 μL LDH检测液,室温避光孵育30 min,490 nm波长下测定生成甲瓒的A值。在相同检测条件下,测定LDH标准品0,10,25,40,100,200和400 μg·L-1偶联催化底物生成甲瓒的A值,通过标准品标准曲线计算检测样品中LDH的含量。
1.5 AnnexinⅤ-FITC/PI流式细胞术分析细胞凋亡
按每孔5×105个细胞接种6孔板,按1.2分组加药处理12 h后,胰酶消化细胞。按照试剂盒操作说明向细胞悬浮液中加入AnnexinⅤ-FITC标记抗体和PI染料,室温(20~25℃)避光孵育20 min后进行流式细胞荧光计数20 000个细胞。计算不同凋亡阶段的细胞比例。早期细胞凋亡率(%)=早期凋亡细胞个数/计数细胞总数×100%,晚期细胞凋亡率(%)=晚期凋亡细胞个数/计数细胞总数×100%
1.6 JC-1探针和Hoechst33342细胞核染料法检测线粒体膜电位
按每孔1×104个细胞的接种96孔板,按1.2分组加药处理12 h后,加入JC-1探针10 μmol·L-1和Hoechst33342细胞核染料孵育30 min,PBS洗涤3次,在荧光显微镜下观察JC-1单体在激发波长488 nm,发射波长530 nm(绿色);JC-1聚合物在激发波长525 nm,发射波长590 nm(红色);细胞核在激发波长360 nm,发射波长460 nm的荧光图像。采用微孔板酶标仪记录相应荧光通道的发射荧光强度值(fluorescence intensity,FI)。计算FI绿/ FI红比值表示膜电位去极化水平。
1.7胱天蛋白酶9和胱天蛋白酶3酶活性测定
按每孔5×105个细胞接种6孔板,按1.2分组加药处理24 h后,提取细胞总蛋白,考马斯亮蓝法测定蛋白质浓度,在37℃下分别用胱天蛋白酶3和胱天蛋白酶9的底物作用细胞蛋白提取物,底物经酶切后生成黄色产物,用酶标仪在405 nm处测定A值,根据标准品标准曲线,分别计算样品中酶活性,以U·g-1蛋白表示。
1.8 Western蛋白印迹法检测胱天蛋白酶3表达水平
按每孔5×105个细胞的密度培养于6孔板中,按1.2分组加药处理24 h后,收集细胞,用含蛋白酶抑制剂的RIPA裂解液冰上裂解30 min,4℃12 000×g离心10 min,收集上清,二喹啉甲酸(bicinchonininc acid,BCA)法测定蛋白质浓度,1∶4比例加上样缓冲液,100℃煮沸样品10 min。SDS-PAGE分离不同相对分子质量蛋白质,然后电转膜至PVDF膜上,用含5%脱脂奶粉的PBST封闭1 h,4℃一抗(1∶2000稀释)孵育过夜,用PBST漂洗2次,PBS漂洗1次,二抗(1∶5000稀释)孵育2 h,同上漂洗数次后滴加1 mL ECL发光液,凝胶成像分析仪记录蛋白印迹发光图像,Quantity One软件对蛋白印迹进行积分吸光度(integrated absorbance,IA)分析。目标蛋白相对表达水平用IA目标蛋白/IAβ肌动蛋白比值表示。
1.9统计学分析
2 结果
2.1姜黄素对Aβ1-42诱导SH-SY5Y细胞存活率的影响
存活率检测结果显示,与溶剂对照组相比,姜黄素1和5 μmol·L-1组细胞存活率升高(P<0.05)(图1A),姜黄素10 μmol·L-1细胞存活率与溶剂对照组无明显差异。Aβ1-425,10和20 μmol·L-1损伤组细胞存活率降低,呈浓度依赖性下降(r=0.920,P<0.01),Aβ1-4210 μmol·L-1时细胞存活率为溶剂对照胞组的65.5%,在后续实验中选取Aβ1-4210 μmol·L-1作为损伤浓度。
与Aβ1-4210 μmol·L-1损伤组相比,姜黄素5和10 μmol·L-1保护组细胞存活率升高(P<0.05,P<0.05)。姜黄素5和10 μmol·L-1均能缓解Aβ1-4210 μmol·L-1导致的细胞存活率降低作用(图1C);提示一定浓度范围内姜黄素缓解了Aβ1-4210 μmol·L-1引起的细胞增殖抑制或者细胞死亡。
2.2姜黄素对Aβ1-42诱导SH-SY5Y细胞LDH含量的影响
与溶剂对照组相比,Aβ1-4210 μmol·L-1组细胞培养液中LDH的酶含量升高(P<0.01),提示Aβ1-4210 μmol·L-1作用24 h,导致细胞膜通透性增大,导致LDH由胞浆向细胞外液的释放;与Aβ1-4210 μmol·L-1组相比较,姜黄素5和10 μmol·L-1保护组细胞培养液中LDH含量降低(P<0.01),而姜黄素10 μmol·L-1对照组与溶剂对照组无明显差异,提示姜黄素对10 μmol·L-1Aβ1-42诱导的细胞损伤有一定的抑制作用。
2.3姜黄素对Aβ1-42诱导SH-SY5Y细胞凋亡作用的影响

Fig.1 Effect of curcumin on cell viability of SH-SY5Y cells damaged by Aβ1-42by MTT.A:cells were treated with curcumin 1,5,10 and 20 μmol·L-1for 24 h;B:cells were treated with Aβ1-421,5,10 and 20 μmol·L-1for 24 h;C:cells were pre-treated with curcumin 1,5,and 10 μmol·L-1for 4 h and then treated with Aβ1-4210 μmol·L-1for 24 h.,n=6.*P<0.05,**P<0.01,compared with vehicle control group;#P<0.05,compared with Aβ1-4210 μmol·L-1group.

Fig.2 Effect of curcumin on lactate dehydrogenase(LDH)in culture of SH-SY5Y cells damaged by Aβ1-42.See Fig.1C for cell treatment.,n=5.**P<0.01 compared with vehicle control group;##P<0.01,compared with Aβ1-4210 μmol·L-1group.
细胞凋亡实验结果显示(图3),与溶剂对照组相比,Aβ1-4210 μmol·L-1损伤组细胞早期和晚期凋亡率均升高(P<0.01);与Aβ1-4210 μmol·L-1损伤组相比,姜黄素5和10 μmol·L-1保护组细胞早期和晚期凋亡率降低(P<0.01),而姜黄素10 μmol·L-1对照组与溶剂对照组无明显差异,提示姜黄素5和10 μmol·L-1降低了Aβ1-4210 μmol·L-1诱导的胞凋亡水平。
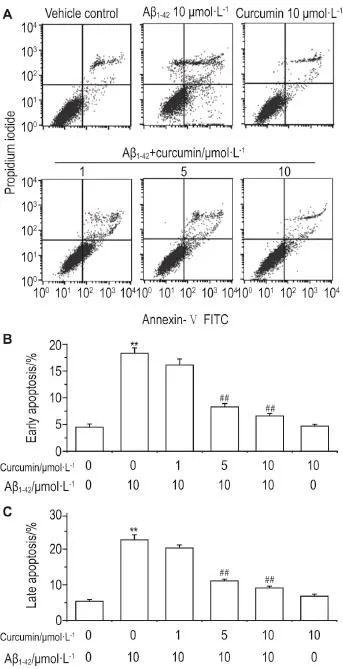
Fig.3 Effect of curcumin on apoptosis of SH-SY5Y cells damaged by Aβ1-42by flow cytometry.See Fig.1Cfor cell treatment.B and C was early and late apoptosis rate,re⁃spectively.,n=5.**P<0.01 compared with vehicle control group;##P<0.01,compared with Aβ1-4210 μmol·L-1group.
2.4姜黄素对Aβ1-42诱导SH-SY5Y细胞线粒体膜电位的影响
线粒体膜电位去极化结果显示(图4),与溶剂对照组相比,Aβ1-42损伤组中细胞绿色/红色FI比值升高(P<0.01),提示Aβ1-4210 μmol·L-1处理细胞12 h后线粒体膜电位发生了去极化。与Aβ1-4210 μmol·L-1损伤组相比,姜黄素10 μmol·L-1保护组中细胞绿色/红色FI比值下降(P<0.01),而姜黄素10 μmol·L-1对照组与溶剂对照组无明显差异,提示姜黄素保护细胞后减缓了Aβ1-42诱导的线粒体膜电位去极化作用。
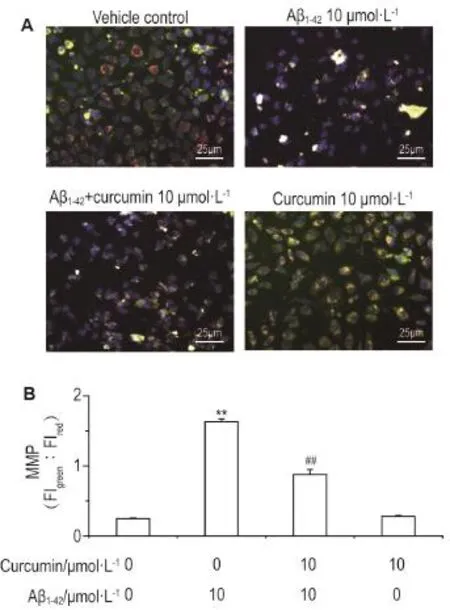
Fig.4 Effect of curcumin on depolarization of mito⁃chondrial membrane potential(MMP)of SH-SY5Y cells damaged by Aβ1-42.A:cells were pre-treated without or with curcumin 1,5,and 10 μmol·L-1for 4 h and then treated with Aβ1-4210 μmol·L-1for 12 h.B:relative fluorescence intensity ratio of green and red fluorescence.Blue,green and red fluorescences indicate the Hoechst33342-stained nuclei,the monomer JC-1 and the aggregate JC-1,respectively.FI:fluorescence intensity.,n=5.**P<0.01,compared with vehicle control group;##P<0.01,compared with Aβ1-4210 μmol·L-1group.
2.5姜黄素对Aβ1-42诱导SH-SY5Y细胞胱天蛋白酶激活作用的影响
图5结果显示,与溶剂对照组相比,Aβ1-4210 μmol·L-1损伤组胱天蛋白酶9和胱天蛋白酶3酶活性均升高(P<0.01);与Aβ1-4210 μmol·L-1损伤组相比,姜黄素1,5和10 μmol·L-1保护组细胞2种酶活性均降低(P<0.01),姜黄素1,5和10μmol·L-1保护细胞后减缓了Aβ1-4210 μmol·L-1诱导胱天蛋白级联激活作用,而姜黄素10 μmol·L-1对照组与溶剂对照组无明显差异。
2.6姜黄素对Aβ1-42诱导SH-SY5Y细胞胱天蛋白酶3表达水平的影响
Western蛋白印迹结果显示(图6),与溶剂对照组相比,Aβ1-4210 μmol·L-1损伤组细胞中活化的胱天蛋白酶3(15~17 ku)表达升高(P<0.01);与Aβ1-4210 μmol·L-1损伤组相比,姜黄素5和10 μmol·L-1保护组中活化的胱天蛋白酶3的表达均降低(P<0.01),而姜黄素10 μmol·L-1对照组与溶剂对照组无明显差异。以上结果提示,姜黄素减缓了Aβ1-4210 μmol·L-1诱导的细胞线粒体损伤而导致的胱天蛋白酶级联促凋亡作用。
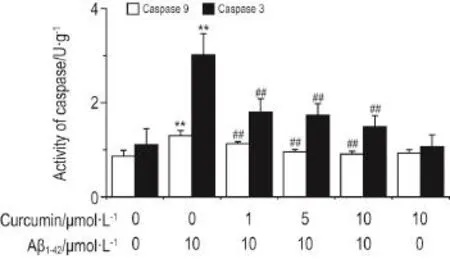
Fig.5 Effect of curcumin on enzymatic activity of cas⁃pases 9 and caspases 3 of SH-SY5Y cells damaged by Aβ1-42.See Fig.1C for cell treatment.,n=5.**P<0.01,compared with vehicle control group;##P<0.01,compared with Aβ1-4210 μmol·L-1group.

Fig.6 Effect of curcumin on protein expression of caspase 3 in SH-SY5Y cells damaged by Aβ1-42.See Fig.1 for cell treatment.IA:integreted absorbance.,n=5.**P<0.01,compared with vehicle control group;##P<0.01,compared with Aβ1-4210 μmol·L-1group.
3 讨论
本研究结果表明,Aβ1-42诱导SH-SY5Y细胞线粒体膜电位降低和胱天蛋白酶9、胱天蛋白酶3的活性上升,Aβ1-42导致了细胞早期凋亡、晚期凋亡和细胞损伤作用水平的增加。线粒体是细胞通过三羧酸循环和氧化磷酸化生成ATP的主要场所,线粒体的稳态失衡会导致细胞凋亡发生。研究表明,Aβ1-42刺激小鼠胚胎皮质神经前体细胞后导致线粒体通透性转换孔(mitochondrial permeability tran⁃sition pores,mPTP)的开放及线粒体内过氧化物的释放,进而导致细胞活性氧水平的升高、线粒体膜电位的降低及细胞色素c的释放。抑制mPTP的开放能改善Aβ1-42诱导的细胞损伤作用[13]。因此,线粒体凋亡途径可能与Aβ1-42造成的细胞凋亡和损伤密切相关。
但外在添加的Aβ1-42诱导细胞线粒体损伤的途径目前有待进一步研究。一方面,Aβ1-42可能与细胞膜表面的受体结合,诱导细胞级联信号传导作用,最终导致线粒体损伤。另一方面,Aβ被认为可能在细胞膜上聚集形成Ca2+通透性的离子通道[14],诱导胞内Ca2+增加。我们以前的实验也表明,Aβ处理细胞后,导致SH-SY5Y细胞内Ca2+浓度的升高[12],胞内升高的Ca2+最终导致线粒体的损伤。另外,我们猜测,细胞内源性分泌的Aβ可能对细胞凋亡也起到促进作用;Aβ存在细胞内分泌的途径[15],培养液中添加的Aβ可能会扰乱细胞内源性的Aβ分泌稳态平衡,导致细胞倾向胞内分泌Aβ,引起胞内Aβ含量升高,从而引发线粒体损伤。
本研究结果表明,姜黄素削弱了Aβ1-42诱导的细胞损伤和细胞早期和晚期凋亡作用,抑制了线粒体膜电位去极化及胱天蛋白酶9和胱天蛋白酶3的激活作用,这可能与姜黄素抑制Aβ1-42诱导的细胞凋亡作用密切相关;姜黄素的抗氧化活性可能对细胞的氧化损伤和凋亡起到重要的抑制作用。体内研究实验结果表明,姜黄素能通过血脑屏障并与Aβ斑块相结合,且能抑制Aβ聚集,破坏Aβ多聚体的形成[16-17],分子结构中含有的酚羟基赋予姜黄素很强的抗氧化活性[18]。体内实验也表明,姜黄素对L-谷氨酸造模的AD模型小鼠脑组织具有抗氧化损伤的保护作用[19]。另外,我们的前期实验表明,姜黄素还具有增强细胞自身的Nrf2/ARE抗氧化通路活性的作用[9]。
[1]Huang HC,Jiang ZF.Accumulated amyloid-beta peptideandhyperphosphorylatedtauprotein:relationship and links in Alzheimer′s disease[J].J Alzheimers Dis,2009,16(1):15-27.
[2]Muramori F,Kobayashi K,Nakamura I.A quantita⁃tive study of neurofibrillary tangles,senile plaques and astrocytes in the hippocampal subdivisions and entorhinal cortex in Alzheimer′s disease,normal controls and non-Alzheimer neuropsychiatric diseases[J].Psychiatry Clin Neurosci,1998,52(6):593-599.
[3]Blennow K,Bogdanovic N,Alafuzoff I,Ekman R,Davidsson P.Synaptic pathology in Alzheimer′s disease:relation to severity of dementia,but not to senile plaques,neurofibrillary tangles,or the ApoE4 allele[J].J Neural Transm(Vienna),1996,103(5):603-618.
[4]Huang HC,Jiang ZF.Amyloid-β protein precursor familymembers:areviewfromhomologyto biological function[J].J Alzheimers Dis,2011,26(4):607-626.
[5]Karran E,Mercken M,De Strooper B.The amyloid cascade hypothesis for Alzheimer′s disease:an appraisal for the development of therapeutics[J]. Nat Rev Drug Discov,2011,10(9):698-712.
[6]Ebenezer PJ,Weidner AM,LeVine H 3rd,Markesbery WR,Murphy MP,Zhang L,et al. Neuron specific toxicity of oligomeric amyloid-β:role for JUN-kinase and oxidative stress[J].J Alzheimers Dis,2010,22(3):839-848.
[7]Jin M,Shepardson N,Yang T,Chen G,Walsh D,Selkoe DJ.Soluble amyloid beta-protein dimers isolated from Alzheimer cortex directly induce Tau hyperphosphorylationandneuriticdegeneration[J].Proc Natl Acad Sci USA,2011,108(14):5819-5824.
[8]Naik SR,Thakare VN,Patil SR.Protective effect of curcumin on experimentally induced inflamma⁃tion,hepatotoxicity and cardiotoxicity in rats:evi⁃dence of its antioxidant property[J].Exp Toxicol Pathol,2011,63(5):419-431.
[9]Huang HC,Chang P,Dai XL,Jiang ZF.Protective effects of curcumin on amyloid-β-induced neuronal oxidative damage[J].Neurochem Res,2012,37(7):1584-1597.
[10]Huang HC,Lu SY,Chang P,Zheng BW,Zhang L,Jiang ZF.Participation of Nrf2-ARE signaling in curcumin inhibition of amyloid-β-induced cellular oxidative stress and cell apoptosis[J].Mod Food Sci Technol(现代食品科技),2015,31(6):1-5,43.
[11]Huang HC,Xu K,Jiang ZF.Curcumin-mediated neuroprotection against amyloid-β-induced mitochon⁃drial dysfunction involves the inhibition of GSK-3β[J].J Alzheimers Dis,2012,32(4):981-996.
[12]Huang HC,Chang P,Lu SY,Zheng BW,Jiang ZF. Protection of curcumin against amyloid-β-induced cell damage and death involves the prevention from NMDA receptor-mediated intracellular Ca2+elevation[J].J Recept Signal Transduct Res,2015,35(5):450-457.
[13]Hou Y,Ghosh P,Wan R,Ouyang X,Cheng H,Mattson MP,et al.Permeability transition pore-me⁃diated mitochondrial superoxide flashes mediate an early inhibitory effect of amyloid beta1-42 on neural progenitor cell proliferation[J].Neurobiol Aging,2014,35(5):975-989.
[14] Arispe N,Pollard HB,Rojas E.Giant multilevel cation channels formed by Alzheimer disease amyloid beta-protein(Aβ P1-40)in bilayer membranes[J].Proc Natl Acad Sci USA,1993,90(22):10573-10577.
[15]Gu XM,Huang HC,Jiang ZF.Mitochondrial dysfunction and cellular metabolic deficiency in Alzheimer′s disease[J].Neurosci Bull,2012,28(5):631-640.
[16]Yang F, Lim GP, Begum AN, Ubeda OJ,Simmons MR,Ambegaokar SS,et al.Curcumin inhibits formation of amyloid beta oligomers and fibrils,binds plaques,and reduces amyloid in vivo[J].J Biol Chem,2005,280(7):5892-5901.
[17] Garcia-Alloza M,Borrelli LA,Rozkalne A,Hyman BT,Bacskai BJ.Curcumin labels amyloid pathology in vivo,disrupts existing plaques,and partially restores distorted neurites in an Alzheimer mouse model[J]. J Neurochem,2007,102(4):1095-1104.
[18]Priyadarsini KI,Maity DK,Naik GH,Kumar MS,Unnikrishnan MK,Satav JG,et al.Role of phenolic O-H and methylene hydrogen on the free radical reactions and antioxidant activity of curcumin[J]. Free Radic Biol Med,2003,35(5):475-484.
[19]Li HZ,Zhang YF.Effect of curcumin on antioxida⁃tive system in Alzheimer′s disease model mice[J]. Acta Chin Med Pharmacol(中医药学报),2014,42(5):34-36.
Inhibitory effect of curcumin on Aβ1-42-induced cell damage and mitochondrial pathway apoptosis
LU Shu-yan1,2,YANG Li1,2,DAI Xue-ling1,2,CHANG Ping1,2,JIANG Zhao-feng1,2, HUANG Han-chang1,2
(1.Research Institute for Science and Technology of Functional Foods,2.Beijing Key Laboratory of Bioactive Substances and Functional Food,Beijing Union University,Beijing 100191,China)
OBJECTIVE To investigate the protective effect of curcumin on Aβ1-42damaged cells. METHODS SH-SY5Y cells were cultured with Aβ1-4210 μmol·L-1in the absence or presence of curcumin 1,5 or 10 μmol·L-1.Cell viability was assayed by MTT.Cell membrane damage was detected by the concentration of lactate dehydrogenase(LDH)in culture medium.Cell apoptosis was measured by flow cytometry with AnnexinⅤ-FITC/PI staining.Mitochondrial membrane potential was characterized by fluorescence of JC-1 dye.Enzymatic activity of caspases-9 and-3 was measured by colorimetric assay. Protein expression of caspase-3 was detected by Western blotting.RESULTS Compared with vehicle control,the cell viability,concentration of LDH and both early and late apoptosis in Aβ1-4210 μmol·L-1damaged group were decreased(P<0.01).However,the cell viability,release of LDH and both early and late apoptosis in curcumin group were promoted compared with that in Aβ1-4210 μmol·L-1damaged group.Curcumin inhibited Aβ1-42-induced depolarization of mitochondrial membrane potential(P<0.01), and attenuated Aβ1-42-induced activation of both caspases9 and caspases3 in a concentration-dependent manner,respectively(r=0.990,P<0.01;r=0.996,P<0.01).There were no significant differences in the above detected indexes between curcumin 10 μmol·L-1group and vehicle control group.CONCLUSION Curcumin inhibits Aβ1-42-induced cell damage and apoptosis by promoting mitochondrial membrane potential and depressing the activation of caspases.
Alzheimer disease;curcumin;β amyloid protein;mitochondrial membrane potential; apoptosis
HUANG Han-chang,E-mail:hanchang@buu.edu.cn
R285
A
1000-3002-(2017)02-0138-07
10.3867/j.issn.1000-3002.2017.02.03
Foundation item:The project supported by National Natural Science Foundation of China(31471587);and Scientific Research Common Program of Beijing Municipal Commission of Education(SQKM201411417003)
2016-01-19接受日期:2016-10-19)
(本文编辑:贺云霞)
国家自然科学基金(31471587);北京市教委科技计划面上发展项目(SQKM201411417003)
路书彦,硕士研究生,主要从事食品科学研究;黄汉昌,博士,副教授,主要从事阿尔茨海默病发病机制及其治疗药物筛选研究
黄汉昌,E-mail:hanchang@buu.edu.cn
