磷脂对大豆乳清蛋白乳化特性的影响
2017-03-28韩天翔李杨毕爽隋晓楠武艳华王中江江连洲王喜波
韩天翔,李杨,毕爽,隋晓楠,武艳华,王中江,江连洲,王喜波
(东北农业大学 食品学院,黑龙江 哈尔滨,150030)
磷脂对大豆乳清蛋白乳化特性的影响
韩天翔,李杨,毕爽,隋晓楠,武艳华,王中江,江连洲,王喜波*
(东北农业大学 食品学院,黑龙江 哈尔滨,150030)
以非变性大豆乳清蛋白(NWSP)及热变性大豆乳清蛋白(DWSP)为研究对象,探究了磷脂(Lec)对NWSP乳液、DWSP乳液的影响,并对Lec添加前后乳化体系的乳化活性、乳化稳定性、大豆乳清蛋白的表面疏水性、ζ-电位、粒径分布、激光共聚焦显微成像(CSLM)等进行表征。研究发现:与纯大豆乳清蛋白乳化体系比较,添加磷脂后的DWSP-Lec乳化体系、NWSP-Lec乳化体系乳化活性显著提高、乳滴平均粒径减小、乳液的ζ-电位值增加,有效阻止了乳滴絮凝聚集乳液稳定性增强,DWSP-Lec乳液稳定性高于NWSP-Lec乳液,这可能是热处理后大豆乳清蛋白分子发生折叠,包埋于蛋白内部的疏水基团及巯基暴露从而增强大豆乳清蛋白与Lec间的疏水交互作用,大豆乳清蛋白-磷脂的协同作用使其乳化活性增强,乳液更趋于稳定。
大豆乳清蛋白;磷脂;乳液、乳化性;粒径分布
随着现代高新技术的飞速发展和人们消费观念的转变,大豆乳清废水的开发利用逐渐得到重视,同时,大豆乳清废水中的部分生理活性物质也逐渐受到关注与研究。大豆乳清蛋白是大豆乳清废水中的重要组分,含有多种生物活性物质;其中,胰蛋白抑制剂(尤其是Bowman-Birk型胰蛋白酶抑制剂)具有显著的抑癌活性[1]。胰蛋白酶抑制剂能抑制某些癌基因的表达及降低诱癌因素引起的基因表达扩增[2],可抑制鳞状细胞癌、结肠癌、腺癌、血管肉瘤等多种类型的肿瘤[3]。大豆乳清蛋白不仅拥有上述诸多生理功能特性,还具有一定的加工功能特性。LASSISSI[4]通过超滤技术把大豆乳清蛋白按照分子质量分为<5、>5、>10、>50 kDa,研究发现大豆乳清蛋白分子质量>5 kDa时均具有良好的起泡性,但是,仅分子质量>50 kDa时,才具有一定乳化稳定性。江连洲等[5]研究了利用膜分离技术提取的大豆乳清蛋白的功能特性,发现大豆乳清蛋白具有较好的溶解性及起泡性,但乳化性及稳定性较低。天然的大豆乳清蛋白的功能特性很难满足所有加工需求,因此常需要对蛋白进行适当的改性。杨晓泉等[6]研究发现,过热处理大豆乳清蛋白会产生可溶性聚集体,该聚集体可改善大豆乳清蛋白乳液的稳定性。PALAZOLO等[7]研究发现,加热处理后大豆乳清蛋白乳液水合作用增强并产生类似凝胶的结构从而提高了乳液的储存稳定性。
磷脂是一种天然表面活性剂,具有优良的乳化性、扩散性和浸润性。磷脂酰胆碱分子与蛋白质结构中的疏水区域通过疏水作用相互结合形成的磷脂-蛋白二元复合物在稳定乳浊液方面有协同促进的作用[8]。BARBANA等[9]研究发现,蛋白质与磷脂间的相互作用影响蛋白质结构及乳液界面特性,进而增强了其乳化能力,并影响到蛋白质的微胶囊化性质。COMAS等[10]研究发现,在SPI与磷脂(Lec)复合后形成的NSI-Lec与DSI-Lec复合物中,磷脂的存在促进了乳浊液初始阶段形成高密度的小而低絮凝的颗粒,因此降低了乳化分层速率,乳浊液很稳定。然而目前对于大豆乳清蛋白乳液乳化稳定性的机理及磷脂对大豆乳清蛋白乳液稳定性的影响研究尚不明确,有待深入的研究。本研究以非变性大豆乳清蛋白(NWSP)及热变性大豆乳清蛋白(DWSP)为研究对象,探究了磷脂(Lec)对NWSP乳液、DWSP乳液的稳定性的影响,通过对大豆乳清蛋白水包油型乳化体系中蛋白的表面疏水性、乳化活性、乳化稳定性、粒径分布、ζ-电位、微观结构的变化进行表征与分析,探究大豆乳清蛋白乳液的稳定性变规律,明确磷脂与大豆乳清蛋白间相互作用机制。
1 材料与方法
1.1 材料与仪器
大豆,东北农业大学大豆研究中心;葵花油,哈尔滨家乐福超市;磷脂,上海楷洋生物技术有限公司;电泳SDS-PAGE凝胶制备试剂盒,北京索莱宝科技有限公司;正己烷、NaOH、HCl、(NH4)2SO4、H3PO4、SDS等试剂均为分析纯。
pH S-25酸度计,上海伟业仪器厂;FD5-3型冷冻干燥机,美国SIM公司;CS910型薄层扫描仪;电子分析天平,梅勒特-托利多仪器(上海)有限公司;电泳仪,北京六一仪器厂;PALS-Zeta电位仪,美国布鲁克海文仪器公司;Mastersize2000激光粒度分析仪,英国马尔文公司;ZEISSLSM700激光共聚焦显微镜,德国蔡司公司;Allegra64R台式高速冷冻离心机,美国贝克曼公司;T18basic高速乳化均质机,英国IKA公司。
1.2 实验方法
1.2.1 大豆乳清蛋白的制备
大豆乳清蛋白的制备采用GONZALO的方法[11]并作了部分修改,原料大豆50 ℃烘干脱皮后进行粉碎60目过筛后按1∶3质量比例(豆粉∶溶剂)加入正己烷,放在磁力搅拌器上搅拌60 min后;用低速离心机离心(4 000×g,15 min)。重复脱脂浸提3次以上,将沉淀物置于通风厨中至正己烷完全挥发。脱脂豆粉室温下溶于水并调至pH 8.0,浸提2 h后离心(104 000×g,15 min,20 ℃),取上清液调节pH值至4.5,静置沉降后离心(104 000×g,15 min,4 ℃),取上清液调pH值至8.0后离心分离(104 000×g,15 min,20 ℃)得澄清透明上清液,加入质量分数90%的(NH4)2SO4饱和溶液沉淀离心(124 000×g,15 min,20 ℃),沉淀水洗两次后4 ℃透析24 h,冷冻干燥可得非变性大豆乳清蛋白(NWSP)。将NWSP溶解在pH 7.0的磷酸缓冲溶液中,70 ℃加热处理5 min后,再经冷冻干燥可得变性大豆乳清蛋白(DWSP)。
1.2.2 凝胶电泳
采用KASRAN的方法[12],并作了部分修改。分离胶浓度(12%),浓缩胶(4%),上样量为15 μL电泳结束后,进行固定、染色、脱色。用Quantity-one软件进行处理分析。
1.2.3 乳液的制备
大豆乳清蛋白乳液的制备:取0.18 g不同大豆乳清蛋白分别溶于18 mL磷酸缓冲溶液(pH 7)中,混合搅拌2 h至完全溶解后加入2 mL葵花籽油在高速均质机20 000 r/min条件下均质2 min。
磷脂乳液的制备:取0.18 g不同大豆乳清蛋白分别溶于18 mL磷酸缓冲溶液(pH 7)中,混合搅拌2h至完全溶解后加入2 mL葵花籽油在高速均质机20 000 r/min条件下均质2 min。
大豆乳清蛋白-磷脂复合乳化体系的制备:m(大豆乳清蛋白)∶m(磷脂)=10∶1,将大豆乳清蛋白、磷脂溶解在pH 7的磷酸缓冲液中[10]。在常温下磁力搅拌2 h,加入一定量的葵花油(油相体积10%),在20 000 r/min条件下高速均质2 min[13]。
1.2.4 表面疏水性的测定
参考KATO等[14]的方法,采用ANS荧光探针法测定蛋白表面疏水性。称取0.05 g蛋白质/蛋白质-磷脂样品溶于100 mL磷酸盐缓冲液(0.01 mol/L ,pH 7.0)中,搅拌1 h后在10 000×g的速度下离心30 min,用Lowry法测定上清液的蛋白质浓度,再用磷酸盐缓冲液对溶液进行梯度稀释,终浓度控制在0.005~0.5 mol/mL,每3 mL溶液中加入60 μL的ANS溶液(8 mmol/L),充分混合后避光静置5 min,测定荧光强度。实验中激发波长选取390 nm,发射波长选取470 nm,夹缝10 nm。以蛋白质浓度为X值,荧光强度为Y值作图,初始段斜率即为蛋白质分子的表面疏水性指数(So)。
1.2.5 乳化特性及乳化稳定性
乳化性的测定参考MOLINA[15]等的实验方法并作部分修改。将均质后的乳状液立即用0.1%的SDS溶液稀释数倍,在500 nm波长的紫外分光光度计测定吸光值计算乳化活性指数(EAI),静置10 min后测定吸光值计算乳化稳定性(ESI),如公式(1)、(2)。
(1)
(2)
式中:T=2.303;N,稀释倍数(300);ρ,乳化液形成前蛋白质水溶液中蛋白质浓度,g/mL;φ,乳化液中油相体积分数(0.1);A0,0min时吸光值;A10,10min时吸光值。
所有的实验结果为3次测定值的平均值。
1.2.6 乳液ζ-电位测定
根据Crudden的测定方法[16],采用ζ-电位仪测定乳液的ζ-电位。将乳液样品用0.0 2 mol/L的磷酸缓冲液(pH 7.0)稀释溶液,上样体积为1 mL,测定温度为25 ℃。重复3次平行测量,计算平均值为测定值。
1.2.7 乳液粒径分布的测定
利用Mastersize 2000激光粒度分析仪测定乳状液的粒度分布,在室温下进行测定。参数设置为:分散剂∶水;颗粒折射率:1.520;颗粒吸收率:0.001;分散剂折射率:1.330。乳液液滴的平均粒径采用体积平均直径D(4,3)来表示,每个样品做3次平行[17]。
1.2.8 乳液激光共聚焦测定(CLSM)
采用ZEISSLSM700激光共聚焦显微镜(CLSM)对乳液的微结构进行观察。吸取15 mL乳液样品与40 μL的荧光染料(0.1 g/L尼罗红和1 g/L尼罗蓝)混合后,取40μL滴加到带有凹槽的玻璃载玻片上。使用40倍的物镜对乳液的微结构进行观察,并且利用Ar/Kr和He/Ne双通道激光模式采集图像,激发波长分别为488 nm和633 nm[18]。
1.3 数据分析
本文的所有数据均进行了3次平行样测定,图表均采用采用SAS(statistics analysis system7.0)软件对数据结果进行统计、分析,ORIGIN8.6软件绘制图表。
2 结果与分析
2.1 凝胶电泳结果分析
电泳图谱是分析蛋白质组成成分的重要手段,通过SDS-PAGE可得知大豆乳清蛋白的分子质量及其分布(见图1)。
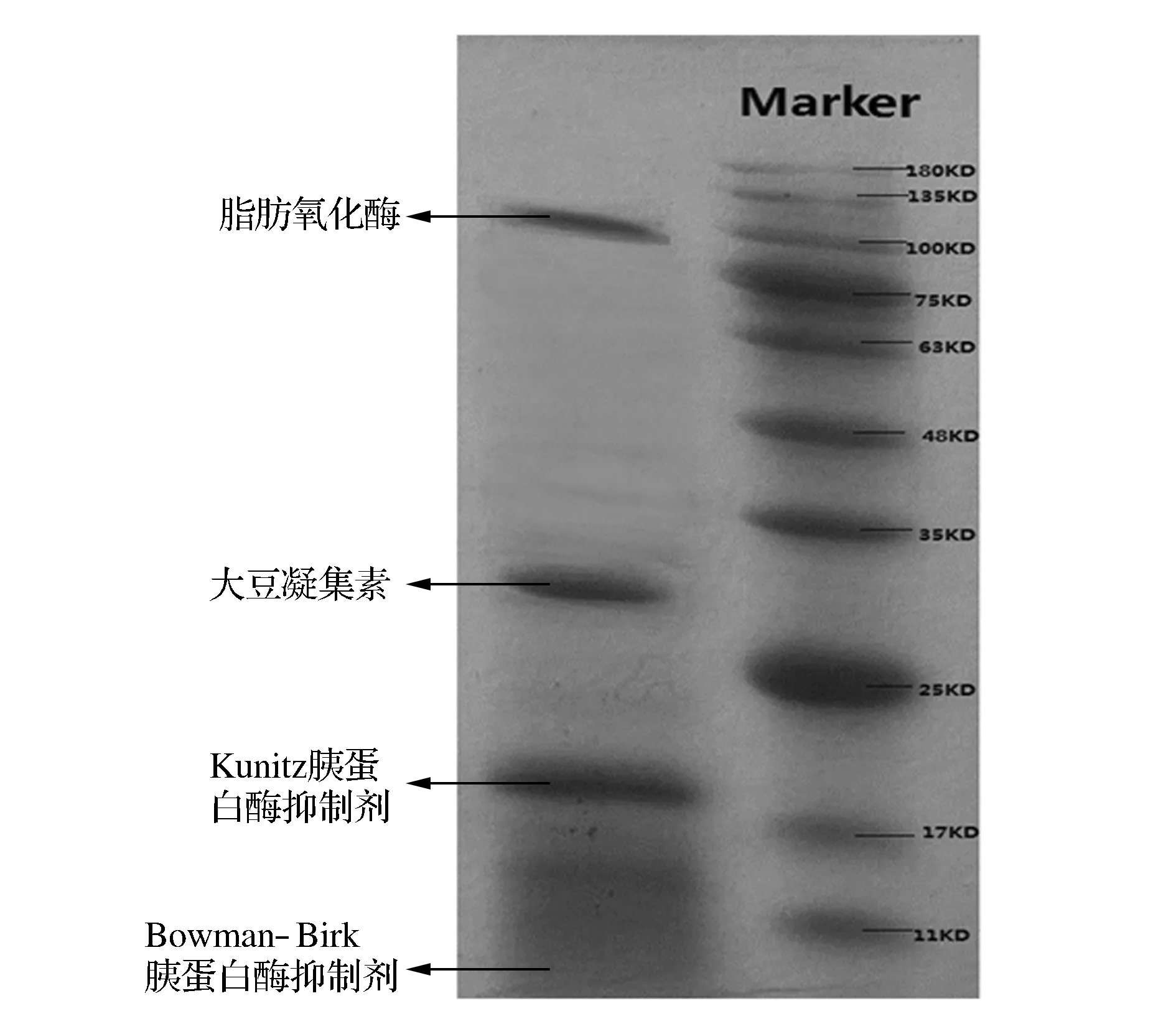
图1 大豆乳清蛋白电泳图Fig.1 Electrophoresis figure of soybean whey protein
从图1的带谱中可以看出,样品蛋白纯度相对较高,大豆乳清蛋白样品的主要成分是脂肪氧化酶(102 kDa)、β-淀粉酶(61.7 kDa)、大豆凝集素(33 kDa)、Kunitz型胰蛋白酶抑制剂(KTI,20 kDa)和Bowman-Birk型胰蛋白酶抑制剂(BBI,7.9 kDa)。结果与SORGENTINI等[19]的研究结果基本吻合。利用Quantity-one软件定量分析SDS-PAGE泳道的各条带可知胰蛋白酶抑制剂相对含量为61.4%,大豆凝集素相对含量为18.5%。可见样品的主要成分为胰蛋白酶抑制剂、大豆凝集素。
2.2 大豆乳清蛋白表面疏水性测定
蛋白质作为一种乳化剂,含有亲水和亲油的两亲结构,通常多数蛋白质的极性氨基酸分布在分子表面,非极性氨基酸多分布在分子内部。然而蛋白质表面也存在一些疏水基团,因此使蛋白质具有表面疏水性。蛋白质的表面疏水性对其功能特性的发挥比整体疏水性更重要[20]。这些疏水基团暴露于蛋白质表面不但对蛋白质的功能性起重要作用,而且对蛋白质-磷脂交互作用起重要作用。为了更好地了解磷脂对蛋白质表面疏水性的影响,对磷脂作用前后大豆乳清蛋白的表面疏水性进行了测定。蛋白质表面疏水性的测定结果如图2,热变性大豆乳清蛋白(DWSP)表面疏水性(579±13.24)大于未变性大豆乳清蛋白(339±3.61),热处理后大豆乳清蛋白的表面疏水性显著增加。PALAZOLO[21]研究得到相似结果,并推测热处理后蛋白质分子发生去折叠,导致处于内部的疏水基团的暴露,表面疏水性提高。蛋白质与磷脂作用后,NWSP和DWSP的表面疏水性都有不同程度的降低,这是由于磷脂与蛋白质发生了疏水作用结合[22]。HE[23]指出磷脂与蛋白质作用会导致蛋白质三级结构的折叠,使疏水基团进行包埋,因此表面疏水性下降。蛋白质经热变性后蛋白质空间结构变化导致表面疏水性增加,进而提高了大豆乳清蛋白质-磷脂相互作用。

图2 磷脂对大豆蛋白表面疏水性的影响Fig.2 The surface hydrophobicity of native proteins and denatured proteins in the absence or presence of lecithin
2.3 乳化活性及稳定性分析
乳化活性(EAI)和乳化稳定性(ESI)是评价蛋白质乳化体系乳化特性的主要指标。乳化活性是指蛋白质形成乳浊液的能力,乳化稳定性是指蛋白质保持乳液稳定,在一定时间内没有出现乳液分层、絮凝的能力[24-25]。图3显示,未变性大豆乳清蛋白(NWSP)乳化活性约为18.76 m2/g,低于热变性大豆乳清蛋白(DWSP)的乳化活性20.26 m2/g,这与PALAZOLO等[7]研究结果相同。磷脂(Lec)分子中含有的亲水亲油基团,是一种天然的乳化活性物质。DWSP-Lec乳液乳化活性值为35.67 m2/g,乳化稳定性为213.45 min。NWSP-Lec乳液乳化活性值为29.85 m2/g,乳化稳定性为198.78 min。DWSP乳液的乳化稳定性明显优于NWSP乳液,热变性处理可以改变蛋白原有空间结构,从而增加其界面活性,加快其吸附到界面的速度,明显改善大豆乳清蛋白的界面特性和乳液稳定性[26]。与NWSP乳液、DWSP乳液比较,NWSP-Lec乳液、DWSP-Lec乳液的乳化活性与乳化稳定性都有明显提升。这可能是由于乳化体系中添加磷脂后,蛋白、磷脂分子间存在疏水作用和氢键等作用力,大豆乳清蛋白-磷脂交互协同作用降低乳液的界面张力,提高了乳液体系的稳定性[27-28]。DWSP-Lec乳液的稳定性高于NWSP-Lec乳液,这可能是由于热处理后大豆乳清蛋白原始空间结构变化,包埋于蛋白内部的疏水基团及巯基暴露从而增强大豆乳清蛋白与Lec间的疏水交互作用,大豆乳清蛋白-磷脂的协同作用使其乳化活性增强,乳液更趋于稳定。
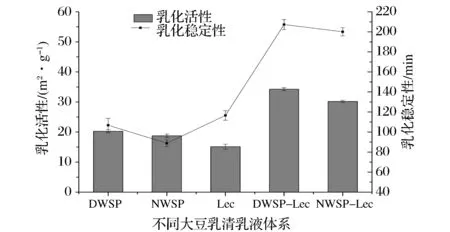
图3 大豆乳清蛋白乳液乳化活性及稳定性Fig.3 Emulsifying activity and stability of the soybean whey protein emulsions
2.4 乳液ζ-电位分析
ζ-电位为内相与流体稳定层之间的电位差,用来衡量胶体颗粒之间的电荷排斥作用,是表征乳液稳定性的一个重要指标[29]。图4显示了不同WSP水包油乳液的ζ-电位值变化情况,pH>pI时,蛋白质呈电负性。WSP乳液体系中ζ-电位值为-21.24 mV,NWSP乳液体系中ζ-电位值为-16.52 mV,Lec乳液体系中ζ-电位值为-24.48 mV。乳滴的ζ-电位(正或负)绝对值越高颗粒间排斥力越大,体系越趋向于稳定,反之,ζ-电位绝对值越低,体系中颗粒由于排斥力较小越倾向于凝结或聚集[30]。磷脂加入可以显著增加乳液的负电性,NWSP-Lec乳液体系、DWSP-Lec乳液体系ζ-电位值明显较低,NWSP-Lec乳液体系ζ-电位值为-31.57 mV,DWSP-Lec乳液体系ζ-电位值为-38.32 mV。磷脂对大豆乳清蛋白的修饰作用直接影响了蛋白表面的电荷分布,电荷的改变导致溶液中蛋白特性的改变,乳液中蛋白表面电负性增强,乳滴间斥力增加[8]。ζ-电位值增大可有效降低游离巯基之间的反应几率,提高乳状液的稳定性[31]。ζ-电位值的测量结果ESI的结果相一致,DWSP-Lec乳液体系的ζ-电位值最大,乳液的稳定性最好。

图4 大豆乳清蛋白水包油乳液ζ-电位图Fig.4 The ζ-potential of whey protein soybean oil in water emulsion
2.5 乳液粒径分布分析

图5 大豆乳清蛋白水包油乳液体积平均粒径分布Fig.5 The volume average particle size distribution of soybean whey protein oil-in-water emulsions
利用动态光散射技术研究不同大豆乳清蛋白水包油型(O/W)乳液液滴粒度分布情况,并用体积平均粒径D(4,3)作为衡量乳液液滴聚集程度指标。从图5可以看出,不同大豆乳清蛋白乳液粒径分布曲线呈双峰分布现象,这与李杨等[32]的研究结果一致。小峰粒径分布范围为0.3~2.2 μm,大峰粒径分布范围为6.4~73 μm。双峰的出现表明乳状液的粒径大小分布不均匀,这可能是由于均质不均匀引起的,也可能是由于均质后部分小乳滴聚集、融合产生体积较大的乳滴造成的。与DWSP、NWSP、Lec等乳液相比,DWSP-Lec乳液、NWSP-Lec乳液粒径曲线中小峰面积较大,峰值跨度变窄,峰值位置有向左平移的趋势,乳液的体积平均粒径D(4,3)也相对较小,DWSP-Lec乳液的D(4,3)值为13.212 μm,NWSP-Lec乳液的D(4,3)值为16.403 μm。与DWSP-Lec乳液、NWSP-Lec乳液相比,DWSP、NWSP、Lec等乳液的粒径分布存在向大粒径方向迁移的现象。D(4,3)值较大,DWSP乳液的D(4,3)值为31.043 μm,NWSP乳液的D(4,3)值为35.151 μm,Lec乳液的D(4,3)值为22.176 μm。这可能是DWSP、NWSP、Lec等纯物质的乳化活性不足,不能长期维持乳滴界面稳定结构,乳滴发生了絮凝、聚集而导致粒径增大。从各种大豆乳清蛋白水包油乳液的粒径分布及乳状液的负ζ-电位可以看出,乳滴的粒径越小,ζ-电位值越大,乳滴间的静电排斥作用越强,乳液的越不容易发生絮凝、聚集等现象,从而提高乳液的稳定性。
2.5 乳液激光共聚焦微观分析
采用CSLM观察乳状液的微观结构,结合乳滴粒径分布曲线分析可以比较准确的反映乳状液的微观结构和分布状态[33]。观测结果如图6所示,脂质被尼罗红染成红色,蛋白被尼罗蓝染成绿色。不同大豆乳清蛋白乳液、磷脂乳液的乳滴大小不一,这与乳滴粒径曲线双峰分布结果一致。DWSP乳液、NWSP乳液中乳滴间聚集现象严重,并出现体积较大的液滴。这可能是小乳滴界面不足以被蛋白完全覆盖,因而小液滴之间发生聚集生长现象[34]。NWSP乳滴体积最大,乳液的稳定性最差。Lec形成的乳状液含有许多大液滴和小液滴的絮凝体,且粒径分布非常广。蛋白乳液中添加Lec后,DWSP-Lec乳液、NWSP-Lec乳液中乳滴体积均较小,乳滴呈相对均匀状态分布,没有出现明显的絮凝、聚集现象,乳液稳定性增强。这可能是由于磷脂、大豆乳清蛋白间协同作用提高了大豆乳清蛋白-磷脂的乳化活性,能够完全覆盖均质过程中形成的小液滴的界面,形成了稳定的乳状液。图6中NWSP-Lec-1是NWSP-Lec乳液的局部放大图,图DWSP-Lec-1是DWSP-Lec乳液的局部放大图,从而可以较直观的观测乳液微观结构,乳液中脂滴被蛋白紧紧包裹。图6中的DWSP-Lec-1图显示,乳滴间距离增大,更多的蛋白被吸附到界面,界面膜厚度明显增加,乳液更趋于稳定。这可能是DWSP与磷脂间存在更强疏水交互作用,也可能是DWSP-Lec乳滴的水合作较强使乳液更趋于稳定。
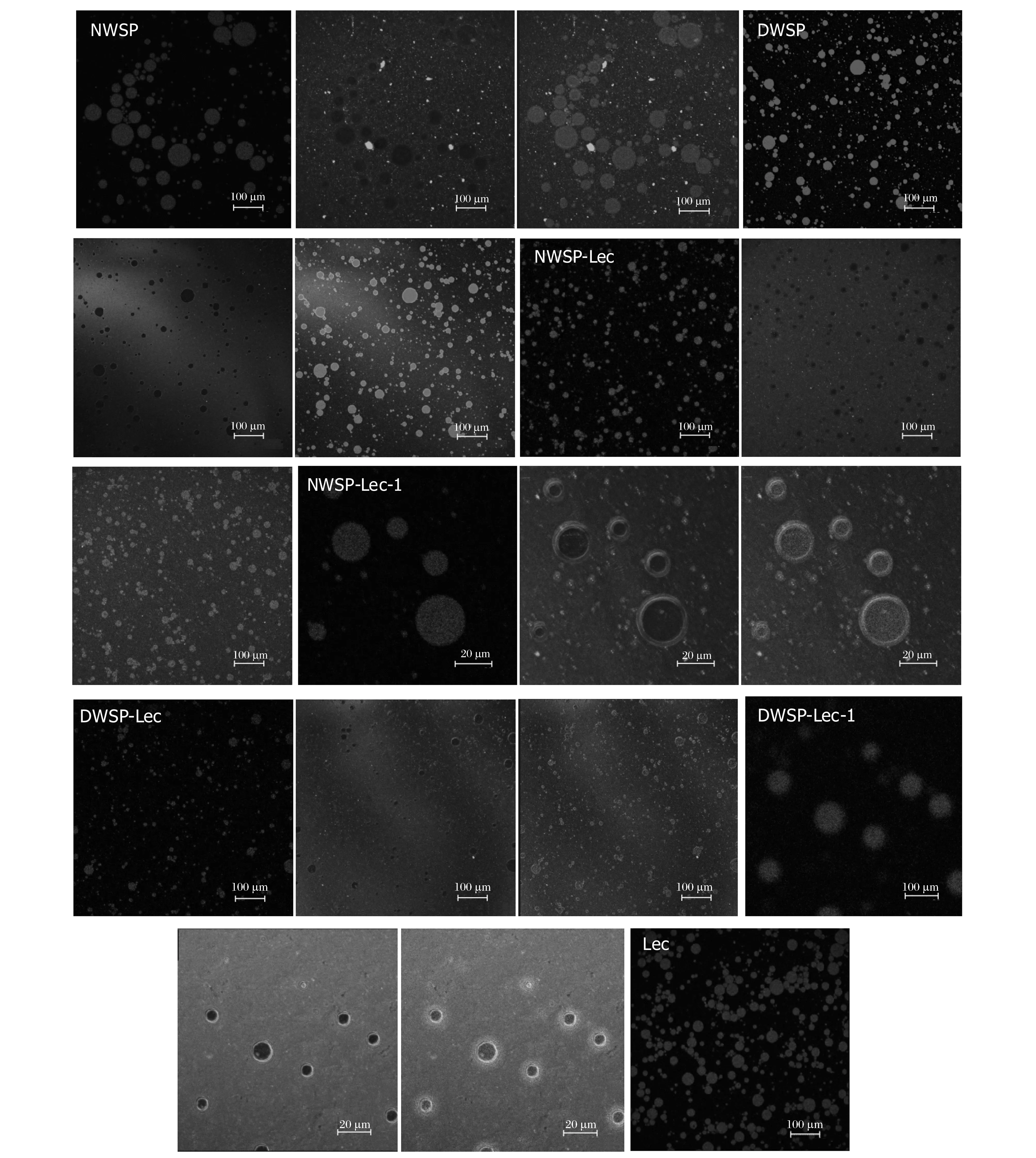
图6 大豆乳清蛋白水包油乳液的CSLM图Fig.6 CSLM pictures of soybean whey protein oil-in-water emulsions
3 结论
通过对大豆乳清蛋白水包油(O/W)型乳化体系,研究发现,与NWSP乳液比较,热变性处理的DWSP乳液乳化活性及稳定性增强。这可能是由于热处理后蛋白结构变性包埋于内部的疏水基团暴露,表面疏水性增加从而增强了其表面活性。加入磷脂后,乳液的稳定性增加。这是由于磷脂加入显著降低乳液的粒径,增加乳液ζ-电位值,乳滴间静电斥力增加,也可能是由于大豆乳清蛋白、磷脂间的疏水交互作用,使其乳化活性增加,改变了蛋白的界面活性,从而提高了乳液的稳定性。热变性处理DWSP-Lec乳液稳定性强于NWSP-Lec乳液这可能是由于热处理后包埋于蛋白内部的疏水基团暴露出来,与磷脂间的疏水作用增强。从而增强了其界面活性。
[1] 黄凯, 郑田要, 李聚海,等. 大豆中植酸和胰蛋白酶抑制剂的抗营养和抗癌效应[J]. 中国油脂, 2008, 33(12):28-31.
[2] 于颖慧, 吴坤. 大豆Bowman-Birk型胰蛋白酶抑制剂(BBI)研究进展[J]. 中华疾病控制杂志, 2005, 9(2):150-153.
[3] CLAIR W H S, BILLINGS P C, CAREW J A, et al. Suppression of DMH-induced carcinogenesis in mice by dietry addition of the Bowman-Birk protease inhibitor[J]. Cancer Research, 1990, 50(3):580-586.
[4] LASSISSI T A, HETTIARACHCHY N S, RAYAPROLU S J, et al. Functional properties and Angiotensin-I converting enzyme inhibitory activity of soy-whey proteins and fractions[J]. Food Research International, 2014, 64:598-602.
[5] 江连洲, 陈爱梅, 欧阳占亮. 大豆乳清蛋白功能特性的研究[J]. 中国油脂, 2006, 31(2):28-30.
[6] 杨晓泉. 郑志雄,大豆乳清蛋白的热变性和热聚集的研究[J]. 食品工业科技, 2009(5):100-102.
[7] PALAZOLO G G, SORGENTINI D A, WAGNER J R. Coalescence and flocculation in o/w emulsions of native and denatured whey soy proteins in comparison with soy protein isolates[J]. Food Hydrocolloids, 2005, 19(3):595-604.
[8] 李菊芳. 磷脂—大豆蛋白复合物形成机理及其理化、功能特性研究[D]. 北京:中国农业大学, 2014.
[9] BARBANA C, PÉREZ M D. Interaction of α-lactalbumin with lipids and possible implications for its emulsifying properties-A review[J]. International Dairy Journal, 2011, 21(10):727-741.
[10] COMAS D I, WAGNER J R, TOMS M C. Creaming stability of oil in water (O/W) emulsions: Influence of pH on soybean protein-lecithin interaction[J]. Food Hydrocolloids, 2006, 20(7):990-996.
[11] PALAZOLO G G, SORGENTINI D A, WAGNER J R. Emulsifying properties and surface behavior of native and denatured whey soy proteins in comparison with other proteins. Creaming stability of oil-in-water emulsions[J]. Journal of the American Oil Chemists Society, 2004, 81(7):625-632.
[12] KASRAN M, CUI S W, GOFF H D. Emulsifying properties of soy whey protein isolate-fenugreek gum conjugates in oil-in-water emulsion model system[J]. Food Hydrocolloids, 2013, 30(2):691-697.
[13] 王欢, 冯红霞, 张雅娜,等. 大豆分离蛋白-磷脂复合乳化体系的制备及pH对其影响的研究[J]. 食品工业科技, 2013, 34(24):159-162.
[14] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins.[J]. Biochimica Et Biophysica Acta, 1980, 624(1):13-20.
[15] MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins ☆[J]. Food Hydrocolloids, 2001, 15(3):263-269.
[16] 徐明进, 李明远, 彭勃,等. Zeta电位和界面膜强度对水包油乳状液稳定性影响[J]. 应用化学, 2007, 24(6):623-627.
[17] CUI Z, KONG X, CHEN Y, et al. Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J]. Food Hydrocolloids, 2014, 41(20):1-9.
[18] SHAO Y, TANG C H. Characteristics and oxidative stability of soy protein-stabilized oil-in-water emulsions: Influence of ionic strength and heat pretreatment[J]. Food Hydrocolloids, 2014, 37(2):149-158.
[19] SORGENTINI D A, WAGNER J R. Comparative study of structural characteristics and thermal behavior of whey and isolate soybean proteins[J]. Journal of Food Biochemistry, 1999, 23(5):489-507.
[20] SHEARD P R, FELLOWS A, LEDWARD D A, et al. Macromolecular changes associated with the heat treatment of soya isolate[J]. International Journal of Food Science & Technology, 1986, 21(1):55-60.
[21] PALAZOLO G G, MITIDIERI F E, WAGNERV J R. Relationship between interfacial behaviour of native and denatured soybean isolates and microstructure and coalescence of oil in water emulsions-effect of salt and protein concentration[J]. Food Science & Technology International, 2003, 9(6):409-419.
[22] CHUNG O K. Lipids-protein interactions in wheat flour, dough, gluten, and protein fractions[J]. Cereal Foods World, 1986, 31(3): 242-256.
[23] QIANG H, YI Z, GANG L, et al. Dynamic adsorption and characterization of phospholipid and mixed phospholipid/protein layers at liquid/liquid interfaces.[J]. Advances in Colloid & Interface Science, 2008, 140(2):67-76.
[24] DIFTIS N G, BILIADERIS C G, KIOSSEOGLOU V D. Rheological properties of model salad dressing emulsions prepared with a dry-heated soy-bean protein isolate-dextran mixture[J]. Food Hydrocolloids, 2005, 19(6):1 025-1 031.
[25] DIFTIS N, KIOSSEOGLOU V. Stability against heat-induced aggregation of emulsions prepared with a dry-heated soy protein isolate-dextran mixture[J]. Food Hydrocolloids, 2006, 20(6):787-792.
[26] CROGUENNEC T, RENAULT A, BEAUFILS S, et al. Interfacial properties of heat-treated ovalbumin.[J]. Journal of Colloid & Interface Science, 2007, 315(2):627-636.
[27] 李杨,王妍,张雅娜,王辰,王欢,江连洲,刘海英,冯丹,王中江.大豆磷脂对大豆蛋白乳化体系的影响[J].食品工业科技,2013,34(19):74-76.
[28] BOUZID H, RABILLER-BAUDRY M, PAUGAM L, et al. Impact of zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafiltration of modified skim milks[J]. Journal of Membrane Science, 2008, 314(1/2):67-75.
[29] 章莉娟.胶体与界面化学[M].广州:华南理工大学出版社,2006:97-100.
[30] 贾娜,刘宁.大豆磷脂对牛乳蛋白乳状液热稳定性的影响[J].中国乳品工业,2010,38(4):42-45.
[31] DYBOWSKA B E. Properties of milk protein concentrate stabilized oil-in-water emulsions[J]. Journal of Food Engineering, 2008, 88(4):507-513.
[32] 李杨, 王妍, 张雅娜,等. 水相组分差异对大豆蛋白-磷脂复合乳化体系的影响[J]. 食品工业科技, 2013, 34(4):74-76.
[33] DICKINSON E. Introduction to Food Colloids[M]. Oxford: Oxford University Press, 1992:410-412.
[34] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J]. Food Chemistry, 2003, 81(1):1-6.
Effect of phospholipids on the emulsifying properties of soy whey protein
HAN Tian-xiang, LI Yang, BI Shuang, SUI Xiao-nan, WU Yan-hua,WANG Zhong-jiang, JIANG Lian-zhou, WANG Xi-bo*
(Northeast Agricultural University College of Food Science and technology, Harbin 150030, China)
The author studied the nature soybean whey protein (NWSP) and denatured soy whey protein (DWSP) and analyzed the effect of lecithin (Lec) on the emulsion system of soybean whey protein. Furthermore, the emulsifying activity, emulsion stability, surface hydrophobicity of soybean whey protein, ζ-potential, particle size distribution, and laser scanning confocal microscopy of soybean whey protein emulsions were studied before and after lecithin added. The results indicated that comparing with soybean whey protein emulsification system, the emulsifying activity of DWSP-Lec and NWSP-Lec significantly increased, the emulsion particle size distribution span become more narrow, emulsion droplet average particle size decreased; however, the emulsion of ζ-potential value increased, the electrostatic repulsion between emulsion droplet increased. All these effectively prevented the phenomenon such as flocculation, aggregation, and improve the emulsion stability. DWSP-Lec emulsion is more stable than NWSP-Lec emulsion. This may be due to the structural changes of soybean whey protein after heat treatment, and the hydrophobic groups embedded in the protein are exposed and enhanced hydrophobic interaction between whey protein and phospholipid. Synergistic effect between soybean whey protein and lecithin enhanced the emulsifying activity and stabilized the emulsion.
soybean whey protein; lecithin; emulsion; emulsibility; particle size distribution
10.13995/j.cnki.11-1802/ts.201702003
硕士研究生(王喜波副教授为通讯作者,E-mail:wangxibo@yahoo.cn)。
国家自然科学基金项目(31571876);国家科技支撑计划课题(2014BAD22B01);国家“863”计划(2013AA102104);霍英东基金(151032);国家大豆产业技术体系专项(CARS-04-PS25);黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT-201511)
2016-04-26,改回日期:2016-08-15
