以豆粕粉为氮源的枯草芽孢杆菌液态发酵生产纳豆激酶
2017-03-28董艳山高丽何加亨胡彪群范青云王业富
董艳山,高丽,何加亨,胡彪群,范青云,王业富*
1(武汉大学 生命科学学院,病毒学国家重点实验室,湖北 武汉,430072) 2(武汉真福医药股份有限公司,湖北 武汉,430075)
以豆粕粉为氮源的枯草芽孢杆菌液态发酵生产纳豆激酶
董艳山1,高丽2,何加亨2,胡彪群2,范青云2,王业富1*
1(武汉大学 生命科学学院,病毒学国家重点实验室,湖北 武汉,430072) 2(武汉真福医药股份有限公司,湖北 武汉,430075)
枯草芽孢杆菌液态发酵通常采用蛋白胨作为氮源生产纳豆激酶,导致生产成本过高,发酵液中酶活性较低。采用价格低廉的豆粕粉作为氮源不仅大幅度降低了原料成本,而且显著提高了发酵液中的酶活性。在摇瓶实验中优化确定豆粕粉最佳添加量,并在此基础上优化确定了最佳接种量、发酵液初始pH、发酵时间。最终摇瓶发酵液中酶活达到5 471 IU/mL,是等量胰蛋白胨作为氮源发酵的3.6倍。上述摇瓶发酵参数进一步在7 L发酵罐和200 L中试水平发酵罐进行验证,并优化确定发酵过程中控制溶氧水平为30%,纳豆激酶活性分别达到6 717 IU/mL和4 236 IU/mL。
豆粕粉;枯草芽孢杆菌;纳豆激酶;发酵
根据《中国居民营养与慢性病状况报告(2015)》报告数据显示,我国心脑血管疾病的死亡率为271.8/10万,已成为国民最主要死因[1]。诱发心脑血管疾病的根本原因是血栓的形成,而目前市场上溶栓药物基本都是急救药物,存在药效时间短,出血性副作用等缺陷[2-3]。纳豆激酶是由日本科学家1987年首次在古老的发酵食物纳豆中发现,该酶表现出非常强的纤维蛋白/原水解活性[4]。在动物实验中,纳豆激酶无论是注射还是口服给药都具有溶解纤维蛋白/原,再通血管的功效[5-15]。并且,该酶制剂在人体试验中,通过口服用药也得到了非常好的功效验证[16-19],具有非常好的安全性,基本不会引起毒副作用[20-23]。
因此,纳豆激酶被认为是最具发展前景和市场应用价值的新一代预防和治疗心脑血管疾病的理想天然溶栓药物。但是,固体发酵产物纳豆中纳豆激酶含量非常低,且固体发酵工艺成本高且费时耗力。近年来依靠枯草芽孢杆菌液体发酵生产纳豆激酶已经成为趋势[24-28]。然而,枯草芽孢杆菌液体发酵存在的主要问题是发酵培养基中使用蛋白胨作为氮源,造成成本过高,同时纳豆激酶含量还有待进一步提高。
综上,本研究采用廉价的豆粕粉作为氮源,优化了豆粕粉使用浓度。并在此基础上进行了摇瓶发酵参数的优化,小试与中试规模的发酵罐发酵工艺优化与验证。最终发酵液中纳豆激酶活性得到了大幅度的提升,是现有发酵工艺的3倍以上。从而为枯草芽孢杆菌发酵生产纳豆激酶进行食品和药物开发大幅度缩减了生产成本,并提供了可靠的发酵工艺。
1 材料与方法
1.1 材料
1.1.1 原料
大豆豆粕粉,为黄豆榨油之后的废料豆粕经过粉碎制备得到,来源于山东万得福实业集团有限公司。
1.1.2 菌种
本课题组自主筛选的1株产纳豆激酶枯草芽孢杆菌,由本实验室自行保存。
1.1.3 主要试剂
胰蛋白胨、酵母提取物,英国Oxoid公司;葡萄糖、NaH2PO4、Na2HPO4,国药集团化学试剂有限公司。
1.2 实验设备
7 L发酵罐,上海保兴生物设备有限公司;200 L发酵罐,江苏科海生物设备有限公司;溶氧,pH电极,梅特勒-托利多仪器有限公司;5424 R离心机,Eppendorf 公司;电子天平 JY,上海浦春计量仪器有限公司;DH5000电热恒温培养箱,天津市泰斯特仪器有限公司;SA-300VA高压灭菌锅;SHZ-82气浴恒温培养箱,金坛市白塔新宝仪器厂。
1.3 分析方法
1.3.1 枯草芽孢杆菌种子液制备
保藏菌种在YPD固体培养基表面划线,挑取单菌落接种于YPD液体培养基(250 mL三角瓶含有50 mL培养基)进行培养。
1.3.2 枯草芽孢杆菌摇瓶发酵
所用三角瓶为250 mL量程,发酵装液量为50 mL。
(1)豆粕粉浓度优化实验:所用发酵培养基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,初始pH为7.0。此外,设置豆粕粉质量体积百分比(m/v)分别为2%、3%、4%、5%。接种量为5%。
(2)接种量优化实验:所用发酵培养基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,初始pH为7.0。豆粕粉含量为豆粕粉浓度实验优化的结果。接种量为5%。
(3)初始pH优化实验:所用发酵培养基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,通过NaOH溶液和盐酸调节发酵液初始pH分别为5、6、7、8、9。豆粕粉含量为豆粕粉浓度实验优化的结果。接种量为接种量实验优化结果。
(4)豆粕粉与胰蛋白胨发酵实验对比:所用发酵培养基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L。接种量为接种量优化实验结果。初始pH为pH实验优化结果。豆粕粉含量为豆粕粉含量实验优化的结果,等量胰蛋白胨代替豆粕粉研究两种氮源对发酵的影响。
1.3.3 枯草芽孢杆菌小试与中试发酵罐发酵
发酵培养基与摇瓶相同,接种量、豆粕粉含量、初始pH为摇瓶实验优化参数。通过溶氧与搅拌相关联控制溶氧水平。
1.3.4 纳豆激酶活性测定方法
2.成人及青少年初始抗反转录病毒治疗方案:初治患者推荐方案为2种NRTIs类骨干药物联合第三类药物治疗 。第三类药物可以为NNRTIs或者增强型PIs(含利托那韦或考比司他)或者INSTIs;有条件的患者可以选用复方单片制剂 (STR)。 基于我国可获得的抗病毒药物,对于未接受过HAART的患者推荐及替代方案见表4。
称量0.15 g的琼脂、0.175 5 g NaCl,加到50 mL小锥形瓶中;量取20 mL的20 mmol/L的pH为8.0的Tris-Hcl缓冲液,溶解琼脂;锥形瓶加塞置于微波炉中加热溶解;待锥形瓶冷却至50 ℃时向瓶中加入1 mL 50 mg/mL的纤维蛋白原溶液及100 μL 100 U/mL的凝血酶,混合均匀后迅速倾入灭菌平皿中;室温放置30 min,以形成纤维蛋白凝块。用打孔器在纤维蛋白平板上打7个孔,并做好标识;取10 μL浓度为320、160、80、40、20 IU/mL的标准尿激酶溶液到对应的孔中,放置10 min后转至37 ℃恒温培养箱中反应,18 h后取出测定各溶解圈的垂直两直径;上述操作设定3个平行组,测量后取其平均值;再用垂直直径的乘积的常用对数为横坐标,标准尿激酶浓度的常用对数为纵坐标,制作尿激酶酶活标准曲线。取待测样品10 μL按上述操作上样于同一平皿,37 ℃恒温培养箱中反应,18 h后测量溶解圈的垂直两直径,根据标准曲线方法及稀释浓度求出样品的酶活力大小。
2 实验结果与分析
2.1 以豆粕粉为氮源的枯草芽孢杆菌摇瓶发酵参数优化
2.1.1 基于枯草芽孢杆菌生长曲线的最佳种子液生长状态的确定
将低温保藏的枯草芽孢杆菌菌株平板划线培养,挑取1个单菌落接入摇瓶中进行菌种活化培养。如图1所示,培养前12 h为延滞期,在第14 h进入对数生长期,第20 h达到菌液浓度的顶峰,第22 h开始进入衰亡期。从种子液的生长曲线可以看出,在14~20 h之间为对数生长期,并且第18 h处于对数生长期的中期,此时菌种生长最活跃旺盛,OD600为0.63,因此,在后期发酵培养种子液活化过程中应当选择活化18 h左右,菌液浓度OD600为0.6左右的菌液作为种子液用于发酵培养。

图1 枯草芽孢杆菌在摇瓶中生长曲线Fig.1 Growth curve of Bacillus subtilis in shake flask
2.1.2 枯草芽孢杆菌发酵最佳豆粕粉添加量的确定
根据枯草芽孢杆菌生长曲线研究结果,取单菌落活化18 h的种子液用于后续的发酵试验研究。设置豆粕粉质量体积百分比分别为2%、3%、4%、5%的4个浓度用于枯草芽孢杆菌发酵,结果如图2所示。在4个豆粕粉浓度条件下,在前36 h内,发酵液中纳豆激酶活性处于直线上升状态,除在2%豆粕粉条件下发酵液中纳豆激酶活性在第36 h达到活性最高值的3 725 IU/mL之外,在3%、4%、5%豆粕粉浓度条件下,发酵液中纳豆激酶活性在第42 h达到峰值,活性大小分别为5 480、5 019、4 015 IU/mL,其中3%豆粕粉发酵条件下,发酵液活性最高。

图2 豆粕粉对发酵液纳豆激酶酶活的影响Fig.2 The effects of soybean cake powder on nattokinase activities in media
2.1.3 枯草芽孢杆菌发酵豆粕粉最佳接种量和最适pH的确定
设置接种量分别为1%、2.5%、5%、7.5%、10%,发酵时间为42 h,对酶活影响结果如图3所示。在接种量为5%的发酵条件下,酶活为5 513 IU/mL,分别是在接种量为1%、2.5%、7.5%、10%发酵条件下的1.44、1.21、1.14、1.31倍,因此 5%为最佳接种量。

图3 接种量对发酵液纳豆激酶酶活的影响Fig.3 The effects of inoculum size on nattokinase activities in media

图4 发酵液初始pH对发酵液纳豆激酶酶活的影响Fig.4 The effects of initial pH on nattokinase activities in media
2.2 豆粕粉枯草芽孢杆菌发酵显著优于胰蛋白胨发酵
在传统的枯草芽孢杆菌液体发酵过程中,一般使用蛋白胨作为重要的氮源物质,但是蛋白胨的高成本是必须面临的问题。本试验将豆粕粉发酵与传统的蛋白胨发酵进行比较,结果如图5所示。在同样都是3%浓度条件下,在第42 h发酵时间,胰蛋白胨发酵液中酶活为1 522 IU/mL,而豆粕粉发酵液中酶活高达5 471 IU/mL,是胰蛋白胨作为氮源发酵的3.6倍。此结果表明以价格低廉的豆粕粉作为枯草芽孢杆菌发酵氮源进行纳豆激酶生产综合效果要远高于胰蛋白胨作为原料发酵。

图5 豆粕粉与胰蛋白胨对发酵液纳豆激酶酶活的影响Fig.5 The effects of soybean cake powder and tryptone on nattokinase activities in media
2.3 枯草芽孢杆菌小试发酵工艺优化和验证
7 L发酵罐工作体积为4 L,根据摇瓶发酵参数的优化结果,设置培养基中豆粕粉含量为3%,初始pH 7.0,接种量为5%。设置溶氧与搅拌联动,溶氧设定为50%。发酵液酶活曲线如图6所示。同样在第42 h发酵液中酶活达到最高峰值为6 519 IU/mL。
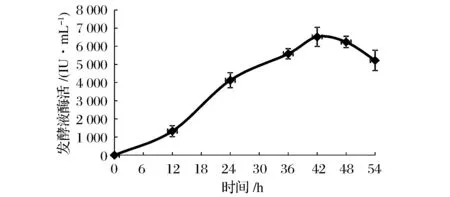
图6 枯草芽孢杆菌在20 L发酵罐中的生长曲线Fig.6 Growth curve of Bacillus subtilis in 20 L fermentation tank
对于枯草芽孢杆菌发酵罐的发酵培养,溶氧是非常关键的工艺参数,本试验进一步通过溶氧与搅拌转速相关联,研究了不同溶氧水平对发酵酶活的影响。根据上述实验结果,发酵第42 h在10%、30%、50%、70%溶氧水平下,发酵液中酶活分别为4 075、6 717、6 033、4 822 IU/mL。因此,枯草芽孢杆菌发酵罐发酵的最佳溶氧水平应控制在30%左右。

图7 溶氧水平对发酵液纳豆激酶酶活的影响Fig.7 The effects of dissolved oxygen level on nattokinase activities in media
2.4 枯草芽孢杆菌中试发酵工艺验证
为了进一步验证前期摇瓶发酵参数与小试发酵罐发酵工艺,本试验采用中试规模的200 L发酵罐对上述参数和工艺进行验证。200 L发酵罐工作体积为120 L,根据摇瓶发酵参数和工艺的优化结果,设置培养基中豆粕粉含量为3%,初始pH 7.0,接种量为5%,溶氧为30%。与摇瓶与小试发酵罐相比,中试发酵规模过程中,发酵液酶活达到最高值时间为第48 h,大小为4 236 IU/mL。这一结果虽然与小试发酵水平相比,活性有所降低,但是仍然是有文献报道实验结果中最高的纳豆激酶生物学活性。

图8 枯草芽孢杆菌在200 L发酵罐中的生长曲线Fig.8 Growth curve of Bacillus subtilis in 200 L fermentation tank
3 讨论
蛋白胨是目前枯草芽孢杆菌发酵生产纳豆激酶的常用氮源[29],蛋白胨价格高昂,势必造成生产成本过高。即使采用蛋白胨作为氮源用于液体发酵,发酵液中纳豆激酶活性也非常有限[24-26,29-30]。张琳等采用胰蛋白胨作为氮源,摇瓶水平纳豆激酶活性为1 004 IU/mL[24];任武贤等采用胰蛋白胨作为氮源,摇瓶水平纳豆激酶活性为2 051 IU/mL[25];熊晓辉等采用胰蛋白胨作为氮源,5 L发酵罐水平纳豆激酶活性为2 250 IU/mL[26];张锋等采用大豆蛋白胨,摇瓶水平纳豆激酶活性为1 000 IU/mL[30]。因此,目前以价格高昂的蛋白胨作为氮源的枯草芽孢杆菌液体发酵的纳豆激酶活性普遍在1 000~2 000 IU/mL左右,仍待进一步提高。
本研究采用价格低廉的豆粕粉作为枯草芽孢杆菌液体发酵的氮源生产纳豆激酶,优化确定了豆粕粉的添加量,并且优化了系列发酵参数,在摇瓶发酵水平,纳豆激酶活性可达到5 471 IU/mL,与等量胰蛋白胨作为氮源发酵相比,酶活有了3.6倍的显著提升。与蛋白胨相比,为什么豆粕粉作为氮源更有利于枯草芽孢杆菌表达分泌纳豆激酶,其机理还不清楚。可能是由于豆粕粉与蛋白胨相比含有高含量的大豆纤维蛋白,因为纳豆激酶可特异性水解纤维蛋白,只有纤维蛋白被水解成小分子短肽才能进一步被枯草杆菌吸收利用,用于自身的生长代谢。可能是大豆纤维蛋白对纳豆激酶的产生具有诱导作用,这一作用需要在后续的试验中进行研究验证。
任武贤等采用1%蛋白胨作为氮源,最佳接种量为3%,最适pH 7.0~7.2[25];熊晓辉等2%胰蛋白胨作为氮源,最佳接种量为5%,最适pH 7.0[26]。张立等采用2%胰蛋白胨作为氮源,最佳接种量为5%,最适pH 7.22[31]。本研究中,以3%豆粕粉作为氮源,最佳接种量为5%,最适pH 7.0。结果表明,蛋白胨或豆粕粉作为氮源,最佳发酵pH值均为pH 7.0左右,没有差异。以蛋白胨作为氮源,当蛋白胨添加量为1%时,最佳接种量为3%(比值为1∶3),当添加量升高到2%时,最佳接种量为5%(比值为2∶5)。本研究3%豆粕粉作为氮源,最佳接种量为5%(比值为3∶5),因此,豆粕粉与蛋白胨作为氮源相比,接种量要高。在后续的工业化发酵生产的实践中,如果以豆粕粉为氮源,应当适当增加接种量。
在摇瓶水平确定了最佳豆粕粉添加量和系列工艺参数的基础之上,又进一步在小试与中试发酵规模进行了验证和放大,7 L发酵罐水平纳豆激酶活性高达6 717 IU/mL,200 L中试发酵罐水平纳豆激酶活性可达4 236 IU/mL。因此,本研究以价格低廉的豆粕粉为发酵原料不仅降低了生产成本,而且大幅度升高了发酵液中的纳豆激酶活性,并且在豆粕粉作为氮源的基础之上优化了系列的发酵参数与工艺,实现了从摇瓶水平到中试水平的工艺验证与放大。为枯草芽孢杆菌产业化生产纳豆激酶用于食品和药物开发提供了廉价的原料选择和可靠的发酵工艺。
[1] 中国居民营养与慢性病状况报告(2015)[M]. 北京:中国卫生与计划生育委员会, 2015.
[2] 李章立. 心脑血管疾病的防治与养生[C].中华中医药学会血栓病分会第七次学术研讨会.中华中医药学会血栓病分会第七次研讨会暨河北省中医药学会健康营养药膳专业委员会学术会议论义集,河北邯郸,中华中医药学会,2013:487.
[3] UEDA M, KUBO T, MIYATAKE K, et al. Purification and characterization of fibrinolytic alkaline protease fromFusariumsp. BLB[J]. Applied Microbiology & Biotechnology, 2007, 74(2):331-338.
[4] SUMI H, HAMADAH, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 43(10):1 110-1 111.
[5] KOU W, ZHANG Y N, XIN R, et al. Application of nattokinase in health drinks and its prospects[J]. Beverage Industry, 2006, 9(8):9-11.
[6] FUJITA M, NOMURA K, HONG K, et al. Purification and characterization of a strong fibrinolytic enzyme (Nattokinase) in the vegetable cheese Natto, a popular soybean fermented food in Japan[J]. Biochemical & Biophysical Research Communications, 1993, 197(3):1 340-1 347.
[7] URANO T, IHARA H, UMEMURA K, et al. The profibrinolytic enzyme subtilisin NAT purified fromBacillussubtilisCleaves and inactivates plasminogen activator inhibitor type 1.[J]. Journal of Biological Chemistry, 2001, 276(27):24 690-24 696.
[8] FUJTIA M, OHNISHI K, TAKAOKA S, et al. Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats.[J]. Biological & Pharmaceutical Bulletin, 2011, 34(11):1 696-1 701.
[9] JANG J Y, KIM T S, CAI J M, et al. Nattokinase improves blood flow by inhibiting platelet aggregation and thrombus formation[J]. Laboratory Animal Research, 2013, 29(4):221-225.
[10] FUJITA M, HONG K, ITO Y, et al. Thrombolytic effect of nattokinase on a chemically induced thrombosis model in rat.[J]. Biological & Pharmaceutical Bulletin, 1995, 18(10):1 387-1 391.
[11] XU J, DU M, YANG X, et al. Thrombolytic effects in vivo of Nattokinase in a carrageenan-induced rat model of thrombosis[J]. Acta Haematologica, 2014, 132(2):247-253.
[12] YAN F, YAN J, SUN W, et al. Thrombolytic effect of Subtilisin QK on carrageenan induced thrombosis model in mice[J]. Journal of Thrombosis & Thrombolysis, 2009, 28(4):444-448.
[13] LEE D L, HONG S Y, JANG Y S, et al. The evaluation of antithrombotic and fibrinolytic activities of nattokinase fromBacillussubtilisnatto[J]. Physics of Plasmas, 2012, 27(6):375-380.
[14] 张利, 成子强, 李培锋, 等. 纳豆激酶溶血栓作用的研究[J]. 山东农业大学学报(自然科学版), 2005,36(4):625-631.
[15] TAI M W, SWEET B V. Nattokinase for prevention of thrombosis[J]. American Journal of Health-System Pharmacy, 2006, 63(12):1 121-1 123.
[16] HSIA C H, ShEN M C, LIN J S, et al. Nattokinase decreases plasma levels of fibrinogen, factor VII, and factor VIII in human subjects[J]. Nutrition Research, 2009, 29(3):190-196.
[17] SUMI H, HAMADA H, Nakanishi K, et al. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J]. Acta Haematologica, 1990, 84(84):139-143.
[18] YUKO K, SHINSUKE N, TOSHIYUKI H, et al. A single-dose of oral nattokinase potentiates thrombolysis and anti-coagulation profiles[J/OL]. Scientific Reports, 2015, 5[2016-09-09]. http://www.nature.com/articles/srep11601 DOI: 10.1038/srep11601.
[19] ERO M P, NG C M, MIHAILOVSKI T, et al. A pilot study on the serum pharmacokinetics of nattokinase in humans following a single, oral, daily dose[J]. Alternative Therapies in Health & Medicine, 2013, 19(3):16-19.
[20] LAMPE B J, ENGLISHI J C. Toxicological assessment of nattokinase derived fromBacillussubtilis, var. natto[J]. Food & Chemical Toxicology, 2015, 88:87-99.
[21] 胡景柱, 夏寿华, 吴林. 纳豆冻干粉的安全性研究[J]. 安徽农业科学, 2000, 28(3):380-381.
[22] 黄晓曼, 杨鹊, 邱志健,等. 纳豆激酶的安全性试验[J]. 中国食品添加剂, 2008(2):109-112.
[23] 付玉生, 李永利, 张焱,等. 纳豆激酶胶囊毒理学安全性评价[J]. 实用预防医学, 2012, 19(11):1 714-1 716.
[24] 张琳, 王凯, 庞丰平,等. 纳豆激酶的液体发酵条件优化[J]. 基因组学与应用生物学, 2016(2):373-377.
[25] 任武贤, 王星星, 戴东升. 纳豆激酶液态发酵工艺的优化[J]. 大豆科学, 2015, 34(1):128-130.
[26] 熊晓辉, 梁剑光, 熊强. 纳豆激酶液体发酵条件的优化[J]. 食品与发酵工业, 2004, 30(1):62-66.
[27] 王萍, 杜连祥, 路福平,等. 溶栓纳豆芽孢杆菌的筛选鉴定及产纳豆激酶条件的研究[J]. 食品与发酵工业, 2006, 32(2):74-77.
[28] CONG W, MING D, ZHENG D, et al. Purification and characterization of Nattokinase fromBacillussubtilisNatto B-12[J]. Journal of Agricultural & Food Chemistry, 2009, 57(20):9 722-9 729.
[29] 许强, 薛建. 纳豆激酶液体发酵培养基优化研究[J]. 北京农业, 2014(33):32-33.
[30] 张锋, 金杰, 安莹, 等. 纳豆激酶液体发酵条件的优化研究[J]. 食品与发酵科技, 2005, 41(4):22-25.
[31] 张立, 赵友云, 马强, 等. 枯草杆菌溶栓酶QK-2发酵工艺的优化及其肠溶胶囊的研制[C]. 湖北生物产业发展高端论坛暨湖北省生物工程学会2012年度学术交流会, 2012年湖北生物产业发展高端论坛暨湖北省生物工程学2012年度学术交流会论文汇编,湖北武汉,湖北省科学技术协会,2012.
Process optimization and validation ofBacillussubtilisliquid fermentation for nattokinase production using soybean cake powder as the nitrogen source
DONG Yan-shan1, Gao Li2,HE Jia-heng2, HU Biao-qun2,FAN Qing-yun2, WANG Ye-fu1*
1(Wuhan University, College of Life Science, State Key Laboratory of Virology, Wuhan 430075,China)2(Wuhan Zhenfu Pharmaceutical Co. Ltd, Wuhan 430075,China)
Tryptone was selected as the nitrogen source in traditionalBacillussubtilisliquid fermentation, which led to high production costs and low nattokinase activities. In this study, tryptone was replaced with low-cost soybean cake powder as the nitrogen source inBacillussubtilisliquid fermentation to produce nattokinase.The amountof soybean cake powder, the optimal inoculum size, media initial pH and fermentation time were confirmed after optimization at shake flask level. The nattokinase activities in shake flask level arrived at 5 471 IU/mL, which was 3.6 times of that from fermentation with same amount of tryptone as nitrogen source. The above parameters at shake flask fermentation level were further verified in 7 L and 200 L fermentation tank, and the optimal dissolved oxygen level was confirmed to be 30%. The nattokinase activities in 7 L and 200 L fermentation tank respectively reached 6 717 IU/mL and 4 236 IU/mL.
soybean cake powder;Bacillussubtilis; nattokinase; fermentation
10.13995/j.cnki.11-1802/ts.201702019
博士,助理研究员(王业富教授为通讯作者,E-mail:wangyefu@whu.edu.cn)。
中国博士后科学(2016M592375);湖北省卫计委青年人才项目(WJ2017Q002)
2016-09-09,改回日期:2016-10-14
