HPLC法同时测定注射用三重霉素中普鲁卡因、二苄基乙二胺和青霉素的含量
2017-03-03陈汝红窦永海靳英会河北省药品检验研究院石家庄050011天津市永久医院天津00450石药集团中诺药业有限公司石家庄050051
陈汝红,窦永海,靳英会(1.河北省药品检验研究院,石家庄 050011;.天津市永久医院,天津 00450;.石药集团中诺药业有限公司,石家庄 050051)
HPLC法同时测定注射用三重霉素中普鲁卡因、二苄基乙二胺和青霉素的含量
陈汝红1*,窦永海2,靳英会3(1.河北省药品检验研究院,石家庄 050011;2.天津市永久医院,天津 300450;3.石药集团中诺药业有限公司,石家庄 050051)
目的:建立同时测定注射用三重霉素中普鲁卡因、二苄基乙二胺、青霉素含量的方法。方法:采用高效液相色谱法。色谱柱为SinoChrom C18,流动相为0.21 mol/L磷酸二氢钾溶液(含0.16%的三乙胺,氢氧化钾溶液调pH至5.6)-乙腈(81∶19,V/V),流速为1.0 mL/min,检测波长为215 nm,柱温为25 ,进样量为10µL。结果:普鲁卡因、二苄基乙二胺、青霉素检测质量浓度线性范围分别为0.011~0.64 mg/mL(r=0.999 9)、0.013~0.80 mg/mL(r=0.999 9)、0.075~4.50 mg/mL(r=0.999 9);精密度、稳定性、重复性试验的RSD<0.70%;加样回收率分别为98.42%~101.51%(RSD=0.90%,n=9)、98.28%~101.50%(RSD=0.90%,n=9)、99.03%~101.11%(RSD=0.66%,n=9)。结论:该方法简便、准确,可用于注射用三重霉素中普鲁卡因、二苄基乙二胺和青霉素含量的同时测定。
注射用三重霉素;普鲁卡因;二苄基乙二胺;青霉素;含量测定;高效液相色谱法
注射用三重霉素,又名强化苄星青霉素,为苄星青霉素、普鲁卡因青霉素、青霉素钠按国际单位比6∶3∶3混合的注射用无菌粉末。苄星青霉素为青霉素的二苄基乙二胺盐,普鲁卡因青霉素为青霉素的普鲁卡因盐,二者抗菌活性成分均为青霉素,肌肉注射后青霉素缓慢释放并被吸收[1]。苄星青霉素、普鲁卡因青霉素、青霉素钠血药浓度达峰时间分别为24 h、1~4 h、15~30 min[2],三者混合使其具有长期、中期和即时起效的优势,可以维持1~4周血液中的有效浓度。《美国药典》[3]分别采用碘量法和分光光度法测定苄星青霉素和普鲁卡因青霉素注射混悬液中苄星青霉素和普鲁卡因青霉素的含量,操作烦琐费时费力,且国内未见测定该复方制剂的报道。鉴于此,笔者参考有关文献[4-10],采用高效液相色谱(HPLC)法建立了同时测定注射用三重霉素中普鲁卡因、二苄基乙二胺和青霉素含量的方法。
1 材料
1.1 仪器
2695型HPLC仪,包括2487型检测器、Alliance自动进样器、Empower色谱工作站(美国Waters公司);XS205型电子分析天平(瑞士Mettler-Toledo公司)。
1.2 药品与试剂
注射用三重霉素(石药集团中诺药业有限公司,批号:SP090810、H091005,规格:苄星青霉素600 000 IU,普鲁卡因青霉素300 000 IU,青霉素钠300 000 IU);青霉素钠对照品(石药集团中诺药业有限公司,批号:101118-1,纯度:93.5%);二苄基乙二胺二乙酸盐对照品(重庆市春瑞医药化工有限公司,批号:20110110,纯度:66.3%);盐酸普鲁卡因对照品(重庆市春瑞医药化工有限公司,批号:20110416,纯度:86.3%);乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 色谱条件
色谱柱:SinoChrom C18(250 mm×4.6 mm,5µm);流动相:0.21 mol/L磷酸二氢钾溶液(含0.16%的三乙胺,用氢氧化钾溶液调pH至5.6)-乙腈(81∶19,V/V);流速:1.0 mL/min;检测波长:215 nm;柱温:25℃;进样量:10µL。
2.2 溶液的制备
2.2.1 混合对照品溶液 取盐酸普鲁卡因对照品约12 mg、二苄基乙二胺二乙酸盐对照品约20 mg、青霉素钠对照品约80 mg,精密称定,置于同一100 mL量瓶中,加乙腈20 mL振摇使均匀分散后,加甲醇20 mL充分振摇使溶解,立即用磷酸盐缓冲液(取磷酸二氢钾6.8 g和磷酸氢二钾1.14 g,置于1 000 mL量瓶中,加水定容,摇匀)定容,摇匀,即得。
2.2.2 供试品溶液 精密称取样品约50 mg,精密称定,置于50 mL量瓶中,加乙腈10 mL振摇使均匀分散后,加甲醇10 mL充分振摇使溶解,立即用磷酸盐缓冲液定容,摇匀,即得。
2.2.3 阴性对照溶液 取甲醇、乙腈各10 mL,置于50 mL量瓶中,用磷酸盐缓冲液定容,摇匀,作为阴性对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各10µL,按“2.1”项下色谱条件下进样测定,记录色谱,详见图1。在该色谱条件下,普鲁卡因、二苄基乙二胺和青霉素峰的保留时间分别为4.982、12.837、20.334 min;理论板数以普鲁卡因、二苄基乙二胺和青霉素峰计分别为12 020、10 802、12 034;相邻两个主峰之间的分离度分别为21.6和14.2。结果表明,阴性对照对测定无干扰。
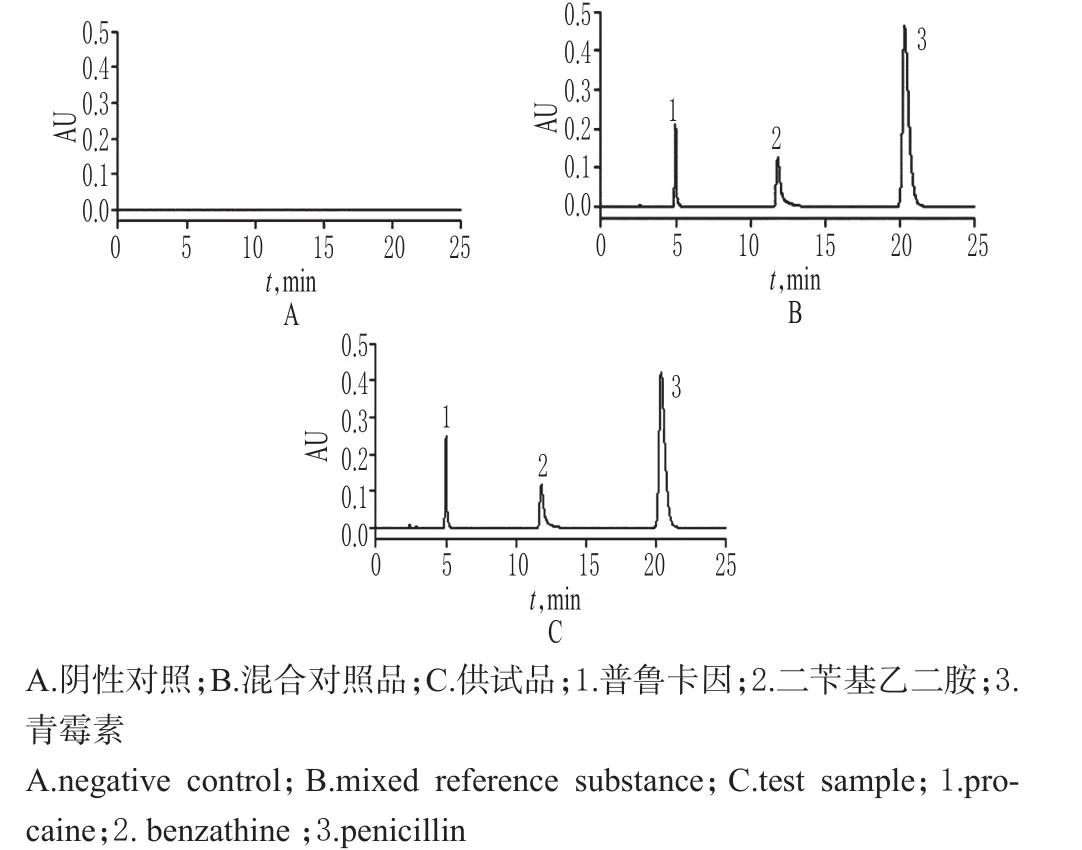
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.4 破坏性试验
按如下方法制备各破坏样品溶液——(1)热破坏样品溶液:取样品50 mg,置于50 mL量瓶中,加乙腈、甲醇各10 mL使溶解,再加磷酸盐缓冲液定容,摇匀,置于100℃水浴中加热60 min,放冷,即得。(2)酸破坏样品溶液:取样品50 mg,置于50 mL量瓶中,加乙腈、甲醇各10 mL使溶解,再加0.1 mol/L盐酸溶液2.0 mL,放置10 min,加0.1 mol/L氢氧化钠溶液2.0 mL进行中和,加磷酸盐缓冲液定容,摇匀,即得。(3)碱破坏样品溶液:取样品50 mg,置于50 mL量瓶中,加乙腈、甲醇各10 mL使溶解,加0.1 mol/L氢氧化钠溶液2.0 mL,放置10 min,加0.1 mol/L盐酸溶液2.0 mL进行中和,加磷酸盐缓冲液定容,摇匀。(4)光破坏样品溶液:取样品50 mg,置于50 mL量瓶中,加乙腈、甲醇各10 mL使溶解,加磷酸盐缓冲液定容,摇匀,置于4 000 lx光照条件下照射48 h,即得。(5)氧化破坏样品溶液:取样品50 mg,置于50 mL量瓶中,加乙腈、甲醇各10 mL使溶解,加10%过氧化氢溶液2.0 mL,放置15 min,加磷酸盐缓冲液定容,摇匀,即得。
精密量取上述溶液各10µL,按“2.1”项下色谱条件进样测定,记录色谱,详见图2。由图2可知,各降解产物与主峰的分离情况良好。
2.5 线性关系考察
精密称取待测成分青霉素钠对照品各适量,按“2.2.1”项下方法制备普鲁卡因质量浓度分别为0.011、0.021、0.053、0.11、0.21、0.43、0.64 mg/mL,二苄基乙二胺质量浓度分别为0.013、0.027、0.066、0.13、0.27、0.53、0.80 mg/mL,青霉素质量浓度分别为0.075、0.15、0.38、0.75、1.5、3.0、4.5 mg/mL的系列混合对照品溶液。取上述系列混合对照品溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,mg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程与线性范围,详见表1。
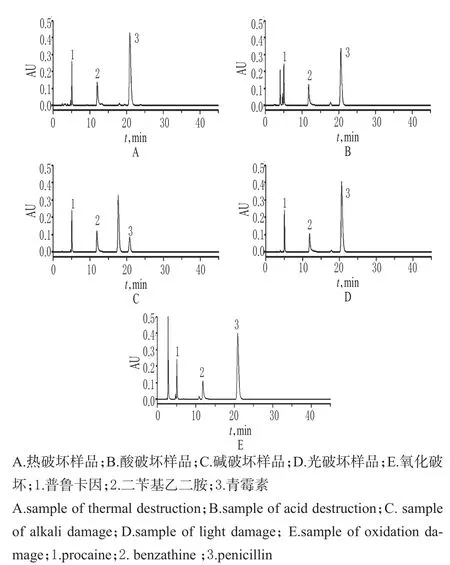
图2 破坏性试验高效液相色谱图Fig 2 HPLC chromatograms of destructive test

表1 回归方程与线性范围Tab 1 Regression equations and linear range
2.6 精密度试验
精密量取“2.2.1”项下供试品溶液(批号:SP090810)适量,按“2.1”项下色谱条件进样测定,记录峰面积。结果,普鲁卡因、二苄基乙二胺、青霉素峰面积的RSD分别为0.10%、0.22%、0.09%(n=6),表明方法精密度良好。
2.7 稳定性试验
精密量取“2.2.2”项下供试品溶液(批号:SP090810)适量,分别于室温下放置0、2、4、6、8、10、12 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,普鲁卡因、二苄基乙二胺、青霉素峰面积的RSD分别为0.30%、0.25%、0.21%(n=7),表明供试品溶液在室温放置12 h内稳定性良好。
2.8 重复性试验
精密量取“2.2.2”项下供试品溶液(批号:SP090810)适量,按“2.1”项下色谱条件进样测定,记录峰面积并计算样品含量。结果,普鲁卡因、二苄基乙二胺、青霉素的平均含量分别为11.88%、12.55%、68.52%,RSD分别为0.66%、0.58%、0.43%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取样品(批号:SP090810)适量,共9份,分别加入低、中、高质量的待测成分对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
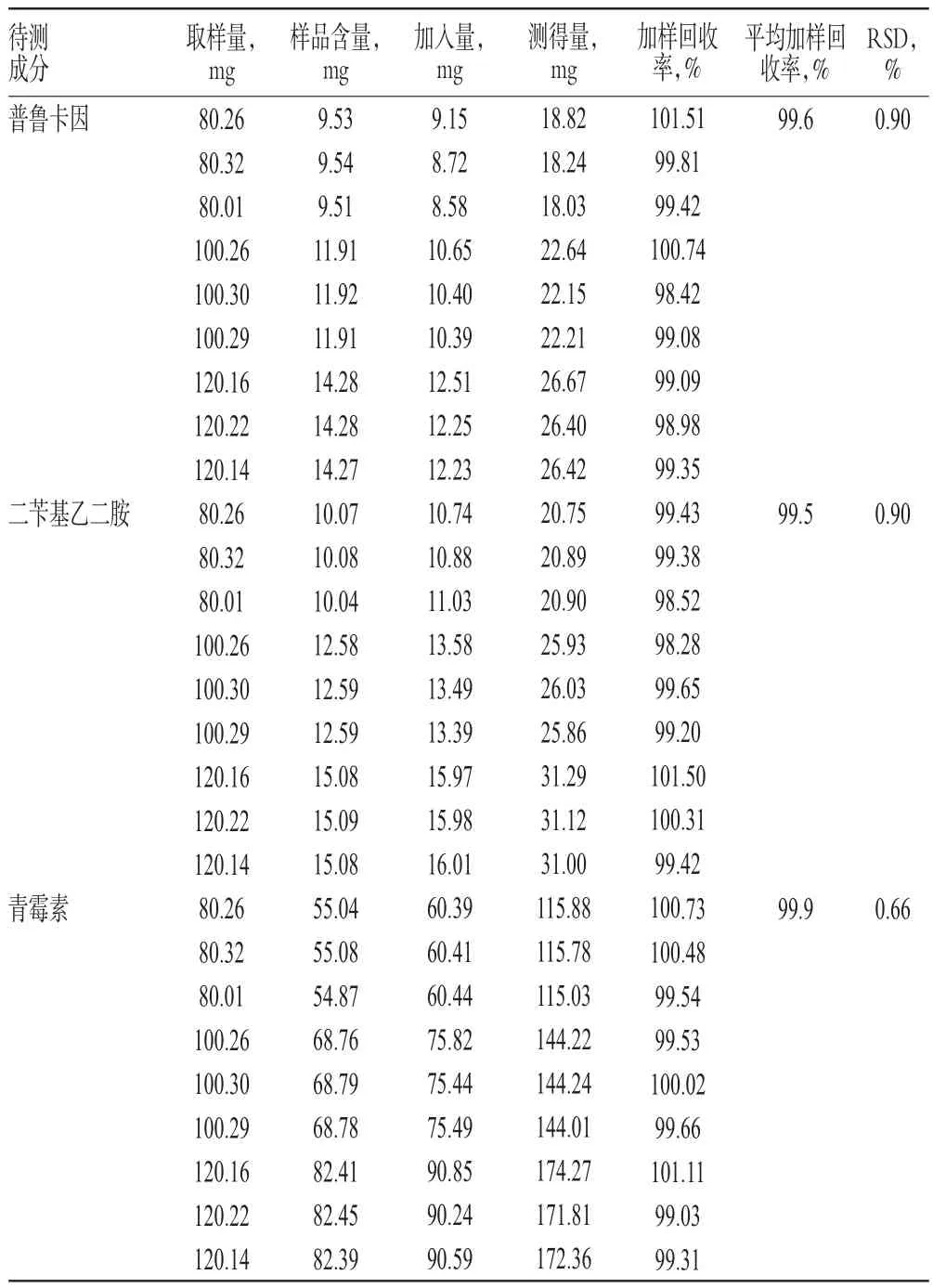
表2 加样回收率试验结果(n=9)Tab 2 Results of recovery test(n=9)
2.10 样品含量测定
取两批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按外标法以峰面积计算样品中普鲁卡因、二苄基乙二胺、青霉素的含量。结果,两批样品(批号:SP090810、H091005)中普鲁卡因的含量为11.88%、12.19%,二苄基乙二胺的含量为12.55%、12.27%,青霉素的含量为68.58%、67.57%;按每1 mg的青霉素相当于1 780青霉素单位计算样品中普鲁卡因青霉素、苄星青霉素、青霉素钠的效价,两批样品(批号:SP090810、H091005)中普鲁卡因青霉素的效价为299、307 IU/mg,苄星青霉素的效价为622、608 IU/mg,青霉素钠的效价为300、288 IU/mg。
3 讨论
3.1 色谱柱、检测波长、溶剂的选择
二苄基乙二胺易与色谱柱的残留硅醇基产生次级保留作用,因此本试验选用封尾完全的C18[11-12]。三重霉素中二苄基乙二胺含量较小,吸收较弱,故选用二苄基乙二胺的最佳检测波长215 nm作为本试验的测定波长。三重霉素中普鲁卡因青霉素在甲醇中易溶,在水中微溶,而苄星青霉素在甲醇中微溶,在水中极微溶解,因此本试验选择文献[4]中的溶剂。
3.2 流动相的优化
普鲁卡因和二苄基乙二胺为有机碱,青霉素为有机酸。流动相pH增大,普鲁卡因和二苄基乙二胺保留时间延长,青霉素则缩短。pH>6时,二苄基乙二胺出峰晚,峰拖尾严重;pH<5时,普鲁卡因出峰太快,不易与溶剂峰或杂质峰分离。为减小二苄基乙二胺的拖尾,加入适量的三乙胺。三乙胺浓度增大,普鲁卡因和二苄基乙二胺保留时间缩短,青霉素则延长。二苄基乙二胺对pH、三乙胺浓度、盐浓度均较敏感;盐浓度增大,二苄基乙二胺保留时间缩短,而盐浓度对另两者影响较小。乙腈在17%~19%,pH为5~6,三乙胺浓度为0.3%的条件下调节,使普鲁卡因和青霉素保留时间合适,并与相邻峰能有效分离。通过调节盐的浓度,使二苄基乙二胺处于合适的峰位,恰与青霉素降解物峰分离完全。最终,本试验的流动相为0.21 mol/L磷酸二氢钾溶液(含0.16%的三乙胺,用氢氧化钾溶液调pH至5.6)-乙腈(81∶19,V/V)。
综上所述,本方法简便、准确,可用于注射用三重霉素中普鲁卡因、二苄基乙二胺和青霉素含量的同时测定。
[1] 杨晓玲.苄星青霉素肌肉注射法临床应用[J].大家健康(学术版),2013,7(1):42-43.
[2] Alison B.Martindale:the complete drug reference[M].38 th edition.London:Pharmaceutical Press,2014:227、228、344.
[3] The United States Pharmacopeial Convention.U.S.Pharmacopeia:volumn 3[S].38th edition.Revision Rockville:United Book Press,2015:4783-4785.
[4] 陈汝红.苄星青霉素中N,N′-二苄基乙二胺和青霉素的HPLC法测定[J].中国医药工业杂志,2012,43(7):598-600.
[5] 陈汝红.梯度洗脱HPLC法测定苄星青霉素中的有关物质[J].中国抗生素杂志,2012,37(3):223-226.
[6] 吴桂英,林銮君,李惠妮.HPLC法测定普鲁卡因青霉素注射液中青霉素含量[J].中国兽药杂志,2008,42(5):24-25.
[7] 蔡金华,顾欣,金凌艳,等.HPLC法鉴别普鲁卡因青霉素注射液及含量测定[J].中国兽药杂志,2009,43(9):1-4.
[8] 刘广桢,林林,李玉杰,等.HPLC法分析注射用普鲁卡因青霉素有关物质[J].中国药品标准,2009,10(5):378-380.
[9] 殷果,秦斌,邓颖.HPLC法梯度洗脱测定普鲁卡因青霉素中有关物质[J].药物分析杂志,2010,30(5):925-928.
[10] 杨德智,徐维盛,张丽,等.优化《中国药典》罗红霉素HPLC含量测定方法研究[J].中国药房,2011,22(17):1604-1606.
[11] 王明娟,李娅萍,胡昌勤.硅胶基质C18柱的分类[J].药物分析杂志,2006,26(10):1521-1526.
[12] 赵贝贝,张艳,唐涛,等.硅胶基质高效液相色谱填料研究进展[J].化学进展,2012,24(1):122-130.
(编辑:刘 柳)
Simultaneous Determination of Procaine,Benzathine and Penicillin in Triple Penicillin for Injection by HPLC
℃
OBJECTIVE:To establish a method for the simultaneous determination of procaine,benzathine and penicillin in Triple penicillin for injection.METHODS:HPLC was performed on the column of SinoChrom C18with mobile phase of 0.21 mol/L potassium dihydrogen phosphate solution(containing 0.16%triethylamine,adjusted pH to 5.6 by potassium hydroxide)-acetonitril(81∶19,V/V)at a flow rate of 1.0 mL/min,detection wavelength was 215 nm,column temperature was 25 ℃ ,and the injection volume was 10µL.RESULTS:The linear range was 0.011-0.64 mg/mL for procaine(r=0.999 9),0.013-0.80 mg/mL for benzathine(r=0.999 9)and 0.075-4.50 mg/mL for penicillin(r=0.999 9);RSDs of precision,stability and reproducibility tests were lower than 0.70%;recoveries were 98.42%-101.51%(RSD=0.90%,n=9),98.28%-101.50%(RSD=0.90%,n=9)and 99.03%-101.11%(RSD=0.66%,n=9).CONCLUSIONS:The method is simple,accurate,and can be used for the simultaneous determination of procaine,benzathine and penicillin in Triple penicillin for injection.
Triple penicillin for injection;Procaine;Benzathine;Penicillin;Content determination;HPLC
R917
A
1001-0408(2017)03-0421-04
2016-06-19
2016-10-26)
*主任药师,硕士。研究方向:药品检验。电话:0311-85212007。E-mail:crh030227@sohu.com
DOI10.6039/j.issn.1001-0408.2017.03.38
CHEN Ruhong1,DOU Yonghai2,JIN Yinghui3(1.Hebei Provincial Institute for Drug Control,Shijiazhuang 050011,China;2.Tianjin Permanent Hospital,Tianjin 300450,China;3.Zhongnuo Pharmaceutical Co.,Ltd.,Shijiazhuang Pharmacy Group,Shijiazhuang 050051,China)
