两种乙二胺碘酸盐的制备与性能
2022-04-16陈世勇易镇鑫陈厚和朱顺官
陈世勇,张 琳,李 燕,易镇鑫,陈厚和,朱顺官
(南京理工大学化学与化工学院,江苏 南京 210094)
1 引言
含能材料作为武器弹药杀伤和毁灭目标的能量来源,逐步朝着高能、钝感、绿色的方向发展[1-4],其中有机共价化合物[5-6]、离子盐[7-9]、含能金属有机框架化合物[10-11]及铝热剂[12]因其结构的可设计性和能量可调控性而受到了广泛的关注,但多数含能化合物因为合成步骤复杂、感度较高、能量较低、成本高等问题而无法使用,因此合成具有工艺简单、能量较高、感度适中的含能化合物具有重要意义。
高氯酸胺盐作为一种燃烧速度较高的含能化合物,具有合成简单且能量水平较高的特点,20 世纪已作为炸药使用,但其普遍存在吸湿性问题。刘丽娟等[13-14]针对三乙烯二胺二高氯酸盐和乙二胺二高氯酸盐吸湿性严重的问题,采用共晶的方法,将两种盐通过分子间作用力结合在一起,成功解决了两种高氯酸胺盐的吸湿性。共晶化合物乙二胺⁃三乙烯二胺高氯酸盐(SY)爆速高达7239 m·s-1且感度适中,良好的耐高温性能使其具有很好的应用前景[15]。有机胺硝酸盐由于其含氧酸根中不含氯等对环境有害的成分而受到关注,但其大部分存在吸湿性强、能量水平较低等问题,本课题组曾对乙二胺二硝酸盐和三乙烯二胺二硝酸盐进行研究,以期通过分子间作用力形成能量水平较高且吸湿性小的共晶硝酸盐,但并未成功。此外,还可以通过改变有机胺和含氧酸的种类,合成不同的有机胺含氧酸盐并筛选出性能均衡的化合物。
碘的含氧酸盐由于产气量大且含有杀菌的碘元素而受到关注,是一种潜在的绿色氧化剂。Wan Z 等[16]以高碘酸钠作为氧化剂制备了一种Al@NaIO4铝热剂,该铝热剂能在8#工业雷管中成功对炸药进行起爆。M.A. Hobosyan[17]和Smith Dylan K 等[18]先后将制备成不同结构的五氧化二碘作为氧化剂与纳米铝粉混合,结果表明该氧化剂有助于提升铝的反应活性。Sullivan K T 等[19]研究了Al@AgIO3铝热剂的点火反应,AgIO3的性能明显优于CuO 和Fe2O3氧化剂,这归因于AgIO3热分解能释放除氧外的碘而增强气体释放,而且最终反应产物中碘和银以碘化银的形式存在,碘化银的纳米球形颗粒包裹在Al2O3表面。Bi(IO3)3、Cu(IO3)2、Fe(IO3)3等均被用作氧化剂制备了性能优异的铝热剂并具有良好杀菌效果[20]。Phanon D[21]、Xu X 等[22]先后制备了NaI3O8、AgI3O8,通过调节氧化剂的种类,达到满足不同能量和杀菌效果的要求,但由于I3O8-阴离子吸湿性严重,限制了其作为铝热剂组分时的应用。氧化剂和可燃剂组合为一体的碘系含能化合物不仅能够在分子层面将不同组分混合均匀,而且能够在一定程度上解决混合组分的吸湿性问题,因此制备这样的化合物具有重要意义。
为此,本研究以乙二胺作为还原剂,碘酸为氧化剂,合成了两种乙二胺碘酸盐——乙二胺二碘酸盐和共晶乙二胺六碘酸盐,测定了其单晶结构,对两种乙二胺碘酸盐行了表征并测试了燃烧性能和输出威力,为探索高能量密度的碘系有机胺含氧酸盐提供了一定的基础。
2 实验部分
2.1 试剂与仪器
无水乙二胺,国药集团化学试剂有限公司;碘酸,上海泰坦科技股份有限公司;无水乙醇,国药集团化学试剂有限公司,以上试剂均为分析纯。去离子水,实验室自制;纳米铝粉,标称粒径为100 nm,99.9%,焦作伴侣纳米材料工程有限公司。
Bruker SMART APEX ⅡX 射线单晶衍射仪(德国Bruker 公司),D8 Advance X 射线衍射仪(德国Bruker公司),NICOLETIS10 傅里叶红外光谱仪(赛默飞世尔科技),梅特勒托利多823E DSC 和851E TGA/SDTA,(瑞士Mettler Toledo 公司)。
2.2 乙二胺碘酸盐的制备
乙二胺二碘酸盐:称取0.6 g 无水乙二胺溶解于去离子水中并稀释成质量分数为5%的溶液,称取53.7 g质量分数为6.5%的碘酸溶液置于夹套反应杯形成底液,同时开启搅拌并加热到70 ℃,采用蠕动泵将乙二胺溶液加入化合器,5 min 进料完毕,继续保温反应10 min。随后冷却至室温后,进行抽滤,采用无水乙醇洗涤2~3 次,将所得乙二胺二碘酸盐烘干称重。
乙二胺六碘酸盐:称取1.2 g 无水乙二胺溶解于去离子水中并稀释成质量分数为6%的溶液,称取100 g质量分数为7.5%的碘酸溶液置于夹套反应杯中形成底液,同时开启搅拌并加热到70 ℃,采用蠕动泵将乙二胺溶液加入化合器中,5 min 进料完毕,保温反应10 min。随后在搅拌状态下对反应液蒸发至60 mL,冷却至室温后,进行抽滤,采用无水乙醇洗涤2~3 次,将所得乙二胺六碘酸盐烘干称重。
2.3 单晶培养与解析
在上述两种化合物合成保温期间,用吸管分别吸取5 mL 反应液置于培养皿中,用70 ℃纯水稀释至30 mL,令其缓慢蒸发,放置数天后即可得单晶颗粒。将乙二胺二碘酸盐和乙二胺六碘酸盐分别选取了尺寸为0.28 mm×0.25 mm×0.25 mm、0.12 mm×0.1 mm×0.1 mm 的单晶置于Bruker SMART APEX ⅡX 射线单晶衍射仪上进行结构测试。测试温度为室温,晶体结构的解析和优化由程序SHELXS 97 完成,整个计算工作由SHELXL 程序计算求解,全部数据经全矩阵最小二乘法校正。
3 结果与讨论
3.1 晶体结构分析
所合成的两种乙二胺碘酸盐各项单晶数据见表1,不对称的分子结构、三维晶胞堆积情况及分子间卤键和氢键作用如图1 和图2 所示。
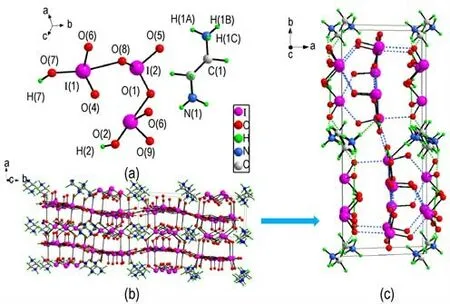
图2 乙二胺六碘酸盐:(a)不对称分子结构单元,(b)晶胞堆积,(c)单个晶胞内卤键及氢键分布Fig.2 CH7I3NO9:(a)asymmetric molecular structural unit,(b)packing diagram,(c)halogen bond and hydrogen bond diagram in single cell
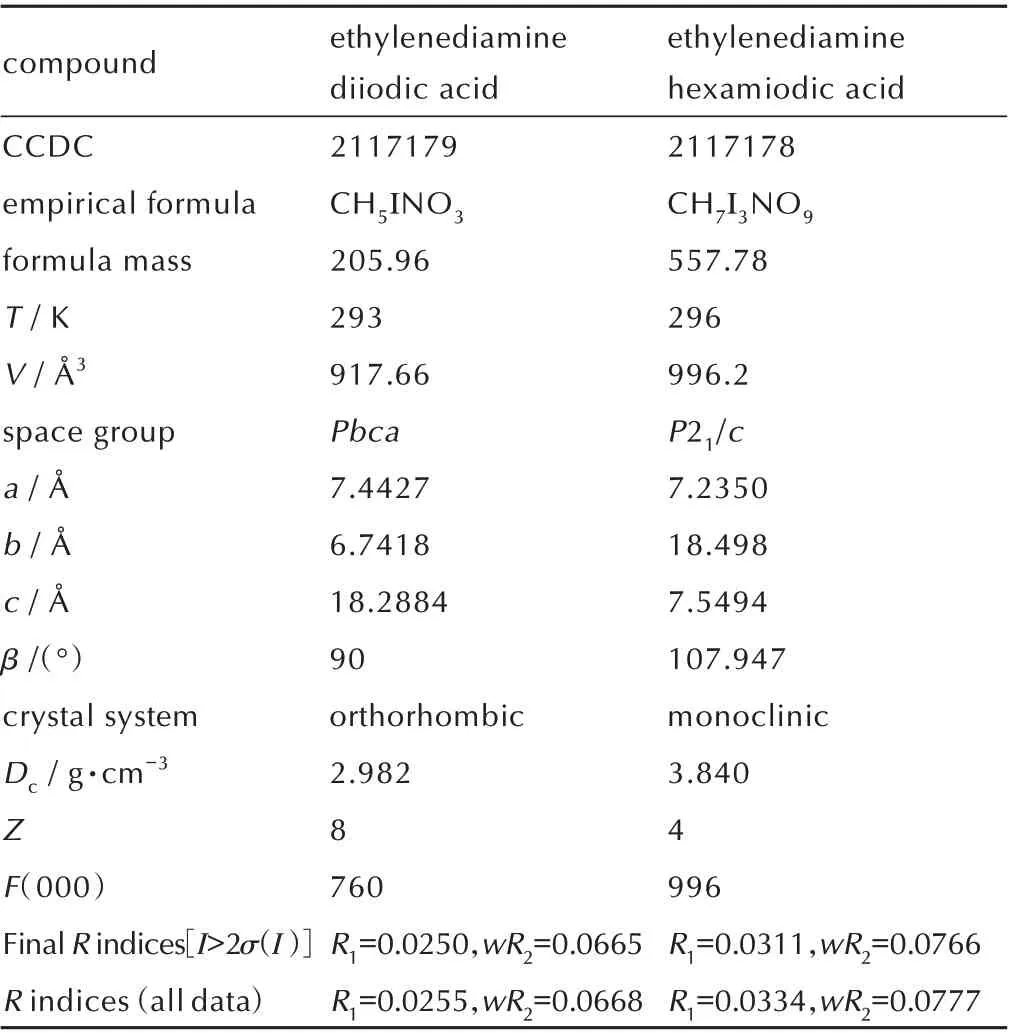
表1 两种乙二胺碘酸盐晶体数据Table 1 Crystallographic data for two ethylenediamineIo⁃date salts
由表1 可知,乙二胺二碘酸盐属于正交晶系,Pbca空间群,晶体密度为2.982 g·cm-3。该化合物分子中乙二胺和碘酸的摩尔比为1∶2,由于乙二胺中的N 原子能够提供孤对电子,容易与游离的氢离子结合发生质子化,该酸碱反应通过静电作用以氢键的方式将质子化后的乙二胺和碘酸根连接在一起,分子中的氢键形式为N—H…O。除此之外,不同的碘酸根之间还存在着O—I…O 形式的卤键作用。单个晶胞中卤键及氢键分布如图1c 所示。沿着b轴方向,不同的碘酸根之间通过O(2)—I(1)…O(1)形式的卤键作用不断的沿着a轴和b轴所在的平面延伸。在c轴方向,质子化后的乙二胺和邻近的碘酸根之间通过三种不同的氢键相连接,保证了该结构在c轴方向的稳定性。该卤键的键长为d(I…O)=2.8184 Å,相较于文献[23]中报道的卤键(I…N)键长2.79~3.380 Å 较短。在碘酸根中,氧原子的电负性大于碘,两者形成的共价键电子云将偏向于氧,使碘具有正电荷的性质,容易与相邻碘酸根中具有合适位置的氧产生静电吸引。此外碘酸根中,碘处于四面体顶点的位置,为与相邻碘酸根中的氧产生静电吸引提供了有利条件。
当乙二胺和碘酸的投料摩尔比为1∶6 时,会形成乙二胺六碘酸盐。该盐属于单斜晶系,晶体密度为2.982 g·cm-3,分子中乙二胺和碘酸的摩尔比同投料比一致。由图2 可知,与乙二胺二碘酸盐不同之处在于分子中两个碘酸和一个碘酸根先通过3 种卤键O(7)—I(1)…O(8)(d=2.404 Å)、O(2)—I(3)…O(7)(d=2.480 Å)、O(9)—I(3)…O(4)(d=2.850 Å)连接在一起形成一个类似于H2I3O9-的六边形阴离子结构,使得该结构具有稳定性。如图2c 所示,不同的H2I3O9-结构在c轴方向通过卤键O(5)—I(2)…O(6)(d=2.560 Å)和O(6)—I(3)…O(6)(d=2.480 Å)以及氢键O(2)—H(2)…O(3)(d=1.774Å)相连接。而沿着b轴,不同该结构通过卤键O(8)—I(2)…O(5)(d=2.68 Å)与共价键I(2)—O(5)形成平行四边形网络相连接,最终形成了由碘酸和碘酸根组成的骨架。质子化后的乙二胺通过三种氢键与H2I3O9-阴离子结构相连接。从乙二胺二碘酸盐到乙二胺六碘酸盐的变化中,碘酸分子间的卤键起到了主要作用,可以认为乙二胺六碘酸盐是由乙二胺二碘酸盐和碘酸通过卤键及氢键作用形成的共晶化合物。两种乙二胺碘酸盐中氢键及卤键的键长和键角见表2 和表3。
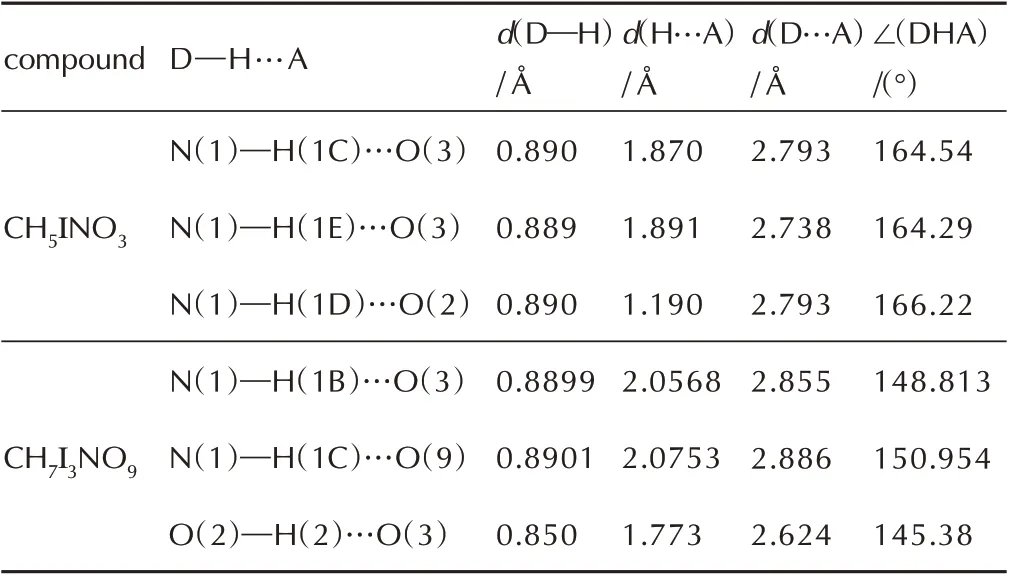
表2 CH5INO3和CH7I3NO9的氢键键长和键角Table 2Hydrogen bond lengths and bond angles of CH5INO3 and CH7I3NO9

表3 CH5INO3和CH7I3NO9的卤键键长和键角Table 3 Bond lengths and bond angles of halogen bonds of CH5INO3 and CH7I3NO9
3.2 PXRD 分析
在用母液培养单晶的过程中,两种样品母液中均有不同形貌的晶体析出,为了测定所制备样品成分,用铜靶(λ=0.15406 nm),步长0.05o,扫描范围2θ为5o~80o,将上述制备的两种不同乙二胺碘酸盐进行了X⁃射线衍射,并与原料HIO3进行对比,结果如图3所示。
“儿童的智慧在指尖上。”动手操作能让学生在体验的同时获得直接经验,促进思维的发展。数学活动经验,是学生不断经历、体验各种数学活动过程的结晶,只有在不断的“做”和“思考”的过程中才能积累起来。

图3 乙二胺二碘酸盐、乙二胺六碘酸盐和碘酸的XRD 曲线Fig.3 PXRD patterns of CH5INO3,CH7I3NO9 and HIO3
由图3 可知,原料HIO3中XRD 特征峰的主要位置为13.67°、18.01°、27.01°、28.23°、44.66°。乙二胺二碘酸(CH5NIO3)的XRD 图谱基线平稳且衍射峰突出,特征衍射峰为13.20° 、18.54° 、22.02° 、23.25° 、25.49°、36.63°,虽然在13.20°、18.54°两处衍射峰的位置同原料HIO3衍射峰位置相近,但其衍射峰强度大幅度增加,其余位置均为出现的新峰。乙二胺六碘酸(CH7NI3O9)的XRD 图谱基线不平稳,衍射峰强度较弱,特征峰位置为10.40°、14.76°、21.77°、26.04°、28.58°、36.53°,同原料HIO3的峰位置均没有重合。对比CH5NIO3和CH7NI3O9与HIO3的XRD 图谱,表明乙二胺和碘酸并不是简单的共沉淀式结晶,而是形成了新的化合物,进一步证明了可以大量制备两种乙二胺碘酸盐的可行性,同时表明在制备共晶化合物乙二胺六碘酸的过程中,没有乙二胺二碘酸盐单独析出。
3.3 FTIR 分析
为了进一步确认两种样品的组分,采用傅里叶红外确定分子中是否含有乙二胺,采用KBr 压片,研究了两种样品在500~4000 cm-1范围内的红外吸收峰,两种样品的红外图谱如图4 所示。
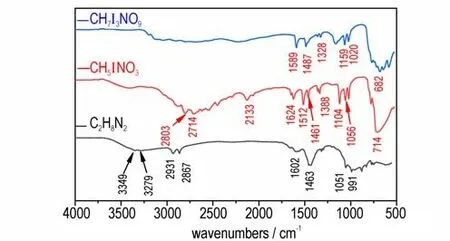
图4 乙二胺二碘酸盐、乙二胺六碘酸盐和乙二胺的红外谱图Fig.4 IR spectra of CH5INO3,CH7I3NO9 and C2H8N2
由图4 可知,两种乙二胺碘酸盐的图谱差别比较明显。乙二胺二碘酸盐在2803,2714 cm-1处的吸收峰为CH2的伸缩振动,相比于原料乙二胺中CH2的伸缩振动吸收峰位置向高频方向发生了移动,其原因为CH2基团与相邻碘酸根中的氧结合形成氢键导致的。1624,1512 cm-1处的吸收峰为典型的N—H 弯曲振动,1461 cm-1处为CH2的弯曲振动,1388 cm-1处为CH2的扭曲振动,1104,1056 cm-1处的峰代表C—N伸缩振动。714 cm-1处为NH2的摇动,在该位置NH2的摇动与HIO3的特征吸收峰会发生重合,以上均表明乙二胺二碘酸盐分子中含有乙二胺。乙二胺六碘酸盐在1589 cm-1处为N—H 的弯曲振动,1487 cm-1处为CH2的弯曲振动,1328 cm-1处为CH2的扭曲振动,1159,1020 cm-1处为C—N 伸缩振动,682 cm-1处峰位置代表NH2的摇动与HIO3的特征吸收,表明乙二胺六碘酸盐的分子中含有乙二胺。但两种乙二胺碘酸盐的红外谱图中,在3300 cm-1附近没有伯胺典型的N—H 伸缩振动,进一步表明了乙二胺的质子化。
3.4 热分解性能测试
为研究两种乙二胺碘酸盐的热分解过程,采用TG⁃DSC,以氮气气氛和10 K·min-1的升温速率为测试条件,研究了乙二胺二碘酸盐在50~420 ℃范围内和乙二胺六碘酸盐在50~500 ℃范围内的热分解情况,两种乙二胺碘酸盐的TG⁃DSC 曲线,如图5 所示。
由图5 可知,两种乙二胺碘酸盐的分解温度均不超过200 ℃,乙二胺二碘酸盐的DSC 曲线只有一个放热峰,放热峰为185.18℃,放热量为995.07 mJ·mg-1,TG 曲线质量损失为100%。TG⁃DSC 曲线表明,乙二胺二碘酸盐在184 ℃附近分解完毕,且分解产物没有固体残渣。乙二胺六碘酸盐的DSC 曲线有两个明显的放热峰,第一个放热峰为179.48 ℃,放热量为603.44 mJ·mg-1,第二个放热峰为356.87 ℃,,放热量为325.46 mJ·mg-1,TG 曲线则有两个台阶,第一个台阶的质量损失为57.46%,第二个台阶的质量损失为42.54%,分析乙二胺六碘酸盐的分解历程为:在177.20 ℃时分解放热,分子内的乙二胺和部分碘酸发生反应,同时分解产生的热量使分子内多余的碘酸脱水形成I2O5。随着温度的升高,在356.87 ℃时,I2O5分解生成碘蒸汽和氧气。相比于乙二胺二碘酸盐,乙二胺六碘酸盐在分子内碘酸数目增加后,分解温度并没有大幅度下降,进一步表明分子内卤键的作用对于结构的稳定性至关重要。
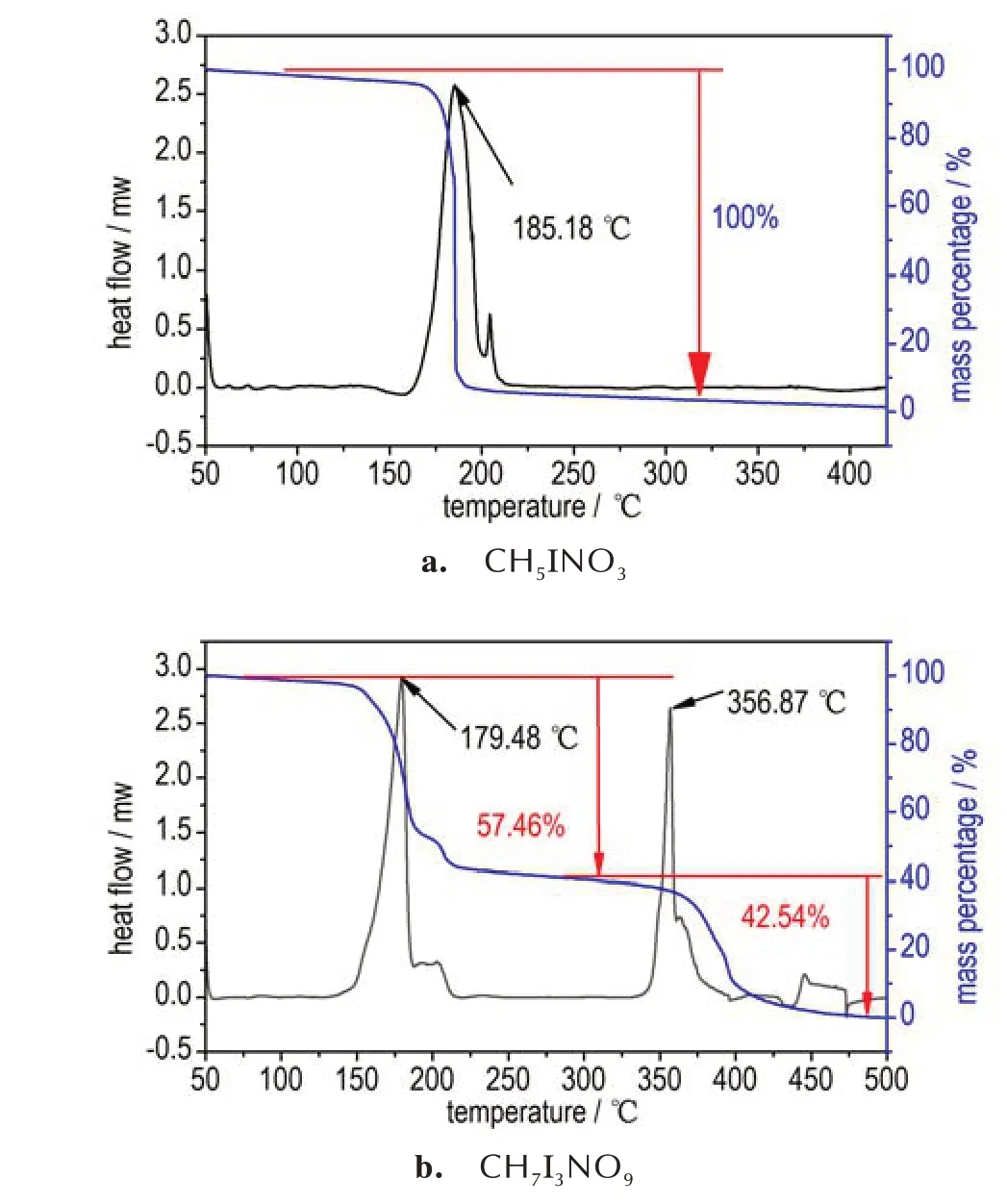
图5 乙二胺二碘酸盐和乙二胺六碘酸盐的TG⁃DSC 曲线Fig.5 TG⁃DSC curves of CH5INO3 and CH7I3NO9
3.5 轴向输出实验

图6 不同样品5 mm 铅板穿孔结果Fig.6 5 mm lead plate perforation results of different samples
由图6 可知,乙二胺二碘酸盐作为主装药时,铅板炸孔直径为7.8 mm,乙二胺六碘酸盐作为主装药时,并不能将铅板贯穿。为了验证乙二胺六碘酸盐是否具有可燃性,称取20 mg 的乙二胺六碘酸盐于称量纸上并通过点燃硝化棉条对样品进行点火,发现样品并不能进行持续燃烧,但与纳米铝粉混合后,燃烧速度变快且有紫色的气体产生。结合两种乙二胺碘酸盐的TG⁃DSC 及氧平衡(OB1=-11.5%,OB2=13%),分析认为乙二胺二碘酸盐处于负氧平衡,在被起爆后,爆炸时分解放出的热量和气体产物全部作用于铅板,使其能够将铅板贯穿。乙二胺六碘酸盐氧平衡比较大,在燃烧分解的过程中,不仅能够自供氧,分子中多余供氧基团碘酸根将会生成五氧化二碘,消耗体系的能量。随着温度的升高,五氧化二碘将分解放出的热量,爆炸瞬间能量和气体并不能一次性作用于铅板,致使乙二胺六碘酸盐的输出威力下降。将乙二胺六碘酸盐掺杂质量分数为10%的纳米铝粉后,进行装药,在爆炸的同时产生大量可见的紫色碘蒸汽,铅板贯穿直径为8.4 mm,铝粉的掺入增加了体系的爆热,结合其富氧特性,可作为铝热剂中的氧化剂。相比于RDX 作为主装药时铅板炸孔直径10.4 mm,两种乙二胺碘酸盐以及乙二胺六碘酸盐和铝粉的混合物输出威力均小于RDX,但当乙二胺六碘酸盐和铝粉混合后,输出威力要高于乙二胺二碘酸盐。
3.6 燃烧实验
依据国军标GJB5891.2-2006 堆积密度测定方法对乙二胺二碘酸盐、乙二胺六碘酸盐及乙二胺六碘酸盐和10%纳米铝粉的复合物进行了松装堆积密度的测量,测得堆积密度分别为0.97,1.37,1.62 g·cm-3。分别称取1.5 g 的乙二胺二碘酸盐和乙二胺六碘酸盐与纳米铝粉的复合物在松装条件下置于直径为1.78 cm 的铁壳中,采用硝化棉条进行点火,利用摄影设备(佳能EOS 90D)拍摄了其发烟时的照片,拍摄位置距离铁壳20 cm,发烟情况和燃烧时间如图7 和表4 所示。

图7 不同样品燃烧照片Fig.7 Burning pictures of different samples

表4 不同样品燃烧数据Table 4 Burning data for the different samples
由图7 可知,乙二胺二碘酸盐在燃烧时能够产生大量的紫色烟雾,由于乙二胺二碘酸盐燃烧时,产物中含有大量的碘蒸汽,碘蒸汽呈现出紫色,因此该化合物具有用于单质紫色发烟剂的潜力,能够减少复合发烟剂在混药时存在的危险。在松装条件下乙二胺六碘酸盐无法燃烧,混合质量分数10%的纳米铝粉后,便可剧烈燃烧,在燃烧的过程中,能够清晰地观察到明亮的火焰、紫色的碘蒸汽以及燃烧的纳米铝粒子,纳米铝粉的加入不仅能够对乙二胺六碘酸盐助燃,还能够提高火焰的温度,亦可以作为一种紫色发烟剂,其中纳米铝粉可以用其他助燃的可燃剂进行代替。
由表4 可知,乙二胺二碘酸盐在铁壳中松装条件下,单位质量的燃速为0.375 g·s-1,乙二胺六碘酸盐和纳米铝的混合物与之相比具有更小的单位质量燃速0.214 g·s-1,纳米铝粉的加入不仅能够使乙二胺六碘酸盐快速燃烧,并且比乙二胺二碘酸盐具有更快的燃速。
4 结论
(1)以乙二胺和碘酸为原料,合成了乙二胺二碘酸盐和乙二胺六碘酸盐,其中乙二胺六碘酸为乙二胺二碘酸盐和碘酸通过卤键和氢键作用形成的共晶化合物。
(2)利用溶剂挥发法中培养了两种乙二胺碘酸盐的单晶,其中乙二胺二碘酸盐属于正交晶系,Pbca空间群,晶体密度为2.982 g·cm-3。乙二胺六碘酸盐属于单斜晶系,P21/c空间群,晶体密度为3.84 g·cm-3。
(3)乙二胺二碘酸盐的DSC 放热峰温为185.18 ℃,乙二胺六碘酸盐的放热峰温为179.48 ℃,进一步表明卤键对于乙二胺六碘酸盐结构稳定性的突出贡献;通过铅板炸孔直径可知,两种乙二胺碘酸盐的输出威力均小于粉末RDX(10.4 mm)。
(4)乙二胺二碘酸盐、乙二胺六碘酸盐与10%纳米铝粉的混合物(CH7I3NO9@10%Al)均可以发出紫色的烟雾,其中乙二胺二碘酸盐具有用作单质紫色发烟剂的潜力。
