布洛芬氯化钠注射液细菌内毒素检查方法的建立
2017-03-03詹晓亮苑新星马军芳沈阳格仕特医药科技有限公司辽宁本溪7004沈阳兴齐眼药股份有限公司沈阳063
詹晓亮,郭 健,苑新星,马军芳(.沈阳格仕特医药科技有限公司,辽宁本溪 7004;.沈阳兴齐眼药股份有限公司,沈阳 063)
布洛芬氯化钠注射液细菌内毒素检查方法的建立
詹晓亮1*,郭 健2,苑新星1,马军芳1(1.沈阳格仕特医药科技有限公司,辽宁本溪 117004;2.沈阳兴齐眼药股份有限公司,沈阳 110163)
目的:建立布洛芬氯化钠注射液细菌内毒素的检查方法。方法:按2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”项下凝胶法的要求,通过干扰试验确定样品主成分最大无干扰质量浓度,并进行方法学验证。结果:样品稀释至含布洛芬质量浓度为1 mg/mL及以下时对细菌内毒素检查无干扰作用。结论:所建立的方法可用于布洛芬氯化钠注射液的细菌内毒素检查,其细菌内毒素限值确定为0.5 EU/mL。
布洛芬氯化钠注射液;细菌内毒素检查;干扰试验
布洛芬为非甾体类解热镇痛抗炎药,具有较强的抗炎、抗风湿及解热镇痛作用,且胃肠道不良反应较轻,耐受性好,目前在临床中被广泛使用,主要应用的是其口服制剂。布洛芬氯化钠注射液是新近开发的注射制剂,能够进一步扩大该药的临床应用范围,更好地满足患者的治疗需求[1]。本研究参考2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”项下凝胶法的要求[2],建立了布洛芬氯化钠注射液细菌内毒素的检查方法。
1 材料
1.1 仪器
BET-32型细菌内毒素测定仪(天津市天大天发科技有限公司);XK96型快速混匀器(江苏新康医疗器械有限公司)。试验用试管、刻度吸管等玻璃器材按规定清洗,于250℃干烤1 h除去外源性内毒素。
1.2 药品与试剂
布洛芬氯化钠注射液(浙江省某制药企业,批号:13122321、13122421、13122422,规格:每100 mL含布洛芬0.4 g和氯化钠0.8 g);鲎试剂[TAL,福州新北生化工业有限公司,批号:13090812,标示灵敏度(λ):0.125 EU/mL;湛江安度斯生物有限公司,批号:1202171,λ:0.125 EU/ mL,规格均为每支0.1 mL];细菌内毒素工作标准品(CSE,批号:130531,规格:每支10 EU)、细菌内毒素检查用水(BET水,批号:13091402,规格:每支2 mL)均购自福州新北生化工业有限公司。
2 方法与结果
2.1 样品细菌内毒素限值(L)的确定
L按2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”规定的公式L=K/M计算。式中,K为人每1 kg体质量每1 h最大可接受的内毒素剂量,注射剂K=5 EU/(kg·h)。M为人用每1 kg体质量每1 h的最大样品剂量,我国人均体质量按60 kg计算,该制剂用于镇痛时每次给药400~800 mg,每6 h一次,每次输注时间不少于30 min;用于发烧时每次给药400 mg,每4~6 h一次,或每次给药100~200 mg,每4 h一次,每次输注时间不少于30 min,即该制剂临床最大剂量为1 h使用800 mg(200 mL),故M=200 mL/(60 kg·1 h)=3.33 mL/(kg·h)。则L=K/M=5 EU/(kg·h)/3.33 mL/(kg· h)=1.5 EU/mL。
按照2015年版《中国药典》(四部)通则9301“注射剂安全性检查法应用指导原则”中的建议[2],限值要求可适当严格,提高至计算值的1/3~1/2,以保证用药安全。本试验安全系数定为3,故L=1.5(EU/mL)/3=0.5 EU/mL。
2.2 TAL灵敏度复核
按照2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”规定,进行TAL的灵敏度复核。根据TAL的λ=0.125 EU/mL,用BET水溶解CSE,并配制成含细菌内毒素2.0λ、1.0λ、0.5λ、0.25λ(0.25、0.125、0.062 5、0.031 25 EU/mL)的系列浓度溶液。取复溶后的规格为每支0.1 mL的TAL原安瓿18管,其中16管分别加入0.1 mL不同浓度的细菌内毒素标准溶液,每个浓度平行4管;另外2管加入0.1 mL BET水作为阴性对照。取2批不同厂家的TAL分别进行试验,结果TAL灵敏度测试值(λC)均在0.5λ~2.0λ之间,表明2批TAL的灵敏度均与λ相符,可以用于细菌内毒素检查试验,结果见表1(注:“+”表示试剂形成凝胶且倒转不变形或滑落,即反应呈阳性;“-”表示未形成凝胶或凝胶不结实、变形并脱落,即反应呈阴性。以下各表同)。

表1 TAL的灵敏度复核试验结果Tab 1 Results of TALsensitivity recheck
2.3 干扰预试验
目前市售TAL的λ通常为0.5~0.03 EU/mL,根据公式MVD=cL/λ计算,则供试品最终对应有效稀释倍数范围为1~16倍。取样品(批号:13122321)适量,使用BET水稀释制成布洛芬质量浓度分别为4、2、1、0.5、0.25 mg/mL的系列溶液,标记为供试品阴性对照系列溶液(NPC系列,各2管);用上述系列溶液作为溶剂,分别溶解并稀释CSE,制得细菌内毒素含量均为2.0λ的供试品阳性对照系列溶液(PPC系列,各2管);同时做细菌内毒素阳性对照溶液(PC)和BET水阴性对照溶液(NC)各2管,然后按“细菌内毒素检查法”操作,进行干扰预试验,结果见表2。由表2可知,样品在稀释4倍及以上,即布洛芬质量浓度为1 mg/mL及以下时,2批TAL对细菌内毒素检查试验均没有干扰作用。

表2 样品干扰预试验结果Tab 2 Results of preliminary interference test
2.4 干扰试验
根据干扰预试验结果,将3批样品均照干扰预试验稀释方法制成含布洛芬质量浓度为1 mg/mL的供试品溶液,将CSE稀释制成含细菌内毒素2.0λ、1.0λ、0.5λ、0.25λ的系列溶液,每个浓度平行4管,然后分别用λ=0.125 EU/mL的2个厂家的TAL,按2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”项下的规定进行干扰试验。结果显示,用BET水制成的细菌内毒素标准溶液反应终点浓度的几何平均值(Es)均在0.5λ~2.0λ之间,用供试品溶液制成的细菌内毒素标准溶液反应终点浓度的几何平均值(Et)均在0.5Es~2.0Es之间[2-3]。表明在此试验条件下,样品对TAL与细菌内素素的凝集反应无干扰作用,详见表3。
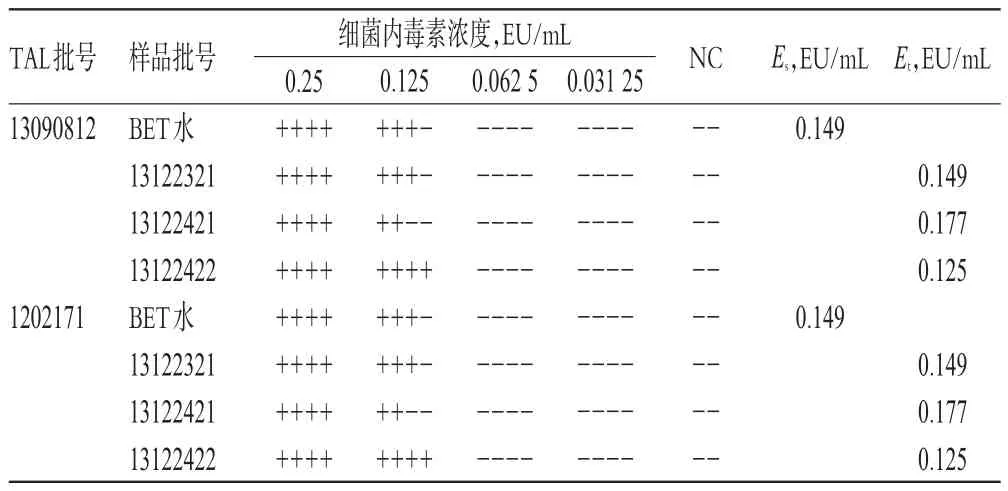
表3 样品干扰试验结果Tab 3 Results of interference test
2.5 样品细菌内毒素检查
取3批样品各适量,照干扰预试验稀释方法制成含布洛芬质量浓度为1 mg/mL的供试品溶液,分别用λ=0.125 EU/mL的TAL(批号:13090812),按照2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”进行操作和结果判断,结果3批样品每1 mL中含细菌内毒素的量均小于0.5 EU,详见表4。

表4 样品细菌内毒素检查结果Tab 4 Results of bacterial endotoxin test of sample
3 讨论
布洛芬氯化钠注射液作为静脉用注射制剂,应设立细菌内毒素或热原检查项。一般利用TAL法或家兔法检查样品所含的细菌内毒素或热原是否符合限量规定,如果不合格,在临床应用时可能产生热原反应而造成严重的不良后果。鉴于布洛芬氯化钠注射液具有解热镇痛作用,若采用家兔热原检查法可能会因其药效学作用而出现假阴性结果[4];而TAL细菌内毒素检查法具有方法简单、结果准确、成本低等优点,适用于该制剂的细菌内毒素检查,并且该方法已被广泛用于具有解热作用的注射剂及其原料药和临床医疗器具中的致热物质的检查[5-7]。本试验初步建立了布洛芬氯化钠注射液的细菌内毒素检查法,并将其细菌内毒素限值确定为:取本品,依法检查(2015年版《中国药典》四部通则1143),每1 mL中含细菌内毒素应小于0.5 EU。
[1] 李健和,曹俊华,易利丹,等.布洛芬静脉注射制剂的开发与临床应用[J].中国新药与临床杂志,2011,30(8):584-587.
[2] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:154-157、400-402.
[3] 中国药品生物制品检定所.中国药品检验标准操作规范:2010年版[M].北京:中国医药科技出版社,2010:310-321.
[4] 程春雷,高天勤,曹珍艳.注射用盐酸丙帕他莫的细菌内毒素检查[J].中国医药工业杂志,2011,42(3):219-221.
[5] 施敬云.对乙酰氨基酚注射液细菌内毒素检查法建立及方法学研究[J].海峡药学,2009,21(10):35-37.
[6] 周继春.双氯芬酸钠注射液细菌内毒素检查法的建立[J].医药论坛杂志,2015,36(4):44-49.
[7] 周筱莉.我国细菌内毒素检查法的应用进展[J].中国医药导报,2010,7(23):14-16.
(编辑:周 箐)
Establishment of Bacterial Endotoxin Test Method of Ibuprofen Sodium Chloride Injection
ZHAN Xiaoliang1,GUO Jian2,YUAN Xinxing1,MA Junfang1(1.Shenyang Greatest Pharmaceutical Tech.Co.,Ltd.,Liaoning Benxi 117004,China;2.Shenyang Sinqi Pharmaceutical Co.,Ltd.,Shenyang 110163,China)
OBJECTIVE:To establish a method for the bacterial endotoxin test of Ibuprofen sodium chloride injection.METHODS:Maximum noninterference concentration of sample was determined by interference test according to bacterial endotoxins gelclot test stated in the general principles 1143 of Chinese Pharmacopoeia 2015 edition(four).And then methodology validation was conducted.RESULTS:Samples were diluted to 1 mg/mL,which did not interfere with bacterial endotoxin test.CONCLUSIONS:The established method can be used for the bacterial endotoxin test of Ibuprofen sodium chloride injection,and the limitation of bacterial endotoxin was 0.5 EU/mL.
Ibuprofen sodium chloride injection;Bacterial endotoxin test;Interference test
R927
A
1001-0408(2017)03-0419-03
2016-01-31
2016-12-14)
*中级工程师。研究方向:药物制剂。电话:024-45595201。E-mail:zhanxiaoliang@gmail.com
DOI10.6039/j.issn.1001-0408.2017.03.37
