HPLC法同时测定杜仲补天素片中6种成分的含量Δ
2017-03-03李云静何忠梅吉林工程职业学院生物工程学院吉林四平136001吉林农业大学中药材学院长春130117
李云静,何忠梅(1.吉林工程职业学院生物工程学院,吉林四平 136001;2.吉林农业大学中药材学院,长春 130117)
HPLC法同时测定杜仲补天素片中6种成分的含量Δ
李云静1*,何忠梅2#(1.吉林工程职业学院生物工程学院,吉林四平 136001;2.吉林农业大学中药材学院,长春 130117)
目的:建立同时测定杜仲补天素片中麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸含量的方法。方法:采用高效液相色谱法。色谱柱为Kromasil C18,流动相为乙腈-0.2%磷酸溶液(梯度洗脱),流速为0.8 mL/min,检测波长为330 nm(麦角甾苷和吉奥诺苷B1)、210 nm(去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸),柱温为35℃,进样量为10 μL。结果:麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸检测质量浓度线性范围分别为~74.20 μg/mL(r=0.999 9)、4.35~87.00 μg/mL(r=0.999 5)、3.86~77.20 μg/mL(r=0.999 9)、5.05~101.00 μg/mL(r=0.999 1)、4.20~84.00 μg/mL(r=0.999 7)、4.73~87.40 μg/mL(r=0.999 6);定量限分别为0.322、0.187、0.105、0.381、0.214、0.452 μg/mL,检测限分别为0.108、0.059、0.032、0.131、0.072、0.149 μg/mL;精密度、稳定性、重复性试验的RSD<2.0%;加样回收率分别为96.20%~99.53%(RSD=1.23%,n=6)、96.99%~100.67%(RSD=1.47%,n=6)、96.64%~100.08%(RSD=1.28%,n=6)、97.47%~100.59%(RSD=1.18%,n=6)、97.97%~100.83%(RSD=1.25%,n=6)、96.81%~99.61%(RSD=1.09%,n=6)。结论:该方法操作简便、快速、准确,可用于杜仲补天素片中麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸含量的同时测定。
高效液相色谱法;杜仲补天素片;麦角甾苷;吉奥诺苷B1;去氢土莫酸;猪苓酸C;去氢茯苓酸;茯苓酸;含量测定
杜仲补天素片由熟地黄、茯苓、杜仲(盐水炒)、菟丝子(制)、肉苁蓉等25味中药材组成,具有补气益血、温肾养心、壮腰安神的功效,主要用于腰膝酸软、夜多小便、神经衰弱等症的治疗。该制剂收载于《中华人民共和国卫生部药品标准·中药成方制剂》(第12册)[1]。现行标准仅规定了性状鉴别及制剂通则的检查项[1-2],未对该制剂处方中的任何药物所含成分进行定量测定;现有相关文献[3-7]也仅对其单一药材及含该药材的其他制剂的含量进行测定。为了更好地控制该制剂的质量,笔者以熟地黄[4]中所含麦角甾苷和吉奥诺苷B1与茯苓[4]中所含去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸为指标成分,采用高效液相色谱法(HPLC),以梯度洗脱的方式同时测定上述6种成分的含量,以期为完善杜仲补天素片质量标准提供依据。
1 材料
1.1 仪器
2695型HPLC仪,包括自动进样器、Empower Pro色谱工作站、G1315B可变波长检测器(美国Waters公司);Tu-1901型紫外可见分光光度计(北京普析通用仪器有限责任公司);BT25S型十万分之一电子分析天平[赛多利斯科学仪器(北京)有限公司);KQ-100DB型数控超声仪(昆山市超声仪器有限公司,功率:100 W,频率:40 kHz)。
1.2 药品与试剂
杜仲补天素片(贵州汉方药业有限公司,批号:1502114、1503108、1504123,规格:0.27 g/片);麦角甾苷对照品(批号:22323-52-0,纯度:98.0%)、茯苓酸对照品(批号:29070-92-6,纯度:98.0%)均购于成都曼思特生物科技有限公司;吉奥诺苷B1对照品(批号:120406-37-3,纯度:98.0%)、去氢土莫酸对照品(批号:6754-16-1,纯度:99.0%)均购于成都普瑞法科技开发有限公司;猪苓酸C对照品(批号:465-18-9,纯度:98.0%)、去氢茯苓酸对照品(批号:77012-31-8,纯度:98.0%)均购于南京森贝伽生物科技有限公司;乙腈为色谱纯,磷酸为分析纯,水为超纯水。
1.3 药材
熟地黄、茯苓、杜仲、菟丝子、肉苁蓉、远志、当归、莲子、泽泻、牡丹皮、白芍、淫羊藿、黄芪、山药、白术、陈皮、砂仁、女贞子、金樱子、山茱萸、巴戟天、柏子仁、党参、枸杞子、甘草等药材均购于吉林省北药药材加工有限公司,经吉林农业大学中药材学院何忠梅副教授鉴定为真品,同时按照2015年版《中国药典》(一部)相关标准[3]检验均符合质量标准规定。
2 方法与结果
2.1 色谱条件
色谱柱:Kromasil C18(250 mm×4.6 mm,5µm);流动相:乙腈(A)-0.2%磷酸溶液(B),梯度洗脱(0~11 min,21.0%A;11~27 min,21.0%→34.0%A;27~48 min,34.0%→65.0%A;48~56 min,65.0→21.0%A);流速:0.8 mL/min;检测波长:330 nm[3,5](0~27 min,麦角甾苷和吉奥诺苷B1)、210 nm[6](27~56 min,去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸);柱温:35℃;进样量:10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 分别精密称取麦角甾苷对照品7.42 mg、吉奥诺苷B1对照品8.70 mg、去氢土莫酸对照品7.72 mg、猪苓酸C对照品10.10 mg、去氢茯苓酸对照品8.40 mg和茯苓酸对照品8.74 mg,分别置于不同的10 mL量瓶中,加甲醇溶解并定容,摇匀,即得各待测成分的单一对照品贮备液。再分别取麦角甾苷对照品贮备液5.0 mL、吉奥诺苷B1对照品贮备液2.0 mL、去氢土莫酸对照品贮备液2.5 mL、猪苓酸C对照品贮备液1.0 mL、去氢茯苓酸对照品贮备液1.5 mL和茯苓酸对照品贮备液5.0 mL,置于同一100 mL量瓶中,加甲醇定容,摇匀,即得混合对照品溶液。
2.2.2 供试品溶液 取样品适量,除去包衣层,研成细粉,精密称取4.0 g,置于100 mL锥形瓶中,精密加甲醇50 mL,称定质量,超声处理60 min,放冷;再次称定质量,加甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.3 阴性对照溶液 按样品的制备工艺和配方比例,分别制备缺熟地黄和茯苓的单一阴性样品,再按“2.2.2”项下方法制备单一阴性对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,各成分均能达到基线分离,分离度>2.0;理论板数分别以麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸、茯苓酸峰计均≥3 000,保留时间分别为16.6、21.5、32.6、34.8、37.6、43.1 min。

图1 高效液相色谱图Fig 1 HPLC chromatograms
2.4 线性关系考察
精密量取“2.2.1”项下混合对照品溶液各0.1、0.2、0.5、1.0、1.5、2.0 mL,分别置于20 mL量瓶中,加甲醇定容,摇匀,即得系列混合对照品溶液。取上述系列混合对照品溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程与线性范围,详见表1。

表1 回归方程与线性范围Tab 1 Regression equation and linear ranges
2.5 定量限与检测限考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得定量限(LOQ);当信噪比为3∶1时,得检测限(LOD)。结果,麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸的LOQ分别为0.322、0.187、0.105、0.381、0.214、0.452µg/mL;LOD分别为0.108、0.059、0.032、0.131、0.072、0.149µg/mL。
2.6 精密度试验
取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件重复进样测定6次,记录峰面积。结果,麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸峰面积的RSD分别为1.02%、0.99%、1.10%、1.17%、0.93%、0.86%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(批号:1502114)适量,分别于室温下放置0、2、4、8、12 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸峰面积的RSD分别为0.83%、0.95%、1.02%、1.07%、0.99%、0.88%(n=5),表明供试品溶液在室温放置12 h内稳定性良好。
2.8 重复性试验
取样品(批号:1502114)6份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算含量。结果,麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸平均含量分别为0.483、0.211、0.227、0.116、0.160、0.571 mg/g,RSD分别为1.08%、1.06%、0.96%、1.01%、1.12%、0.97%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取已知含量的样品(批号:1502114)适量,共6份,每份约2.0 g,分别置于25 mL量瓶中,加甲醇适量,再加入一定质量的待测成分对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。

表2 加样回收率试验结果(n=6)Tab 2 Results of recovery test(n=6)
2.10 样品含量测定
取3批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸的含量,结果见表3。
表3 样品含量测定结果(s,n=3,mg/g)Tab 3 Results of contents determination of samples(s,n=3,mg/g)
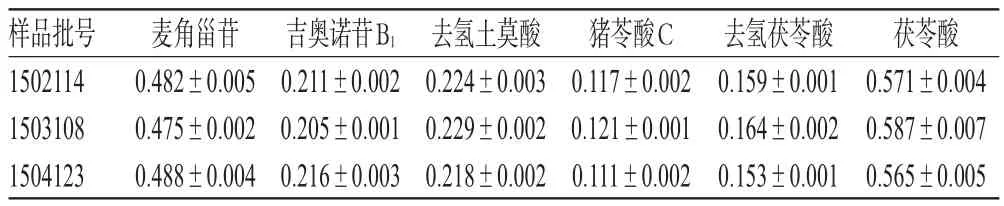
表3 样品含量测定结果(s,n=3,mg/g)Tab 3 Results of contents determination of samples(s,n=3,mg/g)
样品批号1502114 1503108 1504123麦角甾苷0.482±0.005 0.475±0.002 0.488±0.004吉奥诺苷B10.211±0.002 0.205±0.001 0.216±0.003去氢土莫酸0.224±0.003 0.229±0.002 0.218±0.002猪苓酸C 0.117±0.002 0.121±0.001 0.111±0.002去氢茯苓酸0.159±0.001 0.164±0.002 0.153±0.001茯苓酸0.571±0.004 0.587±0.007 0.565±0.005
3 讨论
3.1 提取时间的选择
以待测成分的提取率为指标,对不同超声提取时间(30、60、90 min)进行对比试验,结果超声提取60 min和90 min,所测各成分提取效果差异不大,但都明显高于超声提取30 min所测各成分含量,为了节约试验时间,故本试验选取60 min作为超声提取的最佳时间。
3.2 检测波长的选择
取“2.2.1”项下单一对照品贮备液各适量,在190~400 nm波长范围内进行紫外扫描。结果表明,麦角甾苷和吉奥诺苷B1在330 nm波长处有最大吸收,去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸在210 nm波长处有最大吸收,故麦角甾苷和吉奥诺苷B1检测波长定为330 nm,去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸检测波长定为210 nm。
3.3 流动相的选择
笔者在试验过程中分别采取乙腈-0.05%磷酸溶液[7-8]、乙腈-0.1%乙酸溶液、乙腈-0.2%甲酸溶液[9]、乙腈-0.2%磷酸溶液[10]以不同比例进行梯度洗脱,以待测成分的出峰时间、峰形和分离度效果为评价指标进行综合评价,优选最佳的检测流动相体系。结果,乙腈-0.05%磷酸溶液按不同比例进行梯度洗脱时,麦角甾苷和吉奥诺苷B1分离效果较好,但去氢土莫酸和猪苓酸C达不到有效分离;乙腈-0.1%乙酸溶液按不同比例进行梯度洗脱时,去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸能有效分离,但麦角甾苷峰形较差,拖尾现象严重;以乙腈-0.2%甲酸溶液按不同比例进行梯度洗脱时,去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸分离度均能达到要求,但吉奥诺苷B1与其他杂质峰达不到有效分离;乙腈-0.2%磷酸溶液按照“2.1”项下比例进行梯度洗脱时,各待测成分色谱峰的出峰时间、峰形和分离度效果较好,故选择乙腈-0.2%磷酸溶液为本试验的流动相。
3.4 耐用性试验
取“2.2.2”项下供试品溶液(批号:1502114)适量,分别采用 Diamonsil C18(250 mm×4.6 mm,5µm)、Kromasil C18(200 mm×4.6 mm,5µm)和 Kromasil C18(250 mm×4.6 mm,5µm)进行对比研究。结果,采用Diamonsil C18(250 mm×4.6 mm,5µm)进行试验时,所测成分吉奥诺苷B1与其他峰分离效果较差;采用Kromasil C18(200 mm×4.6 mm,5µm)进行试验时,所测成分去氢土莫酸和猪苓酸C达不到有效分离;采用Kromasil C18(250 mm×4.6 mm,5µm)进行试验时,所测成分均能达到有效分离,故最终采用kromasil C18(250 mm×4.6 mm,5µm)进行试验。
综上所述,本方法操作简便、快速、准确,可用于杜仲补天素片中麦角甾苷、吉奥诺苷B1、去氢土莫酸、猪苓酸C、去氢茯苓酸和茯苓酸含量的同时测定。
[1] 卫生部药典委员会.中华人民共和国卫生部药品标准:中药成方制剂:第12册[M].北京:人民卫生出版社,1997:64-65.
[2] 国家药典委员会.中华人民共和国药典:四部[M].2015年版.北京:中国医药科技出版社,2015:3、38、59、374.
[3]邬兰,王金波,邓媛媛,等.HPLC-ELSD法测定不同产地茯苓中茯苓酸的含量[J].中国药师,2011,14(11):1568-1570.
[4] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:27-29、45-46、81-82、86-87、103-105、125-126、133-136、156-157、165、172、191、221、229、240、247、253、273、281、302、309、327-328.
[5] 许浩,邹超,田永富.女科十珍丸中梓醇、麦角甾苷、吉奥诺苷B1和α-香附酮的定量测定研究[J].中南药学,2016,14(2):186-189.
[6] 李蒙,王光忠,聂磊,等.茯苓不同部位中茯苓酸含量比较研究[J].时珍国医国药,2015,26(12):2858-2860.
[7] 刘校妃,李健康,唐怡,等.茯苓中去氢土莫酸和茯苓酸含量的高效液相色谱波长切换法同时测定[J].时珍国医国药,2016,27(3):516-518.
[8] 张靓琦,贾英,罗洁,等.超高效液相色谱法同时测定茯苓中去氢土莫酸等6种活性成分的含量[J].中国药学杂志,2012,47(13):1080-1083.
[9] 陈香玲,陈红军.高效液相色谱法同时测定八珍益母胶囊中10种活性成分含量[J].中南药学,2016,14(3):306-309.
[10] 车爽,李清,霍艳双,等.波长转换RP-HPLC法同时测定茯苓不同部位中5种三萜酸含量[J].药学学报,2010,45(4):494-497.
Simultaneous Determination of 6 Components in Duzhong Butiansu Tablet by HPLC
LI Yunjing1,HE Zhongmei2(1.College of Bioengineering,Jilin Engineering Vocational College,Jilin Siping 136001,China;2.College of Traditional Chinese Medicinal Materials,Jilin Agricultural University,Changchun 130117,China)
OBJECTIVE:To establish a method for the simultaneous determination of acteoside,jionoside B1,dehydrotumulosic acid,polyporenic acid C,dehydropachymic acid and pachymic acid in Duzhong butiansu tablet.METHODS:HPLC was performed on the column of Kromasil C18with mobile phase of acetonitrile-0.2%phosphate acid(gradient elution)at a flow rate of 0.8 mL/min,the detection wavelength was 330 nm for acteoside and jionoside B1,210 nm for dehydrotumulosic acid,polyporenic acid C,dehydropachymic acid and pachymic acid,the column temperature was 35℃,and the injection volume was 10 μL.RESULTS:The linear range was 3.71-74.20 μg/mL for acteoside(r=0.999 9),4.35-87.00 μg/mL for jionoside B1(r=0.999 5),3.86-77.20 μg/mL for dehydrotumulosic acid(r=0.999 9),5.05-101.00 μg/mL for polyporenic acid C(r=0.999 1)and 4.20-84.00 μg/ mL for dehydropachymic acid(r=0.999 7)and 4.73-87.40 μg/mL for pachymic acid(r=0.999 6);the limits of qu-antification were 0.322,0.187,0.105,0.381,0.214,0.452 μg/mL,and the limits of detection were 0.108,0.059,0.032,0.131,0.072,0.149 μg/mL;RSDs of precision,stability and reproducibility tests were lower than 2.0%;recoveries were 96.20%-99.53%(RSD=1.23%,n=6),96.99%-100.67%(RSD=1.47%,n=6),96.64%-100.08%(RSD=1.28%,n=6),97.47%-100.59%(RSD=1.18%,n=6),97.97%-100.83%(RSD=1.25%,n=6)and 96.81%-99.61%(RSD=1.09%,n=6).CONCLUSIONS:The method is simple,rapid,accurate,and can be used for the simultaneous determination of acteoside,jionoside B1,dehydrotumulosic acid,polyporenic acid C,dehydropachymic acid and pachymic acid in Duzhong butiansu tablet.
HPLC;Duzhong butiansu tablet;Acteoside;Jionoside B1;Dehydrotumulosic acid;Polyporenic acid C;Dehydropachymic acid;Pachymic acid;Content determination
R917
A
1001-0408(2017)03-0401-04
2016-01-30
2016-10-09)
(编辑:刘 柳)
吉林省科技发展计划项目(No.20140311029YY)
*副教授,硕士。研究方向:生物制药、发酵技术、药用酶生产与教学工作。E-mail:523882748@qq.com
#通信作者:副教授,硕士生导师,博士。研究方法:中药有效成分作用机制及产品开发。E-mail:hezhongmei1978@163.com
DOI10.6039/j.issn.1001-0408.2017.03.32
