PHH3在胰腺神经内分泌肿瘤中的表达及其意义
2017-02-20韩换蒋慧郑建明
韩换 蒋慧 郑建明
·论著·
PHH3在胰腺神经内分泌肿瘤中的表达及其意义
韩换 蒋慧 郑建明
目的 检测磷酸化组蛋白H3(PHH3)在胰腺神经内分泌肿瘤(PNENs)中的表达,探讨其对PNENs病理分级的意义。方法 回顾性分析2000年12月至2016年5月长海医院收治的283例PNENs患者的临床病理资料,将所有PNENs组织制成组织芯片,采用免疫组织化学方法检测PHH3、Ki67的表达。通过绘制PHH3的受试者工作特征曲线,计算曲线下面积,确定PHH3对PNENs分级的临界值。同时按国内外公认标准依据Ki67对PNENs进行分级。分析并比较PHH3、Ki67两种分级方法与PNENs临床病理特征、预后及两者之间的相关性。结果 本研究共纳入PNENs患者283例,其中男性132例,女性151例,年龄16~78岁,平均(50±1)岁;功能性PNENs 44例,无功能性PNENs 239例;肿瘤直径1.1~17 cm,平均(4.1±1.2)cm。PHH3法将283例患者分为G1级118例,G2级119例,胰腺神经内分泌瘤(PNET)G3级38例,胰腺神经内分泌癌(PNEC)G3级8例;Ki67法分为G1级127例,G2级116例,PNET G3级33例,PNEC G3级7例。两种分级方法呈正相关关系(r=0.941,P<0.001)。PHH3表达及PNENs分级均与患者的年龄、性别及肿瘤有无功能、肿瘤部位无相关性(P值均>0.05),而与肿瘤大小、组织学分级、淋巴结转移、TNM分期及患者预后呈正相关(P值均<0.05)。每例组织芯片免疫组织化学染色后观察PHH3的平均时间为9 min,观察Ki67的平均时间为45 min。结论 检测PNENs的PHH3表达可对PNENs进行病理诊断分级和预后评估,较Ki67分级法更准确和更便捷。
胰腺肿瘤; 神经内分泌瘤; PHH3; 免疫组织化学
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, PNENs)是起源于肽能神经元和神经内分泌细胞的异质性肿瘤[1]。目前国内对于PNENs的病理诊断分级标准主要依据2010版WHO消化系统肿瘤分类指南[2]和2013版中国胃肠胰神经内分泌肿瘤病理诊断共识[3]。其中细胞增殖活性抗原Ki67是PNENs病理诊断分级的主要标志物,但存在计算方法繁杂、耗时、准确度低等缺点,因此迫切需要寻找方便、有效的新指标。磷酸化组蛋白 H3(phospho-histone H3,PHH3)是真核细胞染色质的主要构成蛋白之一,在有丝分裂期(M期)表达水平最高,是一种特异性核分裂标志物[4-5]。在挤压变形组织中,PHH3可有效区别核碎裂或凋亡细胞。本研究采用组织芯片和免疫组织化学SP法检测PNENs的PHH3、Ki67表达,分析并比较它们与临床病理参数及预后的相关性,探讨PHH3作为PNENs病理诊断分级指标的可行性。
资料与方法
一、临床资料
收集2000年12月至2016年5月第二军医大学附属长海医院收治的PNENs患者临床病理资料,诊断符合上述WHO分类和国内共识标准。入组标准:(1)首次诊断为PNENs;(2)术前未经其他方式治疗。排除标准:(1)混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC);(2)合并胰腺导管腺癌及其他类型肿瘤;(3)随访时间不足4个月者;(4)术前1周至术后1周内围手术期死亡者。所有病例均由两位高年资病理医师重新复片、诊断分级,同时根据肿瘤是否具有激素分泌功能和有无出现激素引起的临床症状,将PNENs分为功能性和无功能性。
二、观察细胞核分裂象
观察核分裂象(mitotic figure,MF)的方法:(1)多在肿瘤近表部取组织块,因近表部肿瘤新生能力强;(2)勿在切片的出血、坏死边缘,血管内皮细胞,淋巴滤泡生发中心等区域计数MF;(3)选取细胞染色清晰,无刀痕区域,采取一字回纹或上下螺纹式法观察。选取10个高倍视野(high power field,HPF)对MF计总数。
三、Ki67、PHH3蛋白的表达检测
取283例石蜡包埋的肿瘤组织标本,采用手工方法在组织芯片制作仪(韩国UNITMA公司)上制作组织芯片。首先在免疫组织化学切片上标记Ki67阳性点,然后在相对应的蜡块上取样,取样直径均2 mm,每个蜡块取样3个点,组织芯片间距1.5 mm。
采用免疫组织化学染色SP法在组织芯片上检测Ki67、PHH3蛋白表达。浓缩型兔抗人PHH3单克隆抗体购自福州迈新公司,工作浓度1∶50;浓缩型兔抗人Ki67单克隆抗体购自上海杰浩生物公司,工作浓度1∶100;即用型HRP标记的羊抗兔/鼠二抗购自上海杰浩生物公司。以PBS代替一抗作为阴性对照,用已知的阳性对照切片作为阳性对照。
胞核呈暗褐色或棕黄色颗粒状着色为阳性表达。在40倍高倍镜下计数10个视野(10HPF)的PHH3阳性细胞数,取总数;在低倍镜下取阳性率最高的区域,计数500~2 000个肿瘤细胞中Ki67阳性细胞数,计算阳性细胞百分比。PHH3、Ki67免疫组织芯片均由两位病理医师独立计数诊断。
四、随访
通过电话及门诊问询方式进行随访,随访截止时间为2016年5月31日。总生存期(overall survival,OS)定义为肿瘤确诊后至患者死亡或至随访截止仍存活的时间。无瘤生存期(disease-free survival,DFS)定义为肿瘤确诊后至肿瘤复发或至随访截止仍未复发的时间。
五、统计学处理
采用SPSS22.0统计分析软件进行数据分析。连续型变量若满足正态分布和方差齐性,则采用t检验,否则采用非参数Mann-WhitneyU检验;分类变量比较采用χ2检验或Fisher确切概率法;生存分析采用Kaplan-Meier法,组间比较采用log-rank检验;两变量之间的相关性采用Spearmen等级相关分析。绘制PHH3受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve, AUC),确定对PNENs分级的临界值。P<0.05为差异有统计学意义。
结 果
一、临床资料
本研究共纳入PNENs患者283例,其中男性132例,女性151例,年龄16~78岁,平均(50±1)岁;功能性PNENs 44例,无功能性PNENs 239例;肿瘤直径1.1~17 cm,平均(4.1±1.2)cm。
二、Ki67法的PNENs分级
每张组织芯片的免疫组织化学染色切片观察Ki67平均耗时45 min。参考共识标准对PNENs进行分级,≤2%为G1级,3%~20%为G2级,21%~60%为胰腺神经内分泌瘤(PNET)G3级,>60%为胰腺神经内分泌癌(PNEC) G3级。本组G1级(图1A)127例,G2级(图1B)116例,PNET G3级33例,PNEC G3级7例。
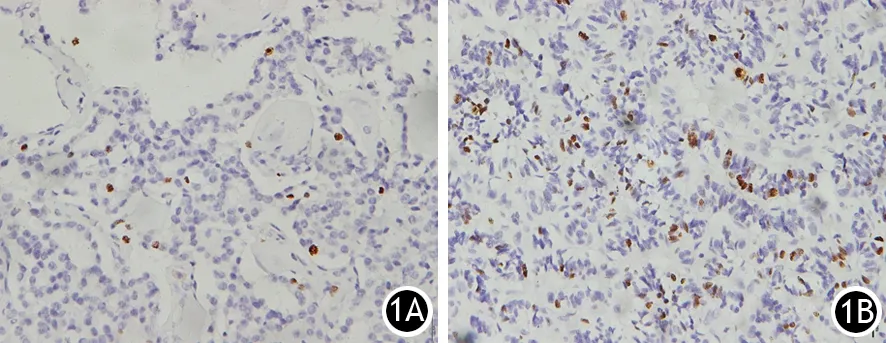
图1 Ki67分级的PNENs G1级(1A)和G2级(1B)(SP ×400)
三、PHH3法PNENs分级标准的确定
每张组织芯片的免疫组织化学染色切片观察PHH3平均耗时9 min。PHH3的ROC曲线见图2。依据约登指数(G1与G2最大值0.992、G2与PNET G3最大值0.982、PNET G3与PNEC G3最大值1)和AUC面积(G1与G2为0.991,G2与PNET G3为0.999,PNET G3与PNEC G3为1.000),分别选取10HPF下5、29和70个核分裂象作为G1和G2期,G2和PNET G3期,PNET G3和PNEC G3期的临界值。按此PHH3标准,本组G1级(图2A)118例,G2级(图2B)119例,PNET G3级38例,PNEC G3级8例。PHH3法PNENs分级与Ki67法的分级呈正相关关系(r=0.941,P<0.001)。
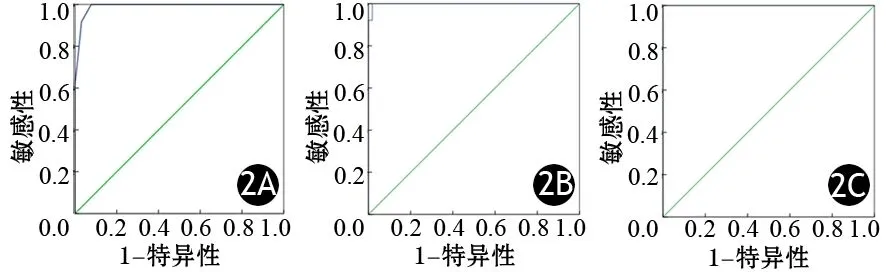
图2 PHH3的ROC曲线,G1与G2(2A)、G2与PNET G3(2B)、PNET G3与PNEC G3(2C)
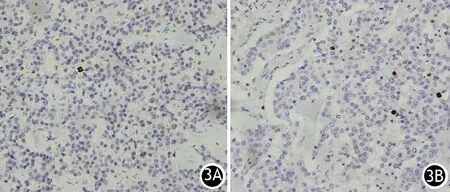
图3 PHH3分级的PNENs G1级(3A)和G2级(3B)(SP ×400)
四、PNENs组织PHH3、Ki67表达与临床病理特征之间的关系
PNENs组织PHH3、Ki67表达与患者的年龄、性别及肿瘤有无功能、肿瘤部位均无相关性(P值均>0.05),而与肿瘤直径、组织学分级、淋巴结转移及TNM分期均呈正相关(P值均<0.05,表1)。
五、生存期分析
283例PNENs患者中34例(12%)失访,249例(88%)获得随访,随访时间为4~166个月,中位时间为42个月。PHH3、Ki67分级患者的术后OS及术后DFS曲线见图4、5。PHH3、Ki67的PNENs分级均能够很好地预测患者的预后。
讨 论
PNENs的发病率逐年升高,从1973至1977年的0.17/10万上升到2003至2007年的0.43/10万,其原因可能与对PNENs认识的提高以及内镜和影像检查技术的发展有关[6-7]。细胞增殖活性与PNENs的恶性程度密切相关,根据肿瘤细胞增殖活性来划分PNENs恶性程度已被国内外广泛接受,但是根据肿瘤增殖指数Ki67和核分裂象对PNENs分级有明显的缺点:(1)计算复杂。核分裂象计数单位为2 mm2,相当于20 mm目镜的10个高倍镜视野;若采用其他孔径的目镜,则需进行相应换算[8],步骤繁复。(2)可重复性差。早期的核分裂象很难识别且易与凋亡小体、坏死细胞及核碎片相混淆[9-10],因此医师主观因素对结果的影响较大。(3)计数耗时长。需在镜下500~2 000个细胞中数出其中Ki67阳性的细胞数,并且要排除淋巴细胞和其他非肿瘤细胞,无论是手动还是自动计数,每个病例至少需要耗时15 min。(4)特异性不高。Ki67不仅能从M期的细胞检出,也能从S、G1、G2期的细胞中检出[11],因此其不能真正反应细胞的增殖指数。
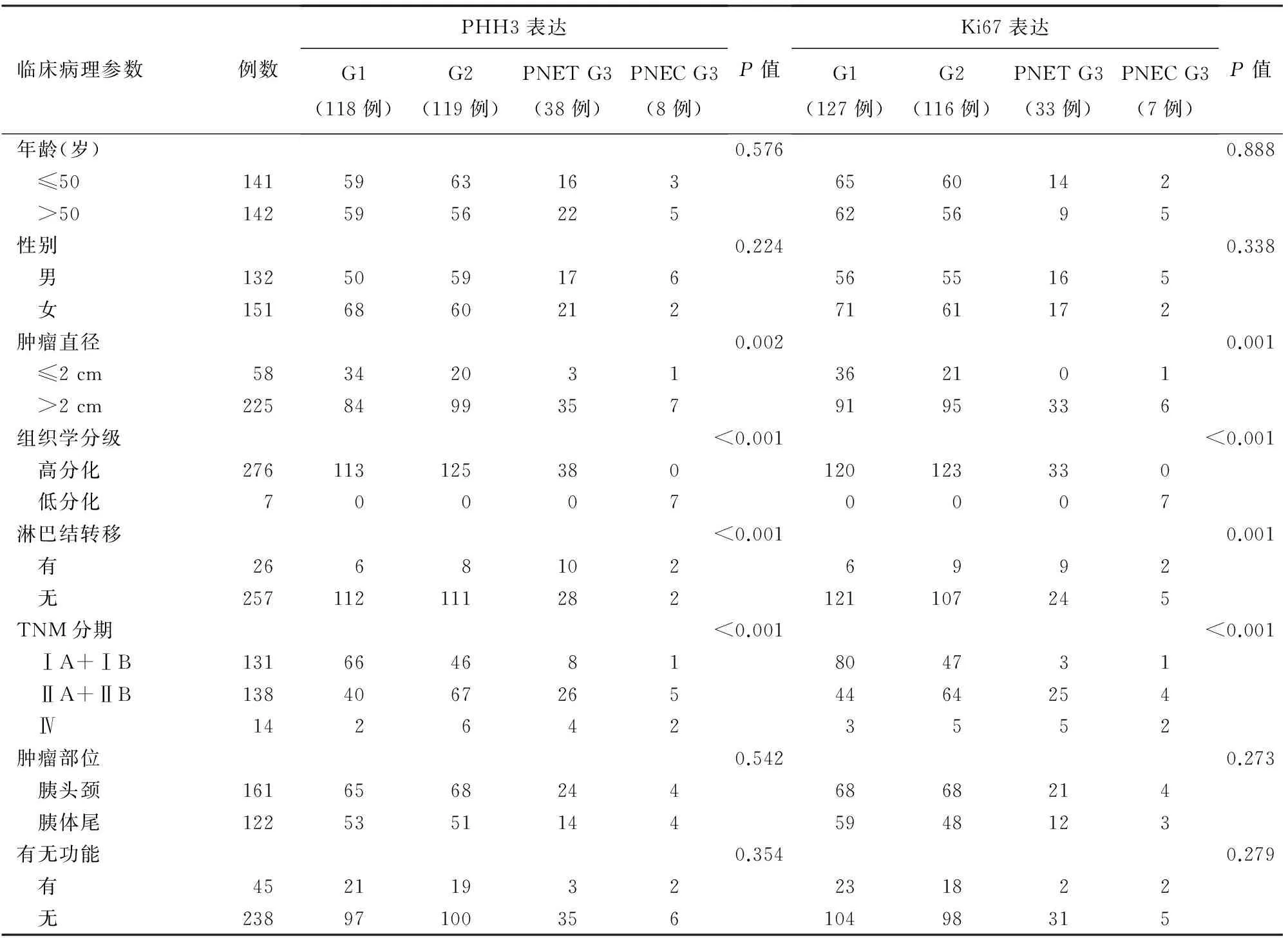
表1 PHH3和Ki67在PNENs患者中的表达及其与临床病理参数的关系
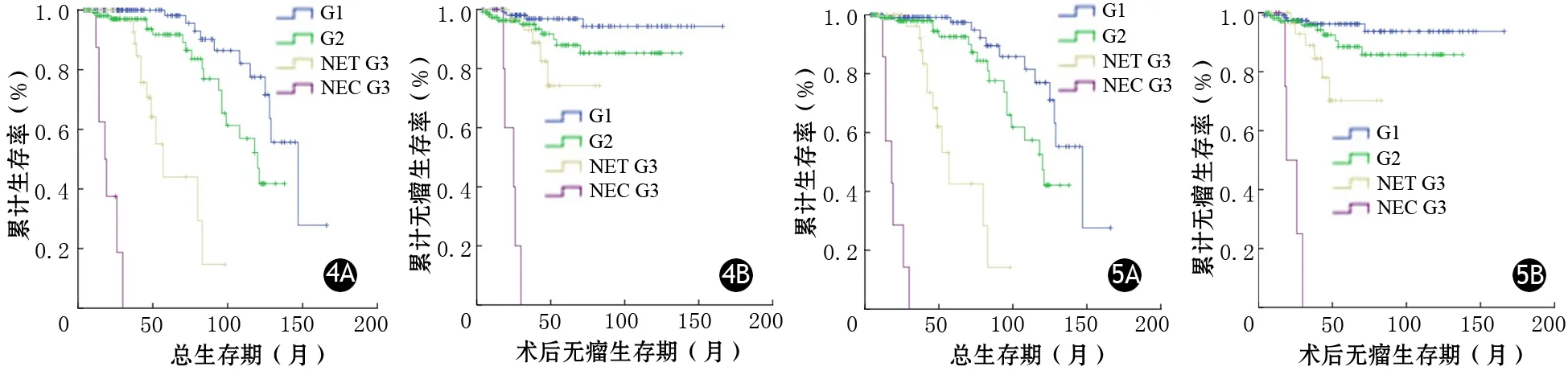
图4 PHH3分级的PNENs患者OS(4A)和DFS(4B)曲线 图5 Ki67分级的PNENs患者OS(5A)和DFS(5B)曲线
1997年Hendzel等[12]首先提出PHH3作为核分裂的标志物,此后关于PHH3的研究不断增加。PHH3是新近发现的5个核心组蛋白之一,在真核细胞中与其他组蛋白共同构成染色质中主要的蛋白组分[13]。
本研究建立了PHH3法PNENs的分级标准,结果显示PHH3法与Ki67法的分级呈正相关。两种分级方法均显示与患者的年龄、性别及肿瘤有无功能、肿瘤部位无相关性,而与肿瘤直径、组织学分级、淋巴结转移、TNM分期呈正相关。两种分级在G1、G2、PNET G3、PNEC G3级患者之间的预后差异均具有统计学意义。
采用PHH3法分级的优势:(1)高分辨率和准确率。特异性染色M期细胞的PHH3能够消除在HE染色下含糊不清的核分裂计数,明显区分核分裂象和凋亡小体,不同观察者之间的差异性不大[14]。(2)高效省时。在低倍镜下可很快找到PHH3 标记的核分裂热点区域,大大缩短计数核分裂的时间,平均每例只需耗时3 min。(3)判断生物学行为。 PHH3特异性染色核分裂象能更加准确地预示肿瘤生物学行为,现已经用于评估脑膜瘤、星形细胞瘤、黑色素瘤、肺类癌以及子宫内膜癌等多种肿瘤细胞的增殖活性[14-19]。因此,检测PNENs组织中PHH3的表达对其病理诊断分级、临床治疗以及预后判断具有重要临床应用价值,但这一结果有待于更多研究中心的验证。
[1] Reid MD, Balci S, Saka B, et al. Neuroendocrine tumors of the pancreas: current concepts and controversies[J]. Endocr Pathol, 2014, 25(1): 65-79.DOI: 10.1007/s12022-013-9295-2.
[2] Farrell JM, Pang JC, Kim GE, et al. Pancreatic neuroendocrine tumors: accurate grading with Ki67 index on fine-needle aspiration specimens using the WHO 2010/ENETS criteria[J]. Cancer Cytopathol, 2014, 122(10): 770-778.DOI: 10.1002/cncy.21457.
[3] 中国胃肠胰神经内分泌肿瘤病理诊断共识专家组: 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志, 2013, 42(10): 691-694.DOI: 10.3760/cma.j.issn.0529-5807.2013.10.011.
[4] Wei Y, Mizzen CA, Cook RG, et al. Phosphorylation of histone H3 at serine 10 is correlated with chromosome condensation during mitosis and meiosis in Tetrahymena[J]. Proc Natl Acad Sci U S A, 1998, 95(13): 7480-7484.
[5] Schimming TT, Grabellus F, Roner M, et al. pHH3 immunostaining improves interobserver agreement of mitotic index in thin melanomas[J]. Am J Dermatopathol, 2012, 34(3): 266-269.DOI: 10.1097/DAD.0b013e31823135a3.
[6] Lawrence B, Gustafsson BI, Chan A, et al. The epidemiology of gastroenteropancreatic neuroendocrine tumors[J]. Endocrinol Metab Clin North Am, 2011, 40(1):1-18.DOI: 10.1016/j.ecl.2010.12.005.
[7] Kuo JH, Lee JA, Chabot JA. Nonfunctional pancreatic neuroendocrine tumors[J]. Surg Clin North Am, 2014, 94(3): 689-708.DOI: 10.1016/j.suc.2014.02.010.
[8] Tang LH, Gonen M, Hedvat C, et al. Objective quantification of the Ki67 proliferative index in neuroendocrine tumors of the gastroenteropancreatic system: a comparison of digital image analysis with manual methods[J]. Am J Surg Pathol, 2012, 36(12): 1761-1770.DOI: 10.1097/PAS.0b013e318263207c.
[9] McCall CM, Shi C, Cornish TC, et al. Grading of well-differentiated pancreatic neuroendocrine tumors is improved by the inclusion of both Ki67 proliferative index and mitotic rate[J]. Am J Surg Pathol, 2013, 37(11): 1671-1677.DOI: 10.1097/PAS.0000000000000089.
[10] Yang Z, Tang LH, Klimstra DS, et al. Gastroenteropancreatic neuroendocrine neoplasms: historical context and current issues[J]. Semin Diagn Pathol, 2013, 30(3): 186-196. DOI: 10.1097/PAS.0000000000000089.
[11] Gerdes J, Lemke H, Baisch H, et al. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki67[J]. J Immunol, 1984, 133(4): 1710-1715.
[12] Hendzel MJ, Wei Y, Mancini MA, et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation[J]. Chromosoma, 1997, 106(6): 348-360.DOI: 10.1007/s004120050256.
[13] Shin Y, Hyeon J, Lee B, et al. PHH3 as an Ancillary Mitotic Marker in Gastrointestinal Stromal Tumors[J]. J Pathol Transl Med, 2015, 49(1): 23-29.DOI: 10.4132/jptm.2014.10.08.
[14] Colman H, Giannini C, Huang L, et al. Assessment and prognostic significance of mitotic index using the mitosis marker phospho-histone H3 in low and intermediate-grade infiltrating astrocytomas[J]. Am J Surg Pathol, 2006, 30(5): 657-664.DOI: 10.1097/01.pas.0000202048.28203.25.
[15] Ribalta T, McCutcheon IE, Aldape KD, et al. The mitosis-specific antibody anti-phosphohistone-H3 (PHH3) facilitates rapid reliable grading of meningiomas according to WHO 2000 criteria[J]. Am J Surg Pathol, 2004, 28(11): 1532-1536.
[16] Casper DJ, Ross KI, Messina JL, et al. Useof anti-phosphohistone H3 immunohistochemistry to determine mitotic rate in thin melanoma[J]. Am J Dermatopathol, 2010, 32(7): 650-654.DOI: 10.1097/DAD.0b013e3181cf7cc1.
[17] Nasr MR, El-Zammar O. Comparison of pHH3, Ki67, and survivin immunoreactivity in benign and malignant melanocytic lesions[J]. Am J Dermatopathol, 2008, 30(2): 117-122.DOI: 10.1097/DAD.0b013e3181624054.
[18] Tamimi TIA-R, Elgouhari HM, Alkhouri N, et al. An apoptosis panel for nonalcoholic steatohepatitis diagnosis[J]. J Hepatol, 2011, 54(6): 1224-1229.DOI: 10.1097/DAD.0b013e3181624054.
[19] Brunner A, Riss P, Heinze G, et al. pHH3 and survivin are co-expressed in high-risk endometrial cancer and are prognostic relevant[J]. Br J Cancer, 2012, 107(1): 84-90.DOI: 10.1038/bjc.2012.198.
(本文编辑:冀凯宏)
Expression and significance of PHH3 in pancreatic neuroendocrine neoplasms
HanHuan,JiangHui,ZhengJiangming.
DepartmentofPathology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
ZhengJiangming,Email:Jmzheng1962@163.com
Objective To investigate the expression of phospho-histone H3(PHH3) protein in pancreatic neuroendocrine neoplasms (PNENs) and explore its potential value for pathological grading of PNENs. Methods Clinical and pathological data of 283 patients with PNENs treated in Changhai Hospital from December 2000 to May 2016 were retrospectively analyzed. PNENs tissue chip was prepared, and immunohistochemistry was used to examine the expression of PHH3 and Ki67. The receiver operating characteristic curve for PHH3 was drawn and the area under the curve(AUC) was calculated to determine the cutoff value for PNENs grading. Ki67 was used for PNENs grading according to domestic and international criteria for PNENs classification. The relationship of PHH3 and Ki67 classification with clinical pathological features and prognosis of PNENs as well as the correlation between the two classification methods were analyzed. Results Of 283 patients, 132 were male and 151 were female, aged from 16 to 78 years old. The average age was (50±1) years old. There were 44 cases with functional PNENs and 239 with non-functional PNENs. The diameter of tumors ranged from 1.1 cm to 17 cm and the average diameter was (4.1±1.2)cm. According to the Ki67 standard, there were 127, 116, 33 and 7 cases of Grade G1, G2, pancreatic neuroendocrine tumor(PNET) G3 and pancreatic neuroendocrine cancer(PNEC) G3. According to the PHH3 positive correlation between the two grading criteria (r=0.941,P<0.001). PHH3 expression and PNENs grading were not correlated with age, gender, tumor functional or not and tumor locations (allP>0.05), but were both positively correlated with tumor size, histological grade, lymph node metastasis, TNM stage and prognosis (allP<0.05). The average time of observing PHH3 and Ki67 staining per case in the immunohistochemistry of tissue chip was 9 min and 45 min, respectively. Conclusions Detection of PHH3 expression in PNENs can be used for the pathological diagnosis, grading and prognostic evaluation, which was more accurate and convenient than Ki67 criteria.
Pancreatic neoplasms; Neuroendocrine tumors; Phospho-histone H3; Immunohistochemistry
10.3760/cma.j.issn.1674-1935.2017.01.005
200433 上海,第二军医大学长海医院病理科
郑建明,Email: Jmzheng1962@163.com
2016-11-14)
