IL-18对胰腺星状细胞及其趋化因子CX3CL1表达的影响
2017-02-20王茜陈浩宇陈洁
王茜 陈浩宇 陈洁
·论著·
IL-18对胰腺星状细胞及其趋化因子CX3CL1表达的影响
王茜 陈浩宇 陈洁
目的 观察IL-18对胰腺星状细胞E-钙黏素(E-cadherin)、α-平滑肌肌动蛋白(α-SMA)及趋化因子CX3CL1表达水平的影响。方法 人胰腺星状细胞(PSCs)株HPaSteC常规培养、传代,应用5、25、50、100 μg/L IL-18干预72 h,以未干预细胞为对照组。收集各组细胞,采用RT-PCR和蛋白质印迹法检测细胞E-cadherin、α-SMA、CX3CL1 mRNA及蛋白表达量。结果 对照组及5、25、50、100 μg/L IL-18干预组PSCs的E-cadherin mRNA表达量分别为1.03±0.17、0.77±0.15、0.89±0.12、0.54±0.11、0.46±0.06;α-SMA mRNA表达量为1.03±0.19、0.85±0.14、1.33±0.22、1.60±0.14、1.94±0.09;CX3CL1 mRNA表达量为1.01±0.08、0.88±0.25、0.86±0.17、1.58±0.26、1.83±0.13。干预组E-cadherin mRNA的表达下调,α-SMA及CX3CL1mRNA表达上调,其中100 μg/L干预组与对照组的差异均有统计学意义(P<0.05或<0.01)。对照组及5、25、50、100 μg/L IL-18干预组PSCs的E-cadherin蛋白表达量分别为1.00±0.14、1.14±0.04、1.14±0.07、0.85±0.08、0.80±0.06;α-SMA蛋白表达量为1.00±0.02、0.77±0.07、1.29±0.02、1.59±0.07、1.70±0.02;CX3CL1蛋白表达量分别为1.00±0.05、1.03±0.05、1.37±0.06、1.46±0.18、1.45±0.12。干预组E-cadherin蛋白表达下调,但各组间的差异无统计学意义;α-SMA蛋白表达上调,25、50、100 μg/L IL-18干预组与对照组的差异有统计学意义(P值均<0.01);CX3CL1蛋白表达上调,其中100 μg/L干预组与对照组的差异有统计学意义(P<0.05)。结论 IL-18能激活人PSCs并上调PSCs趋化因子CX3CL1的表达。
胰腺; 星形细胞; 胰腺炎,慢性; 趋化因子CX3CL1; 白细胞介素18
Fund program:Youth Science Foundation,National Natural Science Foundation of China(81300352)
胰腺星状细胞(pancreatic stellate cells,PSCs)不仅能分泌多种炎性因子和趋化因子参与炎性过程,而且能分泌胶原,在组织再生和纤维化中发挥关键作用[1]。PSCs一般处于静息状态,不表达α-平滑肌肌蛋白(α-SMA),但被激活后α-SMA表达增加[2]。PSCs的激活是胰腺发生纤维化的主要原因。趋化因子CX3CL1在急性胰腺炎(AP)及慢性胰腺炎(CP)中发挥重要作用。研究发现,急性坏死性胰腺炎大鼠及CP患者的血清CX3CL1水平升高[3]。饮酒的CP患者血清CX3CL1水平升高更显著,因酒精协同刺激PSCs分泌CX3CL1[4],提示血清CX3CL1水平升高可能具有致病作用。IL-18是IL-1家族的细胞因子,有免疫反应调节作用[5]。IL-18作用于Th1细胞,刺激干扰素-γ和其他细胞因子的产生,可能通过激活PSCs和上调趋化因子CX3CL1表达参与CP的胰腺纤维化过程。本研究应用不同浓度IL-18干预PSCs,观察E-钙黏素(E-cadherin)、α-SMA、CX3CL1 mRNA和蛋白表达量的变化,探讨IL-18的作用机制。
材料与方法
一、IL-18干预人PSCs
人PSCs株HPaSteC购自Science Cell公司,常规培养、传代。取对数生长期细胞接种于6孔板,每孔5×105个细胞。培养至细胞融合度达80%后在各孔中分别加入终浓度为5、25、50、100 μg/L的IL-18(Biovision公司),以未干预细胞作为对照组,孵育72 h后收集细胞。
二、E-cadherin、α-SMA、CX3CL1 mRNA表达量的检测
收集IL-18干预72 h的细胞,用TRIzol(Invitrogen公司)提取细胞总RNA,采用RT试剂盒(Fermentas公司)逆转录成cDNA,采用实时PCR法检测各组细胞E-cadherin、α-SMA、CX3CL1 mRNA表达量,按试剂盒说明书进行操作。E-cadherin正义序列5′-ATTTTTCCCTCGACACCCGAT-3′,反义序列5′-TCCCAGGCGTAGACCAAGA-3′,扩增产物109 bp;α-SMA正义序列5′-CTGCTGAGCGTGAGATTGTC-3′,反义序列5′-TCAAGGGAGGATGAGGATGC-3′,扩增产物103 bp;CX3CL1(FKN)正义序列5′-ACCACGGTGTGACGAAATG-3′,反义序列5′-TGTTGATAGTGGATGAGCAAAGC-3′,扩增产物82 bp;内参GAPDH正义序列5′-ACAACTTTGGTATCGTGGAAGG-3′,反义序列5′-GCCATCACGCCACAGTTC-3′,扩增产物101 bp。引物由华大基因设计并合成。PCR反应条件:94℃ 2 min;94℃ 30 s、50℃ 30 s、72℃ 30 s,30个循环。用illumina eco实时荧光定量PCR仪自带软件获得Ct值,以对照组细胞的表达量为1,采用公式2-△△Ct计算IL-18干预组细胞 E-cadherin、α-SMA、CX3CL1 mRNA的相对表达量。实验重复3次,取平均值。
三、E-cadherin、α-SMA、CX3CL1蛋白表达量的检测
收集上述各组细胞,常规提取总蛋白,BCA 法定量蛋白后行蛋白质印迹法检测E-cadherin、α-SMA、CX3CL1蛋白表达量,以Tubulin为内参。小鼠抗人E-cadherin一抗购自Proteintech公司,工作浓度1∶8 000;小鼠抗人α-SMA一抗购自Abcam公司,工作浓度1∶300;小鼠抗人CX3CL1一抗购自Proteintech公司,工作浓度1∶500;小鼠抗人Tubulin购自Sigma公司,工作浓度1∶5 000;HRP标记羊抗小鼠二抗、HRP标记兔抗羊二抗购自武汉博士德生物工程有限公司,工作浓度1∶50 000。ECL底物液购自Thermo公司。应用Image J软件进行条带扫描,以目的条带与内参条带灰度值比表示蛋白相对表达量。
四、统计学处理
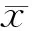
结 果
一、各组E-cadherin、α-SMA、CX3CL1 mRNA表达量
对照组及5、25、50、100 μg/L IL-18干预组PSCs的E-cadherin mRNA表达量分别为1.03±0.17、0.77±0.15、0.89±0.12、0.54±0.11、0.46±0.06,呈浓度依赖性下降趋势,其中100 μg/L干预组与对照组的差异有统计学意义(t=3.08,P<0.05)。
对照组及5、25、50、100 μg/L IL-18干预组PSCs 的α-SMA mRNA表达量分别为1.03±0.19、0.85±0.14、1.33±0.22、1.60±0.14、1.94±0.09,呈浓度依赖性升高趋势,其中100 μg/L干预组与对照组的差异有统计学意义(t=4.27,P<0.05)。
对照组及5、25、50、100 μg/L IL-18干预组PSCs 的CX3CL1 mRNA表达量分别为1.01±0.08、0.88±0.25、0.86±0.17、1.58±0.26、1.83±0.13,5、25 μg/L IL-18干预组表达量低于对照组,50、100 μg/L干预组表达量高于对照组,其中100 μg/L干预组与对照组的差异有统计学意义(t=5.32,P<0.01)。
二、各组E-cadherin、α-SMA、CX3CL1 蛋白表达量(图1)
对照组及5、25、50、100 μg/L IL-18干预组PSCs 的E-cadherin 蛋白表达量分别为1.00±0.14、1.14±0.04、1.14±0.07、0.85±0.08、0.80±0.06,呈浓度依赖性下降趋势,但各组间的差异无统计学意义。
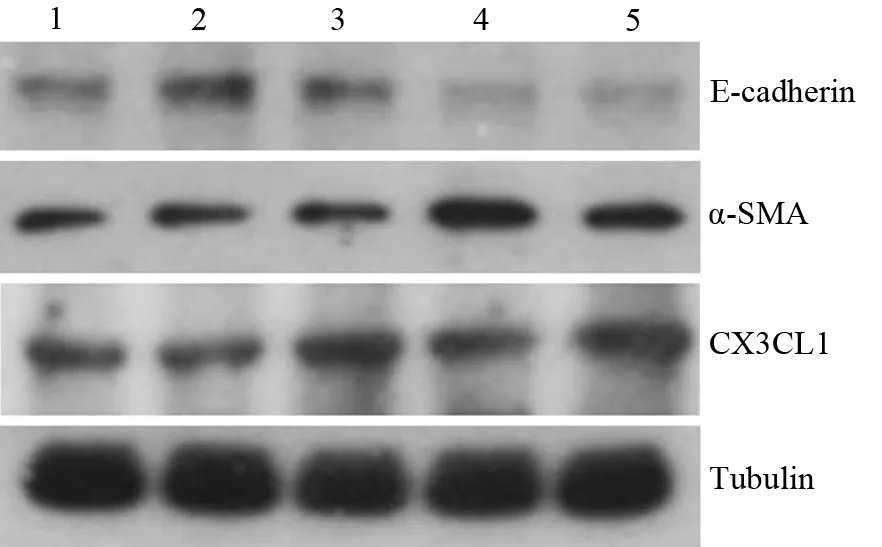
图1 对照组(1)及5、25、50、100 μg/L IL-18干预组(2、3、4、5)PSCs的E-cadherin、α-SMA、CX3CL1蛋白表达
对照组及5、25、50、100 μg/L IL-18干预组PSCs的α-SMA蛋白表达量分别为1.00±0.02、0.77±0.07、1.29±0.02、1.59±0.07、1.70±0.02,呈浓度依赖性升高趋势,25、50、100 μg/L IL-18干预组与对照间差异有统计学意义(t值分别为9.90、7.88、26.84,P值均<0.01)。
对照组及5、25、50、100 μg/L IL-18干预组PSCs的CX3CL1蛋白表达量分别为1.00±0.05、1.03±0.05,1.37±0.06、1.46±0.18、1.45±0.12,呈浓度依赖性升高趋势,其中100 μg/L干预组与对照组的差异有统计学意义(t=3.40,P<0.05)。
讨 论
目前为止,人们对于CP发病机制的了解还处于探索阶段。趋化因子CX3CL1是CX3C家族独特成员,是一种具有黏附功能的炎性趋化因子,它参与肾脏纤维化的病理生理过程[6]。本课题组曾报道[7],CP大鼠的胰腺腺泡细胞、胰腺导管上皮细胞、炎症细胞、胰岛细胞及α-SMA阳性的活化PSCs均高表达IL-18和CX3CL1,提示IL-18和CX3CL1可能参与CP的纤维化进程。田轶伦和姜德谦[8]应用25、50、100 μg/L IL-18干预人脐静脉内皮细胞,结果显示IL-18能够上调CX3CL1的表达并增强内皮细胞的趋化作用。Schneider等[9]报道,CP患者血清IL-18水平显著升高。王丽敏等[10]报道,IL-18可能通过上调CX3CL1的表达增强其趋化作用来参与炎性反应。PSCs激活后CX3CL1表达增加,进一步促进胰腺纤维化形成。
本研究结果显示,100 μg/L IL-18干预能够促进α-SMA mRNA和蛋白表达增加,刺激PSCs激活;同时上调PSCs的CX3CL1表达,参与胰腺纤维化进程。关于CX3CL1表达上调机制的研究,目前相对较少。Uchida1等[5]报道,酒精通过激活PSCs的细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和解联蛋白-金属蛋白酶结构域17(a disintegrin and metalloprotease domain,ADAM17),协同刺激PSCs释放CX3CL1,ERK/ MAPK参与CX3CL1基因转录和产物分泌,但也存在其他因素参与的可能,如NF-κB或者干扰素调节因子[5]。关于PSCs激活后CX3CL1表达上调机制还有待更多研究。
[1] Apte MV, Haber PS, Applegate TL, et al. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture[J]. Gut, 1998,43(1):128-133.
[2] Phillips PA, McCarroll JA, Park S, et al. Rat pancreatic stellate cells secrete matrix metalloproteinases: implications for extracellular matrix turnover[J]. Gut, 2003,52(2):275-282.
[3] Huang LY, Chen P, Xu LX, et al. Fractalkine as a marker for assessment of severe acute pancreatitis[J]. J Dig Dis, 2012,13(4):225-231.DOI: 10.1111/j.1751-2980.2012.00580.x.
[4] Uchida M, Ito T, Nakamura T, et al. ERK pathway and sheddases play an essential role in ethanol-induced CX3CL1 release in pancreatic stellate cells[J]. Lab Invest, 2013,93(1):41-53.DOI:10.1038/labinvest.2012.156.
[5] Dinarello CA. IL-18: A TH1-inducing, proinflammatory cytokine and new member of the IL-1 family[J]. J Allergy Clin Immunol, 1999,103(1pt1):11-24.
[6] Koziolek MJ, Muller GA, Zapf A, et al. Role of CX3C-chemokine CX3C-L/fractalkine expression in a model of slowly progressive renal failure[J]. Nephrol Dial Transplant, 2010,25(3):684-698.DOI:10.1093/ndt/gfp602.
[7] 陈浩宇, 王茜, 陈洁. IL-18及趋化因子CX3CL1在慢性胰腺炎大鼠胰腺纤维化中的表达及其意义[J]. 中华胰腺病杂志, 2016,16:115-118.DOI:10.3760/cma.j.issn.1647-1935.2016.02.009.
[8] 田轶伦, 姜德谦. 白细胞介素-18对Fractalkine表达和趋化作用的影响[J]. 实用预防医学, 2009,16:672-675.
[9] Schneider A, Haas SL, Hildenbrand R, et al. Enhanced expression of interleukin-18 in serum and pancreas of patients with chronic pancreatitis[J]. World J Gastroenterol, 2006,12(40):6507-6514.
[10] 王丽敏, 李春玉, 张佳滨,等.分形素趋化因子在肾脏纤维化大鼠肾组织中的表达及IL-18结合蛋白对其表达的影响[J]. 中国当代儿科杂志, 2013,15:1134-1138.DOI:10.7499/j.issn.1008-8830.2013.12.024.
(本文编辑:屠振兴)
The influence of IL-18 on pancreatic stellate cells and CX3CL1 expression
WangQian,ChenHaoyu,ChenJie.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Objective To evaluate the effect of IL-18 on the expression of E-cadherin, α-SMA and CX3CL1 in pancreatic stellate cells(PSCs). Methods The human PSC line HPaSteC was routinely cultured and passaged. Five, 25, 50 and 100 μg/L IL-18 was used to treat PSCs for 72 h and the untreated PSCs were used as control. Treated and untreated cells were both collected, and RT-PCR and Western blot were used to detect mRNA and protein expression of E-cadherin, α-SMA and CX3CL1 respectively. Results The mRNA expressions of E-cadherin in control group and 5, 25, 50 and 100 μg/L IL-18 treated group were 1.03±0.17, 0.77±0.15, 0.89±0.12, 0.54±0.11 and 0.46±0.06. The mRNA expression of α-SMA were 1.03±0.19, 0.85±0.14, 1.33±0.22, 1.60±0.14 and 1.94±0.09;The mRNA expression of CX3CL1 were 1.01±0.08, 0.88±0.25, 0.86±0.17, 1.58±0.26 and 1.83±0.13. The mRNA expression of E-cadherin in IL-18 treated group were down-regulated , while the mRNA expression of α-SMA and CX3CL1 were up-regulated, and the differences between control and IL-18 100 μg/L treated group were statistically significant (P<0.05 or <0.01). The protein expression of E-cadherin in control group and 5, 25, 50 and 100 μg/L IL-18 treated group were 1.00±0.14,1.14±0.04, 1.14±0.07, 0.85±0.08 and 0.80±0.06. The protein expression of α-SMA were 1.00±0.02, 0.77±0.07, 1.29±0.02, 1.59±0.07 and 1.70±0.02;The protein expression of CX3CL1 were 1.00±0.05, 1.03±0.05, 1.37±0.06, 1.46±0.18 and 1.45±0.12. The protein expression of E-cadherin was down-regulated but no significant differences were observed among different groups. The protein expression of α-SMA was up-regulated and the differences between control group and 25, 50 and 100 μg/L IL-18 treated groups were statistically significant (allP<0.01). The protein expression of CX3CL1 was up-regulated and the differences between control group and 100 ng/ml IL-18 treated group were statistically significant (P<0.05). Conclusions IL-18 can activate PSCs and up-regulate the expression of chemokine CX3CL1.
Pancreas; Astrocytes; Panceatitis, chronic; Chemokine CX3CL1; Interleukin-18
10.3760/cma.j.issn.1674-1935.2017.01.008
200433 上海,第二军医大学长海医院消化内科
陈洁,Email: jiechen0115@sohu.com
国家自然基金青年科学基金项目(81300352)
2016-09-19)
