大麻素受体1对坐骨神经结扎大鼠神经病理性疼痛的影响及机制
2017-02-11
(中国医科大学附属第一医院麻醉科,沈阳 110001)
大麻素受体1对坐骨神经结扎大鼠神经病理性疼痛的影响及机制
李晓倩,包娜仁,张再莉,马虹
(中国医科大学附属第一医院麻醉科,沈阳 110001)
目的 观察鞘内注射大麻素受体1(CB1)激动剂和拮抗剂对坐骨神经结扎大鼠行为学、痛阈以及脊髓组织中CB1表达的影响,探讨CB1在神经病理性疼痛中的作用及机制。方法 SD大鼠随机分为4组:假手术组(sham组)、坐骨神经结扎组(SNL组,鞘内注射30 μL DMSO)、CB1激动剂组[AM841组,坐骨神经结扎前3 d鞘内注射5 μg AM841(溶于30 μL DMSO)]、CB1拮抗剂组[AM281组,坐骨神经结扎前3 d鞘内注射5 μg AM281(溶于30 μL DMSO)]。Sham组仅暴露坐骨神经而不结扎。其余各组均行右侧坐骨神经结扎术,术后1、3、5、7、10、14 d观察大鼠行为学变化,测定各组大鼠的热痛阈、机械性痛阈;Western blotting法检测脊髓组织中CB1表达。结果 与sham组相比,SNL组术后各观察点大鼠逐渐出现术侧后肢足趾并拢、热痛觉过敏和机械异常性疼痛等症状,同时脊髓组织中CB1表达降低(P<0.05);AM841组脊髓CB1表达增加,抑制坐骨神经结扎所引起的热痛阈和机械性痛阈降低(P<0.05);AM281组脊髓CB1表达进一步降低、大鼠痛觉异常增大(P<0.05)。结论 脊髓CB1参与神经病理性疼痛的调节,给予外源性大麻素CB1激动剂可以减轻坐骨神经结扎引起的神经病理性疼痛。
大麻素受体;神经病理性疼痛;脊髓;大鼠
神经病理性疼痛是由于肿瘤、感染、自身免疫 等因素导致神经系统损伤或功能紊乱引起的一种慢性疼痛,其疼痛程度重且多伴有自主神经功能紊乱,临床治疗效果欠佳[1⁃2]。目前神经病理性疼痛机制尚未明确,深入探讨其机制对临床中寻求有效的镇痛方案至关重要。脊髓是联系外周和高级神经中枢,是伤害性信息传递的中转站。越来越多的研究[3⁃4]发现大麻素受体(cannabinoid receptors,CB)参与疼痛中枢敏化形成介导慢性疼痛调节。既往研究[5]发现大鼠经鞘内注射选择性CB2激动剂WIN55、212⁃2可以通过抑制神经炎症递质释放、对抗兴奋性氨基酸毒性和调控钠通道过度开放等多靶点缓解机械性痛觉过敏,而脊髓水平CB1是否参与神经病理性疼痛的调节鲜有报道。本研究观察大鼠坐骨神经结扎后脊髓CB1表达以及鞘内注射CB1激动剂、拮抗剂对坐骨神经结扎(sciatic nerve li⁃gation,SNL)大鼠行为学和痛阈的影响,探讨CB1在神经病理性痛中作用及机制。
1 材料与方法
1.1 实验材料及主要仪器
雄性Sprague⁃Dawley大鼠160只,体质量240~260 g,由中国医科大学实验动物中心提供。AM841、AM281、Dimethyl sulfoxide(DMSO,美国Cayman Chemical公司);兔抗大鼠CB1抗体(美国Sigma公司);鼠爪机械痛阈测定仪(意大利UgoBasi⁃le公司)、大鼠爪热痛阈测定(意大利UgoBasil公司)、图像分析系统(武汉华海公司)、酶标仪(美国BIO⁃TEK公司)由中国医科大学附属第一医院实验动物中心提供。
1.2 实验方法
1.2.1 模型制备[6]:水合氯醛腹腔注射麻醉后,常规消毒,于大鼠右侧大腿后中部切开纵向切口,钝性分离皮下组织和肌肉,于股骨后找到坐骨神经主干,用4⁃0丝线在坐骨神经的中段间隔2 mm结扎4条线,结扎强度以引起小腿肌肉轻度颤动为宜,仅留下缢痕而不阻断神经血供,然后以生理盐水冲洗伤口,逐层缝合。假手术组大鼠仅暴露坐骨神经而不结扎。所有手术步骤都在无菌环境下操作。
1.2.2 鞘内注射[7]:麻醉下,用27号针头注射器在脊髓T9~12节段缓慢穿刺脊髓,当针头进入蛛网膜下腔时,动物可立即出现甩尾反应。然后缓慢注入药物。鞘内用药有CB1激动剂AM841、拮抗剂AM281(溶于30 μL DMSO)、等量DMSO,1次/d,连续3 d。
1.2.3 实验分组:大鼠随机分为4组,每组40只。假手术组(sham组),坐骨神经结扎前3 d鞘内注射DMSO 30 μL,开腹并暴露坐骨神经而不结扎;SNL组,坐骨神经结扎前3 d鞘内注射DMSO 30 μL,开腹暴露右侧坐骨神经并结扎;CB1激动剂组(AM841组):坐骨神经结扎前3d鞘内注射AM841(5μg/30μL);CB1阻断剂组(AM281组):坐骨神经结扎前3 d鞘内注射AM281(5 μg/30 μL)。1次/d,连续3 d。
1.2.4 疼痛一般行为学测定[8]:术后大鼠单笼饲养,观察大鼠的精神状态、进食和饮水、伤口愈合情况以及大鼠安静时的姿势运动能力。
1.2.5 机械性痛阈及热痛阈测定[9]:分别于SNL前3 d及术后1、3、5、7、10、14 d,上午8时至10时,室温保持在20~24℃,待大鼠安静后,采用电子自动爪触觉测试仪测定各组大鼠右足机械刺激缩爪阈值(paw withdrawal threshold,PWT),将刺激针对准右足底并逐渐增加刺激力量,大鼠感觉到痛觉后移开足部,设备记录并显示大鼠移开右足瞬间的最大值,即PWT。照射内侧第1足趾的着力点,采用辐射热测痛仪测定各组大鼠右足辐射热刺激缩爪潜伏期(paw withdrawal latency,PWL),单次照射不超过20 s,以免损伤照射部位。测定值精确到0.1 s。测定3次,每次间隔5 min,取平均值。
1.2.6 Western blotting测定大鼠脊髓组织中CB1蛋白表达:大鼠完成痛阈测定后处死,取术侧L4~6节段脊髓组织,提取总蛋白溶液,进行SDS⁃PAGE电泳将蛋白湿转至PVDF膜上,5%牛奶封闭后加入抗CB1抗体,4℃过夜,洗膜后再用HRP标记的山羊抗兔IgG杂交,37℃2 h。最后加入ECL试剂反应1~2 min显像,用扫描仪行蛋白条带扫描并进行蛋白条带半定量分析。以CB1和GAPDH的比值作为表达强度。
1.3 统计学分析
数据处理采用SPSS 19.0统计学软件,计数资料采用χ2检验;计量资料结果以x±s表示,采用单因素方差分析(ANOVA)比较组间差异,使用post hoc进行多重比较,P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠疼痛一般行为学比较
4组大鼠术后体质量无明显下降,进食和饮水无明显改变。sham组大鼠术后行为学表现较术前无明显改变,而SNL组大鼠术后随时间进展逐渐出现术侧后肢足趾并拢,足外翻以及反复舔舐术侧后肢等症状;与SNL组比较,AM841组出现上述症状大鼠的数目明显降低,舔舐术侧后肢次数减少,而AM281组上述症状加重,甚至出现触摸痛体征,舔舐次数明显增多。见表1。
2.2 4组大鼠机械性痛阈的比较
各组大鼠术前基础机械性PWT差异均无统计学意义(P>0.05)。与sham组比较,从术后第1天开始SNL组大鼠术侧右足PWT值逐渐降低,持续至手术后第14天,而在第5天和第7天达最低水平(P<0.05)。与SNL组比较,AM841组术后各观察点PWT值明显升高(P<0.05),而AM281组PWT值进一步降低(P<0.05)。术后各时间点SNL组、AM841组和AM241组大鼠与sham组比较差异均有统计学意义(P<0.05),见图1。

表1 各组大鼠坐骨神经结扎后各时间点行为学变化Tab.1 Behavior changes in rats of 4 groups at different time points after SNL

图1 4组大鼠SNL后1、3、5、7、10、14 d右足机械刺激PWT比较Fig.1 Comparison of 4 groups of PWT in right paws at 1,3,5,7,10,14 d after SNL
2.3 各组大鼠热痛阈比较
热痛阈的变化与机械痛阈的变化趋势大体一致。各组大鼠术前基础热痛阈(PWL)的差异均无统计学意义(P>0.05)。与sham组相比,术后各时间点SNL组大鼠术侧右足出现PWL降低,术后第5和7天达最低水平(P<0.05)。与SNL组相比,AM841组术后各观察点PWL值明显升高(P<0.05)而AM281组PWL值进一步降低(P<0.05)。术后各时间点SNL、AM841和AM241 3组大鼠与sham组相比差异均有统计学意义(P<0.05),见图2。
2.4 各组大鼠脊髓组织中CB1蛋白表达比较
Western blotting结果显示:与sham组比较,术后各观察点(第5天和第7天差别最为明显)SNL组大鼠脊髓组织中CB1蛋白明显下降(P<0.05),与SNL组比较,AM841组术后各观察点大鼠脊髓组织中CB1蛋白表达明显增加,而AM281组CB1蛋白表达进一步降低(均P<0.05),见表2和图3。
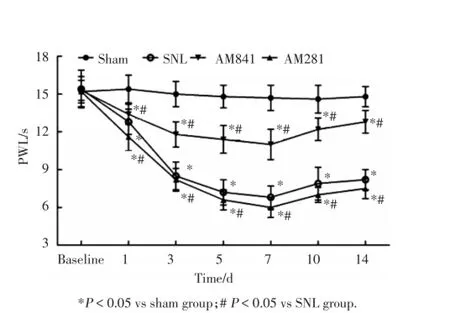
图2 4组大鼠SNL后1、3、5、7、10、14 d右足热刺激PWL比较Fig.2 Comparison of 4 groups of PWL in right paws at 1,3,5,7,10,14 d after SNL

图3 SNL后5、7 d各组大鼠脊髓CB1蛋白表达Fig.3 Comparison of spinal CB1 protein levels at 5 and 7 days after SNL in four groups by Western blotting
3 讨论
神经病理性疼痛具有症状多样、发病机制复杂、无法在人体中模拟研究等特点,因此选择合适的动物模型是深入研究其分子机制的必要手段。SNL是目前使用最广泛的神经病理性疼痛模型之一,具有高度的重复性。本研究制作的SNL大鼠模型术后精神和饮食状态正常,逐渐出现后肢足趾并拢,足外翻以及反复舔舐术侧后肢等现象,且PWT和PWL随时间下降明显,表明模型建立成功。

表2 各组大鼠SNL后各时间点脊髓组织中CB1蛋白表达Tab.2 Spinal CB1 protein levels at different time points after SNL
坐骨神经损伤后可以引起局部组织的炎症反应,引起5⁃HT缓激肽等内源性物质大量释放,从而活化外周感受器,并将伤害性刺激传入脊髓[10]。脊髓作为伤害性信息传递的中转站,损伤后组织中免疫反应细胞通过改变表面受体迅速发生活化,同时释放出大量炎症介质、P物质等致痛因子,参与神经病理性疼痛的发生和发展[11⁃12]。越来越多的研究[3⁃4]发现CB在应激、疼痛等病理情况下也迅速发生变化。人体内主要存在2种CB,CB1和CB2,均为G蛋白耦联受体,生理状态下可调节某些神经递质(谷氨酸、γ⁃氨基丁酸等)的释放,被单酰基甘油酯酶迅速降解[10]。大麻素对神经系统的影响最初是在1996年被发现,SHEN等[13]指出大麻素可减少海马组织切片的谷氨酸释放从而对抗兴奋性氨基酸对神经元的毒性作用。近年来,随着研究深入发展,CB激活后还参与疼痛中枢敏化形成介导慢性疼痛调节。YAO等[5]对L5脊神经结扎大鼠鞘内注射选择性CB2激动剂WIN55、212⁃2能够明显减轻大鼠的机械痛敏,而给予CB1受体拮抗剂利莫那班可逆转WIN55、212⁃2的保护作用[14]。不仅如此,敲除CB1基因的小鼠神经敏感性增加,神经功能学评分较野生型相比明显异常,且恢复速度缓慢[15],基因克隆进一步发现CB1和CB2总氨基酸序列44%同源,跨膜区氨基酸序列68%同源,可能在神经病理性疼痛中存在共同的作用靶点[16]。本研究中对SNL模型大鼠鞘内注射A841激动剂,术后各观察点右足PWL值和PWT值均明显升高,获得良好的镇痛效果,而给予CB1拮抗剂后逆转了上述的镇痛作用。本研究中PWT值和PWL值在术后5 d和7 d变化最明显(降低2倍以上)。同样Western blotting检测鞘内注射AM841能明显增加脊髓中CB1的表达,而注射CM281则进一步抑制CB1的表达,与PWT值和PWL值的变化趋势相符,表明通过注射外源性CB1可以有效上调脊髓组织中的CB1表达,从而缓解疼痛,与既往研究[3,17]结果一致。
综上所述,本研究观察鞘内注射CB1激动和拮抗剂对SNL大鼠行为学、痛阈以及脊髓组织中CB1表达的影响,证实CB1参与神经病理性痛中的发生和发展,给予外源性CB1可以有效缓解疼痛,为临床治疗提供了新的治疗靶点。
[1]BENNETT GJ,XIE YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J]. Pain,1988,33(1):87-107.
[2]PATRICK DL,FERKETICH SL,FRAME PS,et al.National insti⁃tutes of health state⁃of⁃the⁃science conference statement:symptom management in cancer:pain,depression,and fatigue,July 15⁃17,2002[J].J Natl Cancer Inst,2003,95(15):1110-1117.DOI:10.1093/jncimonographs/djg014.
[3]HAN ZL,WANG ZL,LI XH,et al.Neuropeptide of enhances canna⁃binoid agonist win55,212⁃2⁃induced antinociception in mice[J]. Anesth Analg,2015,121(5):1360-1368.DOI:10.1213/ANE.0000 000000000921.
[4]TOMIC MA,PECOLPZA UB,MICOV AM,et al.The efficacy of esli⁃carbazepine acetate in models of trigeminal,neuropathic,and viscer⁃al pain:the involvement of 5⁃HT1B/1D serotonergic and CB1/CB2 cannabinoid receptors[J].Anesth Analg,2015,12(6):1632-1639.DOI:10.1213/ANE.00000000000009 53.
[5]YAO BB,HSIEH GC,FROST JM,et al.In vitro and in vivo charac⁃terization of A⁃796260:a selective cannabinoid CB2 receptor ago⁃nist exhibiting analgesic activity in rodent pain models[J].Br J Pharmacol,2008,153(2):390-401.DOI:10.1038/sj.bjp.0707568.
[6]MYERS RR,CAMPANA WM,SHUBAYEV VI.The role of neuroin⁃flammation in neuropathic pain:mechanisms and therapeutic targets[J].Drug Discov Today,2006,11(1/2):8-20.DOI:10.1016/S1359⁃6446(05)03637⁃8.
[7]LI XQ,WANG J,FANG B,et al.Intrathecal antagonism of microgli⁃al TLR4 reduces inflammatory damage to blood⁃spinal cord barrier following ischemia/reperfusion injury in rats[J].Mol Brain,2014,7(1):28.DOI:10.1186/1756⁃6606⁃7⁃28.
[8]刘巍,陈佳,唐晓婷,等.大鼠坐骨神经损伤后早期脊髓背角小胶质细胞活化状态和活化类型的变化规律[J].中国比较医学杂志,2015,25(12):37-41.
[9]OBATA K,YAMANAKA H,KOBAYASHI K,et al.Role of mitogen activated protein kinase activation in injured and intact primary af⁃ferent neurons for mechanical and heat hypersensitivity after spinal nerve ligation[J].Neuroscience,2004,24(45):10211-10222. DOI:10.1523/JNEUROSCI.3388⁃04.2004.
[10]BOSIER B,DOYEN PJ,BROLET A,et al.Inhibition of the regula⁃tor of G protein signalling RGS4 in the spinal cord decreases neuro⁃pathic hyperalgesia and restores cannabinoid CB1 receptor signal⁃ing[J].Br J Pharmacol,2015,172(22):5333-5346.DOI:10.1111/bph.13324.
[11]TSIDA M.Microglia in the spinal cord and neuropathic pain[J].J Diabetes Investig,2016,7(1):17-26.DOI:10.1111/jdi.12379.
[12]LIN TB,LAI CY,HSIEH MC,et al.Neuropathic allodynia involves spinal neurexin⁃1β⁃dependent neuroligin⁃1/postsynaptic density⁃95/NR2B cascade in rats[J].Anesthesiology,2015,123(4):909-926.DOI:10.1097/ALN.0000000000000809.
[13]SHEN M,PISER TM,SEYBOLD VS,et al.Cannabinoid receptor agonists inhibit glutamatergic synaptic transmission in rat hippo⁃campal cultures[J].J Neurosci,1996,16(14):4322-4334.
[14]LEVIN R,ALMEIDA V,PERES FF,et al.Antipsychotic profile of cannabidiol and rimonabant in an animal model of emotional con⁃text processing in schizophrenia[J].Curr Pharm Des,2012,18(32):4960-4965.DOI:10.2174/138161212802884735.
[15]DENG L,CORNETT BL,MACKIE K,et al.CB1 knockout mice unveil sustained CB2⁃mediated antiallodynic effects of the mixed CB1/CB2 agonist CP55,940 in a mouse model of paclitaxel⁃in⁃duced neuropathic pain[J].Mol Pharmacol,2015,88(1):64-74. DOI:10.1124/mol.115.098483.
[16]ZUROLO E,IYER AM,SPLIET WG,et al.CB1 and CB2 cannabi⁃noid receptor expression during development and in epileptogenic developmental pathologies[J].Neuroscience,2010,170(1):28-41.DOI:10.1016/j.neuroscience.2010.07.004.
[17]WILKERSON JL,GENTRY KR,DENGLER EC,et al.Intrathecal cannabilactone CB(2)R agonist,AM1710,controls pathological pain and restores basal cytokine levels[J].Pain,2012,153(5):1091-1106.DOI:10.1016/j.pain.2012.02.015.
(编辑 武玉欣)
Mechanism and Effects of Cannabinoid Receptor 1 on Sciatic Nerve Ligation⁃induced Neuropathic Pain in Rat Model
LI Xiaoqian,BAO Naren,ZHANG Zaili,MA Hong
(Department of Anesthesiology,The First Hospital,China Medical University,Shenyang 110001,China)
Objective To observe the effects of intrathecal injection(IT)of agonist and antagonist of cannabinoid receptor 1 on pain threshold in rat model of sciatic nerve ligation(SNL)induced neuropathic pain,and investigate the role and mechanism of CB1 in neuropathic pain.Methods Male Sprague⁃Dawley rats were randomly divided into 4 groups:sham group(intrathecal normal saline,IT DMSO),SNL group(SNL+IT 30 μL DMSO),AM841 group(SNL+IT 5 μg AM841,dissolved in 30 μL of DMSO)and AM281 group(SNL+IT 5 μg AM281,dissolved in 30 μL of DMSO).IT was given 3 days before surgery.Sham group only had sciatic nerve exposure but without ligation.SNL model in the other three groups were established by right sciatic nerve ligation.The thermal and mechanical thresholds were assessed by paw withdrawal latency(PWL)to radiant heat and von Frey filaments at 1,3,5,7,10 and 14 days as well as behavior after SNL.Spinal expressions of CB1 were assessed by West⁃ern blotting.Results Compared with the sham group,symptoms of rats in SNL group,such as heat hyperalgesia,mechanical allodynia and poste⁃rior paws prone to close together,were gradually appeared in the observation time points,with lower spinal proteins expression of CB1(P<0.05). AM841 group exhibited increased proteins expression of CB1 and inhibited SNL⁃induced heat hyperalgesia and mechanical allodynia(P<0.05). AM281 group further decreased expression of CB1 and amplified the pain abnormality(P<0.05).Conclusion Spinal CB1 participates in the regulation of neuropathic pain,and exogenous cannabinoid CB1 agonists can alleviate the SNL⁃induced neuropathic pain.
cannabinoid receptor;neuropathic pain;spinal cord;rat
R741.02
A
0258-4646(2017)03-0205-04
10.12007/j.issn.0258⁃4646.2017.03.004
国家自然科学基金(81601053);辽宁省教育厅科学研究项目(LK201636)
李晓倩(1984-),女,主治医师,博士.
马虹,E-mail:mahong5466@yahoo.com
2016-08-20
网络出版时间:
