pH对小麦HMW-GS 1Dx5的N端结构域分子特性的影响*
2017-01-05胡松青张亚萍王敬敬刘光毅黄滟波李琳侯轶
胡松青 张亚萍 王敬敬 刘光毅 黄滟波, 李琳 侯轶
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.华南理工大学 广东省天然产物绿色加工与产品安全重点实验室, 广东 广州 510640; 3.华南理工大学 制浆造纸工程国家重点实验室, 广东 广州 510640)
pH对小麦HMW-GS 1Dx5的N端结构域分子特性的影响*
胡松青1,2张亚萍1王敬敬1刘光毅1黄滟波1,3李琳1,2侯轶3
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.华南理工大学 广东省天然产物绿色加工与产品安全重点实验室, 广东 广州 510640; 3.华南理工大学 制浆造纸工程国家重点实验室, 广东 广州 510640)
采用内源荧光光谱、总自由巯基定量、非还原和还原十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)以及原子力显微镜(AFM)等方法探究了pH值对高分子量麦谷蛋白亚基(HMW-GS)1Dx5的N端结构域(1Dx5-N)聚集体形成的影响规律.结果显示:与酸性和碱性条件下相比,中性(pH=7.0)条件下,1Dx5-N的荧光最大发射波长发生了蓝移,表明中性条件下1Dx5-N聚集程度增加;与酸性和碱性处理条件相比,中性条件下1Dx5-N的总自由巯基含量降低,且形成了更多的二聚体和高聚体,表明中性环境更有利于1Dx5-N的聚集,且分子间二硫键对聚集体的形成发挥了重要作用;中性条件下形成了颗粒直径相对较大的聚集体,进一步证明了中性条件更有利于1Dx5-N的聚集.从而从分子层面证明了中性条件下进行面制品加工的合理性.
高分子量麦谷蛋白亚基;N端结构域;聚集体
小麦是目前世界上最重要的农作物之一,小麦中含有的面筋蛋白赋予了面团独特的性质,进而满足不同质地、不同形状面制品(如面条、面包、馒头等)的加工需要[1- 2].小麦面筋蛋白主要由麦谷蛋白和醇溶蛋白组成,其中高分子量麦谷蛋白亚基(HMW-GS)是麦谷蛋白的重要组成成分.HMW-GS的相对分子质量范围为68 000~89 000,其氨基酸序列可分为3个区域,分别为非重复的N-末端区、C-末端区和高度重复的中间区[3- 5].尽管 HMW-GS 在小麦面筋蛋白中占的比例不大(约占10%),但由于其赋予了小麦面筋弹性,因此在很大程度上决定着面制品的加工品质[5- 6].
由于面筋蛋白分子链上存在着自由氨基和羧基,这些基团能在溶液中发生酸性电离或碱性电离,进而改变面筋蛋白基团的性质,因此pH值的改变可能会影响以蛋白质为基础形成的面筋网络结构[7].Doguchi等[8]研究了酸性条件下生面团的流变学性质,结果显示pH在4.5~6.0范围内,面团强度呈现线性增加趋势.同时,Holmes等[9]研究了pH对面包烘焙品质的影响,发现pH在4.65~6.15范围内时,面包的烘焙体积增加,而在更高pH值条件下面包体积则明显下降.以上结果充分表明,pH值具有影响面团强度以及面制品加工品质的能力.
研究已经证明,面团和面制品品质与面筋网络结构密切相关,在面筋网络的形成中,高分子量麦谷蛋白亚基通过分子间二硫键“头尾相连”的方式构成骨架结构,而HMW-GS的N端结构域是半胱氨酸的集中区,半胱氨酸是形成二硫键的反应位点,这是形成弹性骨架的重要结构域基础[10- 13].另外,研究表明,在HMW-GS的不同种类的亚基中,同时含有亚基1Dx5和1Dy10的面筋蛋白对面粉加工品质的影响最为显著,且当单独添加1Dx5或1Dy10到面粉中时,1Dx5在增强面团强度上效果更加明显[13- 14],因此,选择1Dx5-N为研究对象,既具有HMW-GS的N-末端结构域的普遍意义,又有优质亚基的独特性.
笔者所在课题组已经成功克隆并表达出高分子量麦谷蛋白亚基1Dx5的N端结构域(1Dx5-N),并研究了1Dx5-N的溶解性以及盐离子对其聚集行为的影响[15].因此,文中在前期研究基础之上,旨在通过研究不同pH条件下1Dx5-N聚集行为的变化,从分子层面揭示pH值对面制品加工品质的影响情况.
1 材料与方法
1.1 实验材料
1Dx5-N由笔者所在实验室克隆表达,其中构建表达载体的质粒为pET-30b,蛋白诱导表达菌株为E.coliBL21(DE3)[15].
1.2 仪器与设备
镍离子亲和层析柱(预装柱),26/10 Desalting脱盐柱(预装柱),美国GE公司生产;3 ku超滤管,美国菲博生物科技有限公司生产;F-7000型荧光光谱仪,HITACHI公司生产;MuLtiMode SPM原子力显微镜,美国Veeco公司生产;Sunrise 酶标仪,瑞士TECAN公司生产;Brion 3 STAR精密pH计,美国Thermo公司生产;蛋白电泳仪,美国Bio-Rad公司生产.
1.3 实验方法
1.3.1 1Dx5-N的表达和纯化
以亚基1Dx5的全长基因组序列为模板,运用PCR技术扩增编码1Dx5-N的目的基因,以pET-30b质粒为载体构建1Dx5-N重组表达质粒[15].构建的重组质粒pET-30b-1Dx5-N转入宿主菌E.coliBL21(DE3)中,20 ℃诱导表达6 h,其中诱导剂IPTG 终浓度为0.5 mmol/L.离心收集菌体,0.5 mol/L Tris-HCl缓冲液(pH=7.0)重悬菌体,冰浴下超声破碎(超声功率300 W,超声频率50 Hz,占空比0.4∶0.6).将破碎液于4 ℃、8 000 r/min下离心30 min,收集上清液,经微滤后(0.22 μm)用于层析上样.
应用镍离子亲和层析柱对目的蛋白进行纯化,通过SDS-PAGE进行鉴定.对收集得到的目的蛋白使用脱盐柱脱盐,脱盐缓冲液为20 mmol/L的磷酸盐溶液(pH=7.0).然后,于4 ℃、4 500 r/min下对目的蛋白进行浓缩,采用紫外光谱法测定其浓度,液氮速冻后保存在-80 ℃下备用[16].
1.3.2 等电点(PI)的测定
使用20 mmol/L的磷酸盐缓冲液(pH=7.0)将1Dx5-N稀释至0.1 g/L,测定pH值在2.5~7.5区间内的Zeta电位变化.当Zeta电位为零时的pH值即为样品的等电点.
1.3.3 内源荧光光谱的测定
将1Dx5-N溶液pH值分别调节至3.5、7.0、7.6、8.2、9.4、10.2和11.0,最终质量浓度为0.4 g/L,测定不同pH值对1Dx5-N的内源荧光光谱影响.激发波长为295 nm,激发和发射狭缝宽度均为5 nm,测定300~400 nm发射波长范围内样品的荧光发射图谱.1.3.4 总自由巯基含量的测定
将1Dx5-N溶液pH值分别调节至3.0、7.0和10.0,终质量浓度为1.0 g/L,参照Zhao等[17]的方法进行总自由巯基含量测定.取50 μL的蛋白样品,依次加入150 μL 三羟甲基氨基甲烷-甘氨酸稀释缓冲液(86 mmol/L 三羟甲基氨基甲烷、90 mmol/L 甘氨酸,4 mmol/L 乙二胺四乙酸二钠、0.5%(质量分数)SDS、8 mol/L 尿素,pH=8.0)、100 μL 5,5′-二巯基(2-硝基苯甲酸)反应液(4 mg/L,pH=8.0)混合均匀,25 ℃放置15 min后在6 000 r/min下室温离心1 min.吸取100 μL上清液置于96孔板中,用酶标仪测定412 nm处的吸光度值,以还原型谷胱甘肽为标准品绘制标准曲线,将样本吸光度值转换为总自由巯基含量.
1.3.5 非还原SDS-PAGE和还原SDS-PAGE分析
使用20 mmol/L的磷酸盐缓冲液(pH=7.0)将1Dx5-N稀释至1 g/L,分别调节pH值为3.0、7.0和10.0,配置3%的浓缩胶和12%的分离胶,参照Zhao等[18]的方法对蛋白样品进行非还原SDS-PAGE和还原SDS-PAGE分析.
1.3.6 原子力显微镜(AFM)观察
调节1Dx5-N溶液pH值至3.0、7.0和10.0,蛋白质量浓度为0.1 mg/L.吸取3 μL蛋白溶液滴在新剥离的云母片上,室温下干燥30 min,采用原子力显微镜(探针Scanasyst-Air)的轻敲模式室温下(25±2)℃观察每个pH值下的蛋白形貌.
1.3.7 数据处理
使用Origin 8.0软件对实验数据进行绘图,采用SPSS 16.0软件对实验数据进行显著性分析(P<0.05).
2 结果与讨论
2.1 1Dx5-N等电点分析
图1为1Dx5-N的Zeta电位随pH值的变化曲线.从图中可以看出,当pH值从2.5升高至4.0时,Zeta电位值相对恒定,随着pH值的继续增加,Zeta电位迅速下降;当pH值上升到5.0时,Zeta电位降为零;当pH值达到6.0后,Zeta电位变化又恢复平稳.因此,1Dx5-N的等电点pI=5.0.当蛋白质pH值位于其等电点附近(pH=4.0~6.0)时,其表面电荷下降,分子间静电排斥力降低,容易形成沉淀[19],为了排除沉淀对实验的干扰,后续研究中不选择此段pH值进行测试.
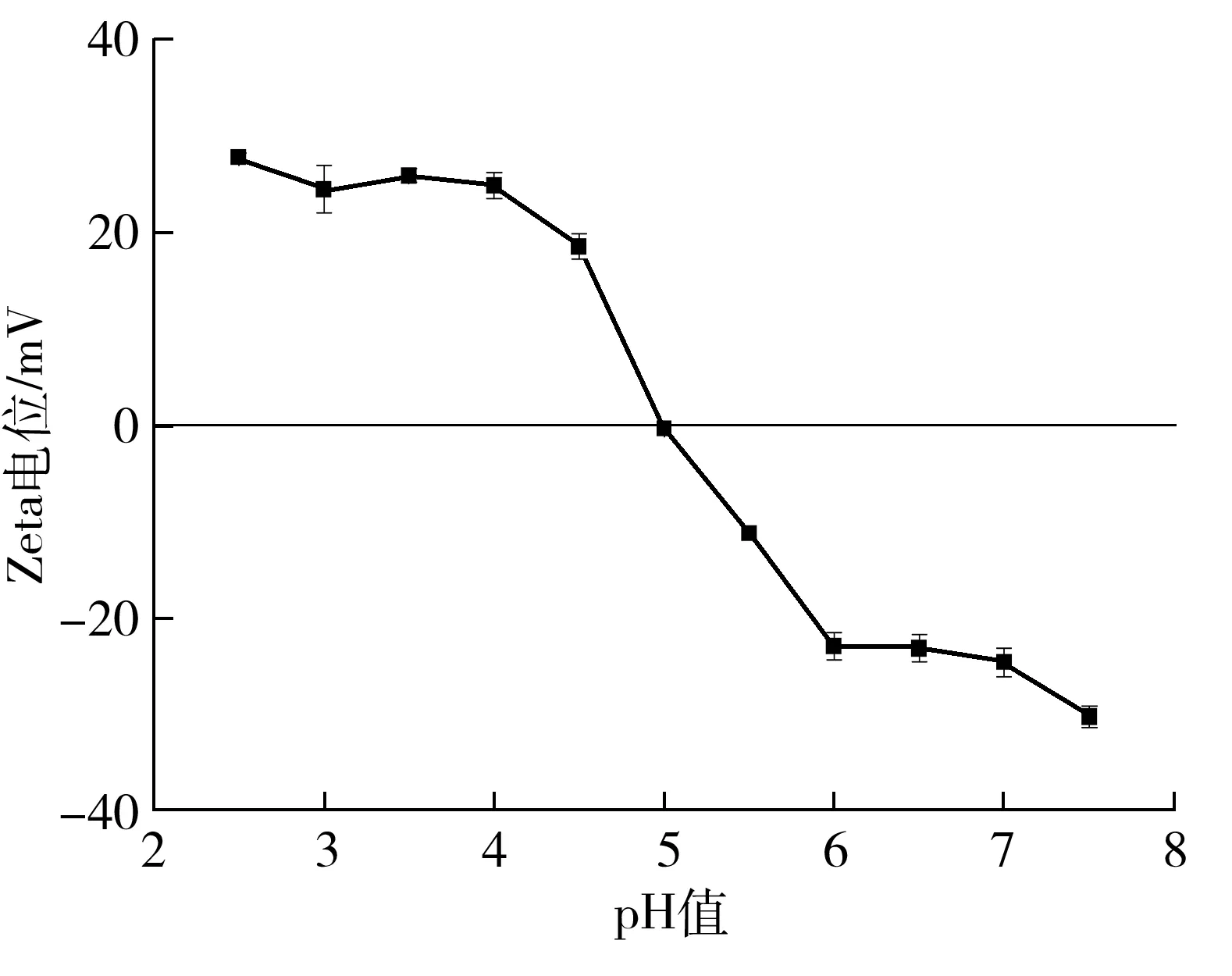
图1 重组1Dx5-N的Zeta电位曲线
2.2 pH对1Dx5-N内源荧光光谱的影响

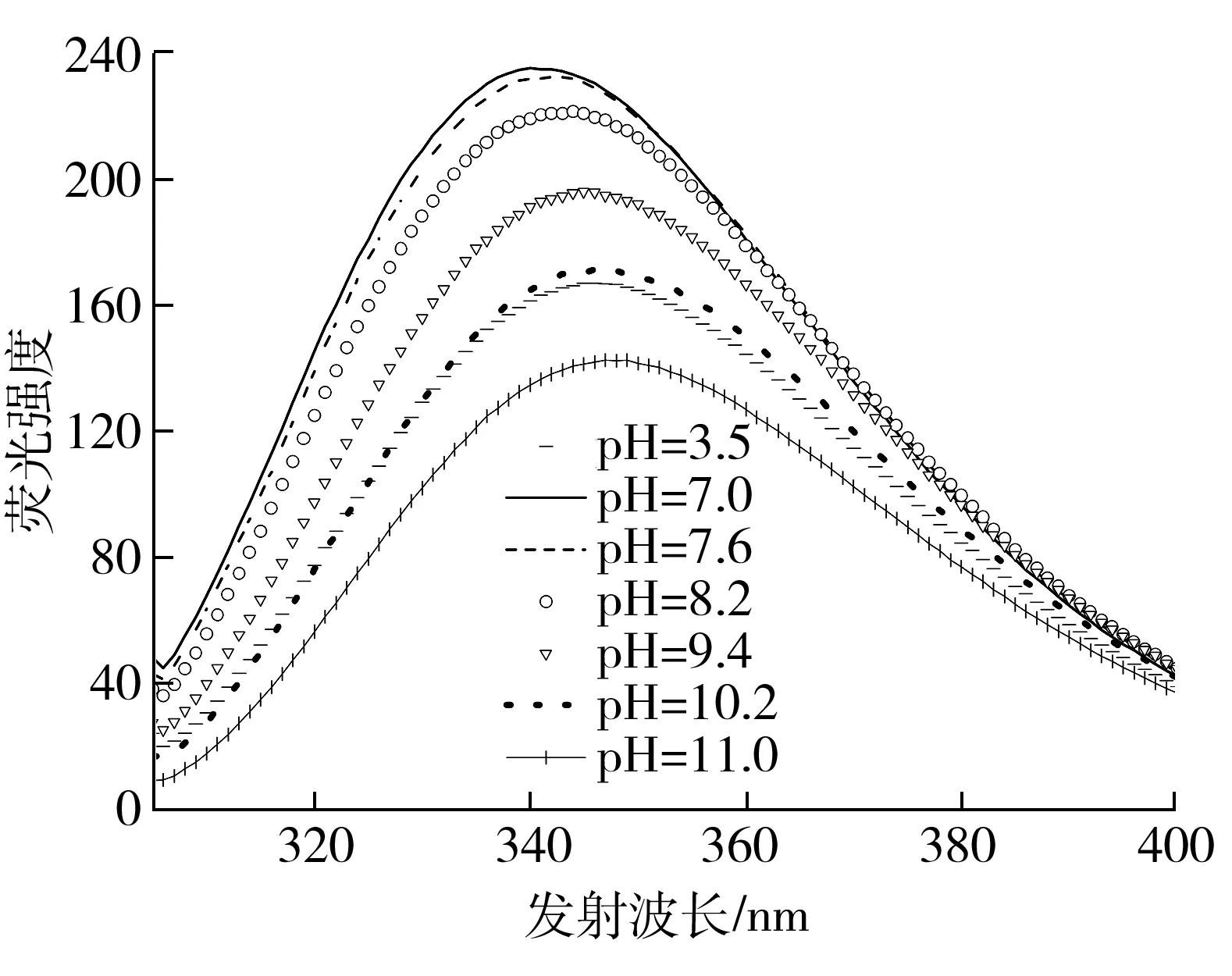
图2 放置54 h后不同pH值1Dx5-N的内源荧光光谱图
Fig.2 Fluorescence spectrum of 1Dx5-N at different pH values at 54 h
2.3 pH对1Dx5-N二硫键形成的影响
为了更全面地阐述pH值对1Dx5-N蛋白质分子聚集的影响,分别选择酸性条件(pH=3.0)、碱性条件(pH=10.0)和中性条件(pH=7.0)下的1Dx5-N蛋白质分子进行研究.图3为1Dx5-N在不同pH值条件下,总自由巯基含量随放置时间的变化曲线.从图中可以看出,1Dx5-N的总自由巯基含量在酸性条件下最高,碱性条件下次之,中性条件下最低;随着放置时间的延长,不同pH条件处理下的1Dx5-N
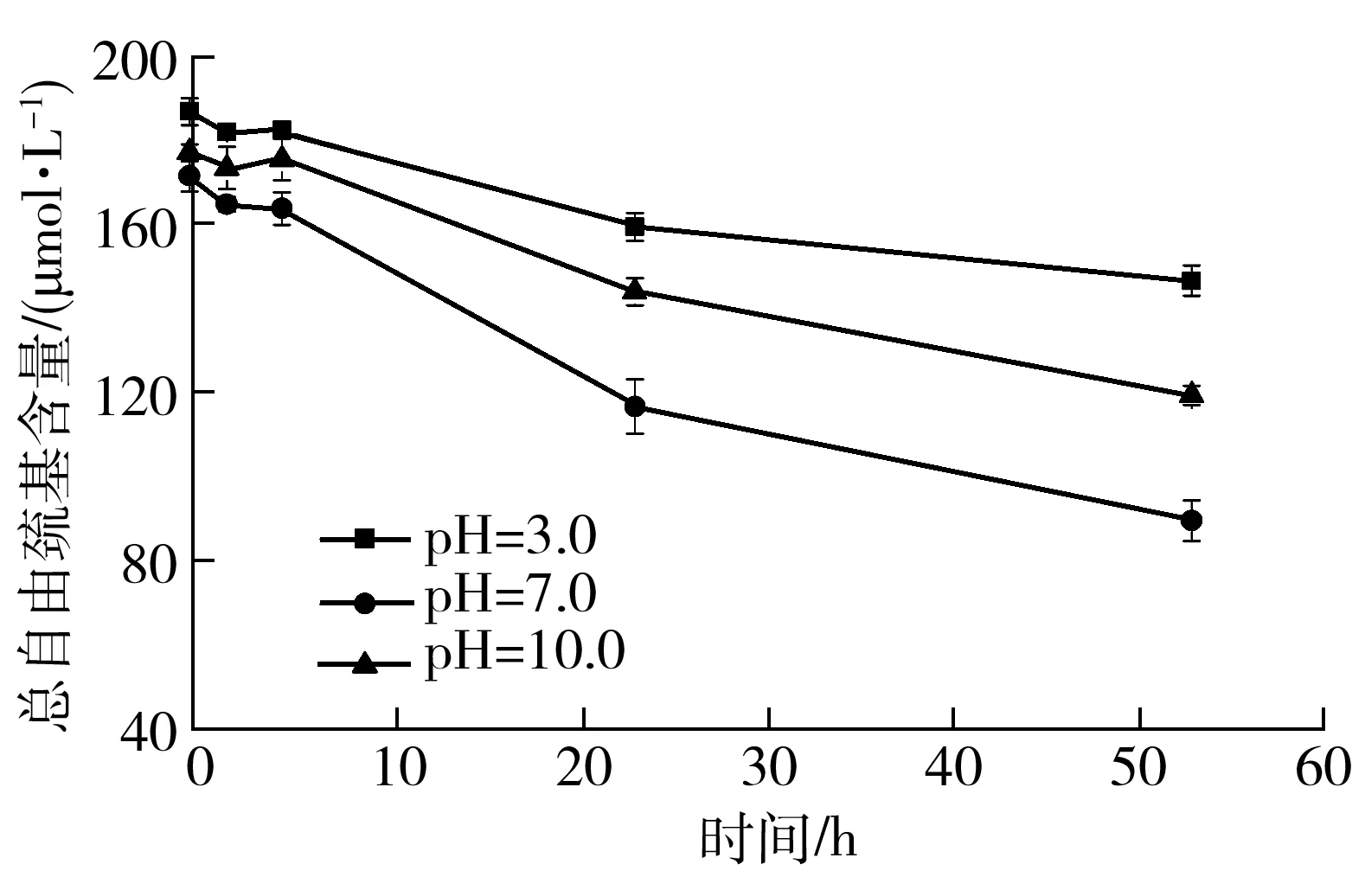
图3 不同处理时间和pH值下1Dx5-N的总自由巯基含量变化
Fig.3 Change of total free thiol group content in 1Dx5-N at different time and pH values
总自由巯基含量不断降低.放置0 h时,1Dx5-N在pH=7.0,10.0和3.0条件下的总自由巯基含量分别为171.2±3.6、176.8±1.8、186.5±3.2 μmol/L,放置24 h后,总自由巯基含量相对0 h时分别降低了32.7%、18.6%和12.3%;放置时间达到54 h时,1Dx5-N的总自由巯基含量相对0 h时分别降低了46.8%、31.8%和21.5%.
同时,从非还原SDS-PAGE分析(见图4)可以看出,1Dx5-N的存在形式有单体、二聚体和高聚体,对于放置0 h下的目的蛋白主要以单体和少量二聚体、高聚体形式存在;随着放置时间的延长(0~54 h),单体逐渐减少,二聚体和高聚体逐渐增加,且中性条件下这种变化更快,当放置24 h后,中性条件下的单体条带已基本消失,放置54 h后,其单体条带已经消失不见;另外,从还原SDS-PAGE分析可以看出,目的蛋白多聚体被还原后只有一个单体条带,表明分子间二硫键参与了1Dx5-N多聚体的形成.因此,中性条件更能促进1Dx5-N通过分子间二硫键形成二聚体和高聚体,且随着放置时间的延长(0~54 h),二聚体和高聚体含量增加较快.以上结果表明,


图4 处理时间和pH值对1Dx5-N聚集影响的SDS-PAGE分析
Fig.4 SDS-PAGE analysis of recombinant 1Dx5-N under different time and pH values
与酸性(pH=3.0)和碱性条件(pH=10.0)相比,中性条件更能促进1Dx5-N形成二硫键,且随着放置时间的延长(0~54 h),中性条件下二硫键形成速度最快,碱性次之,酸性最慢.
综合内源荧光光谱、总自由巯基含量测定、非还原和还原SDS-PAGE的分析表明,中性环境更有利于1Dx5-N聚集,且分子间二硫键对聚集体的形成发挥了重要作用.
2.4 AFM分析
图5为不同pH值下1Dx5-N的AFM照片.当1Dx5-N处于中性条件下时,形成了少量的大聚集体颗粒,颗粒直径在100 nm以上,同时还出现了大量颗粒直径约50 nm的较小聚集体颗粒.但是,当溶液pH值调节至酸性(pH=3.0)时,1Dx5-N的聚集体颗粒直径减小,大颗粒聚集体消失,出现了大量颗粒直径约20 nm的小蛋白颗粒;当溶液pH值调节至碱性(pH=10.0)时,聚集体直径进一步减小,其颗粒直径比酸性条件下更小.该结果与内源荧光光谱和非还原SDS-PAGE的实验结果相一致,即中性条件下更有利于1Dx5-N聚集,聚集体颗粒较大;而在酸性和碱性条件下,1Dx5-N会发生解聚,导致聚集体颗粒较小.

图5 不同pH处理下1Dx5-N的AFM照片
3 结论
采用内源荧光光谱、总自由巯基定量、非还原和还原SDS-PAGE以及原子力显微镜等方法研究pH值对1Dx5-N聚集程度的影响,得到以下主要结论:
(1)与酸性和碱性条件下相比,中性条件下1Dx5-N的荧光最大发射波长最小,色氨酸残基所处微环境的极性较低,表明该条件下1Dx5-N形成的聚集体程度增加;
(2)总自由巯基定量、非还原和还原SDS-PAGE测定结果显示,中性条件下1Dx5-N巯基含量较酸性和碱性条件下偏低,且形成了更多的二聚体和多聚体,表明中性环境下更有利于1Dx5-N通过分子间二硫键进行聚集;
(3)观察发现,中性条件下1Dx5-N形成的聚集体颗粒直径较大,进一步说明中性条件下有利于1Dx5-N的聚集.
基于以上分析,本研究从基础理论层面证明了中性条件下进行面制品加工的合理性.
[1] SHEWRY P R,TATHAM A F,BARCELO P,et al.Biotechnology of breadmaking-unraveling and manipulating the multi-protein gluten complex [J].Bio/technology,1995,13(11):1185- 1190.
[2] 王晶,肖安红.小麦中麦谷蛋白亚基组成及其含量与面粉品质关系的研究进展 [J].武汉工业学院学报,2007,26(4):33- 37. WANG Jing,XIAO An-hong.Study on the relationship between constituent and content of glutenin subunit and the quality of flour [J].Journal of Wuhan Polytechnic University,2007,26(4):33- 37.
[3] 刘丽,杨金华,胡银星,等.麦谷蛋白亚基与小麦品质的关系研究进展 [J].中国农业科技导报,2012,14(1):33- 42. LIU Li,YANG Jin-hua,HU Yin-xing,et al.Research progress in effects of glutenin subunits on wheat processing quality [J].Journal of Agricultural Science and Technology,2012,14(1):33- 42.
[4] EGELHAAF SU,SWIETEN E V,BOSMA T,et al.Size and shape of the repetitive domain of high molecular weight wheat gluten proteins(I):Small-angle neutron scattering [J].Biopolymers,2003,69(3):311- 324.
[5] ANJUM F M,KHAN M R,DIN A,et al.Wheat gluten:high molecular weight glutenin subunits—structure,genetics,and relation to dough elasticity [J].Journal of Food Science,2007,72(3):56- 63.
[6] PATTISON A L,APPELBEE M,TRETHOWAN R M.Characteristics of modern triticale quality:glutenin and secalin subunit composition and mixograph properties [J].Journal of Agricultural & Food Cheimstry,2014,62(21):4924- 4931.
[7] CHAN R,CHEN V.The effects of electrolyte concentration and pH on protein aggregation and deposition:critical flux and constant flux membrane filtration [J].Journal of Membrane Science,2001,185(2):177- 192.
[8] DOGUCHI M,HLYNKA I.Some rheological properties of crude gluten mixed in the farinograph [J].Cereal Che-mistry,1967,44(6):561- 575.
[9] HOLMES J T,HOSENEY R C.Chemical leavening:effect of pH and certain ions on breadmaking properties [J].Cereal Chemistry,1987,64(5):343- 348.
[10] JUSTIN R Barone,KIRSTEN Dangaran,WALTER F Schmidt.Blends of cysteine-containing proteins [J].Journal of Agricultural and Food Chemistry,2006,54(15):5393- 5399.
[11] JOYE I J,LAGRAIN B,DELCOUR J A.Use of chemi-cal redox agents and exogenous enzymes to modify the protein network during breadmaking:A review [J].Journal of Cereal Science,2009,50(1):11- 21.
[12] OSZVALD M,BALZS G,TÖMÖSKÖZI S,et al.Comparative study of the effect of incorporated individual wheat storage proteins on mixing properties of rice and wheat doughs [J].Journal of Agricultural & Food Chemi-stry,2011,59(59):9664- 9672.
[13] ANDERSON O D,BEKES F,D’OVIDIO R.Effects of specific domains of high-molecular-weight glutenin subunits on dough properties by an in vitro assay [J].Journal of Cereal Science,2011,54(3):280- 287.
[14] SHEWRY P R,HALFORD N G,TATHAM A S.High molecular weight subunits of wheat glutenin [J].Journal of Cereal Science,1992,15(2):105- 120.
[15] WANG J J,LIU G Y,LIU G,et al.The soluble recombinant N-terminal domain of HMW 1Dx5 and its aggregation behavior [J].Food Research International,2015,78:201- 208.
[16] 姜晴晴,李珊,刘文娟,等.冻融循环对秘鲁鱿鱼蛋白及肌肉品质的影响 [J].现代食品科技,2014(7):171- 178. JIANG Qing-qing,LI Shan,LIU Wen-juan,et al.Effect of freeze-thaw cycles on proteins and muscle quality of dosidicus gigas [J].Modern Food Science and Techno-logy,2014(7):171- 178.
[17] ZHAO Y,CHEN Z,LI J,et al.Changes of microstructure characteristics and intermolecular interactions of preserved egg white gel during pickling [J].Food Chemistry,2016,203:323- 330.
[18] ZHAO Q,SELOMULYA C,XIONG H,et al.Comparison of functional and structural properties of native and industrial process-modified proteins from long-grain indica rice [J].Journal of Cereal Science,2012,56(3):568- 575.[19] 银玉容,刘婉乔,肖凯军.芝麻蛋白的溶解性和乳化性的研究 [J].食品科学,1996(3):3- 6. YIN Yu-rong,LIU Wan-qiao,XIAO Kai-jun.Study on solubility and emulsifying properties of sesame protein [J].Food Science,1996(3):3- 6.
[20] 蒋将.pH偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善 [D].无锡:江南大学,2011.
[21] BABCOCK J J,BRANCALEON L.Bovine serum albumin oligomers in the E- and B-forms at low protein concentration and ionic strength [J].International Journal of Biological Macromolecules,2013,53(2):42- 53.
Effect of pH on Molecular Characteristics of N-Terminal Domain of Wheat HMW-GS 1Dx5
HUSong-qing1,2ZHANGYa-ping1WANGJing-jing1LIUGuang-yi1HUANGYan-bo1,3LILin1,2HOUYi3
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,Guangdong,China; 2.Guangdong Province Key Laboratory for Green Processing of Natural Products and Product Safety,South China University of Technology,Guangzhou 510640,Guangdong,China;3.State Key Laboratory of Pulp and Paper Engineering, South China University of Technology,Guangzhou 510640,Guangdong,China)
By means of intrinsic fluorescence measurements, total free sulfhydryl (SH) quantitation, non-reducing and reducing SDS-PAGE analysis and AFM, the effect of pH on the forming of the N-terminal domain aggregation of high molecular weight glutenin subunits (HMW-GS) 1Dx5 (1Dx5-N) was investigated.The results show that(1) in comparison with the acidic and alkaline conditions, the maximum emission wavelength of 1Dx5-N displays a blue shift under the neutral pH condition(pH 7.0),indicating that 1Dx5-N under the neutral pH condition has a higher degree of aggregation; (2)in comparison with the acidic and alkaline conditions, the 1Dx5-N under the neutral condition is of a lower total free sulfhydryl (SH) content with more dimers and polymers, indicating that, in the aggregation of 1Dx5-N,the neutral condition is more helpful and the disulfide bonds play an important role;and (3) under the neutral pH condition, the aggregation of greater particle size forms, which further proves that the neutral pH condition is superior to the acidic and alkaline conditions in terms of the aggregation of 1Dx5-N.Thus, the rationality of the flour product processing under the neutral condition is demonstrated at the molecular level.
high molecular weight glutenin subunit; N-terminal domain; aggregation
2016- 03- 11
国家自然科学基金资助项目(31171630,31471691,31130042);高等学校博士学科点专项科研基金资助项目(20130172110018);广东省科技计划项目(2014A010107002);佛山市科技计划项目(2015AG10011) Foundation items: Supported by the National Natural Science Foundation of China(31171630,31471691,31130042),the Research Fund for the Doctoral Program of Higher Education of China(20130172110018) and the Science and Technology Planning Project of Guangdong Province(2014A010107002)
胡松青(1972-),男,博士,教授,主要从事食品蛋白质生物化学研究.E-mail:fesqhu@scut.edu.cn
† 通信作者: 侯轶(1973-),女,博士,高级工程师,主要从事生物质利用研究.E-mail:ceyhou@scut.edu.cn
1000- 565X(2016)10- 0137- 06
TS 20
10.3969/j.issn.1000-565X.2016.10.020
