铜纳米簇聚集体的合成、发光与胞内温度传感
2024-03-23孔令灿
孔令灿
(南京医科大学附属无锡市疾病预防控制中心,江苏 无锡 214023)
金属纳米簇是一种由几个到几百个原子组成的纳米材料[1-6]。由于它们的直径(<2 nm)与电子的费米波长非常类似,因此能显示出不连续的电子能级和发光行为[7-11]。金属纳米簇的合成成本低、毒性小、生物相容性好而且结构确定,这些优势使金属纳米簇成为催化、发光、生物成像和超分子组装研究的理想模型,近年来引起了人们的广泛关注[12-14]。目前,人们提出了各种各样的合成策略,如化学还原、化学刻蚀和光还原制备小分子、多肽、蛋白质和DNA稳定的金属纳米簇[15-18]。然而,这些方法要么需要还原剂(如硼氢化钠),要么需要加热,要么纳米簇不发光,给金属纳米簇的广泛应用带来了一定的毒性和限制。
利用纳米簇和纳米簇之间的强相互作用构筑金属纳米簇组装体是一个很好的解决策略[19-22]。张皓等[19]利用簇间强疏水-疏水相互作用制备了形貌和发光可调的铜纳米簇聚集体。据此可以预料,簇间的强氢键相互作用也能够制备强发光的铜纳米簇聚集体。然而,氢键稳定的金属纳米簇聚集体大部分不发光,主要由于它们的有序性和紧密性不足。因此,如何控制氢键的有序性和紧密性,进而制备出具有强发光的金属纳米簇聚集体,特别是价格便宜的铜纳米簇聚集体仍然是一个很大的挑战。
本课题组前期利用金纳米簇、银纳米簇以及铜纳米簇实现了细胞以及细菌内多种重金属的可视化检测和细胞成像[23-26],但是对于氢键稳定的发光聚集体能否顺利跨过细胞膜以及跨过细胞膜后聚集诱导发光能否保持,进而实现细胞成像以及依赖于温度的胞内成像尚不清楚。氢键稳定的聚集体的细胞毒性也不明确,这严重影响了铜纳米簇聚集体在生物医学方面的应用。
基于以上考虑,本研究利用手性D-青霉胺作为稳定剂“一步法”合成了具有强发光的铜纳米簇聚集体,并利用红外光谱、热重分析、X-射线光电子能谱、X-射线衍射、质谱、扫描电镜、透射电镜、发光光谱和激光共聚焦显微镜对其进行了详细研究。本研究为铜纳米簇聚集体的绿色构筑、强发光的实现以及细胞中的应用提供了一个很好的模型和思路。
1 实验部分
1.1 仪器与试剂
Vario EL cube型元素分析仪(德国Elementar公司);Nicolet Nexus 470型傅里叶变换红外光谱仪(美国Nicolet公司);Thermo ESCALAB 250Xi型X-射线光电子能谱仪(美国Thermo Scientific公司);TG/DTA 6300型热重分析仪(日本TG/DTA 6300公司);X’Pert-Pro MPD型X-射线粉末衍射仪(荷兰Panalytical公司);6220 LC/MS-TOF型质谱仪(美国Agilent公司);Quanta 400 FEG型扫描电子显微镜(美国FEI公司);JEOL JEM-2100型透射电子显微镜(日本JEOL公司);UV-2550型紫外可见吸收光谱仪(日本岛津公司);F-4500型发光光谱仪(日本Hitachi公司);FLS920型发光寿命(英国Edinburgh公司);Olympus Fluoview FV1000型激光共聚焦显微镜(日本Olympus公司)。
D-青霉胺(DPA,纯度≥98%),五水硫酸铜(CuSO4·5H2O,纯度≥98%),均购于阿拉丁生化科技股份有限公司(中国上海)。
1.2 铜纳米簇聚集体的合成
将190 mg(1.27 mmol) D-青霉胺溶于200 mL水中,加入CuSO4·5H2O(40 mg,0.16 mmol,5 mL),室温搅拌40 min。随后在10000 r/min条件下离心5 min移除溶剂,固体冻干,得到32.6 mg白色固体,产率96%。元素分析,(CuDPA)n,实测值(计算值),%:C 28.63(28.28); H 4.67(4.71); N 6.29(6.60)。
1.3 测试与表征
将铜纳米簇聚集体在低温下冻干,测量红外光谱、X-射线光电子能谱、热重以及粉末X-射线衍射;将冻干的铜纳米簇聚集体分散在甲醇中测量质谱;将铜纳米簇聚集体粉末分散在水中,并滴在硅片和铜网上干燥,然后在扫描电子显微镜和透射电子显微镜上测量铜纳米簇聚集体的微观结构;将铜纳米簇聚集体粉末分散在水中测量紫外可见吸收光谱、发光光谱以及发光寿命。
按照文献方法测定铜纳米簇聚集体的细胞毒性和细胞成像[23]。具体过程如下:将人肝癌HepG2细胞接种在Dulbecco’s修饰的Eagle’s介质中,加入10 μL 10%(体积分数,下同)的胎牛血清和1%的青霉素/链霉素,然后在96孔板中培养24 h。将不同浓度的铜纳米簇聚集体分散在Dulbecco’s磷酸缓冲液中,替换上述细胞培养液再培养24 h。根据MTT方法测量铜纳米簇聚集体的细胞毒性,每个样品平行测量6次。对于细胞成像实验,将铜纳米簇聚集体溶液(60 μg/mL)和HepG2细胞在激光共聚焦培养皿中培养24 h。将细胞培养液倾倒,并加入少量PBS缓冲溶液清洗细胞表面残留的铜纳米簇聚集体3次,利用激光共聚焦显微镜进行测量。
2 结果与讨论
2.1 铜纳米簇聚集体的合成和表征分析
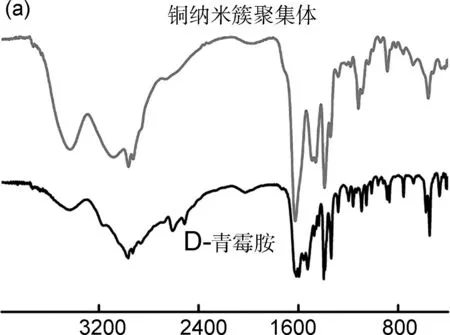
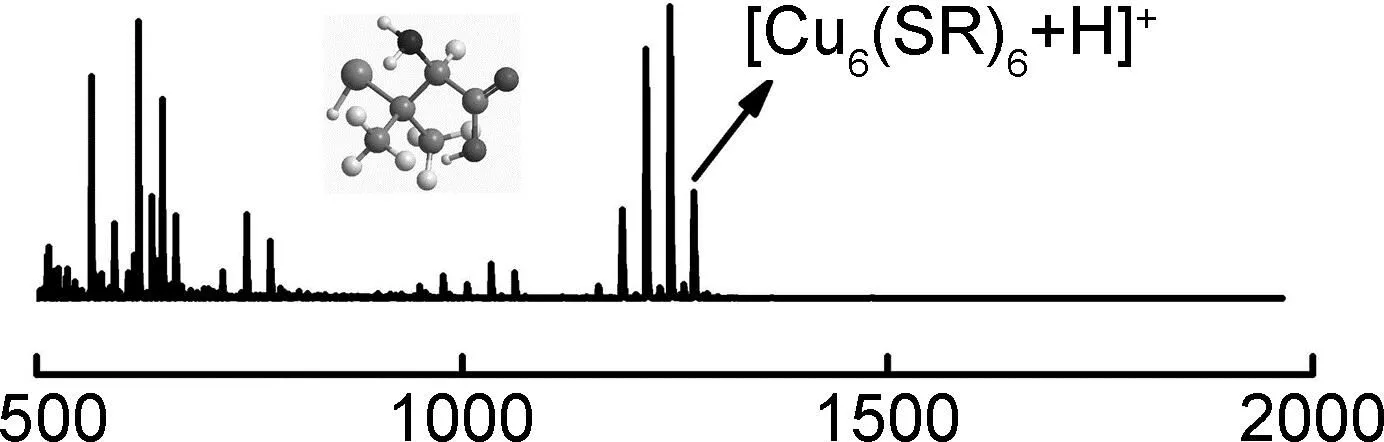
铜纳米簇聚集体是D-青霉胺和CuSO4·5H2O在水中通过“一锅法”合成的。合成方法虽然简单但产率很高(96%)。根据反应4RSH+2Cu2+→2RSCu+RS-SR+4H+(RSH为D-青霉胺)可以清晰地看出:合成纯度高产率好的铜纳米簇聚集体需要投入更多的D-青霉胺,这是由于D-青霉胺既是配体又是还原剂。从节约成本以及合成高纯度的铜纳米簇聚集体的角度考虑,选择了物质的量分数8倍于CuSO4·5H2O的D-青霉胺作为反应物。红外光谱中位于2510 cm-1和2608 cm-1处的透射峰消失,表明S—H键发生了断裂,如图1(a)所示。X-射线光电子能谱出现了Cu 2p,N 1s,C 1s,S 2p的电子结合峰,表明铜纳米簇聚集体已经形成,如图1(b)所示。铜元素和硫元素的物质的量之比为0.96∶1.00,说明铜纳米簇聚集体的化学式是(CuSR)n。在图1(c)和图2中,铜纳米簇聚集体的化学式进一步得到了热重分析和质谱结果的证实。热重分析结果显示,灼烧后的金属质量是原来聚集体质量的30.6%,与理论结果30.2%一致[26]。质谱数据表明,铜纳米簇聚集体构筑基元中最大的分子离子峰是Cu6(SR)6。由于缺少单晶结构,铜纳米簇聚集体的精确结构目前还不能确定,但它们的化学式可以确定为(CuSR)n。为了更好地认识铜纳米簇聚集体的内部结果,本研究测量了它们的X-射线粉末衍射(PXRD),PXRD分析结果表明,铜纳米簇聚集体不仅具有很强的衍射峰,而且衍射成比例关系,如D1,D2,D3和d1,d2,d3,说明铜纳米簇聚集体不仅结晶性好而且是一种层状结构,如图1(d)所示。从化学式(CuSR)n中可以看出,铜纳米簇聚集体中的配体间存在很强的羧基-氨基氢键,它们可能驱动铜纳米簇沿着a,b,c晶轴中的1个或者2个有序排列,另1个晶轴中可能存在多个铜原子形成的铜-铜作用,这种现象在文献中也有报道[27-29]。通过计算,铜纳米簇聚集体中的层间距为1.280 nm(d1)和0.900 nm(D1)。
ν/nm-1
m/z
2.2 铜纳米簇聚集体的形貌和光学性质分析
为了更深入地认识铜纳米簇聚集体的结构,本研究通过扫描电镜、透射电镜以及高分辨透射电镜对它们的形貌进行了详细研究。扫描电镜显示,铜纳米簇聚集体是多层片状结构,这些片层结构堆积在一起形成了1~2 μm的不规则聚集体,如图3(a)所示。这种不规则的聚集体也可以从透射电镜中观察到,如图3(b)所示。由高分辨透射电子显微镜确定了聚集体是纳米簇的聚集体,如图3(c)所示。从图3(c)中可以看出,多个纳米簇堆积在一起且具有很好的晶格条纹,晶格之间的距离约为0.250 nm,这与粉末X-射线衍射是一致的(2θ=35.8°,此衍射峰对应的层间距离是0.251 nm)。

图3 铜纳米簇聚集体:(a)扫描电镜;(b)透射电镜和(c)高分辨透射电镜照片
为了深入认识堆积紧密、排列有序的铜纳米簇聚集体,本研究对其进行了光学性质研究。紫外可见吸收光谱表明,铜纳米簇聚集体具有显著的吸收行为,最大吸收峰在308 nm,如图4(a)所示。通过在360 nm激发,铜纳米簇聚集体显示了很强的聚集诱导发光,发光峰位在615 nm,如图4(b)所示。聚集体粉末的绝对发光量子产率高达30.4%,这样高的发光量子产率说明铜纳米簇聚集体的刚性很强,进一步表明青霉胺配体间存在很强的氢键相互作用。强的氢键作用减小了纳米簇聚集体的非辐射跃迁导致发光增强。铜纳米簇聚集体的发光寿命为25.2 μs。这种微秒级别的发光寿命以及最大吸收峰和最大发光峰之间的巨大差值(307 nm)表明铜纳米簇聚集体的发光是磷光。

波长/纳米
2.3 铜纳米簇聚集体的细胞毒性效应、细胞成像以及依赖于温度的细胞成像
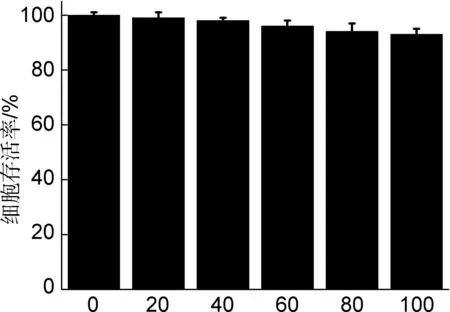
结构稳定、强发光的铜纳米簇聚集体可能在生物方面具有很好的应用前景,比如细胞成像。基于此,本研究分析了铜纳米簇聚集体的细胞毒性和细胞成像行为。将人肝癌HepG2细胞与不同浓度的铜纳米簇聚集体(0,20,40,60,80,100 μg/mL)一起培养24 h后看到细胞的存活率在93%以上,这一结果说明D-青霉胺稳定的铜纳米簇聚集体具有很低的细胞毒性以及良好的生物相容性(图5)。接着以浓度为100 μg/mL的铜纳米簇聚集体为例研究铜纳米簇聚集体的细胞成像。将铜纳米簇聚集体和HepG2细胞一起培养24 h后,可以看到细胞内显示了很强的发光,几乎没有细胞死亡,说明铜纳米簇聚集体具有良好的生物相容性和很小的细胞毒性(图6)。有趣的是,进入细胞的铜纳米簇聚集体显示了很强的绿色发光,这与它们胞外的红色发光有所不同,说明铜纳米簇聚集体进入细胞的过程中可能和细胞中的蛋白、多肽等物质形成了一定的相互作用,影响了铜纳米簇聚集体中的铜-铜距离,最终导致发光颜色变化。
波度/(μg·mL-1)

图6 人肝癌HepG2细胞的(a)亮场,(b)共聚焦荧光以及(c)亮场和共聚焦荧光复合后的激光共聚焦成像照片
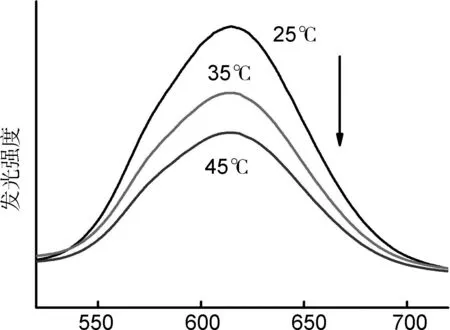
考虑铜纳米簇聚集体具有依赖于温度的发光行为,即当温度升高时发光减弱,这是由于温度升高增加了铜纳米簇聚集体以非辐射跃迁形式释放能量的机会(图7)。在细胞成像的基础上,进一步详细研究依赖于温度的荧光成像行为。将铜纳米簇聚集体和人肝癌HepG2细胞分别在25 ℃,35 ℃和45 ℃条件下一起培养,并测量了细胞成像(图8~10)。在其它温度下HepG2细胞也显示了绿色发光,进一步说明铜纳米簇聚集体和细胞内的蛋白质或者多肽有一定的相互作用,影响了铜纳米簇聚集体中的铜-铜距离,最终导致发光颜色变化。而且,随着温度的升高,细胞体内的发光明显减弱,说明铜纳米簇聚集体在细胞内的结构没有破坏,可以用来在细胞内探测温度。
λ/nm

图8 人肝癌HepG2细胞在25 ℃的(a)亮场,(b)共聚焦荧光以及(c)亮场和共聚焦荧光复合在一起的激光共聚焦成像照片

图9 人肝癌HepG2细胞在35℃的(a)亮场,(b)共聚焦荧光以及(c)亮场和共聚焦荧光复合在一起的激光共聚焦成像照片

图10 人肝癌HepG2细胞在45 ℃的(a)亮场,(b)共聚焦荧光以及(c)亮场和共聚焦荧光复合在一起的激光共聚焦成像照片
3 结论
本文以D-青霉胺为配体在室温下“一步法”
合成了强发光的铜纳米簇聚集体,并通过红外光谱、热重分析、X-射线光电子能谱、X-射线衍射、质谱、扫描电镜、透射电镜、发光光谱和激光共聚焦显微镜表征手段对其进行了详细研究。铜纳米簇聚集体的绝对发光量子产率高达30.4%,这在发光铜纳米簇中是非常罕见的。这种强发光行为是铜纳米簇之间强氢键作用导致的。此外,这些铜纳米簇聚集体显示了很低的细胞毒性,可以用于细胞成像以及胞内温度传感。本研究不仅为铜纳米簇聚集体合成、发光和生物应用提供了一个很好的模型,而且为其它金属纳米簇聚集体的设计和应用提供了重要参考和指导。
