凝胶剂对三元油脂凝胶结构及其荷载量的影响*
2017-01-05刘国琴万文博
刘国琴 万文博
(华南理工大学 食品科学与工程学院, 广东 广州 510640)
凝胶剂对三元油脂凝胶结构及其荷载量的影响*
刘国琴 万文博
(华南理工大学 食品科学与工程学院, 广东 广州 510640)
以玉米油为基料油,通过添加3种不同的凝胶剂(谷甾醇+卵磷脂,神经酰胺和乙基纤维素),制备了荷载姜黄素的三元油脂凝胶体系,并探讨了不同凝胶剂对三元油脂凝胶的流变行为、固体脂肪含量等宏观性质及其微观形貌、晶型结构等微观性质以及荷载量的影响.实验结果表明,谷甾醇+卵磷脂与神经酰胺形成的三元凝胶结构相似,都形成纤维状的结晶结构;前者的结构更为紧密,荷载量[(3.14±0.10)mg/g]和包埋率[(62.78±2.01)%]较高;乙基纤维素形成的凝胶结构与前两种有很大不同,其结晶结构为颗粒状,晶体较小,结构较为松散,但是由于其较高的制备温度,它的荷载水平最佳,荷载量和包埋率分别为(4.810±0.174)mg/g和(96.19±3.48)%.这说明油脂凝胶剂的种类对三元油脂凝胶的性能、微观结构和荷载量都有显著影响.
油脂凝胶;三元体系;姜黄素;凝胶剂;微观结构
近年来,油脂凝胶作为液态油脂结构化的新方法受到了广泛关注.研究人员已开发出了12-羟基硬脂酸[1]、小烛树蜡[2]、长链脂肪酸[3]、谷甾醇+谷维素[4]等有效的凝胶剂,并详细研究了这些凝胶体系的宏观性质和微观结构.但是,目前的研究主要集中在凝胶剂+油相的二元体系上.事实上,已有学者提出将油脂凝胶作为药物荷载的载体应用在医学领域[5].在食品领域,油脂凝胶同样也能作为载体荷载脂溶性的营养素,但关于凝胶剂+营养素+油相这类三元体系的研究还比较少见.
在凝胶体系中,凝胶剂是决定凝胶性能和结构的重要物质.在三元体系中凝胶剂对凝胶性能的研究还非常缺乏.Rogers 等[6]将可食凝胶剂分成了两类;一类是高分子质量聚合物凝胶剂;一类是低分子质量凝胶剂.目前发现安全可食的聚合物凝胶剂仅有乙基纤维素一种,它形成珊瑚状的小晶胞包裹油脂最终形成凝胶[7].低分子质量的凝胶剂较多,如:12-羟基硬脂酸、虫胶等.大多数都是通过非共价键之间的交联自组装构成不同的晶型结构最终形成凝胶.在低分子质量凝胶剂中,神经酰胺的凝胶效果较好,在添加量为油相质量2%时就可以成胶,营养价值也较高,但是关于它的研究较少[8].谷甾醇+卵磷脂同样也是一类低分子质量的凝胶剂[9- 10],它是近年来才开发出的一种新型复合凝胶剂,凝胶效果好,营养价值高,有十分广泛的应用前景.因此,以乙基纤维素、神经酰胺和谷甾醇+谷维素为基础,制备荷载姜黄素的凝胶体系,并对比3种凝胶剂对三元凝胶体系结构和性质的影响十分重要.同时,营养素的荷载能力对于凝胶体系来说也是十分重要的性质,研究凝胶剂种类对凝胶体系荷载能力的影响也具有重要的意义.
本实验拟通过研究凝胶剂种类对三元凝胶体系流变行为、固体脂肪含量等宏观性质及其微观形貌、晶型结构等微观性质以及荷载量的影响,得到凝胶剂种类与凝胶形成机制和凝胶性质的相关性,为三元体系油脂凝胶的实际应用提供理论指导.
1 材料和方法
1.1 材料
1.1.1 原料与试剂
玉米油,东莞市永益食品有限公司生产;磷脂(纯度98%)、乙基纤维素(45~55 m Pa·s,5%甲苯/异丙醇质量比80∶20),均购自阿拉丁试剂公司;神经酰胺(纯度98%),购自阿达玛斯试剂公司;乙醇(纯度95%),购自国药集团化学试剂有限公司.
1.1.2 仪器
Rheostress转矩流变仪,德国HAKKE公司生产;D8 Advance X-射线衍射仪、Minispec l20脉冲核磁共振仪,德国Bruker公司生产;CiPOL偏光显微镜,日本尼康公司生产;Genesys 10s紫外分光光度计,美国ThermoFisher公司生产;DF-101恒温磁力搅拌器,中国巩义市予华仪器公司生产;BCD-225SECH-ES冰箱,中国海尔电器公司生产;LRH-100生化培养箱,中国韶关鑫腾科普仪器公司生产;MS304S电子天平,梅特勒-托利多仪器公司生产.
1.2 试验方法
1.2.1 样品制备
样品A(谷甾醇+卵磷脂油脂凝胶(S+L)):取一定质量的干燥玉米油加热至90 ℃,向其中加入占油脂质量12%的凝胶剂(谷甾醇和卵磷脂的混合物,质量比为8∶2),将此混合体系在90 ℃下加热搅拌至凝胶剂溶解.然后,向混合体系中加入油脂质量0.5%的姜黄素,继续加热搅拌使姜黄素溶解.然后,将热的混合溶液转入5 ℃的冰箱中(这个过程中的平均冷却速率约为10 ℃/min)储藏24 h,然后置于25 ℃的恒温培养箱中储藏5 d.
样品B(神经酰胺油脂凝胶(CO)):取一定质量的干燥玉米油加热至85 ℃,向其中加入占油脂质量12%的神经酰胺,将此混合体系在85 ℃下加热搅拌至凝胶剂溶解.之后的操作如样品A中所述.
样品C(乙基纤维素油脂凝胶(EC)):取一定质量的干燥玉米油加热至170 ℃,向其中加入占油脂质量12%的乙基纤维素,将此二元混合体系在170 ℃下加热搅拌至凝胶剂溶解.之后的操作如样品A中所述.
1.2.2 油脂凝胶流变学行为分析
应变扫描:在开始其他测试之前,需要通过应变扫描来定义油脂凝胶的线性黏弹区(LVR).恒定剪切频率f=1 Hz,锥板直径为 35 mm,角度为 1°,间隙设置为 0.052 mm,测试温度为 25 ℃.再取适量油脂凝胶样品置于锥板与样品台之间,稳定 10 min 后开始测试,获得剪切应变0.001%~10%对应的黏弹性(弹性模量和黏性模量)的变化谱图.
频率扫描:在线性黏弹区范围恒定的低应变水平下(0.01%),对样品进行小变形测试的频率扫描,f为 0.01~100.00 Hz.锥板直径为 35 mm,角度为 1°.间隙设置为 0.052 mm.
流动曲线测定:采用转矩流变仪进行测定,所用锥板直径为 35 mm,角度为 1°,间隙设置为 0.052 mm.取适量油脂凝胶样品置于锥板与样品台之间.在固定的剪切应变下,得到表观黏度值(η*)随着剪切速率(γ)的变化曲线,剪切速率范围 0.01~200 s-1,测试温度为25 ℃,每个样品测试时间为 300 s.
1.2.3 油脂凝胶固体脂肪含量测定
样品的固体脂肪含量(SFC)根据 AOCS Cd 16b—93 标准方法采用德国Bruker公司的Minispec l20脉冲核磁共振仪直接进行测定.将3种油脂凝胶样品分别放入pNMR专用玻璃管中,分别用90、85 ℃和170 ℃熔化 30 min 以消除结晶记忆,然后,在 0 ℃恒温槽中放置 90 min,测其 SFC 值,再依次升温至 10、20、30、40、50、60、70、 和 80 ℃,各保留 30 min,测得各个温度下的 SFC 值,每个样品重复测定3次,取平均值.
1.2.4 油脂凝胶微观结构分析
取热熔胶样品(约 25 μL)滴于预热的载玻片上,盖上盖玻片,5 ℃下储藏24 h,然后置于25 ℃的恒温培养箱中储藏5 d.采用偏光显微镜观察油脂凝胶中晶态聚集体形貌和三维网络情况并拍照.
1.2.5 油脂凝胶晶型分析

1.2.6 荷载量和包埋率的测定
准确称取2 g油脂凝胶样品,用10 mL 95%(质量分数)的乙醇超声提取10 min后过滤,收集滤液.重复此步骤3次.将得到的滤液稀释100倍,用紫外分光光度计测定其吸光值,从吸光值-姜黄素质量浓度标准曲线求得姜黄素的质量浓度,按下列公式计算荷载量和包埋率:


并对3种体系中荷载量和包埋率做差异性的显著性分析.
2 结果与讨论
2.1 凝胶剂种类对三元油脂凝胶流变学行为的影响
2.1.1 凝胶剂种类对三元油脂凝胶强度的影响
流变学是表征材料(溶液、熔体和凝胶等)的流动行为的重要手段,研究油脂凝胶的流变学行为可以提供油脂凝胶弹性、硬度、强度等相关信息.
通过应变扫描确定S+L、EC、CO的线性黏弹区分别为10-5~10-3、10-5~10-2、10-5~10-3.因此选择在应变值为0.01%时进行频率扫描.图1是3种凝胶体系的频率扫描图.从图中可以看出,3种凝胶剂形成的三元凝胶体系的储能模量(G′)都显著大于损耗模量(G″),其储能模量也一直维持在一个较为恒定的范围内,说明这3种三元凝胶体系都是“真凝胶”[11],内部形成了较为稳固的结构,表现出了类固体的性质.
油脂凝胶的强度可以通过体系的储能模量来反映.图2中显示了3种三元凝胶体系的G′和G″的变化情况.S+L体系中凝胶强度最大,EC次之,CO最弱.凝胶的强度是由凝胶内部晶态聚集体和超分子的拓扑结构的差异引起的,体系强度增大说明凝胶内部结晶结构增多,内部交联得更加紧密,形成了更多的结构化的网络结构[12].这些结果表明,S+L体系中的内部结晶结构最多,交联结构最为紧密,凝胶强度最大.
2.1.2 凝胶剂种类对三元油脂凝胶流动曲线的影响
3种不同凝胶剂形成的晶型结构不同,形成的
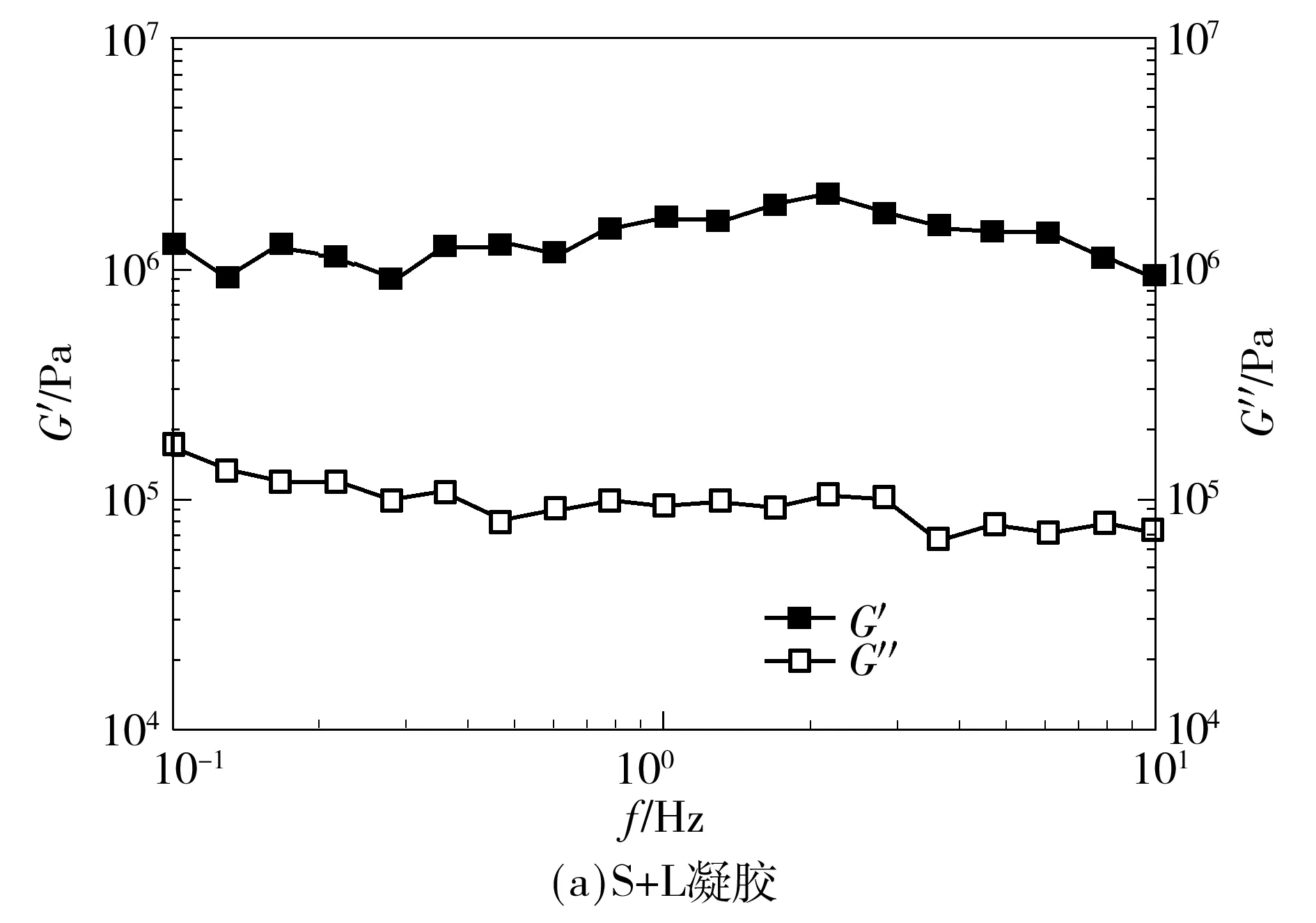


图1 3种不同姜黄素-凝胶体系频率扫描图
Fig.1 Frequency scanning of 3 different curcumin-organogel systems
内部网络结构也有所差异,这些会对三元凝胶体系的粘稠度造成较大的影响.本实验通过测定三元凝胶的流动曲线(见图3)得到不同凝胶体系的粘稠度变化情况.
从图 3可以看出,三元油脂凝胶的表观黏度随着剪切速率的增加逐渐降低,表现出剪切变稀的假塑性.一般假塑性体的表观黏度与剪切速率的关系符合幂律方程[13]:


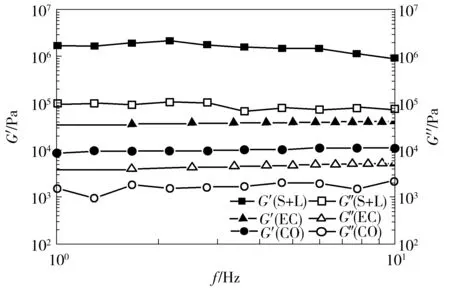
图2 不同凝胶剂对姜黄素-油脂凝胶体系中储能模量和损耗模量的影响
Fig.2 Effect of structurant on storage modulus and loss modulus in curcumin-organogel system
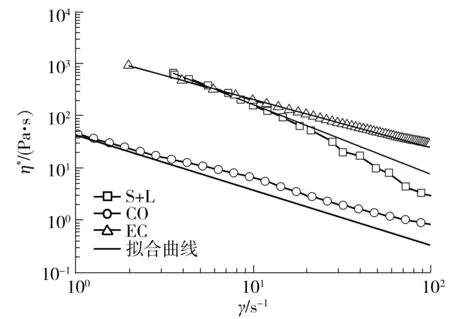
图3 3种姜黄素-油脂凝胶体系的流动曲线
Fig.3 Flow curves of three kinds of curcumin-organogel systems
流动曲线通过拟合之后得到的K值和n值如表1所示.拟合函数的相关系数平方值(R2)在0.991~0.999之间,说明表观黏度和剪切速率试验数据的关系符合幂律方程关系式.实验结果表明,3种三元凝胶体系中稠度系数的变化是:S+L>EC>CO.稠度系数的增加说明体系具有更紧密的结构,

表1 姜黄素-油脂凝胶的K值和n值
即3种三元油脂凝胶网络结构中S+L所形成的内部三维结构最为稳定和坚固,交联最为紧密,这与凝胶剂种类对凝胶强度的影响结果一致.
流变测试的结果表明,3种凝胶体系中,谷甾醇+卵磷脂所构成的凝胶强度最大,黏度最大,内部交联最紧密.
2.2 凝胶剂种类对三元凝胶体系固体脂肪含量的影响
可塑性是塑性脂肪最重要的特性之一,而塑性脂肪中固体脂肪含量以及结晶颗粒的大小等因素决定了它的可塑性.在油脂凝胶体系中,由于发生固化的物质不是甘油三酯而是凝胶剂分子,因此在油脂凝胶体系中的SFC指的是发生固化的凝胶剂含量.固化的凝胶剂分子所形成的晶体网络和分散在此网络中的液体植物油共同组成了具有特殊功能特性的油脂凝胶,因此,研究固化的凝胶剂含量变化对于后续的油脂凝胶功能特性的探讨非常重要.图4为3种三元凝胶体系的固体脂肪含量随温度的变化情况.

图4 凝胶剂种类对姜黄素-油脂凝胶体系SFC的影响
Fig.4 Effects of structurant on SFC of curcumin-organogel systems
从图4中可以看出,3种三元凝胶体系在0 ℃时SFC值相差不大,都在9%左右.实验中添加的凝胶剂占油脂质量的12%,说明3种体系中都有部分的凝胶剂没有形成结晶结构.并且,SFC没有大幅度增加也说明在凝胶过程中油中的脂肪酸没有发生化学反应[14].从图4还可看出,随着温度的增加,3种三元凝胶体系中SFC的下降速度为:CO>S+L>EC,凝胶体系中SFC值主要决定于凝胶剂分子的含量,因为3种三元凝胶剂中,乙基纤维素的熔点最高,谷甾醇+卵磷脂次之,神经酰胺最低.因此随着温度升高,CO体系中SFC值下降得最快,在60 ℃时体系中已不含有固相成分;EC体系中固相成分的含量较为稳定,80 ℃时还维持在8%左右.
据报道,商品起酥油在 20 ℃下的 SFC 值(由结晶的 TAG 分子提供)就已经达到30%左右.本研究中油脂凝胶体系的 SFC 值(由结晶的凝胶剂分子提供)只达到10%左右.这也反映了植物油在采用不同的固化机制获得相近的物理性能时,油脂凝胶固化机制途径具有一定的优势.
2.3 凝胶剂种类对三元油脂凝胶微观结构的影响
三维结晶网络结构的存在是油脂凝胶具有粘弹性行为等宏观性能的基础,并且根据宏观性能的研究尚不能明确姜黄素是否参与了凝胶形成的过程,因此,为了更深入地研究之前所分析的油脂凝胶在流变学行为和固体脂肪含量等宏观性能上的差异的原因和姜黄素在凝胶形成过程中的参与程度,本研究采用偏光显微镜观察了凝胶剂组成不同情况下得到的三元油脂凝胶体系内部晶态聚集体的形貌和三维晶态网络结构(见图5).






图5 3种姜黄素三元凝胶体系的偏光显微照片
对比3种三元凝胶体系添加姜黄素前后的微观结构图(图5(a1)和5(a2),图5(b1)和5(b2),图5(c1)和5(c2))可以发现两者的微观结构几乎没有改变,说明姜黄素并没有参与凝胶网络结构的形成,体系中的结晶结构全部由凝胶剂分子提供.姜黄素在高温下溶解于油中,进而被凝胶剂分子形成的网络结构所包裹.Yu等[15]在研究单甘脂形成的凝胶时也得到过相同的实验结果.
同时,对比图5(a1)、5(b1)和5(c1)可以看出,3种三元凝胶剂分子形成的网络结晶结构差异很大.S+L和CO形成纤维状的结晶,结构类似,但前者的结晶长度和宽度要稍大一些,网络交联也更紧密一些;而EC形成的网络结晶结构接近颗粒状,交联得也不是很紧密.结合之前的宏观性能分析可以看出,S+L和CO两种凝胶体系的网络结晶情况和相关性质是比较相似的,S+L所形成的凝胶体系结晶区更多,交联更加紧密,因此,相比于CO体系,它的粘弹性更好,凝胶强度更大.而EC体系中,它的结晶方式和以上两种凝胶剂区别较大,形成的是颗粒状结晶,而且晶体网络之间的交联不是十分紧密.从宏观性质的结果分析得到:EC体系的粘弹性介于S+L和CO之间,固体脂肪含量较高,说明这种EC形成的此种结晶网络结构质地较硬,熔点较高.
图6中显示的是3种三元凝胶的外观形貌,从图中可以进一步看出,S+L和CO体系的结构是比较类似的,形成的凝胶表面都较光滑,并且呈黏稠不透明状,而EC表面不光滑,颗粒感较明显,形成的是透明的凝胶.以上的实验结果可以表明,3种三元凝胶的宏观性能与其微观三维网络结构有着密切的关系.



图6 3种姜黄素-凝胶体系的外观形貌
Fig.6 Appearances of three kinds of curcumin-organogel systems
2.4 凝胶剂种类对三元油脂凝胶晶型的影响
通过偏光显微镜得到的偏光照片只能粗略地看出体系内部的结晶情况,凝胶形成具体的晶型还需要通过X-射线衍射来进行深入的分析.3种三元凝胶体系的XRD谱图如图7所示.由图7可见,添加姜黄素和未添加姜黄素的凝胶体系的XRD谱图的衍射峰的种类和强度都没有明显区别,说明3种三元凝胶体系中姜黄素没有参与结晶形成的过程,进一步验证了2.3节中得到的结果.

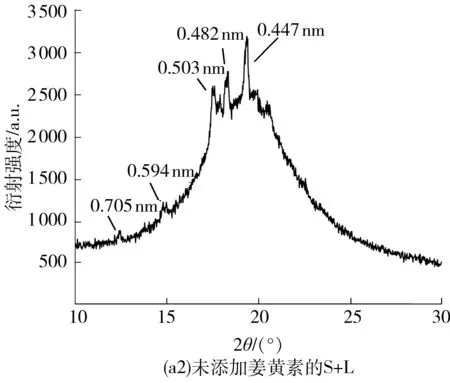




图7 3种凝胶体系的XRD谱图
对比图7(a1)、7(b1)、7(c1) 可以看出:S+L体系中的结晶结构种类最多,其中短间距值d为0.458 nm是典型的油脂中的β晶型衍射峰[16],这种晶型的亚晶胞为三斜结晶,熔点较高,稳定性好;CO体系中主要晶型的短间距值范围为0.418~0.357 nm,这个范围内的短间距值是β′晶型的特征衍射峰,它的亚晶胞为正交结晶,熔点和稳定性适中,值得注意的是,此种晶型构成的固体脂肪的口感是最好的;EC的XRD谱图中只出现了短间距值为0.459、0.445和0.440 nm的晶型,可以认为它们同属于β晶型衍射峰,并且这些衍射峰的强度很弱.证明在EC体系中只存在β这一种晶型结构,此种晶型的稳定性和熔点较高,验证了其在流变学和固体脂肪含量中表现出的独特性质.同时,衍射峰的强度很弱说明各晶胞之间的交联很弱,组装体的数量较少.
由于3种三元油脂凝胶体系结晶机理的不同使得它们形成的晶体结构产生了较大的差异,这可以满足制备不同食品专用油脂的需求.
2.5 凝胶剂种类对三元油脂凝胶荷载能力的影响
通过对油脂凝胶宏观和微观性质的分析发现姜黄素没有参与凝胶的形成过程,这个结果与Yu等[15]的研究结果一致,因此进一步证明了凝胶体系的网络致密程度直接影响其荷载营养素的能力.3种三元凝胶剂形成的凝胶体系中姜黄素的荷载量和包埋率如表2所示.
表2 3种凝胶体系中姜黄素的荷载量和包埋率1)
Table 2 Loading capacity and encapsulation efficiency of organogels with different structurants

凝胶剂种类荷载量/(mg·g-1)包埋率/%谷甾醇+卵磷脂3.14±0.10b62.78±2.01b神经酰胺2.747±0.034a54.94±1.98a乙基纤维素4.810±0.174c96.19±3.48c
1)在同一列中平均值±标准差所带字母不同时说明差异显著(P<0.05).
从表2中可以看出,3种三元凝胶体系中EC的荷载量最大,S+L次之,CO荷载量最少.比较S+L和CO体系的实验结果可以得到,凝胶网络结构越紧密,结晶结构越多,姜黄素的荷载量就越大.而乙基纤维素体系的网络交联是最弱的,结晶结构也较少,但它的荷载量最大.这里需要考虑到乙基纤维素体系的制备温度,乙基纤维素凝胶的制备温度为170 ℃,是其他两种体系的2倍左右.较高的制备温度使得姜黄素在油中的溶解度增加,进而增加了EC体系的荷载量.
这部分的实验结果也进一步验证了姜黄素荷载的机理:姜黄素首先溶解于油脂中,然后通过凝胶剂分子形成的网络结构将其包裹住,进而被荷载在油脂凝胶体系中.因此,较高的制备温度和较紧密的网络结构可以有效地提高姜黄素的荷载量.也就是说,可以通过调控油脂凝胶的制备温度,同时改变凝胶剂的种类来调节体系的三维网络结构的方式提高油脂凝胶的荷载量,为其实际应用提供理论帮助.
3 结论
(1)谷甾醇+卵磷脂和神经酰胺形成的三元凝胶体系结构相似,都是纤维状的结晶结构;但前者的晶体结构更大,结构更加紧密;而乙基纤维素形成的三元油脂凝胶体系其晶体结构是颗粒状的结晶结构,晶体之间的交联也比较松散,但是其凝胶强度介于谷甾醇+卵磷脂和神经酰胺形成的三元凝胶体系之间,这可能是由体系中结晶结构硬度较大造成的.
(2)3种三元凝胶体系的SFC含量在低温时相差较小,随着温度升高SFC值逐渐降低,降低的速率和凝胶剂分子的熔点呈负相关.
(3)油脂凝胶的制备温度和形成的微观结构对荷载量有很大的影响.
(4)本研究表明三元油脂凝胶的性质及荷载量与凝胶剂种类紧密相关,这与凝胶剂对二元凝胶体系的影响类似,在实际生产中可以通过改变凝胶剂种类得到具有各种功能性和营养性的塑性脂肪,同时它还可以作为一种有效的脂溶性营养素运载体系应用于食品工业中和药物制备中.
[1] ROGERS M A,WRIGHT A J,MARANGONI A G.Crystalline stability of self-assembled fibrillar networks of 12-hydroxystearic acid in edible oils [J].Food Research International,2008,41(10):1026- 1034.
[2] ALVAREZ-MITRE F M,TORO-VZQUEZ J F,MOSCOSA-SANTILLN M.Shear rate and cooling modeling for the study of candelilla wax organogels’ rheological properties [J].Journal of Food Engineering,2013,119(3):611- 618.
[3] DANIEL J,RAJASEKHARAN R.Organogelation of plant oils and hydrocarbons by long-chain saturated FA,fatty alcohols,wax esters,and dicarboxylic acids [J].Journal of the American Oil Chemists Society,2003,80(5):417- 421.
[4] BOT A,ADEL R D,ROIJERS E C.Fibrils ofγ-oryzanol+β-sitosterol in edible oil organogels [J].Journal of the American Oil Chemists Society,2008,85(12):1127- 1134.
[5] BHATIA A,SINGH B,RAZA K,et al.Tamoxifen-loaded lecithin organogel(LO) for topical application:Development,optimization and characterization [J].International Journal of Pharmaceutics,2013,444(1/2):47- 59.
[6] ROGERS M A,STROBER T,BOT A,et al.Edible oleogels in molecular gastronomy [J].International Journal of Gastronomy & Food Science,2014,2(1):22- 31.
[7] ZETZL A K,MARANGONI A G,BARBUT S.Mechanical properties of ethylcellulose oleogels and their potential for saturated fat reduction in frankfurters [J].Food & Function,2012,3(3):327- 337.
[8] ROGERS M A,WRIGHT A J,MARANGONI A G.Oil organogels:the fat of the future? [J].Soft Matter,2009,5(8):1594- 1596.
[9] HAN L J,LI L,ZHAO L,et al.Rheological properties of organogels developed by sitosterol and lecithin [J].Food Research International,2013,53(1):42- 48.
[10] HAN L,LI L,LI B,et al.Structure and physical properties of organogels developed by sitosterol and lecithin with sunflower oil [J].Journal of the American Oil Chemists Society,2014,91(10):1783- 1792.
[11] ALMDAL K,DYRE J,HVIDT S,et al.Towards a phenomenological definition of the term ‘gel’ [J].Polymer Gels & Networks,1993,1(1):5- 17.
[12] PIEVE S D,CALLIGARIS S,PANOZZO A,et al.Effect of monoglyceride organogel structure on cod liver oil stability [J].Food Research International,2011,44(9):2978- 2983.
[13] NARSIMHAN G.Rheological methods in food process engineering:By James F.Steffe [J].Journal of Food Engineering,1994,23(2):249- 250.
[15] YU H,KE S,DONG L,et al.Development of a food-grade organogel with high bioaccessibility and loading of curcuminoids [J].Food Chemistry,2012,131(1):48- 54.
[16] 张阜青,王兴国,胡鹏,等.不同硬度棕榈油基人造奶油组成及结晶行为研究 [J].中国油脂,2009,34(9):30- 34. ZHANG Fu-qing,WANG Xing-guo,HU Peng,et al.Composition and crystallization behavior of palm oil-based margarine with different hardness [J].China Qils and Fats,2009,34(9):30- 34.
Effects of Structurants on Structure and Loading Capacity of Ternary Organogels
LIUGuo-qinWANWen-bo
(School of Food Science and Engineering, South China University of Technology, Guangzhou 510640, Guangdong, China)
Ternary curcumin-organogels were prepared based on corn oil and by using sitosterol+letithin,cera-mide,ethyecellulose as thestructurants.Then,the effects of the structurants on the macroscopic properties (the rheological behaviors,the solid fat content,etc)and the microscopic properties (the microstructures,the crystalline structure,etc) of ternary organogels were discussed,and the corresponding loading capacities were also evaluated.Experimental results show that (1) the structures of sitosterol+letithin-organogels and ceramide-organogels are similar and are both fibrous crystal structure,and the former exhibits a tighter network with higher encapsulation efficiency (EE) and loading capacity (LC),which are respectively (3.14±0.10)mg/g and (62.78±2.01)%; (2) however,the structure of ethyecellulose-organogelsis totally different from the above two structures,and it is granular with a smaller crystal and relatively loose network;and (3) because of higher preparation temperature,ethyecellulose-organogels show the highest load level,specifically,LC and EE are respectively(4.810±0.174)mg/g and (96.19±3.48)%.The above results indicate that the structurants significantly affect the properties,microstructures and loading capacity of organogels.
organogel;ternary systems;curcumin;structurants;microstructure
2015- 09- 02
国家自然科学基金资助项目(31471677,31271885);国家高技术研究发展计划项目(2013AA102103);公益性行业(农业)科研专项(201303072) Foundation items: Supported by the National Natural Science Foundation of China(31471677,31271885),the National High-tech Research and Development Project(2013AA102103) and the Public Welfare Industry(Agriculture) Research Project(201303072)
刘国琴(1962-),女,教授,博士生导师,主要从事油脂与植物蛋白研究.E-mail:liuguoqin2009@126.com
1000- 565X(2016)10- 0143- 08
TS 22
10.3969/j.issn.1000-565X.2016.10.021
