内蒙古荒漠草原植物遗传多样性对模拟增温处理的响应
2016-12-28李春瑞田青松杜建材王忠武
曹 路,李春瑞,田青松,杜建材,王忠武,韩 冰,*
1 中国农业科学院草原研究所,呼和浩特 010018 2 内蒙古农业大学生命科学学院,呼和浩特 010018 3 内蒙古农业大学生态与环境学院, 呼和浩特 010018
内蒙古荒漠草原植物遗传多样性对模拟增温处理的响应
曹 路1,2,李春瑞1,2,田青松1,杜建材1,王忠武3,韩 冰1,2,*
1 中国农业科学院草原研究所,呼和浩特 010018 2 内蒙古农业大学生命科学学院,呼和浩特 010018 3 内蒙古农业大学生态与环境学院, 呼和浩特 010018
为探究全球变暖对温带荒漠草原地上种群的遗传影响,对已经接受模拟增温处理6年的短花针茅草原4种不同生活型植物,即半灌木、多年生禾草、多年生杂类草和一年生植物,应用AFLP分子标记方法研究了其遗传多样性和遗传结构。结果显示,对照处理与增温处理下的木地肤、短花针茅、细叶葱、猪毛菜4种植物的多态位点百分率(PPB)分别为11.32%,11.32%;40.83%,39.91%;14.29%,13.10%;19.85%,19.12%。Nei′s基因多样性指数(He)分别为0.0274,0.0259;0.0812,0.0899;0.0131,0.0084;0.0506,0.0456。Shannon′s 信息指数值(I)分别为0.0447,0.0430;0.1354,0.1466;0.0267,0.0182;0.0811,0.0733。分子方差分析(AMOVA)显示4种植物的变异主要来源于实验处理内部,木地肤为85.03%,短花针茅为66.35%,细叶葱为70.00%,猪毛菜为66.52%;增温处理间的变异分别占-2.81%,-5.47%,-3.60%,2.53%(P>0.05)。4种植物增温处理与变异程度之间在统计学上并无相关性。研究表明虽然短时间的模拟增温并不足以使4种生活型植物种群遗传多样性和遗传结构发生显著变化,但相对于3种多年生植物,一年生植物猪毛菜更容易受到增温影响。多年生和一年生植物对增温具有不同的遗传响应。
木地肤;短花针茅;细叶葱;猪毛菜;遗传多样性;扩增片段长度多态性(AFLP);模拟增温
气候是决定地球上植被类型及物种分布最主要的因素,而植被类型和物种分布是地球气候最鲜明的反映和标志。目前,人们普遍认同环境变化必然引起植物群落结构和功能的改变,如果这种变化持续下去,影响将是深刻而持久的[1- 2]。已有的研究结果表明,增温使发草(Deschampsiacaespitosa)、黑褐苔草(Carexalrofusca)、羊草(Leymuschinensis)的生物量有所增加;矮篙草草甸建群种和主要伴生种春季物候期提前,秋季物候期推迟;川西北高寒草甸植物发草(Deschampsiacaespitosa)的植物光合速率增加;而对植物气孔导度变化没有规律,叶片中钠、钾、磷的含量显著下降[3- 4]。李英年[5]对矮嵩草(Kobresiahumilis)草甸的模拟增温研究表明,短期增温条件下群落的总生物量变化不明显,增温导致禾草生物量显著增加,而杂类草生物量显著减少。田云录[6]利用开放式主动增温系统模拟增温使冬小麦(Triticumaestivum)地上生物量、产量、有效穗数和千粒重显著提高。在贺刚[7]对烟苗的研究中,增温增加了烟苗茎粗、叶片数、干物质含量。而在模拟增温条件下有关植物种群遗传多样性和遗传结构的研究还相对较少。
在全球气候变化的背景下,中国的气候与环境也发生了显著变化[8]。近50年的观测发现,内蒙古自治区的气候也有明显变暖的趋势。根据马瑞芳的研究[9],内蒙古荒漠草原气温呈现波动式升高的规律,平均温度从20世纪50年代的8.1℃增加到90年代的9.0℃。
为了更准确地预测未来气候变化对生态系统的影响,由国家自然科学基金委资助,在我国温带典型草原进行了“全球变暖背景下白天和夜间增温对温带草原群落结构和生态系统功能的特异性影响”的增温实验。本研究所在的“内蒙古农牧科学院四子王旗实验基地”是设置在该增温样带上荒漠草原的一个观测站点,地处内蒙古乌兰察布市四子王旗王府一队。在模拟全球气候变暖的条件下,以红外线辐射器照射提高温度为手段[10],在野外自然条件中进行生态系统控制性增温实验。经测定经过增温处理1年后样地内的0cm,7.5cm,15cm,30cm 和 50cm 土壤平均温度与不增温样地相比,平均增加了1.32℃,0.92℃,0.88℃,0.80℃,0.74℃[11]。目前在该实验区内已经取得了大量的实验成果,模拟增温使荒漠草原上的短花针茅(Stipabreviflora)、冷蒿(Artemisiafrigida)、无芒隐子草(Cleistogenessongorica)、木地肤(Kochiaprostrata)、阿氏旋花(Convolvulusammannii)、细叶葱(Alliumtenuissimum)春季返青提前,总物候持续天数延长[11];但未能显著促进土壤呼吸[12];没有明显改变植物群落的组成[13];模拟增温和氮素添加降低荒漠草原多年生植物氮素回收效率[14]。本研究选择了4种生活型植物,分别属于灌木、半灌木(Shrubs、halfshrubs)的木地肤、多年生禾草(Perennialgrasses)的短花针茅、多年生杂类草(Perennialforbs)的细叶葱以及一、二年生植物(Annualsandbiennials)中的猪毛菜(Salsolacollina)。运用扩增片段长度多态性(amplified fragment length polymorphism,AFLP)方法,研究温度增加对荒漠草原4种生活型植物种群结构和遗传多样性的影响,揭示从2006年5月3日开始增温至2012年7月14日,上述4种植物种群遗传多样性对模拟增温的响应趋势,为预测野生牧草的产量、品质变化及维持生态系统稳定性,探究荒漠草原不同生活型的野生牧草对环境变化的适应潜能提供实验依据。
1 材料与方法
1.1 样地概况及增温设置
实验样地设立在内蒙古四子王旗境内的“内蒙古农牧科学院四子王旗实验基地”。地理位置为东经111°53′41 7",北纬41°46′43 6",海拔高度1456m,年均降水量约为248mm,年平均气温2—5℃,土壤为淡栗钙土。该区是处于内蒙古中部、阴山山脉以北乌兰察布高原地区的荒漠草原,是内蒙古草原的重要组成部分,也是草原区向荒漠区过渡的旱生性最强的草原生态系统。荒漠草原以其独特的种类组成、结构和功能,以及地理分布规律和独特的自然景观,成为亚洲中部的一种特殊的、十分重要的生态系统类型,具有强烈的大陆性特点。荒漠草原是草原中最旱生的类型,建群种由强旱生丛生禾草组成,经常生有大量的强旱生的小半灌木、并在群落中形成稳定的优势层片。试验区属于以短花针茅为建群种的荒漠草原的地带性植被,草地植物群落类型为短花针茅+冷篙+无芒隐子草,植被草层低矮,平均高度为8cm,且植被较稀疏,盖度为12%—18%,种类组成较贫乏,植物群落主要由20多种植物组成,建群种为短花针茅,优势种为冷篙、无芒隐子草。研究区域内植物类型划分见表1。
该样地在野外自然条件下进行生态系统控制增温实验,设置增温处理小区和对照处理小区,每处理6次重复,共12个小区。样地内增温处理小区和对照小区为随机分布,每个小区面积为3m×4m=12m2;在6个增温小区内各安装一个红外线辐射器(Infrared Radiator)进行加热,该装置通过悬挂于样地中央上方、可以散发红外线辐射的灯管来实现模拟气候变暖。红外线辐射器由美国伯利恒Kalglo电子公司(Kalglo Electronics Bethlehem, PA,USA)生产,在对照小区同样安装用于悬挂灯管的装置,但不安装灯管,用以消除增温装置对样地内植物生长环境的影响。从2006年5月3日开始加热。样地示意图见图1。

表1 样地内植物生活型功能群组成
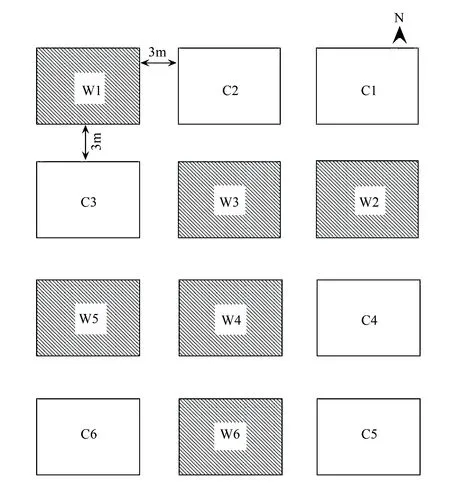
图1 样地示意图Fig.1 Schematic plots 灰色阴影小区(W1—W6)为增温处理(Warming)小区,白色小区(C1—C6)为空白对照(Control)小区
1.2 样品采集与DNA提取
2012年7月,在植物生长旺盛期,分别采集增温小区和对照小区的木地肤、短花针茅、细叶葱、猪毛菜(因W6、C6小区中木地肤和猪毛菜数量极少,数据分析过程中予以剔除)。在每个小区每种植物分单株采样,选择健康无病斑的植物将嫩叶剪下,用无菌水冲洗干净后置放于2ml冻存管中,立即投放在液氮罐中备用。具体采样情况见表2。
采用CTAB法提取基因组DNA[15]。用琼脂糖凝胶电泳检测DNA完整性,用紫外分光光度计检测DNA纯度和浓度。条带单一明亮,OD(A260/280)值在1.8—2.0之间,表明所提取的DNA纯度高,可用于AFLP的操作。将DNA浓度稀释至50ng/μL,于-20℃保存备用。
1.3 PCR扩增与数据统计
AFLP扩增参照Vos[16]等的方法。EcoR I和Mse I酶切后连接接头,进行预扩增,反应程序:94℃预变性3min; (94℃, 40s; 60℃, 40s; 72℃, 60s) ×35循环;72℃,10min。每种植物从32对选择性扩增引物中筛选出5对信号强度一致、条带分布均匀、清晰并具有多态性的引物进行后续实验。扩增产物用8%的聚丙烯酰胺凝胶电泳检测。银染后室温干燥过夜,扫描图像。AFLP条带大小从100—1500 bp,按照电泳结果中,同一迁移率上条带的有无进行统计,有条带的记为“1”,无条带的记为“0”,获得01矩阵。
1.4 数据分析
根据AFLP获得的01矩阵,分别利用POPGEN 1.31[17]软件计算4种生活型植物处理间的位点数,多态位点数,多态位点百分率(PPB),Nei′s基因多样性指数(He),Shannon′s信息指数(I),遗传一致度和遗传距离。利用NTSYS 2.1[18]软件进行非加权算术平均法(UPGMA)聚类。并利用Arlequin3.11[19]软件进行分子方差分析及等级剖分分析。
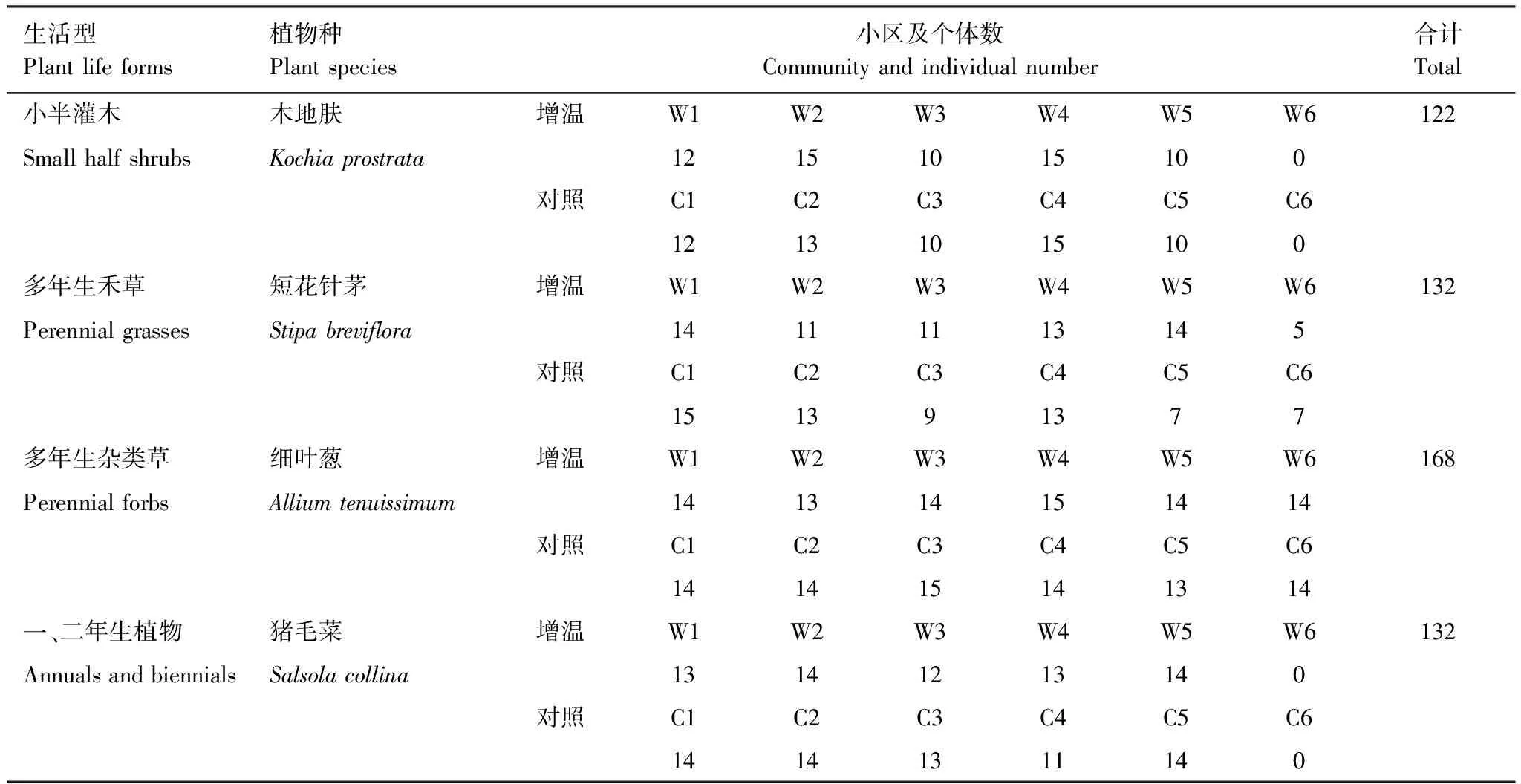
表2 4种生活型植物的采样情况
2 结果与分析
2.1 遗传多样性分析
经过POPGEN 1.32软件的计算,木地肤5对引物扩增出106个位点,其中对照小区多态性位点12个,多态位点百分率11.32%;增温小区多态性位点12个,多态位点百分率11.32%。短花针茅5对引物扩增出218个位点,其中对照小区多态性位点89个,多态位点比例40.83%;增温小区多态性位点87个,多态位点百分率39.91%。细叶葱5对引物扩增出84个位点,其中对照小区多态性位点12个,多态位点百分率14.29%;增温小区多态性位点11个,多态位点百分率13.10%。猪毛菜5对引物扩增出136个位点,其中对照小区多态性位点27个,多态位点百分率19.85%;增温小区多态性位点26个,多态位点百分率19.12%。Nei′s基因多样性指数与Shannon′s 信息指数普遍较低,4种植物对照与增温处理下的Nei′s基因多样性指数(He)分别为0.0274,0.0259(木地肤);0.0812,0.0899(短花针茅);0.0131,0.0084(细叶葱);0.0506,0.04569(猪毛菜)。Shannon′s 信息指数值(I)分别为0.0447,0.0430(木地肤);0.1354,0.14669(短花针茅);0.0267,0.0182(细叶葱);0.0811,0.07339(猪毛菜)。4种植物在增温处理和对照间的遗传差异较小(表3)。增温处理并未对其遗传多样性产生明显影响。
2.2 遗传分化
遗传一致度和遗传距离代表了不同处理间的植物的亲缘关系。遗传一致度越大、遗传距离越小,则亲缘关系较近。由表4可见木地肤、短花针茅、细叶葱和猪毛菜增温与对照之间的的遗传一致度分别为0.9999,0.9963,0.9994,0.9929;遗传距离分别为0.0001,0.0037,0.0006,0.0071。其中猪毛菜的遗传一致度最小为0.9929,遗传距离最远为0.0071。
根据遗传一致度,利用NTSYS 2.10软件进行非加权组平均法(unweighted pair-group method with arithmetic means, UPGMA)聚类。图2为4种植物的不同小区间的聚类图,其中木地肤增温处理小区W4、W1、W3分别依次和对照小区的C5、C4、C3形成3个一级聚类,依次形成的二、三级及高级聚类都没有将增温和对照小区聚为大类;短花针茅虽然C1和C2、W1和W2、C3和C6这6个小区分别形成3个相同处理的一级聚类,但是在更高级的聚类中没有相同规律;细叶葱的C1和W4形成一级聚类,W2、W3和C3形成一级聚类,然后依次与C4、W6和C5形成二、三、四级聚类;猪毛菜W3和W5,C4和W4,W1和W2分别形成一级聚类,进一步的聚类也没有规律。可见4种植物并没有按照增温与对照处理的聚为不同的两支,聚类皆没有规律可循。
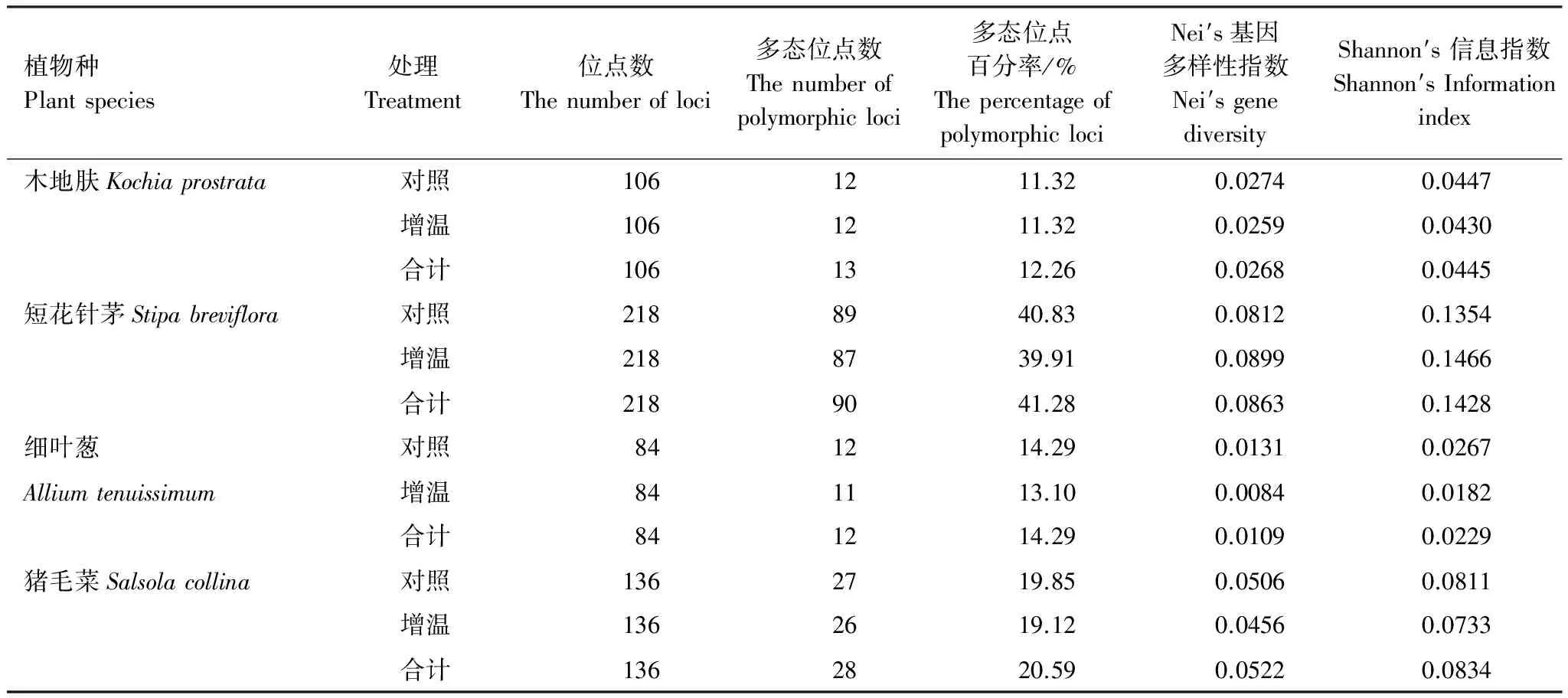
表3 4种植物的遗传多样性分析

表 4 4种植物处理间的遗传一致度和遗传距离
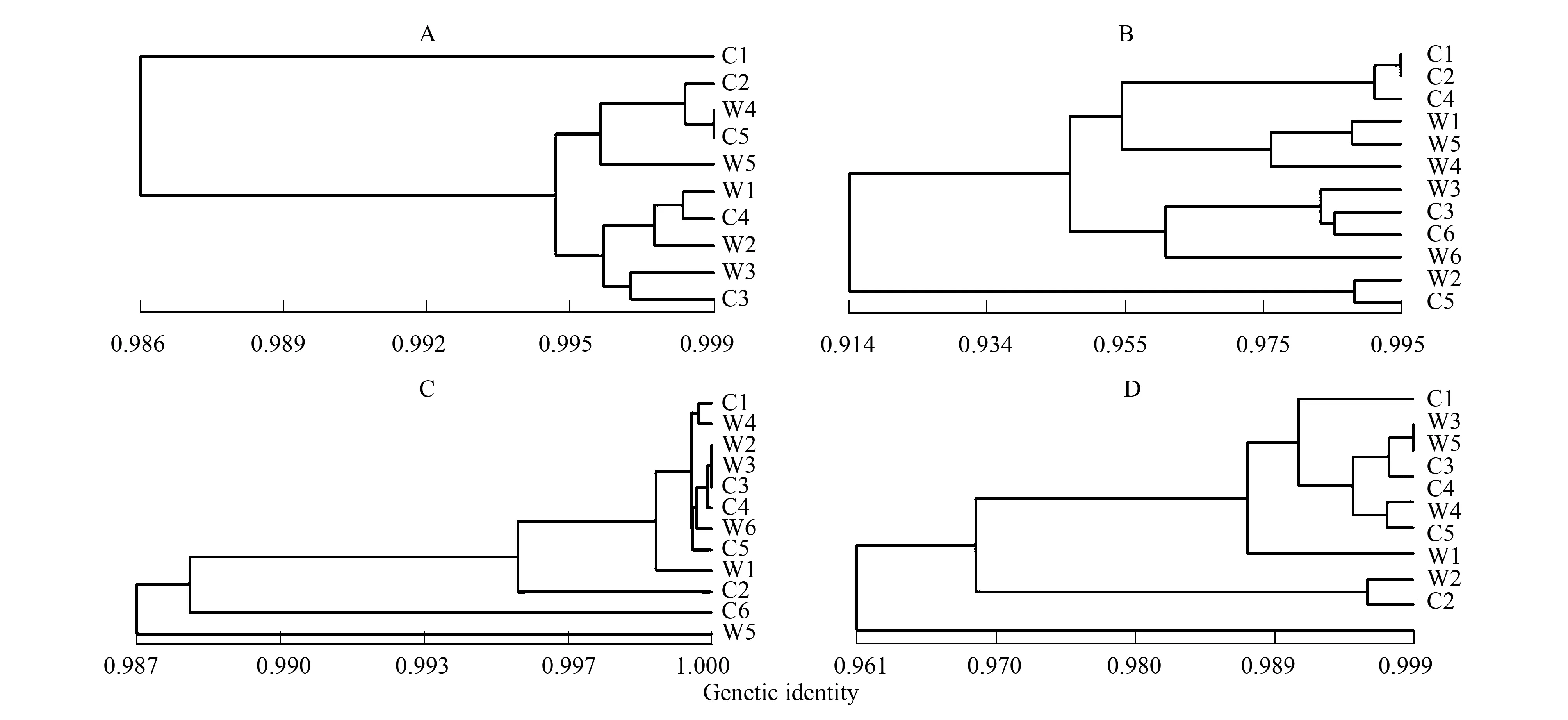
图2 4种生活型植物的UPGMA聚类图Fig.2 Dendrogram by UPGMA analysis of four life forms plantsA: 木地肤10个小区的UPGMA聚类图;B: 短花针茅12个小区的UPGMA聚类图;C: 细叶葱12个小区的UPGMA聚类图;D: 猪毛菜10个小区的UPGMA聚类图
2.3 分子方差分析
对4种植物进行AMOVA分析,结果(表5)显示4种植物的变异主要来源于种群内。其中,木地肤种群内变异最多85.03%,细叶葱70.00%,猪毛菜次之66.52%,短花针茅最少66.35%。而4种植物来源于处理间的变异都较少分别为-2.81%(木地肤)、-5.47%(短花针茅)、-3.60%(细叶葱)、2.53%(猪毛菜)。其中木地肤、短花针茅、细叶葱的处理间的变异百分率都为负值,说明增温处理与其变异并没有相关性。而猪毛菜来源于处理间的变异占到了总变异的2.53%,虽然P值仍然大于0.05,但表明在模拟增温处理6年之后发生了一定程度上的遗传结构的变化。猪毛菜作为一年生植物,表现出与其他生活型植物不同的响应。
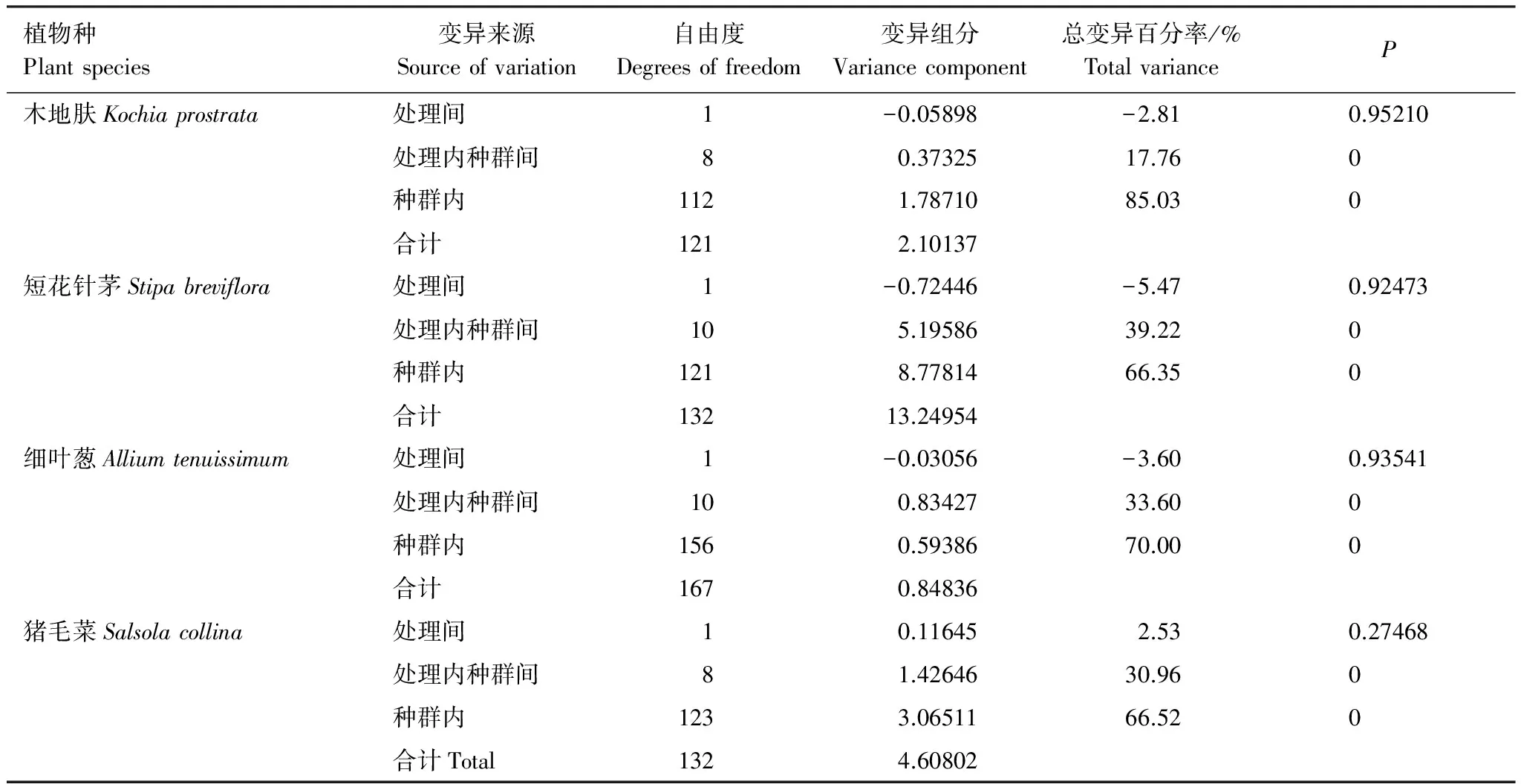
表5 4种植物的AMOVA分析
通过等级剖分(nested analysis of molecular variance)分析4种植物种群内、处理内种群间和处理间的遗传分化系数(表6)。处理间的遗传分化都较低,其中木地肤、短花针茅、细叶葱都为负值(-0.02807、-0.05468、-0.03602),只有猪毛菜数为正值(0.02527)。说明木地肤、短花针茅、细叶葱3种植物的遗传分化与增温处理之间并无相关性。而猪毛菜在增温处理之下发生了一定程度遗传变异。
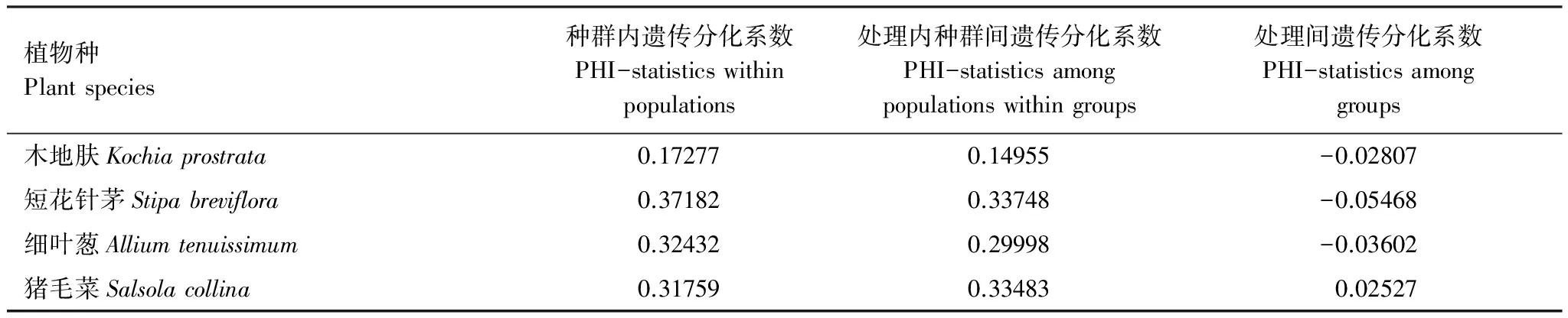
表6 4种植物的遗传分化系数
3 讨论与结论
气候预测显示,未来我国气温仍将升高[3]。在野外自然条件下的生态系统增温实验成为了研究全球变暖与陆地生态系统的关键[20]。本研究所使用的红外线辐射器(Infrared radiator)可以同时影响显热、潜热和土壤热通量[21],因而有效的模拟了全球变暖的情况。
在本研究中4种生活型植物木地肤、短花针茅、细叶葱、猪毛菜的多态位点百分率分别为12.26%、41.28、14.29、20.59,Nei′s基因多样性指数分别为0.0268、0.0863、0.0109、0.0522和Shannon′s 信息指数分别为0.0445、0.1428、0.0229、0.0834,都较低,遗传多样性并不丰富。对4种生活型植物的聚类图分析也显示增温处理组与对照组并未聚为两个类群。首先,这与样地设置有关,在以往有关遗传多样性的研究中大都是以不同品种或是地理间隔较远的植物为研究目标[22- 24],如在对大针茅(Stipagrandis)[25]和克氏针茅(Stipakrylovii)[26]遗传多样性的研究中,研究者在同一地点不同样本之间的采样距离也会间隔50m以上,因为以往都是研究自然种群遗传差异,由于研究目的不同,地理种群间距离较远,种群间有较高的遗传多样性(克氏针茅Nei′s基因多样性指数0. 2989,Shannon′s 信息指数0. 4014;大针茅Nei′s基因多样性指数0.3486,Shannon′s 信息指数0.2314)而在本研究中12个小区间相隔只有3m,由于间隔近,不同小区间植物的遗传背景较一致,有的不同小区内的植株甚至可能来源于同一个母株的种子。这是种群间遗传多样性较低的直接原因。其次,由于增温处理的时间有限,6a的时间很有可能并不足以使植物种群遗传发生明显分化。在模拟增温对青藏高原草甸生态系统影响的研究中发现[27],在增温实验的前两年出现植物初级生产量大幅增加,生物多样性增加的现象,而在实验的第3年之后初级生产量开始下降,并且生物多样性也在降低。这说明在植物响应模拟增温的过程,其反应随处理时间的长短会产生不同的结果,推测短花针茅草原各种生活型植物在遗传上对增温的响应还没有出现。另外多年生植物在样地内并没有适宜的条件允许实生苗建植,即使增温处理使种子产生了某些变化,这些种子也未必能在小区内形成植株,继而无法被采集到相关遗传改变的信息;而且多年生植物对这种温和的增温处理在新芽和新生叶片生长过程中可能未受到影响。
分子方差分析是1992年由Excoffier[19]发展出来的一种进行遗传变异等级剖分的方法,并提出了与F-statistics类似的PHI-statistics等方法来有效地度量亚群体的分化。在本研究中,4种生活型植物当中的多年生植物处理间变异占总变异的百分率(Total variance)以及遗传分化系数(PHI-statistics)都为负值。这种现象在张丽[28]对中华白蛉(Phlebotomuschinensis)的研究中也曾经出现过,负值说明处理间不存在遗传分化。而一年生植物猪毛菜则表现出了不同,其处理间的遗传分化系数为0.0253,处理间的变异百分率也达到了2.53%,虽然P值仍然大于0.05,但表现出一定程度的遗传分化趋势。这4种生活型植物都是荒漠草原的典型植物,从形态结构上来看,他们都具有典型的旱生结构,可以有效的反射阳光,控制水分的蒸发[29- 32]。以往的研究结果显示一年生植物对增温处理有较敏感的响应,常兆丰[33]对民勤荒漠区不同生活型植物响应气候变暖的研究中发现,草本植物的春季物候和秋季物候响应气候变暖的敏感程度都大于灌木。在杨健[34]的研究中发现,增温处理对多年生植物加拿大一枝黄花(Hemerocalliscitrina)地下部分没有影响,但趋于降低一年生植物鬼针草(Bidenspilosa)对根系生物量的分配。本研究中作为一年生植物的猪毛菜很可能是因为具备了更短的生活周期,才能够在相同的时间内较早的对模拟增温作出了遗传层面上的应答。推测每次含有一些变异的种子飘落后都会在小区内参与下一年群落的形成,因而增温处理对其影响在每个世代(每年)中都有一些积累,虽然这种积累非常的微弱。这种变异在一定程度上反映了增温对植物影响的趋势。
而王迪[35]等认为,当植物遇到环境压力时,即使DNA序列水平上没有发生变化,也会发生表观遗传学上的变化,这种变化一部分是可以遗传的,一部分会因为压力的去除而在同一代细胞中发生回复。近年来表观遗传学已经越来越受到关注[36]。和传统意义上的遗传学相比,所谓的表观遗传学,就是不涉及DNA序列改变,然而最终可能影响表型变化的可遗传的现象[37]。在作者其他的研究中发现,短花针茅虽然在增温处理与未增温处理间DNA水平没有发生改变,但是在转录组水平上发现了一些基因的差异表达,表明增温影响了基因的表达,这其中不能否定有表观遗传学水平的变化,模拟增温使表观遗传的修饰程度会发生改变。自然选择是塑造和维持植物自然遗传多样性与种群遗传结构的主要动力[38]。随着全球气候变暖的趋势,植物的种群[39]、群落[40- 41]、生态系统[42-45]乃至整个生物圈[46]必将发生巨大改变。而本研究发现不同的生活型植物面对这一变化产生不同的结果,一年生植物会容易受到增温影响。随着时间的推移,研究的深入,在之后的研究中将会加入对增温去除组的关注,并进行表观遗传学的研究,将对模拟增温下不同生活型植物的适应机制会有更加透彻的了解。
[1] Dwire K A, Kauffman J B, Brookshire E N J, Baham J E. Plant biomass and species composition along an environmental gradient in montane riparian meadows. Oecologia, 2004, 139(2): 309- 317.
[2] Alemayehu F R, Frenck G, van der Linden L, Mikkelsen T N, Jørgensen R B. Can barley (HordeumvulgareL. s.l.) adapt to fast climate changes? A controlled selection experiment. Genetic Resources and Crop Evolution, 2014, 61(1): 151- 161.
[3] 李娜, 王根绪, 杨燕, 高永恒, 柳林安, 刘光生. 短期增温对青藏高原高寒草甸植物群落结构和生物量的影响. 生态学报, 2011, 31(4): 895- 905.
[4] 黄文华, 王树彦, 韩冰, 焦志军, 韩国栋. 草地生态系统对模拟大气增温的响应. 草业科学, 2014, 31(11): 2069- 2076.
[5] 李英年, 赵亮, 赵新全, 周华坤. 5年模拟增温后矮嵩草草甸群落结构及生产量的变化. 草地学报, 2004, 12(3): 236- 239.
[6] 田云录, 郑建初, 张彬, 陈金, 董文军, 杨飞, 张卫建. 麦田开放式昼夜不同增温系统的设计及增温效果. 中国农业科学, 2010, 43(18): 3724- 3731.
[7] 贺刚, 周辉, 廖衡斌, 刘喜庆. 烤烟漂浮育苗中增温对烟苗的影响. 作物研究, 2014, 28(7): 798- 800.
[8] 丁一汇, 任国玉, 石广玉, 宫鹏, 郑循华, 翟盘茂, 张德二, 赵宗慈, 王绍武, 王会军, 罗勇, 陈德亮, 高学杰, 戴晓苏. 气候变化国家评估报告(Ⅰ): 中国气候变化的历史和未来趋势. 气候变化研究进展, 2006, 2(1): 3- 8.
[9] 马瑞芳. 内蒙古草原区近50年气候变化及其对草地生产力的影响[D]. 北京: 中国农业科学院研究生院, 2007.
[10] Shaver G R, Johnson L C, Cades D H, Murray G, Laundre J A, Rastetter E B, Nadelhoffer K J, Giblin A E. Biomass and CO2flux in wet sedge tundra: responses to nutrients, temperature, and light. Ecological Monographs, 1998, 68(1): 75- 97.
[11] 珊丹, 韩国栋, 赵萌莉, 王珍, 韩雄, 高福光. 控制性增温和施氮对荒漠草原土壤呼吸的影响. 干旱区资源与环境, 2009, 23(9): 106- 112.
[12] 张宇, 红梅. 内蒙古荒漠草原土壤呼吸对模拟增温和氮素添加的响应. 草地学报, 2014, 22(6): 1227- 1231.
[13] 王晨晨, 王珍, 张新杰, 李寅龙, 刘军利, 韩国栋. 增温对荒漠草原植物群落组成及物种多样性的影响. 生态环境学报, 2014, 23(1): 43- 49.
[14] 李元恒, 韩国栋, 王珍, 王正文, 赵萌莉, 王萨仁娜. 增温和氮素添加降低荒漠草原多年生植物氮素回收效率. 生态学报, 2015, 35(18):. (未出版刊物)
[15] 李荣华, 夏岩石, 刘顺枝, 孙莉丽, 郭培国, 缪绅裕, 陈健辉. 改进的CTAB提取植物DNA方法. 实验室研究与探索, 2009, 28(9): 14- 16.
[16] Vos P, Hogers R, Bleeker M, Reijans, M, van de Lee T, Hornes M, Frijters A, Pot J, Peleman J, Kuiper M, Zabeau M. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research, 1995, 23(21): 4407- 4414.
[17] Yeh F C, Yang R C, Boyle T B J. POPGENE version 1. 31. Microsoft Windows-based freeware for population genetic analysis. Edmonton: University of Alberta, 1997.
[18] Rohlf F J. NTSYS-PC: Numerical Taxonomy and Multivariate Analysis System, Version 2. 1. New York: Exeter Software, Setauket, 2000.
[19] Excoffier L, Smouse P E, Quattro J M. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data. Genetics, 1992, 131(2): 479- 491.
[20] Shen K P, Harte J. Ecosystem climate manipulations // Methods in Ecosystem Science. New York: Springer-Verlag, 2000: 353- 369.
[21] 牛书丽, 韩兴国, 马克平, 万师强. 全球变暖与陆地生态系统研究中的野外增温装置. 植物生态学报, 2007, 31(2): 262- 271.
[22] 李娜, 杨鹰, 万洁, 韦雷飞, 钟金城, 武志娟, 姜雪鸥, 张利亚. 攀西黑山羊群体的AFLP遗传多样性研究. 家畜生态学报, 2013, 34(2): 22- 26.
[23] 赵冰, 徐曼, 司国臣, 李厚华, 张延龙. 秦岭秀雅杜鹃野生种群遗传多样性和遗传分化的AFLP分析. 应用生态学报, 2012, 23(11): 2983- 2990.
[24] 张庆, 牛建明, 董建军. 内蒙古地区短花针茅(Stipabreviflora)种群遗传多样性. 生态学报, 2008, 28(7): 3447- 3455.
[25] 珊丹, 赵萌莉, 韩冰, 韩国栋. 不同放牧压力下大针茅种群的遗传多样性. 生态学报, 2006, 26(10): 3175- 3183.
[26] 王金龙, 高玉葆, 赵念席, 刘景玲, 林枫, 宋涛. 内蒙古中东部草原区克氏针茅形态特征和RAPD遗传分化的相关性研究. 植物研究, 2006, 26(6): 708- 714.
[27] 赵新全, 陈世龙, 曹广民, 师生波, 徐世晓, 王启兰. 研究方向: 青藏高原高寒草甸生态系统与全球气候变化的相互作用机理研究. 科技和产业, 2003, 3(8): 51- 59.
[28] 张丽. 我国中华白蛉的鉴别和分子群体遗传结构研究[D]. 上海: 第二军医大学, 2010.
[29] 康萨如拉, 牛建明, 张庆, 陈丽萍. 短花针茅叶片解剖结构及与气候因子的关系. 草业学报, 2013, 22(1): 77- 86.
[30] 高松, 苏培玺, 严巧娣, 丁松爽, 张岭梅. C4荒漠植物猪毛菜与木本猪毛菜的叶片解剖结构及光合生理特征. 植物生态学报, 2009, 33(2): 347- 354.
[31] 刘涛, 李柱, 安沙舟, 许帼英. 干旱胁迫对木地肤幼苗生理生化特性的影响. 干旱区研究, 2008, 25(2): 231- 235.
[32] 栗利元, 张未芳, 郑联寿. 细叶韭生活习性的研究. 黑龙江农业科学, 2011, (2): 63- 65.
[33] 常兆丰, 王强强, 韩福贵, 仲生年. 民勤荒漠区不同生活型植物物候响应气候变暖的差异. 生态学杂志, 2011, 30(9): 1921- 1929.
[34] 杨健. 增温和氮沉降对加拿大一枝黄花入侵性的影响[D]. 成都: 成都理工大学, 2014.
[35] 王迪, 傅彬英, 张立军. 植物表观遗传变化与环境压力研究进展. 分子植物育种, 2008, 6(3): 569- 573.
[36] Bender J. Plant epigenetics. Current Biology, 2002, 12(12): R412-R414.
[37] Bird A. Perceptions of epigenetics. Nature, 2007, 447(7143): 396- 398.
[38] Linhart Y B, Grant M C. Evolutionary significance of local genetic differentiation in plants. Annual Review of Ecology and Systematics, 1996, 27: 237- 277.
[39] Klanderud K. Climate change effects on species interactions in an alpine plant community. Journal of Ecology, 2005, 93(1): 127- 137.
[40] Klein J A, Harte J, Zhao X Q. Experimental warming causes large and rapid species loss, dampened by simulated grazing, on the Tibetan Plateau. Ecology Letters, 2004, 7(12): 1170- 1179.
[41] Harte J, Shaw R. Shifting dominance within a montane vegetation community: results of a climate-warming experiment. Science, 1995, 267(5199): 876- 880.
[42] Tilman D, Knops J, Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5330): 1300- 1302.
[43] Zhou G S, Wang Y H, Zhang X S. Advance in the responses of vegetation/ecosystems in China to global change. Bulletin of the Chinese Academy of Sciences, 1999, 13(3): 158- 165.
[44] Aerts R, Cornelissen J H C, Dorrepaal E. Plant performance in a warmer world: general responses of plants from cold, northern biomes and the importance of winter and spring events. Plant Ecology, 2006, 182(1/2): 65- 77.
[45] Morgan J A, LeCain D R, Pendall E, Blumenthal D M, Kimball B A, Carrillo Y, Williams D G, Heisler-White J, Dijkstra F A, West M. C4 grasses prosper as carbon dioxide eliminates desiccation in warmed semi-arid grassland. Nature, 2011, 476(7359): 202- 205.
[46] Yin H J, Lai T, Cheng X Y, Jiang X M, Liu Q. Warming effect on growth and physiology of seedlings ofBetulaalbo-sinensisandAbiesfaxonianaunder two contrasting light conditions in subalpine coniferous forests of western Sichuan, China. Frontiers of Forestry in China, 2009, 4(4): 432- 442.
The response of genetic diversity in desert steppe plants to simulated warming in Inner Mongolia, China
CAO Lu1,2,LI Chunrui1,2,TIAN Qingsong1,DU Jiancai1,WANG Zhongwu3,HAN Bing1,2,*
1InstituteofGrasslandResearch,ChineseAcademyofAgriculturalSciences,Hohhot010018,China2CollegeofLifeScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China3CollegeofEcologyandEnvironmentalScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China
Climate is the most important factor that determines vegetation types and the distribution of species, and, accordingly, these features are two of the most prominent indicators of climate change. Currently, scientists generally agree that climate change will inevitably lead to changes in plant community structure and function, and if this change continues, the effects will be profound and enduring. Existing research shows that simulated warming causes an increase in biomass inDeschampsiacaespitosa,Carexalrofusca, andLeymuschinensis; as climates change, these constructive species and their main companion species within aKobresiahumilismeadow have experienced an advancement in their spring phenology and a delay in their autumn phenophase. In addition, the photosynthetic rate ofDeschampsiacaespitosain a Northwest Sichuan alpine meadow has increased. Although the change in stomatal conductance was irregular, a significant decrease has also been observed in the sodium, potassium, and phosphorus content of leaves. However, relatively little research has been conducted on the effects of simulated warming on the genetic structure and diversity of plant populations. Against the background of global climate change, the temperatures of the Inner Mongolian desert steppe have become unevenly elevated, with average annual temperatures increasing from 8.1℃ in the 1950s to 9.0℃ in the 1990s. The present study explores the effects of global warming on the genetics of wild forage plant populations with different life forms in desert steppe habitat, in an effort to elucidate their potential to adapt to environmental change. The study site was located in the desert steppe in Siziwangqi territory of Inner Mongolia. Suspension infrared radiators were used to create a controlled warming experiment under otherwise natural field conditions. Warming began on May 3, 2006. The average soil temperature at depths of 0, 7.5, 15, 30, and 50 cm increased by 1.32, 0.92, 0.88, 0.80, and 0.74℃, respectively, after warming for 1 year compared with the average in plots not exposed to warming. For this study, changes in genetic diversity and structure were analyzed in four plant populations: (1) small half shrubs, represented byKochiaprostrata; (2) perennial grasses, represented byStipabreviflora; (3) perennial forbs, represented byAlliumtenuissimum; and (4) annuals and biennials, represented bySalsolacollina). The study was conducted under simulated warming pressure and genetic analysis was performed using amplified fragment length polymorphism. The percentages of polymorphic loci inK.prostrata,S.breviflora,A.tenuissimum, andS.collinaunder non-warming were 11.32%, 40.83%, 14.29%, and 19.85%, whereas those under simulated warming were 11.32%, 39.91%, 13.10%, and 19.12%, respectively. The genetic diversity of the four populations measured under control and simulated warming, measured by the Shannon′s information index, were as follows:K.prostrata(0.0274, 0.0259),S.breviflora(0.0812, 0.0899),Alliumtenuissimum(0.0131, 0.0084), andS.collina(0.0506, 0.0456). These findings exhibited the same distributional pattern as that of Nei′s genetic diversity index forK.prostrata(0.0447, 0.0430),S.breviflora(0.1354, 0.1466),Alliumtenuissimum(0.0267, 0.0182), andS.collina(0.0811, 0.0733). Cluster analysis of these four species showed that known of the species reacted significantly to the warming process, and that inter-individual clusters were not significantly different. The results of an analysis of molecular variance (AMOVA) indicated that the main source of variation among the four life form populations was within-population variation:K.prostrata(85.03%),S.breviflora(66.35%),A.tenuissimum(70.00%), andS.collina(66.52%). The among-groups variation was not significant and accounted for the following percentages of variation:K.prostrata(-2.81%),S.breviflora(-5.47%),Alliumtenuissimum(-3.60%), andS.collina(2.53%). No statistically significant correlation was found between simulated warming and genetic differentiation. This study shows that a short period of simulated warming was not sufficient to create a significant change in genetic diversity and structure for the four life form populations studied here; however, compared with the three types of perennials studied, the annual plantS.collina, is more susceptible to the effects of warming. Perennials and annuals have different genetic responses to warming. This study provides experimental evidence that can reveal the potential adaptation of plants to environmental change for different life forms of wild forage plants of the desert steppe, and will help researchers to predict forage yield and changes in forage quality.
Kochiaprostrata;Stipabreviflora;Alliumtenuissimum;Salsolacollina; genetic diversity; AFLP; simulated warming
内蒙古自治区自然科学基金资助项目(2015MS0305);中国科学院西部之光“人才培养”项目;中国农业科学院草原研究所科技创新工程资助项目
2015- 04- 22;
日期:2016- 03- 03
10.5846/stxb201504220826
*通讯作者Corresponding author.E-mail: hb_nmg@163.com
曹路,李春瑞,田青松,杜建材,王忠武,韩冰.内蒙古荒漠草原植物遗传多样性对模拟增温处理的响应.生态学报,2016,36(21):6909- 6918.
Cao L,Li C R,Tian Q S,Du J C,Wang Z W,Han B.The response of genetic diversity in desert steppe plants to simulated warming in Inner Mongolia, China.Acta Ecologica Sinica,2016,36(21):6909- 6918.
