二烯丙基二硫下调uPA和MMP9抑制乳腺癌细胞侵袭迁移
2016-12-25,,,,,,,
,,, ,,, ,
(1.南华大学药物药理研究所,湖南 衡阳421001;2.南华大学附属第一医院麻醉科)
·基础医学·
二烯丙基二硫下调uPA和MMP9抑制乳腺癌细胞侵袭迁移
刘晓旺1,陈霄霄1*,周志刚2**,熊婷1,李丽丁1,陈雪艳1,彭露1,涂剑1**
(1.南华大学药物药理研究所,湖南 衡阳421001;2.南华大学附属第一医院麻醉科)
目的研究大蒜提取物二烯丙基二硫(DADS)对MCF-7和MDA-MB-231两种人乳腺癌细胞侵袭迁移的作用。方法采用不同浓度(0,100,200,400 μmol/L)DADS处理MCF-7和MDA-MB-231两种人乳腺癌细胞24 h,Transwell侵袭实验检测DADS对细胞侵袭能力的影响;划痕愈合实验观察DADS对细胞迁移能力的改变;western blot检测两种细胞中尿激酶型纤溶酶原激活剂(uPA)和基质金属蛋白酶9(MMP9)的表达。结果Transwell实验发现DADS呈浓度依赖性抑制MCF-7和MDA-MB-231两种乳腺癌细胞的侵袭,划痕愈合实验则发现DADS呈浓度依赖性抑制两种乳腺癌细胞的迁移。与此同时,Western blot结果显示DADS可浓度依赖性下调侵袭迁移相关蛋白uPA和MMP9的表达。结论DADS可下调uPA和MMP9表达,抑制乳腺癌细胞侵袭迁移。
二烯丙基二硫; 人乳腺癌细胞; 细胞侵袭; 细胞迁移
乳腺癌是女性常见的恶性肿瘤之一,其发病率和死亡率逐年升高[1-2]。远处转移是乳腺癌致死的主要原因之一[3],但相关机制尚未阐明。
二烯丙基二硫(diallyl disulfide,DADS)是从大蒜中分离出的一种脂溶性有机硫化合物,对乳腺癌、结肠癌、胃癌和白血病等多种肿瘤均有明显的抑制作用[4-9],提示DADS是一种具有开发潜力的新型抗癌药物。前期研究中用DADS 50、100、200、400 μmol/L处理MCF-7细胞24 h,结果显示DADS能降低MCF-7细胞的增殖活性,其作用呈浓度依赖性。基质金属蛋白酶(matrix metalloproteinases,MMPs)中基质金属蛋白酶9 (matrix metalloproteinase 9,MMP9)与肿瘤的转移潜能关系最密切[10]。尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)是一种丝氨酸蛋白水解酶[11],许多研究证实uPA在多种肿瘤中过表达,在肿瘤的浸润转移中扮演重要角色[12]。本研究探讨DADS对人乳腺癌细胞侵袭迁移能力和对细胞中uPA /MMP9表达的影响。
1 材料与方法
1.1材料MCF-7和MDA-MB-231两种人乳腺癌细胞均购自中科院上海生命科学研究院细胞资源中心,DADS、β-actin一抗、Transwell小室和基质胶均购于美国Sigma公司,MMP9一抗为美国Santa Cruz公司产品,uPA一抗购自美国Peprotech公司,辣根过氧化物酶标记的羊抗兔和抗鼠二抗均购自联科生物公司。
1.2方法
1.2.1 细胞培养和DADS分组 MCF-7和MDA-MB-231细胞用含10%胎牛血清的DMEM培养基于37 ℃、5%CO2的细胞培养箱中进行培养。采用不同浓度(0,100,200,400 μmol/L) DADS处理MCF-7和MDA-MB-231两种人乳腺癌细胞24 h。
1.2.2 Transwell侵袭实验检测细胞侵袭能力 将4 ℃的Matrigel用无血清培养基以1∶5稀释混匀。在transwell上室均匀铺40 μL稀释的Matrigel,放入5% CO2、37 ℃培养箱中孵育2 h,使之形成均匀的凝胶。将细胞重悬至1×106个/mL,上室每孔加入100 μL细胞悬液,下室加入500 μL含有10%胎牛血清的DMEM,培养24 h。取出transwell小室,擦去上室面的Matrigel和非侵袭细胞,下室用4%多聚甲醛固定,结晶紫染色后漂洗晾干,在倒置显微镜下观察。用Image ProPlus软件对图片分析扫描,对各组细胞计数。
1.2.3 划痕愈合实验检测细胞迁移能力 在6孔板背后均匀的划横线,每孔加入细胞5×105个,穿过5条线;放入5% CO2、37 ℃培养箱中孵育12 h后,用tip头垂至于背后的横线划痕,PBS洗去划下的细胞,加入各处理因素后继续培养24 h后在显微镜下拍照。使用Image ProPlus软件对图片分析扫描,计算各组细胞的迁移率。
1.2.4 Western blot检测uPA和MMP9的蛋白表达 将各处理组蛋白收集后根据BCA 蛋白定量试剂盒操作说明检测各组蛋白浓度。高温变性后,对各样品上样进行电泳,将SDS-PAGE胶转至 PVDF 膜上,室温封闭2 h,一抗4 ℃孵育过夜,TBST洗涤15 min×3次。二抗37 ℃孵育45 min后用 TBST 洗涤 15 min×4次,显影。条带用AlphaImager2200软件灰度扫描。
1.3统计学分析实验所得数据采用均数±标准差表示,用SPSS 13.0进行统计处理,组间比较采用方差分析及t检验,P<0.05判定差异有显著性。
2 结 果
2.1 DADS对人乳腺癌细胞侵袭能力的影响Transwell侵袭实验检测结果表明:随着DADS处理浓度的增加,100、200和400 μmol/L DADS组MCF-7细胞穿过基底膜的数目均明显减少 (P<0.05),尤以200和400 μmol/L DADS组效果显著 (P<0.01,图1A2);200和400 μmol/L DADS组MDA-MB-231细胞穿过基底膜的数目均明显减少 (P<0.05),尤以400 μmol/L DADS组效果显著 (P<0.01,图1B2)。DADS可随着处理浓度的增高,显著抑制MCF-7 和MDA-MB-231两种乳腺癌细胞的侵袭能力。
2.2 DADS对人乳腺癌细胞迁移能力的影响划痕愈合实验结果显示,经DADS处理后的MCF-7细胞,与0μmol/L DADS组相比,随着处理浓度的增加,细胞迁移能力显著降低(图2A2);经DADS处理后的MDA-MB-231细胞迁移能力也显著降低且具有浓度依赖性(图2B2)。DADS可以明显抑制MCF-7和MDA-MB-231两种人乳腺癌细胞的迁移能力。
2.3 DADS对人乳腺癌细胞中uPA与MMP9蛋白表达的影响Western blot结果发现,随着DADS处理浓度的增加,MCF-7细胞中uPA与MMP9蛋白表达逐渐减弱,且差异具有显著性(P<0.05,图3A2)。而MDA-MB-231细胞中同样也可观察到DADS呈浓度依赖性下调uPA与MMP9的蛋白表达 (图3B2)。
3 讨 论
DADS是一种具有开发潜力的新型抗癌药物,已有报道对乳腺癌细胞增殖具有明显的抑制作用[4-5]。另有研究提示[13],大蒜内另一含硫成分DATS可以抑制乳腺癌MDA-MB-231细胞的血行转移过程。而DADS是否存在相似的作用效果?
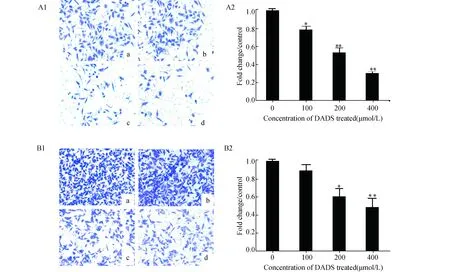
图1 DADS对人乳腺癌细胞侵袭的影响 *:P<0.05,**:P<0.01,与0 μmol/L DADS处理细胞组相比. A1:细胞显微镜观察DADS对MCF-7细胞侵袭的影响(×100),A2:DADS对MCF-7细胞侵袭的相对密度; B1:细胞显微镜下DADS对MDA-MB-231细胞侵袭的影响(×100);B2:DADS对MDA-MB-231细胞侵袭的相对密度; a:0 μmol/L;b:100 μmol/L;c:200 μmol/L;d:400 μmol/L DADS

图2 DADS对人乳腺癌细胞迁移的影响 与0 μmol/L DADS处理细胞组相比,**:P<0.01. A1:DADS对MCF-7细胞迁移的细胞划痕(×40);A2:DADS对MCF-7细胞迁移的相对速度;B1:DADS对MDA-MB-231细胞迁移的细胞划痕(×40);B2:DADS对MDA-MB-231细胞迁移的相对速度. a:0 μmol/L;b:100 μmol/L;c:200 μmol/L;d:400 μmol/L DADS.
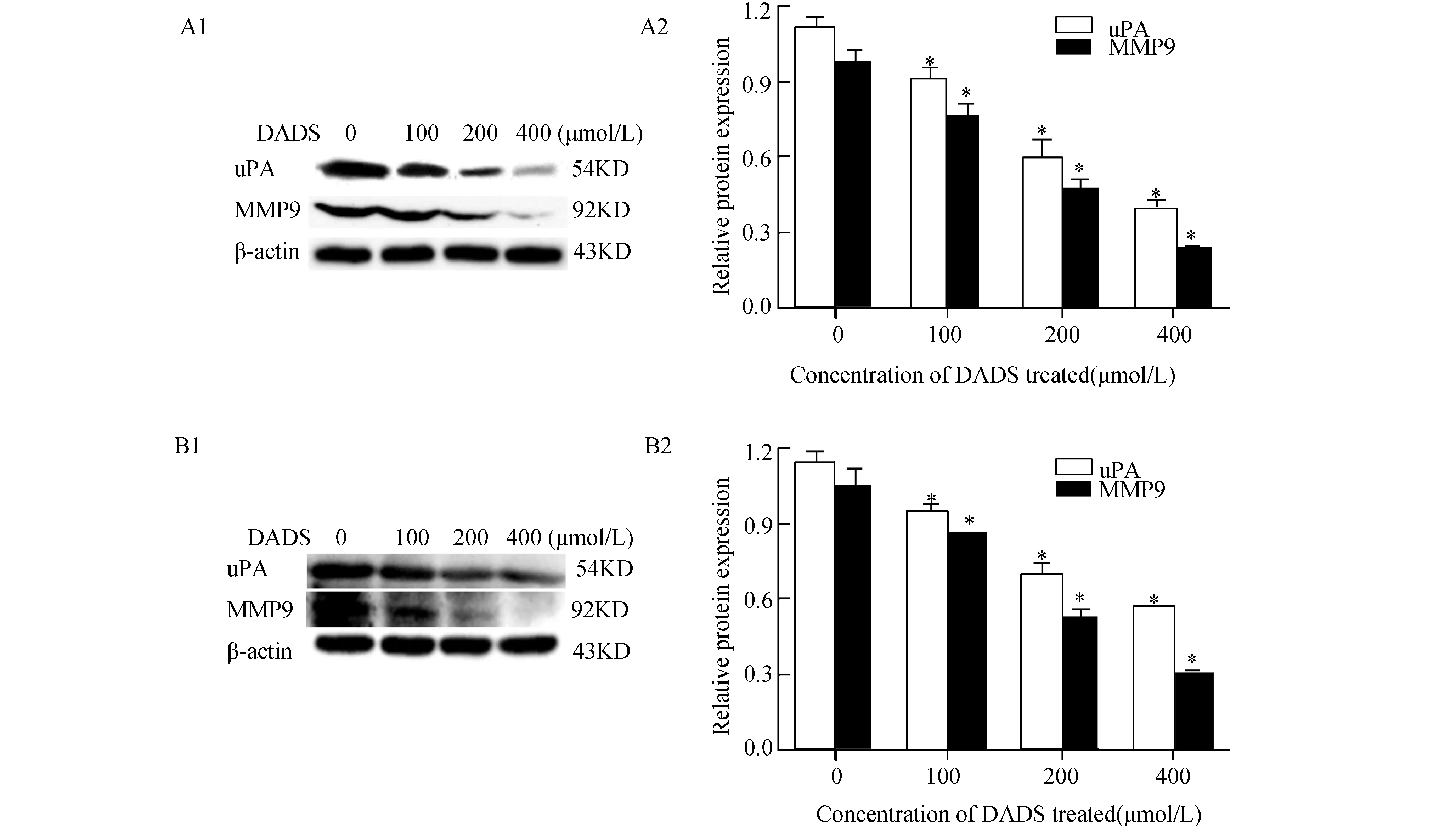
图3 DADS对人乳腺癌细胞中uPA和MMP9蛋白表达的影响(western blot检测) 与0 μmol/L组相比,*:P<0.05. A1:DADS对MCF-7细胞中uPA和MMP9蛋白表达的电泳图;A2:DADS对MCF-7细胞中uPA和MMP9蛋白表达的相对表达;B1:DADS对MDA-MB-231细胞中uPA和MMP9蛋白表达的电泳图;B2:DADS对MDA-MB-231细胞中uPA和MMP9蛋白表达的相对表达
实验中发现,DADS随处理浓度的增加,可明显抑制MCF-7和MDA-MB-231两种乳腺癌细胞的侵袭和迁移。
侵袭/转移是恶性肿瘤的重要生物学特征,是肿瘤生长发展过程中密不可分的相关阶段[14]。在侵袭/转移过程中,癌细胞与基底膜或细胞外基质粘附,然后释放和激活多种蛋白水解酶降解基底膜和细胞外基质,在趋化因子、自分泌以及旁分泌生长因子等作用下迁移到达靶组织,克隆增殖从而形成转移灶[15]。Aharinejad等[10,16]的研究显示,MMP9能降解细胞外基质和基底膜,使基底膜完整性的破坏引起肿瘤细胞发生局部侵袭和远处转移。通过实验结果发现,DADS抑制乳腺癌细胞侵袭和迁移的同时可显著下调乳腺癌细胞中MMP9的蛋白表达,可证实DADS对乳腺癌细胞侵袭和迁移的抑制作用。
许多研究证实uPA在多种肿瘤中过表达,在肿瘤的浸润转移中扮演重要角色[12]。通过DADS抑制乳腺癌细胞侵袭和迁移的同时可显著下调乳腺癌细胞中uPA的蛋白表达,则进一步证实DADS对乳腺癌细胞侵袭和迁移的体外抑制作用。接下来将进一步通过动物实验验证其在体内是否具有一致作用并探讨可能机制,以期为乳腺癌提供新的治疗靶点并深入开发DADS的抗肿瘤作用。
综上所述,本研究通过体外实验证实DADS显著抑制乳腺癌细胞侵袭和迁移的同时可下调细胞中uPA和MMP9的蛋白表达。
[1] Niu HY,Niu CY,Wang JH,et al.Health-related quality of life in women with breast cancer:a literature-based review of psychometric properties of breast cancer-specific measures[J].Asian Pac J Cancer Prev,2014,15(8):3533-3536.
[2] Harris RE,Casto BC,Harris ZM.Cyclooxygenase-2 and the inflammogenesis of breast cancer[J].World J Clin Oncol,2014,5(4):677-692.
[3] Almendro V,Kim HJ,Cheng YK,et al.Genetic and phenotypic diversity in breast tumor metastases[J].Cancer Res,2014,74(5):1338-1348.
[4] Altonsy MO,Habib TN,Andrews SC.Diallyl disulfide-induced apoptosis in a breast-cancer cell line (MCF-7) may be caused by inhibition of histone deacetylation[J].Nutr Cancer,2012,64(8):1251-1260.
[5] Yao SQ,Zu XY,Huang ZX,et al.Apoptosis induced by diallyl disulfide in human breast cancer cell line MCF-7[J].Acta Pharmacol Sin,2008,29(10):1233-1239.
[6] Kuang CH,Chao LK,Heng CH,et al.Diallyl sulfide,diallyl disulfide and diallyl trisulfide affect drug resistant gene expression in colo 205 human colon cancer cells in vitro and in vivo[J].Phytomedicine,2012,19(7):625-630.
[7] Ling H,Wen L,Ji XX,et al.Growth inhibitory effect and Chk1-dependent signaling involved in G2/M arrest on human gastric cancer cells induced by diallyl disulfide[J].Braz J Med Biol Res,2010,43(3):271-278.
[8] Yang JS,Kok LF,Lin YH,et al.Diallyl disulfide inhibits WEHI-3 leukemia cells in vivo[J].Anticancer Res,2006,26(1A):219-225.
[9] 黄琳琳,白勇,邹俊,等.从大蒜有机硫化合物开发抗癌药的潜在可能[J].医药导报,2012,31 (11):1463-1467.
[10] Aharinejad S,Krenn K,Zuckermann A,et al.Matrix metalloproteases and their tissue inhibitor in cardiac transplantation[J].Eur J Cardiothorac Surg,2007,32(1):48-51.
[11] Roomi MW,Kalinovsky T,Niedzwiecki A,et al.Modulation of uPA,MMPs and their inhibitors by a novel nutrient mixture in human colorectal,pancreatic and hepatic carcinoma cell lines[J].Int J Oncol,2015,47(1):370-376.
[12] Mekkawy AH,Pourgholami MH,Morris DL.Involvement of urokinase-type plasminogen activator system in cancer:an overview[J].Med Res Rev,2014,34(5):918-956.
[13] 王颖钰.大蒜二烯丙基三硫化物抗乳腺癌MDA-MB-231细胞血行转移的机制初探[D].南京:南京中医药大学,2011.
[14] Liotta LA,Stetler-Stevenson WG.Tumor invasion and metastasis:an imbalance of positive and negative regulation[J].Cancer Res,1991,51(18 Suppl):5054s-5059s.
[15] Fan SH,Wang YY,Lu J,et al.CERS2 suppresses tumor cell invasion and is associated with decreased V-ATPase and MMP-2/MMP-9 activities in breast cancer[J].J Cell Biochem,2015,116(4):502-513.
[16] Aharinejad S,Krenn K,Zuckermann A,et al.Serum matrix metalloprotease-1 and vascular endothelial growth factor-a predict cardiac allograft rejection[J].Am J Transplant,2009,9(1):149-159.
DiallylDisulfideInhibitstheInvasionandMigrationofBreastCancerCellsDown-regulatinguPAandMMP9
LIU Xiaowang,CHEN Xiaoxiao,ZHOU Zhigang,etal
(InstituteofPharmacyandPharmacology,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo explore the role of diallyl disulfide (DADS) on the invasion and migration of human breast cancer cells.MethodsMCF-7 and MDA-MB-231 human breast cancer cells were in vitro treated with different concentration (0,100,200,400 μmol/L) of DADS for 24h.Then,Transwell chamber assay and wound healing assay were used to detect the ability of cell invasion/migration.The protein expression of uPA and MMP9 were detected by western blot.ResultsDADS inhibited the invasion and migration of MCF-7 and MDA-MB-231 cells in a dose-dependent manner.At the same time,the invasion and migration-related protein expression of uPA and MMP9 were both down-regulated.ConclusionDADS could inhibit the invasion and migration of MCF-7 and MDA-MB-231 cells by down-regulating the protein expression of uPA and MMP9.
diallyl disulfide (DADS); human breast cancer cells; cell invasion; cell migration
10.15972/j.cnki.43-1509/r.2016.02.002
2015-11-21;
2016-02-28
国家级大学生创新创业训练计划项目(201410555008)和湖南省大学生创新性课题(2014-234);湖南省中医药局课题(2014144);南华大学研究生创新性课题(2015XCX33);“湖南省分子靶标新药研究协同创新中心”培育项目(2014-405)和湖南省“十二五”重点学科建设项目.
*:并列第一作者.
**通讯作者,E-mail:zhouzhigang0734@sina.com;E-mail:tujian0734@aliyun.com.
R961.1
A
蒋湘莲)
