干扰miR-21表达抑制胶质瘤U251细胞增殖迁移与侵袭
2016-12-25,,,
, ,,
(南华大学永州临床学院神经外科,湖南 永州 425100)
·基础医学·
干扰miR-21表达抑制胶质瘤U251细胞增殖迁移与侵袭
张金灿*,胡丹,贺礼进,桂成佳
(南华大学永州临床学院神经外科,湖南 永州 425100)
目的探讨干扰miR-21表达对胶质瘤细胞U251增殖、迁移和侵袭的影响。方法使用脂质体将miR-21抑制物(人工合成干扰miR-21表达的核苷酸片段,miR-21处理组)以及对照组转染于U251细胞,利用qRT-PCR验证miR-21处理组转染的细胞中miR-21表达水平;通过MTT法、细胞划痕、transwell等实验观察miR-21处理组和对照组对U251细胞增殖迁移和侵袭的影响。结果miR-21 处理组中miR-21的表达量明显下调。即转染miR-21 抑制剂能有效降低U251细胞中miR-21的表达。miR-21 处理组的 U251细胞与对照细胞相比,增殖速度明显下降,差异具有显著性。细胞划痕实验显示干扰miR-21抑制U251细胞迁移能力。Transwell侵袭实验结果显示,miR-21 处理组的U251细胞的侵袭能力较对照组细胞明显下降。结论miR-21能促进胶质瘤细胞增殖、迁移和侵袭能力,它可能在胶质瘤的发生和进展中发挥重要作用。
胶质瘤; miR-21; 细胞增殖; 细胞侵袭
迄今为止,在人类中共发现有900多个miRNA,大约调控人类基因组中30%的基因。miRNA在很多生物学过程中发挥重要的调控作用,包括分化,增殖,凋亡以及肿瘤的发生[1]。以往的研究表明,miR-21具有促进肿瘤发生发展的功能,其在许多肿瘤细胞和组织中呈现高表达,如:乳腺癌、肺癌、胃癌、胰腺癌等[2-7]。有研究报道[8]miR-21在胶质瘤细胞和组织中表达升高。本研究通过将miR-21 抑制剂(人工合成干扰miR-21表达的核苷酸片段)转染到胶质瘤U251细胞中使得miR-21表达下调,探讨干扰miR-21对胶质瘤细胞增殖、侵袭、迁移的影响,并初步揭示miR-21在胶质瘤中生物学功能。
1 材料与方法
1.1主要材料miR-21抑制剂以及qRT-PCR miRNA 检测试剂盒(上海吉玛生物公司)。转染试剂脂质体2000(购置美国invitrogen公司)。
1.2细胞培养胶质瘤细胞株U251为恶性胶质瘤细胞,购置上海细胞研究所,培养于含10%小牛血清的RPMI1640,在95%湿度,5% CO2,37 ℃条件下。
1.3细胞转染实验分为miR-21处理组(miR-21 inhibitors)与对照组(NC inhibitors)。接种细胞于96孔板完全培养基中细胞生长至30%~50%密度;在无菌的EP管中计算配好转染试剂盒质粒于无血清培养液,室温放置5 min,然后按操作程序,置于37 ℃,5% CO2培养箱中,6 h后换液加入完全培养基,继续培养48 h后,收集细胞。
1.4 qRT-PCR检测qRT-PCR反应:反应体系为20 μL,包括5 μmol/L miR-21特异性PCR引物0.4 μL、稀释后的RT产物2 μL、5 U/μL耐热DNA聚合酶0.2 μL、2×qRT-PCR缓冲液10 μL、灭菌双蒸水7.4 μL。反应条件:95 ℃ 3 min活化Tag酶,然后95 ℃ 12 s、62 ℃ 35 s,共40个循环。
1.5 MTT法检测细胞增殖活性miR-21处理组转染U251细胞24 h后, 0.25%胰酶消化,吹打成单细胞悬液后收集离心。用含10%胎牛血清的RPMI-1640培养基稀释并制成0.5×105个/mL的细胞悬液,取200 μL即1×104个细胞接种于96孔板中,设复孔5个。37 ℃、5%CO2的细胞培养箱中培养24、48、72和96 h。每孔加灭菌MTT液(5 mg/mL)20 μL。选择570 nm波长,在酶标仪上检测各孔吸光值,记录结果。实验重复3次。
1.6细胞划痕和transwell实验miR-21处理组转染U251细胞24 h后,消化细胞,用无血清培基洗涤2次,按操作步骤进行。
1.7统计学处理所有数据均采用SPSS16.0软件处理,计量资料以均数±标准差表示,采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1干扰miR-21后U251细胞增殖速度下降首先分别用对照组及miR-21处理组转染U251细胞,48 h后抽提细胞总RNA,运用qRT-PCR验证miR-21在细胞中的表达。结果显示,不同浓度的miR-21 抑制剂的细胞中miR-21的表达量呈现明显的浓度依赖性下调(图1A)。
通过MTT法检测,绘制生长曲线来考察干扰miR-21对胶质瘤细胞U251增殖的影响。结果发现,转染miR-21 处理组后的U251细胞从第48 h开始增殖速度明显减慢。统计分析各组在96 h时的细胞增殖情况发现, miR-21 处理组与对照细胞组相比,差异均有统计学意义(P<0.05,n=3)(图1B)。
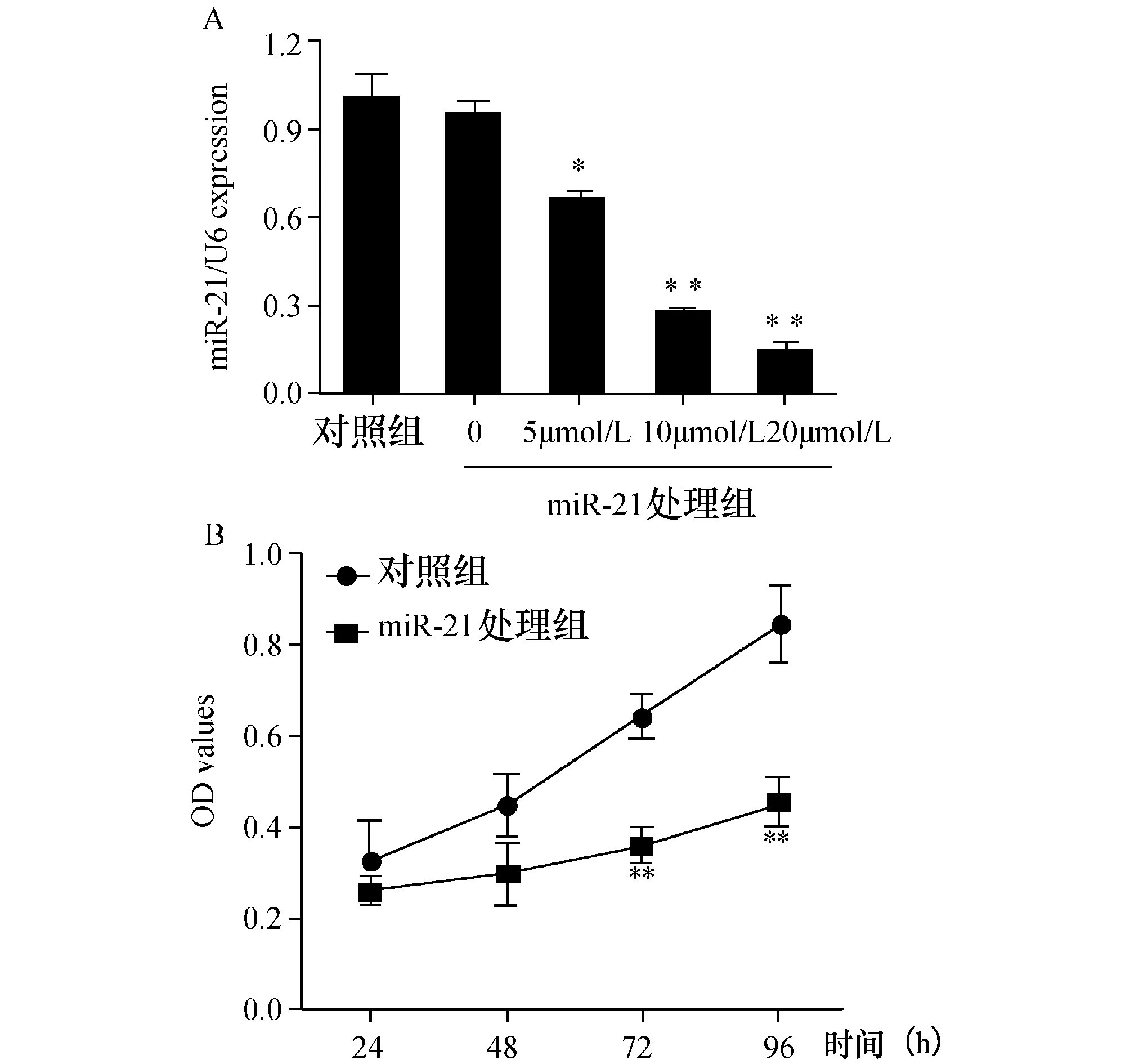
图1 miR抑制剂对U251细胞增殖的影响 与对照组相比,*P<0.05,**P<0.01;A:转染miR-21 抑制剂细胞内miR-21表达变化;B:下调miR-21对U251细胞增殖的影响
2.2干扰miR-21抑制U251细胞迁移能力在细胞划痕实验中,划痕后24 h转染miR-21 处理组的U251细胞划痕愈合率明显低于对照组细胞(P<0.01,图2)。
2.3下调miR-21表达抑制U251细胞侵袭能力
为了进一步检测干扰miR-21对细胞侵袭能力的改变,将转染了miR-21 抑制剂的人胶质瘤U251细胞接种于24孔板上的Transwells小室,在转染48 h后取出Transwells小室固定,结晶紫染色,剔除膜用中性树胶封片。统计分析发现,转染miR-21 处理组的U251细胞较对照细胞侵袭能力明显降低,差异有显著性(P<0.01,图3)。
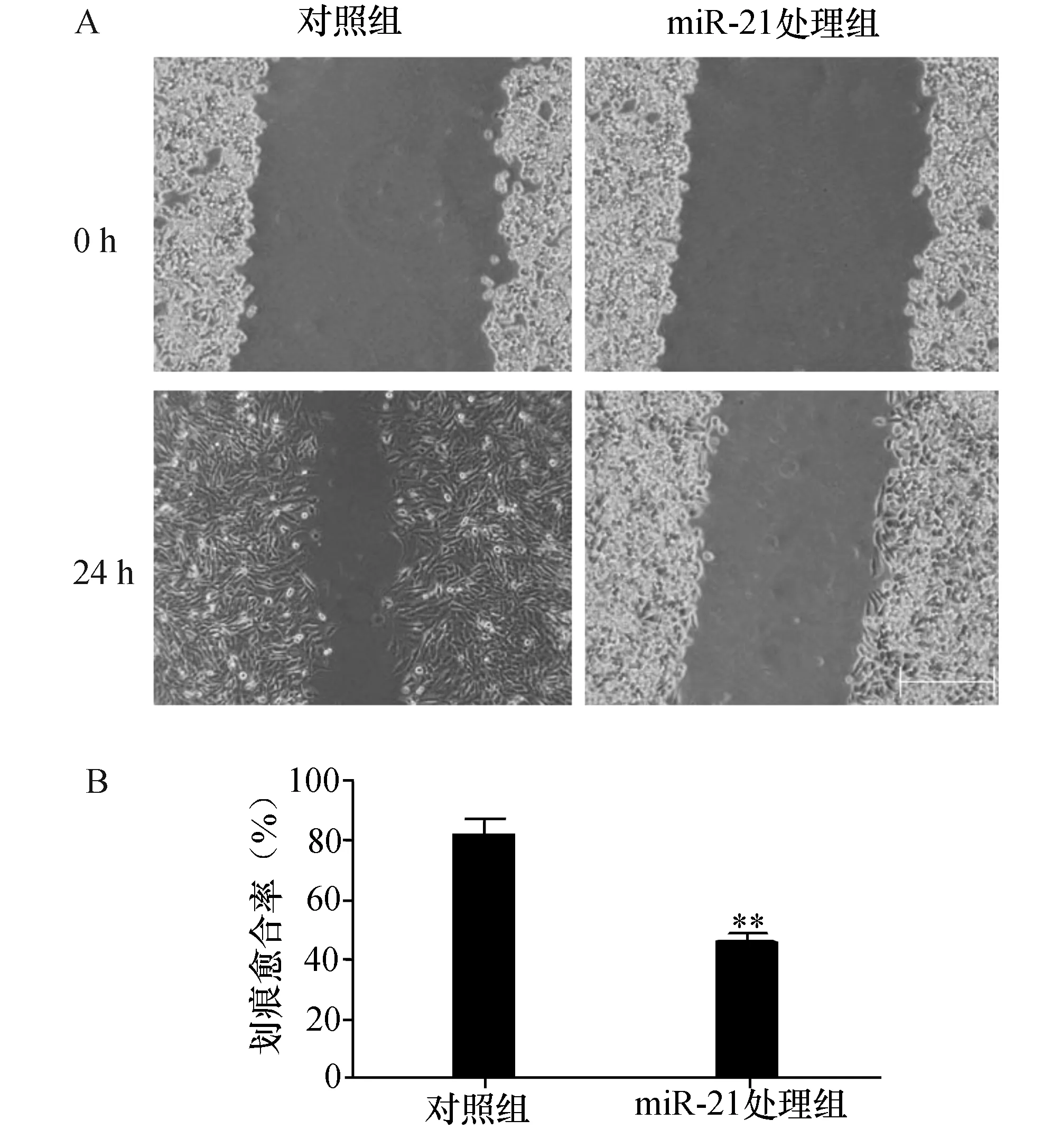
图2 miR-21表达下调对U251细胞迁移的影响 A:细胞划痕实验显微照相图(×200);B:划痕愈合率.与对照组比较,**P<0.01
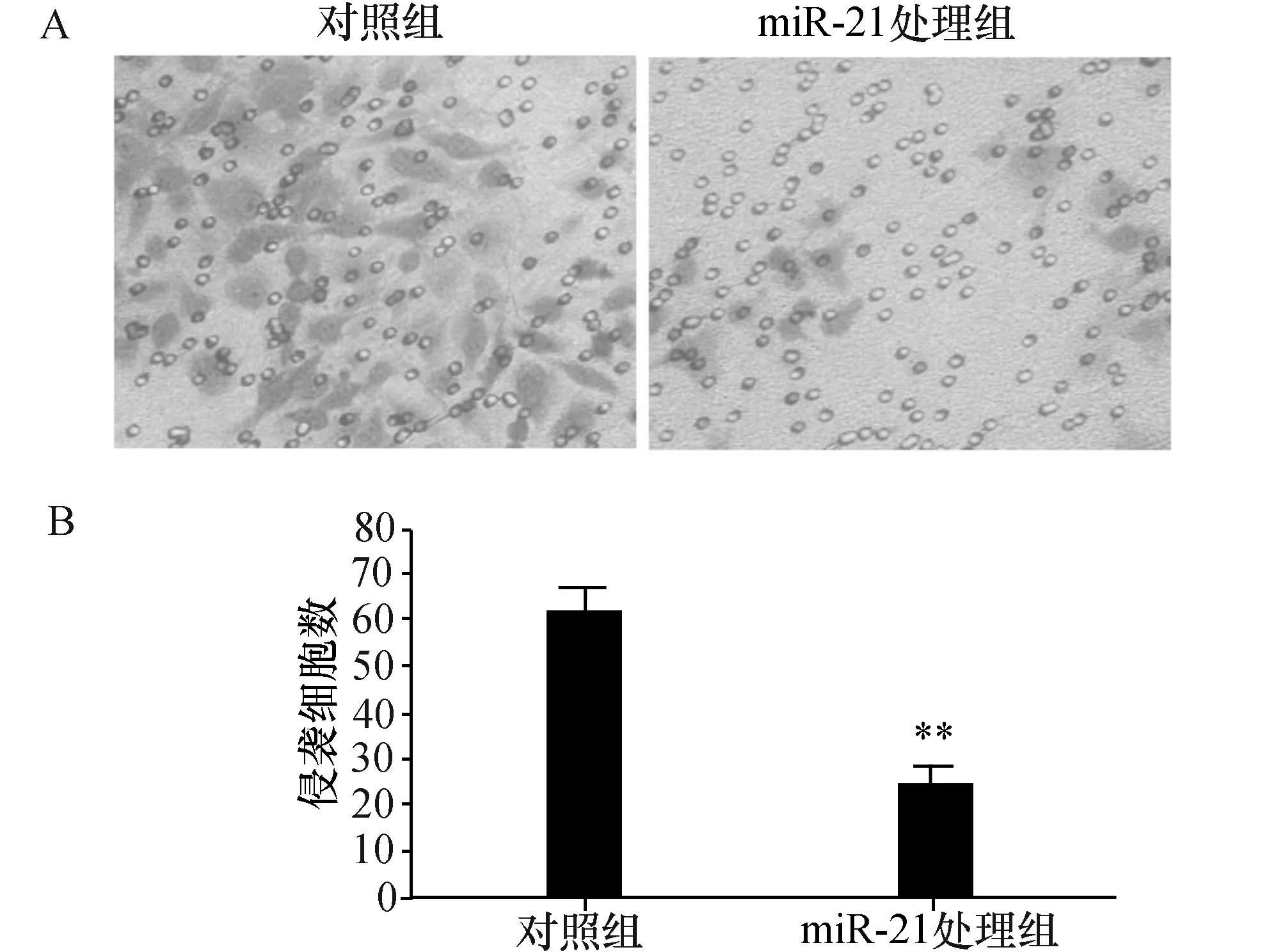
图3 miR-21抑制剂对U251细胞侵袭能力的改变 A:Transwells小室穿出的细胞结晶紫染色显微照相图(×200);B:显微照相平均5个视野穿出的平均细胞数.与对照组比较,**P<0.01
3 讨 论
miRNA 是一种内源性非编码小RNA,由高等生物基因组编码,其大小约21~25 nt。miRNA通过与位于靶mRNA 3’UTR的 miRNA调控元件相互作用引导沉默复合体,降解mRNA或阻碍mRNA翻译,从而参与调控个体发育、增殖、分化以及细胞凋亡等生命活动[9-10]。miRNA在肿瘤研究中进展迅速,研究表明,大多数miRNA在肿瘤发生发展中发挥重要作用[11]。
大量的研究表明 miR-21在肺癌、肝癌、胃癌、结肠癌、前列腺癌等多种恶性肿瘤组织和细胞中过表达[2-5]。miR-21作为癌miRNA能够调控靶基因如PTEN[3],CCL20[5], FAS等[12]促进肿瘤细胞增殖,生长,以及提升侵袭能力。然而miR-21在胶质瘤的发生发展中的作用目前尚不清楚。本研究通过胶质瘤细胞U251细胞中转染miR-21 抑制剂,观察干扰miR-21对U251细胞增殖和侵袭能力的影响。结果表明转染miR-21 抑制剂的U251细胞从48 h起增殖速度明显减慢。细胞划痕实验及transwell侵袭实验结果显示,miR-21表达下调抑制U251细胞迁移侵袭能力。本文结果与文献报道的一致,即miR-21能促进胶质瘤增殖和侵袭能力,很可能作为一个癌基因参与胶质瘤的发生与进展。miR-21能正调控胶质瘤增殖和侵袭能力,因而它有可能成为胶质瘤治疗的潜在靶点。
miRNAs是基因表达的调节因子,是肿瘤发展过程中的控制中心。miRNAs可以调节蛋白表达和影响多个信息通路。miRNAs作为肿瘤生物治疗的靶分子将比编码基因更有效。当前基于miRNAs治疗的基本策略是将基因敲除变成抑制或下调原癌基因miRNAs的表达水平。相反地,对抑癌基因,采取基因敲入的方法引入外源miRNAs,增加其表达水平,从而达到肿瘤治疗目的[13]。miRNA作为癌基因或抑癌基因功能的发现为肿瘤病因以及发病机制研究提供了新的思路,也为肿瘤的筛查、诊断防治、预后以及疗效监测提供了新策略。在日后的研究中,将继续深入miR-21在胶质瘤中的功能和分子研究,系统阐明miR-21参与胶质瘤发生发展的可能分子机制,为恶性胶质瘤的防治提供理论依据。
[1] Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67(18):8699-8707.
[2] Zhu Q,Wang Z,Hu Y,et al.miR-21 promotes migration and invasion by the miR-21-PDCD4-AP-1 feedback loop in human hepatocellular carcinoma [J].Oncol Rep,2012,27(5):1660-1668.
[3] Zhang BG,Li JF,Yu BQ,et al.microRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN [J].Oncol Rep,2012,27(4):1019-1026.
[4] Darido C,Georgy SR,Wilanowski T,et al.Targeting of the tumor suppressor GRHL3 by a miR-21-dependent proto-oncogenic network results in PTEN loss and tumorigenesis [J].Cancer Cell,2011,20(5):635-648.
[5] Vicinus B,Rubie C,Faust SK,et al.miR-21 functionally interacts with the 3′UTR of chemokine CCL20 and down-regulates CCL20 expression in miR-21 transfected colorectal cancer cells [J].Cancer Lett,2012,316(1):105-112.
[6] Medina PP,Nolde M,Slack FJ.OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma [J].Nature,2010,467(7311):86-90.
[7] Hatley ME,Patrick DM,Garcia MR,et al.Modulation of K-Ras-dependent lung tumorigenesis by MicroRNA-21 [J].Cancer Cell,2010,18(3):282-293.
[8] Hermansen SK,Dahlrot RH,Nielsen BS,et al.MiR-21?expression in the tumor cell compartment holds unfavorable prognostic value in gliomas [J].J Neurooncol,2013,111(1):71-81.
[9] Iliopoulos D,Lindahl-Allen M,Polytarchou C,et al.Loss of miR-200 inhibition of Suz12 leads to polycomb-mediated repression required for the formation and maintenance of cancer stem cells[J].Mol Cell,2010,39(5):761-772.
[10] Howe EN,Cochrane DR,Richer JK.Targets of miR-200c mediate suppression of cell motility and anoikis resistance[J].Breast Cancer Res,2011,13(2):R45.
[11] Tang H,Liu X,Wang Z,et al.Interaction of hsa-miR-381 and glioma suppressor LRRC4 is involved in glioma growth [J].Brain Res,2011,1390(1):21-32.
[12] Zhang A,Liu Y,Shen Y,et al.miR-21 modulates cell apoptosis by targeting multiple genes in renal cell carcinoma [J].Urology,2011,78(2):474.e13-19.
[13] Sotiropoulou G,Pampalakis G,Lianidou E,et al.Emerging roles of microRNAs as molecular switches in theintegrated circuit of the cancer cell[J].RNA,2009,15(8):1443-1461.
miR-21DownregulationInhibitsCellProliferation,MigrationandInvasioninGlioma
ZHANG Jincan,HU Dan,HE Lijin,etal
(DepartmentofNeurosurgery,YongzhouClinicalCollege,UniversityofSouthChina,Yongzhou,Hunan425000,China)
ObjectiveThis study was designed to investigate the effect of miR-21 knockdown on cell proliferation,migration and invasion of glioma cell line U251.MethodsU251 were transfected with miR-21 inhibitor by Lipofectamine.Meanwhile U251 was transfected with NC inhibitor as negative control.qRT-PCR was used to detect the miR-21 expression in these cells.The experiment was divided in negative control inhibitor group and miR-21 inhibitor group.The effects of miR-21 downregulation on cell proliferation,migration and invasion were evaluated by MTT,wound-healing transwell and invasion assays.ResultsmiR-21 expression was remarkably downregulated in miR-21 inhibitor-transfected cells in concentration-dependent manner,indicating transfection with miR-21 inhibitor can effectively reduce expression level of miR-21 in U251 cells.Transfection of miR-21 inhibitor into U251 cells led to a significant decrease in cell proliferation rate compared with control cells (P<0.01).miR-21 inhibitor results in reduction of cell migration(P<0.01).Moreover,the cell invasion by transwell invasion assay was reduced in miR-21-downregulated cells relative to control cells.ConclusionsmiR-21 can promote cell proliferation,migration and invasion of glioma cells.And it maybe plays an important role in tumorigenesis and development of glioma.
glioma;miR-21;cell proliferation;cell invasion
10.15972/j.cnki.43-1509/r.2016.02.006
2015-11-7;
2016-2-19
*通讯作者,E-mail:zjc_hnyz@sina.com.
R730.2
A
蒋湘莲)
