梅毒螺旋体粘附素Tp0751重组菌影的构建与鉴定
2016-12-25,,2,,,,,,*
,,2, ,,,, ,*
(1.南华大学医学院病原生物学研究所 湖南 衡阳 421001;2.邵阳医学高等专科学校医学检验系;3.深圳市南山区妇幼保健院检验科)
·基础医学·
梅毒螺旋体粘附素Tp0751重组菌影的构建与鉴定
江银波1,曹二龙1,2,朱洪3,赵飞骏1,甄红娇1,张佳俐1,余坚1,曾铁兵1*
(1.南华大学医学院病原生物学研究所 湖南 衡阳 421001;2.邵阳医学高等专科学校医学检验系;3.深圳市南山区妇幼保健院检验科)
目的构建梅毒螺旋体(Tp)粘附素Tp0751的重组大肠埃希菌菌影(E.colibacterial ghosts,EBG),为深入评价其在抗Tp感染中的潜在免疫保护作用奠定基础。方法将含有噬菌体PhiX174裂解基因E的质粒pHH43转化E.coliDH5α,42 ℃温控诱导使其形成EBG并计算裂解效率,用琼脂糖DNA电泳和透射电镜(TEM)鉴定EBG。构建含有裂解基因盒E-box、膜锚定序列E′-linker及Tp0751目的基因的原核双表达重组质粒pET28a-E′-Tp0751-E-box,28 ℃诱导重组E.coliBL21表达Tp0751并用Western Blot鉴定;42 ℃诱导形成重组EBG(rEBG),计算裂解效率并用DNA电泳和TEM鉴定。结果构建的EBG裂解率为98.13%,DNA电泳未观察到DNA条带,TEM显示绝大部分细菌都裂解成缺乏胞浆成分的细胞空壳并保持活菌基本形态。rEBG在28 ℃时高效表达重组Tp0751蛋白,且仅与梅毒患者血清特异性结合; 42 ℃下其rEBG裂解率为96.37%,电泳和TEM鉴定结果与EBG的相似。结论成功构建表达Tp粘附素Tp0751的rEGB,其所表达目的蛋白具有良好免疫反应性。
梅毒螺旋体;Tp0751;粘附素;菌影;大肠埃希菌
梅毒是由梅毒螺旋体(Treponemapallidum,Tp)感染引起的一种性传播疾病(STD),严重危害成人和新生儿健康,并明显增加感染艾滋病风险[1]。我国梅毒发病数近年来呈迅速上升趋势[2],但目前缺乏高效疫苗进行预防[3],这与Tp外膜蛋白不明确及相对落后的梅毒疫苗研究方法学等因素有关[3,4]。抗粘附和播散作用是发展梅毒疫苗的重要内容[3,4]。Tp0751是目前已知最为重要的Tp粘附素分子[3,4],还具有降解宿主蛋白的金属蛋白酶活性[6,7],导致Tp感染和扩散;以重组Tp0751免疫血清体外能阻止Tp在培养细胞间扩散[4]。因此,Tp0751成为最为理想的梅毒疫苗候选分子之一[3,4],但目前尚未见评价其体内免疫保护作用的研究报道。
保持重组抗原的天然构象、选择适当的抗原递送系统/佐剂对诱导机体高水平适应性应答至关重要。在当今众多的抗原递送系统/佐剂中,菌影(Bacterial ghost,BG)是近乎完美的一种[9]。BG作为一种高效的递送系统,能将外来蛋白抗原、核酸、药物等锚定于胞膜或胞质间隙[8]。理论上革兰阴性菌均可作为BG,其中以大肠埃希菌(E.coli)最常见。本实验采用单质粒双表达法构表达Tp0751的重组EBG并对其鉴定,为深入探讨其免疫保护作用奠定基础。
1 材料与方法
1.1材料pHH43质粒为军事医学科学院王惠教授惠赠;E.coliDH5α、BL21、表达载体pET28a(+)、pET32a(+)为美国Novagen公司产品;质粒提取试剂盒与DNA纯化试剂盒为美国Omega公司产品;限制性内切酶(NcoI、BamHI、XhoI、BglII、kpnI、EcoRⅤ)、碱性磷酸酶(CIP)、T4 DNA连接酶购自美国NEB(北京)有限公司;DNA Marker购自广州东盛生物科技有限公司;预染蛋白Marker为加拿大Fermentas公司产品;一抗为南华大学附属第一医院检验科经TPPA和ELISA确诊梅毒血清;二抗(HRP-羊抗小鼠)购自北京康为世纪有限公司。
1.2方法
1.2.1 EBG制备与裂解率计算 将质粒pHH43转化E.coliDH5α,接种于含氯霉素(150 μg/mL)的LB平板上,28 ℃过夜培养;挑单个克隆接种于含氯霉素的LB液体培养基中,28 ℃摇菌过夜培养,次日转种28 ℃培养至OD600值为0.5时,升温至42 ℃培养诱导细菌裂解,每30 min测定OD600值,当OD600值降至0.3时,离心收集菌体,重悬于无菌水中,剩余菌液加入DNaseⅠ (3.3 μg/mL) ,充分混匀后静置1 h,沉淀洗涤3次重悬于无菌水中,保存于4 ℃备用。同时设置非诱导组作对照。将诱导前后的菌液离心,菌体沉淀经稀释后涂布于LB平板上,37 ℃过夜培养,次日计数菌落数目。根据菌落形成单位(CFU)计算裂解效率:裂解率= 1-(诱导后的CFU/诱导前的CFU)]×100%。
1.2.2 EBG鉴定 取制备好的20 μl BG用1%琼脂糖凝胶电泳(取同体积对照菌液裂解去除蛋白后的上清液作对照),凝胶成像系统观察结果。新鲜制备的BG,经PBS洗涤、固定、包埋、脱水和切片,透射电镜观察鉴定(由中南大学湘雅生物医学电镜实验室完成)。
1.2.3 PCR扩增膜锚定序列 膜锚定序列E′是pHH43质粒上裂解基因E的第1~56位核苷酸,设计一对含linker(碱基序列为TACGCGCCGCAGGATCCT)的引物:P1:5′-GCGCCGCCATGGTACGCTGGACTTTGTG-3′(划线处为NcoI酶切位点)、P2:5′-AGGATCCTGCGGTGCATAGACGCTCGACGCCATT-3′ (划线处为BamH I酶切位点),将linker序列设计在E′基因的3′端,便于与已构建的pET28a-Tp0751(本研究所保存)上的Tp0751基因融合,引物由上海生工公司合成。PCR产物用DNA纯化试剂盒纯化。
1.2.4 pET28a-E′-Tp0751表达载体构建与鉴定 将上述扩增的E′-linker产物和已经构建好的pET28a-Tp0751均分别用NcoI和BamHI双酶切,用T4连接酶连接得到后pET28a-E′-Tp0751表达载体,转化E.coliBL21,酶切鉴定和测序鉴定重组子。
1.2.5 重组质粒pET32a-E-box与pET28a--E′-Tp0751-E-box构建与鉴定 含裂解基因盒E-box的pHH43经kpnI+EcoRⅤ双酶切,与同样双酶切的载体pET-32a连接,构建重组质粒pET32a-E-box,再经BglⅡ单酶切,将酶切完全的线性化载体 pET28a-E’-Tp0751通过柱离心的方法纯化DNA,再溶在1×CIP 去磷酸化反应缓冲液中,按每μg载体加0.5单位的酶,37 ℃温育60 min,再次纯化载体DNA。将经BglⅡ单酶切的pET32a-E-box与同样单酶切质粒pET28a-E’-Tp0751连接,构建重组质粒 pET28a-E′-Tp0751-E-box,酶切与测序鉴定。
1.2.6 重组Tp0751-EBG制备与鉴定 以pHH43/DH5α为裂解阳性对照菌,将pET28a-E′-Tp0751-E-box转化的E.coliBL21以终浓度1 mM的IPTG在28 ℃诱导90 min表达Tp0751后,迅速升温至42 ℃热诱导裂解,按上述方法观察OD600值和收集BG,通过CFU计算裂解率。以梅毒阳性血清为一抗(1∶100),正常人血清为阴性对照,Western Blot鉴定Tp0751的表达;用琼脂糖凝胶电泳及透射电镜观察鉴定BG的形成。
2 结 果
2.1热诱导E.coliDH5α(pHH43)裂解及裂解率计算三组细菌在28 ℃培养至OD600值为0.5后,将转化与未转化对照组升温至42 ℃,转化组OD600值在42 ℃诱导至90 min时开始下降,240 min左右时降到最低值;而42 ℃下未转化组和保持28 ℃培养的转化组的OD600值均随着培养延长而呈持续上升趋势(图1)。以上表明42 ℃下pHH43上E基因被激活导致E.coli裂解形成BG。BG裂解效率=[1-(30×104/160×105) ]×100% = 98.13%,即热诱导后有98.13%左右细菌被裂解。

图1 E.coli DH5α (pHH43)生长动态
2.2 EBG鉴定制备的E.coliDH5α BG和对照菌体经琼脂糖凝胶电泳结果显示,对照组有明显的大小不等的 DNA 条带,而BG组无条带显示,表明EBG内DNA已随菌体裂解而释放 (图2) 。TEM显示,大部分细菌呈空泡状结构,胞内容物被排出,基本形态无明显改变,未裂解的细菌(箭头所指处)很少(图3)。
2.3 pET28a-E′-Tp0751表达载体构建与鉴定PCR 扩增 E’-Linker 基因得到一长度约180 bp的片段,与预期大小一致。酶切后的扩增的E′-linker和pET28a-Tp0751的连接产物经双酶切鉴定(图4)和测序鉴定,表明pET28a-E′-Tp0751载体构建成功。

图2 E.coli DH5α BG的DNA琼脂糖凝胶电泳鉴定 Note:1:DNA Marker;2:lysis of E.coli DH5α harboring pHH43;3:lysis of E.coli DH5α

图3 E.coli DH5α BG的透射电镜(TEM)图
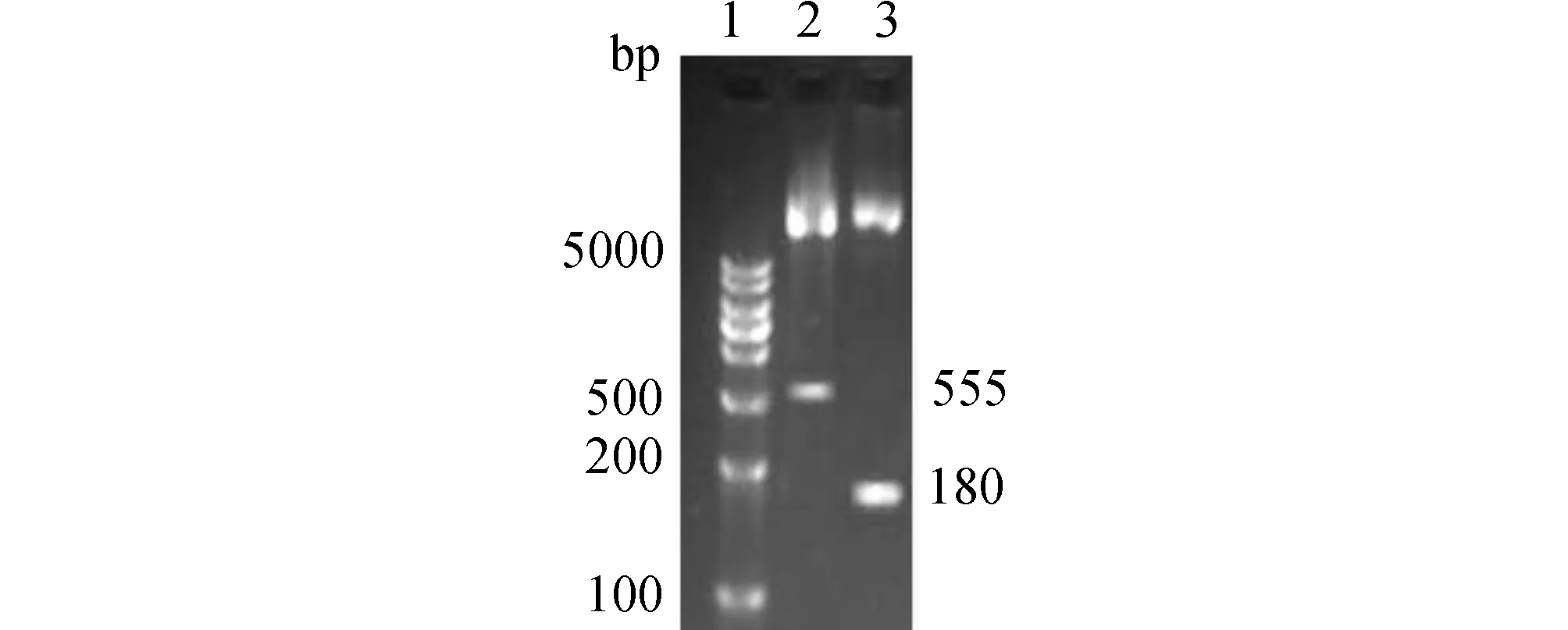
图4 pET28a-E′-Tp0751酶切鉴定 Note:1:DNA Marker;2:pET28a-E’-Tp0751 digested with BamH I and Xho I;3:pET28a-E’-Tp0751 digested with Nco I and BamH I
2.4重组质粒pET32a-E-box与pET28a-E’-Tp0751-E-box的构建与鉴定重组质粒pET32a-E-box经BglⅡ或kpnI+EcoRⅤ酶切后,目的片段大小约1 435 bp,载体约为5 900 bp,初步表明该质粒构建成功(图5-A)。重组质粒pET28a-E’-Tp0751-E-box 经BglⅡ单酶切后,得到一约1435bp的目的条带及一条与载体pET28a-E’-Tp0751单酶切后大小相当的6,104bp的片段(图5-B),测序结果显示E-box核苷酸序列与理论序列完全相同,以上表明表达质粒pET28a-E’-Tp0751-E-box构建成功。
2.5重组BG中Tp0751蛋白表达与鉴定
pET28a-E′-Tp0751-E-box转化的E.coliBL21经28 ℃诱导表达一分子量约28 KDa大小的明显条带(图6-A),结果显示,纯化的重组蛋白仅与梅毒阳性血清反应(图6-B),表明该重组蛋白为Tp0751。在 42 ℃诱导重组BG 70 min后,OD600值开始下降,150 min后又开始上升。计算裂解率为96.37%。TEM显示,大部分细菌都裂解成空泡状的BG形式,形态完好,仅极少量裂解不完全。
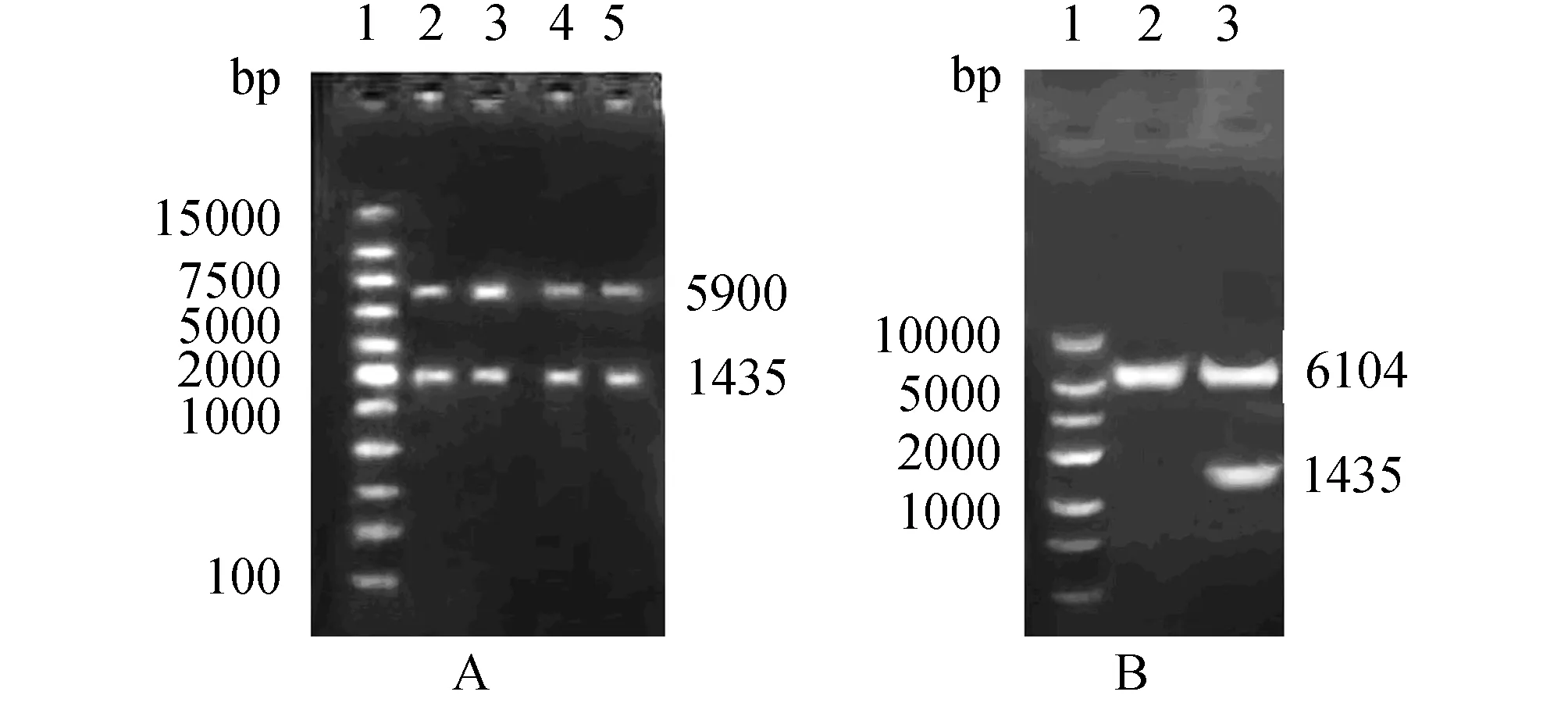
图5 pET32a-E-box (A)与pET28a-E’-Tp0751-E-box (B)的酶切鉴定 Note:A.1:DNA Marker;2,4:pET32a-E’-box digested with kpn I and EcoRⅤ;3,5:pET32a-E’-box digested with BglⅡ,B.1:DM10000;2:pET28a-E’-Tp0751 digested with BglⅡ;3:pET28a-E’-Tp0751-E-box digested with BglⅡ

图6 重组EBG中Tp0751的表达(A)与鉴定(B) Note:A.1:Protein marker;2,3:uninduced pET28a-E’-Tp0751-E-box/BL21;4,5:induced pET28a-E’-Tp0751-E-box/BL21,B.1-3:Syphilitic serum.1:pET28a /BL21;2,3:pET28a-E′-Tp0751-E-box/BL21;4:Healthy serum.pET28a-E′-Tp0751-E-box/BL21
3 讨 论
BG是一种裂解E基因被激活后表达裂解蛋白后导致革兰阴性细菌裂解、释放胞浆和核酸而形成的空细菌体[8]。装载外源目的基因的重组BG在较低温度(如28 ℃)时诱导表达目的蛋白,再通过较高温度(如42 ℃)时激活表达质粒中的裂解基因E表达E蛋白,裂解宿主菌而形成BG。双链 DNA 噬菌体至少需两个编码基因激活来裂解宿主细胞,而单链DNA噬菌体PhiX174只需单一的裂解E基因就能诱导宿主菌裂解[9]。本研究选择的pHH43是人工构建的新一代裂解质粒,含有裂解基因盒E-box,即裂解基因E和相应的调控组件λP Rmut启动子/CI857抑制子序列。本研究琼脂糖电泳和电镜结果显示,E.coliDH5α BG及Tp0751重组BL21 BG均充分释放胞内核酸且保持基本形态,裂解效率达到98%以上,表明42 ℃下pHH43的E基因表达产物具有强大的裂解效率。
本研究中采用单质粒双基因表达系统,即将表达E蛋白的E-box和表达锚定Tp0751的E′-Tp0751构建在一个表达质粒pET28a中,该重组质粒包含T7Lac启动子下的Tp0751表达系统和λPRmut启动子/CI857 抑制子调控的E 基因表达系统[10]。采用单质粒可解决双质粒在同一宿主菌的拷贝限制问题,以pET28a作为最终表达载体,因其是一种用于在E.coli中的高效表达载体,克隆到该质粒的目的基因受噬菌体T7强转录及翻译信号控制,表达由宿主细胞提供的T7RNA聚合酶诱导。本研究表明,28 ℃下诱导了Tp0751的高水平表达,而42 ℃下又诱导E蛋白表达,高效裂解形成BG。
外源目的蛋白可以通过锚定蛋白OmpA、E’和L’、SbsA以融合蛋白形式分别被锚定在BG的外膜、内膜、周质间隙胞浆[8],其中E’ 锚定蛋白最为常用。作为膜锚定序列,构象应以疏水的α螺旋为优,无裂解细胞效应,抗酶解且具有与细胞膜整合功能。本研究中选择的膜锚定蛋白是噬菌体phiX174上的裂解蛋白E的第1~54位氨基酸,其编码基因序列明确,可直接从裂解E基因中克隆获得;其N段30个氨基酸基本属于强疏水区,构象主要为α螺旋。此外,E’ 锚定目的蛋白后不会干扰后者空间构象的正确折叠[11]。动物实验也表明,内膜表达HIV-1 RT和HIV-1 gp41蛋白的重组BG能诱导明显的细胞和体液免疫反应[12]。膜锚定序列与重组目的蛋白之间需要靠一段柔性疏水的氨基酸序列即 linker 来连接,本研究中选用的linker由6个氨基酸组成,含有两个脯氨酸残基,具有良好的柔韧性。
总之,本研究成功构建了表达Tp0751的重组EBG,为后续探讨其免疫原性和免疫保护性奠定了基础。
[1] Douglas JM Jr.Penicillin treatment of syphilis:clearing away the shadow on the land[J].JAMA,2009,301(7):769-771.
[2] Zhou Y,Li D,Lu D,et al.Prevalence of HIV and syphilis infection among men who have sex with men in China:a meta-analysis[J].Biomed Res Int,2014,2014:620431.
[3] Cameron CE,Lukehart SA.Current status of syphilis vaccine development:need,challenges,prospects[J].Vaccine,2014,32(14):1602-1609.
[4] Cullen PA,Cameron CE.Progress towards an effective syphilis vaccine:the past,present and future[J].Expert Rev Vaccines,2006,5(1):67-80.
[5] Cameron CE,Brouwer NL,Tisch LM,et al.Defining the interaction of theTreponemapallidumadhesin Tp0751 with laminin[J].Infection and immunity,2005,73(11):7485-7494.
[6] Houston S,Hof R,Francescutti T,et al.Bifunctional role of theTreponemapallidumextracellular matrix binding adhesin Tp0751[J].Infect Immun,2011,79(3):1386-1398.
[7] Houston S,Hof R,Honeyman L,et al.Activation and proteolytic activity of theTreponemapallidummetalloprotease,pallilysin[J].PLoS Pathogens,2012,8(7):e1002822.
[8] Muhammad A,Champeimont J,Mayr UB,et al.Bacterial ghosts as carriers of protein subunit and DNA-encoded antigens for vaccine applications[J].Expert Rev Vaccines,2012,11(1),97-116.
[9] Lubitz P,Mayr UB,Lubitz W.Applications of bacterial ghosts in biomedicine[J].Adv Exp Med Biol,2009,655:159-170.
[10] Jechlinger W,Szostak MP,Witte A,et al.Altered temperature induction sensitivity of the lambda pR/cI857 system for controlled gene E expression inEscherichiacoli[J].FEMS Microbiol Lett,1999,173(2):347-352.
[11] Jechlinger W,Haidinger W,Paukner S et al.Bacterial ghosts as carrier and targeting systems for antigen delivery[A].Norfolk.Dietrich G,Goebel W [M].Horizon Scientific Press,2003:163-184.
[12] Szostak MP,Hensel A,Eko FO,et al.Bacterial ghosts:non-living candidate vaccines[J].J Biotechnol, 1996,44(1-3):161-170.
ConstructionandIdentificationofRecombinantE.coliBacterial
GhostsExpressingTreponemaPallidumAdhesinTp0751
JIANG Yinbo,CAO Erlong,ZHU Hong,etal
(InstitutionofPathogenicBiology,MedicalCollege,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo construct the recombinantE.colibacterial ghosts (EBG) expressing Treponema pallidum(Tp) adhesin Tp0751 and to further investigate its potential immunoprotection against Tp infection.MethodsE.coliDH5α cells transformed with the plasmids pHH43,containing phagephiX174 lysis E gene,were induced at 42 ℃ to produce EBG.The lysis rate was calculated and EBG were identified by DNA agarose gel electrophoresis and Transmission Electron Microscope (TEM).E.coliBL21 cells with prokaryotic double expression recombinant plasmids pET28a-E′-Tp0751-E-box,containing lysis gene cassette (E-box),membrane anchor sequence E’-linker and target gene Tp0751,were induced to express recombinant prtotein Tp0751 at 28 ℃ and to generate EBG at 42 ℃.Recombinant Tp0751 was identified by western blot.The lysis rate of recombinant EBG(rEBG) was calculated,DNA agarose gel electrophoresis and TEM were used to identify the EBG.ResultsThe lysis rate of EBG was 98.13%.No DNA ladder was observed by DNA gel electrophoresis and TEM showed that the vast majority of bacteria were lysed into empty cell envelopes lacking cytoplasmic content yet retaining unaltered morphological features of their living counterparts.At 28 ℃,rEBG effectively expressed Tp0751 that were specifically reactive with syphilitic sera by Western blot.At 42 ℃,the lysis rate of rEBG was 96.37%.and similar to EBG tested by electrophoresis and TEM.ConclusionThe recombinant EBG expressing Tp0751 are successfully constructed and expressed Tp0751 shows good immunoreactivity.
Treponemapallidum; Tp0751; adhesion; bacterial ghost; Esherichia coli
10.15972/j.cnki.43-1509/r.2016.02.001
2016-02-24;
2016-03-10
国家自然科学基金(No.81273322);湖南省教育厅开放创新平台基金(No.15K110);湖南省教育厅资助科研项目(No.15C1256);湖南省分子靶标新药研究协同创新中心(湘教通[2014])405号);湖南省高校科技创新团队支持计划资助(湘教通[2010]53号).
*通讯作者,E-mail:nhdxztb@126.com.
R377.1
A
秦旭平)
