E-cadherin和Fascin在子宫内膜样腺癌联合表达的临床病理意义
2016-12-25,,,,
,,,,
(广州市花都区人民医院病理科,广东 广州 510800)
·基础医学·
E-cadherin和Fascin在子宫内膜样腺癌联合表达的临床病理意义
胡名娟*,罗孟疌,王美超,江鹤灵,李国伟
(广州市花都区人民医院病理科,广东 广州 510800)
目的探讨上皮性钙黏蛋白(E-cadherin)和肌动蛋白聚合蛋白(Fascin)在子宫内膜样腺癌及前驱病变组织中的表达及临床意义。方法采用免疫组化法检测50例子宫内膜样腺癌、20例非典型子宫内膜增生、20例不伴非典型性子宫内膜增生和20例正常增殖期子宫内膜组织E-cadherin和Fascin蛋白表达,并与子宫内膜样腺癌的临床病理特征相联系。结果E-cadherin在子宫内膜样腺癌和非典型内膜增生组织中的异常表达明显高于其它内膜病变(P<0.05);Fascin蛋白高表达仅见于子宫内膜样腺癌,表达程度明显高于正常内膜和前驱病变(P<0.05)。E-cadherin异常表达和Fascin高表达均与肌层浸润深度及FIGO分期相关,但与淋巴结转移无关(P>0.05)。结论E-cadherin和Fascin协同参与子宫内膜腺上皮癌变过程,两者联合检测有助于鉴别子宫内膜样腺癌及其前驱病变。
上皮性钙黏蛋白(E-cadherin); 肌动蛋白聚合蛋白(fascin); 子宫内膜样腺癌; 前驱病变
子宫内膜样腺癌是女性生殖道最常见的恶性肿瘤之一,根据临床病理特征及分子遗传表型,子宫内膜样腺癌属I型子宫内膜癌,与持续性雌激素刺激和子宫内膜增生有关。尽管目前已有研究显示子宫内膜样腺癌在发生发展过程中伴有一些特殊的分子事件[1-2],但要预测肿瘤的生物学行为仍需要更为精准的分子标志物。非典型子宫内膜增生作为子宫内膜样腺癌的前驱病变,两者在分子遗传学水平上表现为一个疾病的连续性不同阶段[3],组织学鉴别十分困难,过高或过低诊断均是导致临床不当治疗的重要原因,要明确区分两者也需要更精准的分子标志物进行鉴别诊断。
肌动蛋白聚合蛋白(Fascin)是近年来发现的能与肌动蛋白结合的一种细胞骨架蛋白,主要表达于间叶组织和神经组织,但最近研究发现在多种人类肿瘤中的Fascin阳性表达,且其在上皮性肿瘤中的上调表达与瘤细胞浸润和淋巴结转移有密切关系[4]。而上皮性钙黏蛋白(E-cadherin)是细胞间黏附分子重要成员,能介导同种细胞黏附,参与细胞信号转导,研究表明肿瘤细胞对E-cadherin表达的失调控是肿瘤发生侵袭和远处转移最重要的机制之一[5]。这两种分子在子宫内膜样腺癌发展演进中的作用,特别是从子宫内膜非典型增生至癌变过程中作用机制尚不清楚。本研究的目的就是通过评估这两种蛋白在子宫内膜不同程度病变中的表达差异,探讨它们能否作为预测子宫内膜样腺癌生物学行为和组织学鉴别诊断的关键分子。
1 材料与方法
1.1材料收集广州市花都区人民医院2013~2015年间经手术切除、子宫诊刮的子宫内膜病变石蜡包埋存档标本110例,重新制片并HE染色。经专科病理医师按照2014年《世界卫生组织(WHO)女性生殖系统肿瘤分类》[6]的子宫内膜病变组织学诊断标准重新阅片并行病理组织学确诊。其中正常增殖期子宫内膜(proliferative stage of endometrium,PSE)20例,年龄38~48岁;不伴非典型性子宫内膜增生(hyperplasia without atypia,HWA)20例,年龄40~51岁;非典型子宫内膜增生(atypical hyperplasia,AH)20例,年龄40~52岁;子宫内膜样腺癌(endometrioid carcinoma,EA)50例,年龄41~55岁。4组病例年龄间比较,差异无显著性(P>0.05),术前均无激素替代治疗及放、化疗病史。子宫内膜样腺癌按国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)(2009)临床分期标准[7],I期18例,II期15例,Ⅲ和Ⅳ期17例。其中根据肌层浸润深度分为无肌层浸润或浅肌层浸润(<1/2肌层)34例,深肌层浸润(≥ 1/2肌层)16例。按WHO(2014)子宫内膜样腺癌组织学分级标准[6],24例为高分化(G1),14例为中分化(G2),12例为低分化(G3)。50例子宫内膜样腺癌病例中42例无淋巴结转移,仅8例可见淋巴结转移癌。
1.2方法所有标本均为经体积分数为4%中性甲醛溶液固定后常规石蜡包埋组织。4 μm厚连续切片,脱蜡至水,高温高压热修复抗原。免疫组织化学染色采用ChemMate Envision/HRP试剂盒和二氨基联苯胺(DAB)显色试剂盒(Dako公司,丹麦)。鼠抗人单克隆E-cadherin抗体(NCH-38,工作浓度1∶100,Dako公司,丹麦);Fascin单克隆抗体(即用型)购自福州迈新生物技术有限公司。采用EnVision两步法染色,具体步骤参照试剂盒说明书进行。Fascin和E-cadherin染色分别以已知阳性的卵巢癌和乳腺癌作为阳性对照,PBS代替一抗作空白对照。
1.3结果判读免疫组织化学染色结果由二位病理医师采用双盲法独立判读,并采用双评分系统(染色强度×染色面积)进行半定量评分。Fascin阳性信号为位于细胞膜和/或细胞浆的黄色细颗粒,染色强度评分0为无阳性信号,1为淡黄色,2为棕黄色,3为棕褐色。染色面积评分1为少于10%细胞阳性,2为10%~50%细胞阳性,3为>50%细胞阳性。Fascin表达双评分≤3定义为低表达,评分>3时定义为高表达。E-cadherin正常表达时定位于细胞膜呈连续线状阳性信号,当观察到子宫内膜病变的腺体上皮细胞E-cadherin只位于细胞膜连续性线状表达时,定义为正常表达。如果E-cadherin阴性、细胞膜不连续线状表达或定位于细胞浆中表达,均定义为异常表达[8-9]。
1.4统计方法采用SPSS 13.0统计软件进行数据分析。采用卡方检验,P<0.05为差异有统计学意义。
2 结 果
2.1 E-cadherin和Fascin在不同子宫内膜病变中的表达情况E-cadherin的连续性线状表达多见于正常增殖期内膜腺体和不伴非典型性内膜增生,正常表达率分别为100%(20/20)和85%(17/20)。但在非典型内膜增生和子宫内膜样腺癌中均可见较高比例的异常表达(图1),正常表达率仅为55%(11/20)和44%(22/50)。E-cadherin在内膜腺体的异常表达有助于区分非典型增生和普通内膜增生(P=0.038),但不能区分非典型增生与腺癌(P=0.405)(图2A)。Fascin阳性信号可见于子宫内膜腺体上皮细胞和间质,包括血管内皮细胞、纤维母细胞和内膜间质细胞(图3)。Fascin蛋白在正常增殖期宫内膜、不伴非典型内膜增生和非典型内膜增生的高表达率分别为0%(0/20),5%(1/20)和15%(3/20),三者间差异无显著性(P=0.153)。但子宫内膜样腺癌的Fascin高表达率为58%(29/50),与其它三种病变间比较,差异有显著性(P=0.001)(图2B)。
2.2 E-cadherin和Fascin表达与子宫内膜样腺癌临床病理特征的关系在50例子宫内膜样腺癌中,E-cadherin的异常表达与肿瘤临床分期有关,Ⅲ~Ⅳ期病例癌细胞E-cadherin异常表达明显增多(P=0.025),且有深肌层浸润者表达异常也显著增多(P=0.041),但与组织学分级和淋巴结转移均不相关(P>0.05)。Fascin高表达与组织学分级、临床分期和肌层浸润均有密切关系(P<0.05)。Fascin主要在G2和G3型腺癌中高表达,且G2和G3病例间差异无显著性(P=0.473)。Fascin的高表达主要出现在临床II期以上的病例中,II-Ⅳ期病例之间差异无显著性(P=0.538),与I期病例有明显的不同(P=0.010)。同时,Fascin高表达与淋巴结转移也无关联(P=0.288)。在50例腺癌中,E-cadherin异常表达与Fascin高表达密切相关(P=0.001)。为了明确E-cadherin异常表达和Fascin高表达在子宫内膜样腺癌中的是否具有协同作用,本研究分析了高表达Fascin蛋白和E-cadherin异常表达同时并存病例的临床病理特征,结果表明,E-cadherin和Fascin同时异常表达病例的临床分期更高(P=0.023),但并非预测肿瘤浸润深度和淋巴结转移的关键因素(P>0.05)见表1。
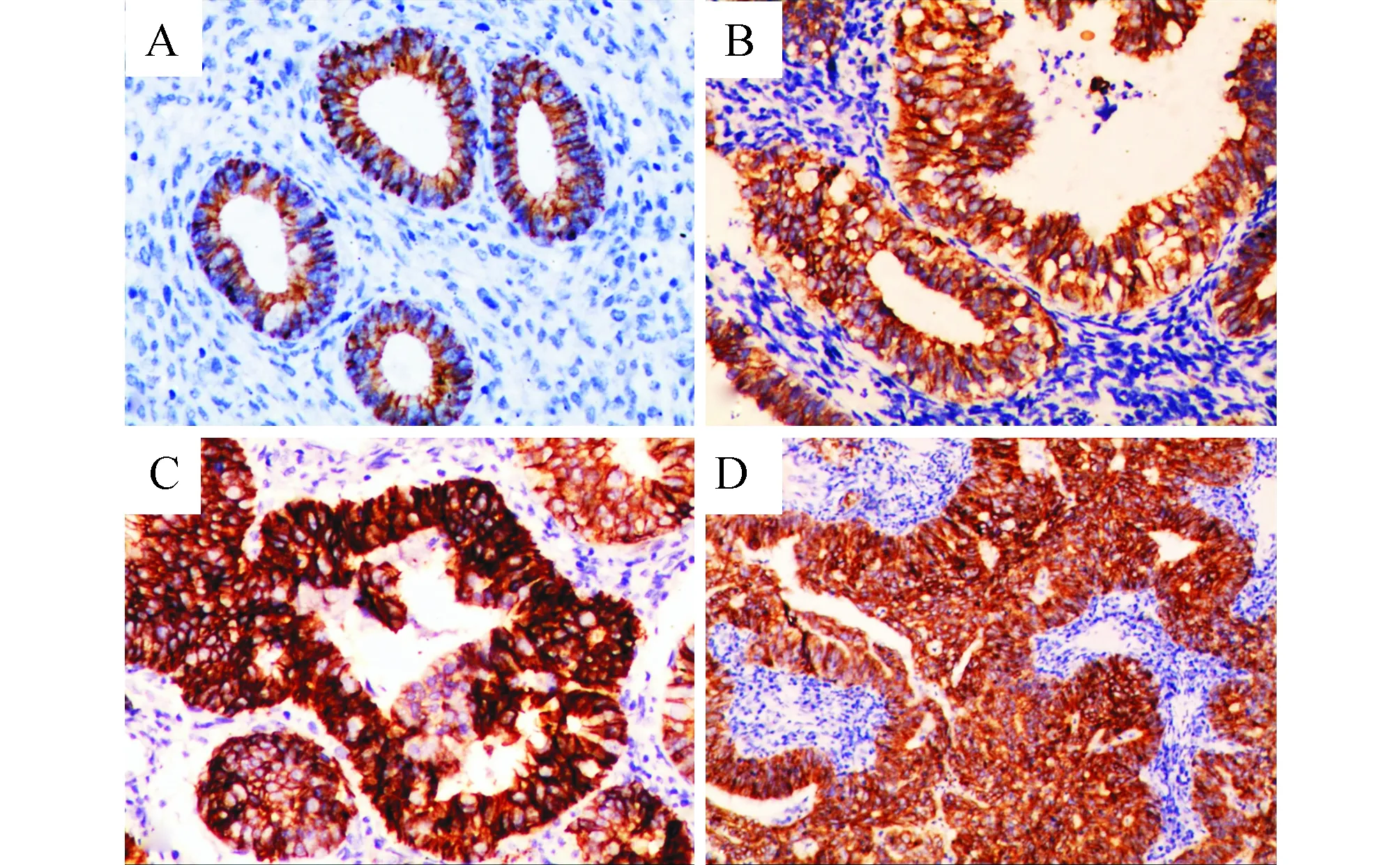
图1 E-cadherin在子宫内膜病变中的表达(免疫组化染色Envision二步法,×400) A:正常增殖期宫内膜组织中,E-cadherin定位于细胞膜呈连续性线状表达;B:不伴非典型性子宫内膜增生病变中,E-cadherin也呈正常表达;C:非典型子宫内膜增生组织中,E-cadherin明显出现胞浆内表达,此为异常表达;D:子宫内膜样腺癌组织中,E-cadherin也呈异常表达

图2 E-cadherin和Fascin蛋白在不同子宫内膜病变中的表达情况 PSE:正常增殖期宫内膜;HWA:不伴非典型性子宫内膜增生;AH:非典型子宫内膜增生;EA:子宫内膜样腺癌组织 A:E-cadherin异常表达多见于AH和EA中,较PSE和HWA有统计学差异,但AH和EA之间E-cadherin异常表达差异不存在显著性;B:Fascin蛋白高表达在EA组织中明显增多,但前驱病变(PSE、AWA和AH)之间Fascin高表达差异无显著性

图3 Fascin在子宫内膜病变中的表达(免疫组化染色Envision二步法,×400) A:正常增殖期宫内膜组织中,Fascin表达于间质细胞和血管内皮细胞,内膜腺体上皮阴性;B:不伴非典型性子宫内膜增生病变中,腺上皮也呈Fascin阴性;C:非典型子宫内膜增生组织中,Fascin可见小灶腺上皮细胞弱阳性表达,阳性范围不超10%;D:子宫内膜样腺癌组织中,Fascin蛋白弥漫强阳性
表1E-cadherin和Fascin在50例子宫内膜样腺癌中表达与临床病理特征的关系
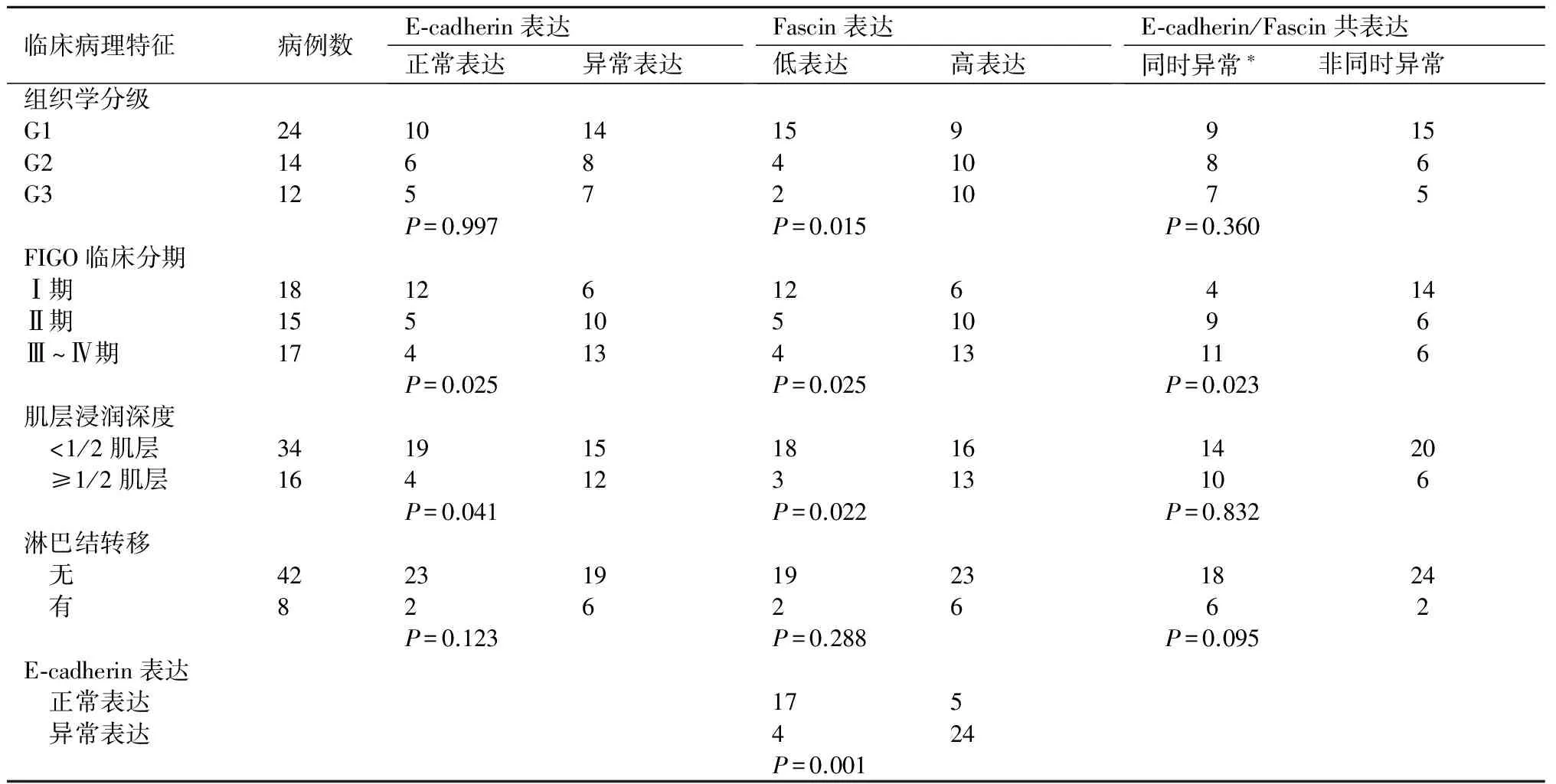
临床病理特征病例数E⁃cadherin表达正常表达异常表达Fascin表达低表达高表达E⁃cadherin/Fascin共表达同时异常∗非同时异常组织学分级G1241014159915G2146841086G3125721075P=0.997P=0.015P=0.360FIGO临床分期Ⅰ期18126126414Ⅱ期1551051096Ⅲ~Ⅳ期17413413116P=0.025P=0.025P=0.023肌层浸润深度 <1/2肌层34191518161420 ≥1/2肌层16412313106P=0.041P=0.022P=0.832淋巴结转移 无42231919231824 有8262662P=0.123P=0.288P=0.095E⁃cadherin表达 正常表达175 异常表达424P=0.001
*同时异常指腺癌细胞E-cadherin表达异常同时伴有Fascin高表达
3 讨 论
子宫内膜样腺癌是临床常见的妇科肿瘤,其生物学行为却难以预测[10],由于肿瘤的侵袭和远处转移是导致子宫内膜样腺癌预后不佳的最关键因素,故对癌细胞侵袭转移能力的研究,特别是对癌细胞“上皮-间叶性转化(epithelial- mesenchymal transformation,EMT)”的观察,成为了解癌细胞发展演进机制的重要途径。
E-cadherin是EMT过程的关键蛋白之一,与细胞内的连环蛋白(catenins)构成聚体结构,主要介导同种细胞间黏附,维持上皮细胞的形态,其表达下降或定位异常时,细胞黏附作用减弱,导致肿瘤细胞发生浸润转移和较差的临床预后[11-12]。E-cadherin下调作为子宫内膜癌变早期事件[13-14],其表达方式和表达强度与本研究的结果基本一致,提示E-cadherin参与了肿瘤由良性向恶性转变的过程。但与以往结果不同的是,本研究显示非典型内膜增生与子宫内膜样腺癌组织中E-cadherin的异常表达并无差异,提示在组织学诊断时并不宜通过E-cadherin表达状态来判断病变性质,否则会造成病变的过诊断而带来不当治疗。这可能与E-cadherin异常表达是细胞恶变的早期事件有关,表明这种改变早期即在具有恶性潜能的细胞中存在。
这时就需要增加一些分子标志物来协同判断病变性质。Fascin为55 kD多肽,是与细胞粘着、 运动和侵袭力相关的结构蛋白[15],并在多种人类肿瘤中异常表达[16-17]。本研究的结果也提示Fascin高表达有助于“癌”与“非癌”的诊断,但不能作为普通型内膜增生和非典型内膜增生的标志分子。推测Fascin在细胞癌变过程中所处的时期可能相对较晚,直到癌变不可逆时方起作用,在非典型增生时仍处在静止状态。Fascin的晚期作用恰好与E-cadherin的早期异常表达形成互补:利用E-cadherin异常表达区别普通型与非典型增生,再利用Fascin高表达鉴别癌与非癌。采用E-cadherin和Fascin的联合检测,可以使得诊断困难的普通型增生、非典型增生和子宫内膜样癌得以明确区分,有效地避免了因诊断失误所导致的不当治疗。
有关E-cadherin异常表达与子宫内膜样腺癌生物学行为关系仍在争论中,是否与肌层浸润或淋巴结转移有关尚无定论[18-19]。本研究结果显示,E-cadherin异常表达与肌层浸润和临床分期有关,但与肿瘤组织学分级和淋巴结转移无关。由于E-cadherin表达异常是癌细胞恶变的早期事件,其影响临床分期也主要是通过肌层浸润来实现的,而细胞的组织学分化程度除了与EMT过程相关外,更主要的是通过影响细胞增殖、凋亡、分化以及细胞周期蛋白的调控来实现[20],故单一的E-cadherin表达异常并不能全面客观地反映癌细胞生物学行为。Fascin高表达有助于子宫内膜疾病的良、恶性鉴别及肿瘤临床分期和淋巴结转移状态,提示Fascin高表达的组织可能具有更强的侵袭性和转移能力[21]。本研究结果仅显示了Fascin高表达与肌层浸润和组织分化有关,并未显示与淋巴结转移有明确关系。由于Fascin不是单一与细胞黏附侵袭相关的蛋白,而是受多种信号调控、参与多种病理生理过程的多功能蛋白[22-23],其是否真正具有预测子宫内膜样腺癌淋巴结转移的作用及作用机制仍需用进一步探讨。另外,本研究结果显示E-cadherin和Fascin在子宫内膜样腺癌组织中表达高度一致,但并不能更好地评估肿瘤的组织学分级、肌层浸润和淋巴结转移情况。这些结果说明二者的联合检测可能对子宫内膜疾病的良、恶性分析、恶性程度的判断有一定的价值,但尚不能作为预后指标对局部淋巴结转移乃至预后判断有更明确的指导作用。
E-cadherin和Fascin作为影响细胞间粘附和促进细胞运动的关键蛋白,在上皮组织肿瘤中的表达上调或异常表达可能具有普遍性,并在一定程度上影响肿瘤的浸润、转移和临床分期,与患者预后的关系密切。这两种蛋白在子宫内膜病变的联合检测,不但能够有效地鉴别良、恶性,还能够区分病变程度差异,同时能对子宫内膜样腺癌的生物学行为给予一定程度的评估预测,在临床鉴别诊断及基因靶向治疗具有广阔的应用前景。
[1] Makker A,Goel MM.Tumor progression,metastasis,and modulators of epithelial-mesenchymal transition in endometrioid endometrial carcinoma:an update[J].Endocr Relat Cancer,2016,23(2):R85-R111.
[2] Yeramian A,Moreno-Bueno G,Dolcet X,et al.Endometrial carcinoma:molecular alterations involved in tumor development and progression [J].Oncogene,2013,32(4):403-413.
[3] Matias-Guiu X,Prat J.Molecular pathology of endometrial carcinoma[J].Histopathology,2013,62(1):111-123.
[4] Jayo A,Parsons M.Fascin:a key regulator of cytoskeletal dynamics[J].Int J Biochem Cell Biol,2010,42(10):1614-1617.
[5] Paredes J,Figueiredo J,Albergaria A,et al.Epithelial E- and P-cadherins:role and clinical significance in cancer [J].Biochim Biophys Acta,2012,1826(2):297-311.
[6] Kurman RJ,Carcangiu ML,Herrington CS,et al.WHO classification of tumors of female reproductive organs [M].Lyon :IARC press,2014:125-128.
[7] Pecorelli S.Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium[J].Int J Gynaecol Obstet,2009,105(2):103-104.
[8] Nakanishi Y,Ochiai A,Akimoto S,et al.Expression of E-cadherin,alpha-catenin,beta-catenin and plakoglobin in esophageal carcinomas and its prognostic significance:immunohistochemical analysis of 96 lesions[J].Oncology,1997,54(2):158-165.
[9] Xie LQ,Bian LJ,Li Z,et al.Altered expression of E-cadherin by hepatocyte growth factor and effect on the prognosis of nasopharyngeal carcinoma[J].Ann Surg Oncol,2010,17(7):1927-1936.
[10] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[11] Gumbinera BM.Regulation of cadherin adhesive activity[J].J Cell Biol,2000,148:399-404.
[12] Troyanovsky RB,Klingelhöfer J,Troyanovsky SM.α-Catenin contributes to the strength of E-cadherin-p120 interactions[J].Mol Biol Cell,2011,22(22):4247-4255.
[13] Kogan EA,Niziaeva NV,Demura TA,et al.The morphological and immunohiochemical features of foci of adenomyosis:in its concurrence with endometrial adenocarcinoma[J].Arkh Patol,2010,72(4):7-12.
[14] Faleiro-Rodrigues C,Lopes C.E-cadherin,CD44 and CD44v6 in squamous intraepithelial lesions and invasive carcinomas of the uterine cervix:an immunohistochemical study [J].Pathobiology,2004,71(6):329-336.
[15] Türmer K,Orbán J,Gróf P,et al.FASCIN and alpha-actinin can regulate the conformation of actin filaments[J].Biochim Biophys Acta,2015,1850(9):1855-1861.
[16] Stewart CJ,Crook ML.Fascin expression in undifferentiated and dedifferentiated endometrial carcinoma[J].Hum Pathol,2015,46(10):1514-1520.
[17] Kim SJ,Kim DC,Kim MC,et al.Fascin expression is related to poor survival in gastric cancer[J].Pathol Int,2012,62(12):777-784.
[18] Mell LK,Meyer JJ,Tretiakova M,et al.Prognostic significance of E-cadherin protein expression in pathological stage I-Ⅲ endometrial cancer[J].Clin Cancer Res,2004,10(16):5546-5553.
[19] 王玲,薛慧荣,王艳丽.上皮性钙黏蛋白和B-连环素与子宫内膜癌的关系[J].中国实验诊断学,2006,10(5):478-481.
[20] 任占平,石喆,张芫.子宫内膜样腺癌组织中 p27、 MCM 7蛋白的表达及意义[J].肿瘤防治研究,2011,38(1):73-76.
[21] 黄岭,舒红,马晓欣.肌动蛋白聚合蛋白(fascin)和CD44V6在子宫内膜样腺癌组织中的表达及意义[J].生殖与避孕,2008,28(8):471-475.
[22] Grothey A,Hashizume R,Ji H,et al.C-erbB-2/ HER-2 upregulates fascin,an actin-bundling protein associated with cell motility,in human breast cancer cell lines [J].Oncogene,2000,19(42):4864-4875.
[23] Hölsken A,Buchfelder M,Fahlbusch R,et al.Tumour cell migration in adamantinomatous craniopharyngiomas is promoted by activated Wnt-signalling [J].Acta Neuropathol,2010,119(5):631-639.
ClinicopathologicalSignificanceofCo-expressionofE-cadherinandFascininEndometrioidCarcinoma
HU Mingjuan,LUO Mengjie,WANG Meichao,etal
(DepartmentofPathology,HuaduDistrictPeople’sHospitalofGuangzhouCity,Guangzhou,Guangdong510800,China)
ObjectiveTo investigate the co-expression of E-cadherin and Fascin in endometrioid carcinoma and its precursor lesions,and evaluate their clinicopathological significance in the development and progression of endometrioid carcinoma.MethodsOne hundred and ten cases of endometrial lesions,including 50 endometrioid carcinomas,20 atypical hyperplasia,20 hyperplasia without atypia,and 20 proliferative stage of endometrium were collected,and expression of E-cadherin and Fascin was evaluated by immunohistochemical staining.Correlation between immunostainings and clinicopathological parameters of patients was analyzed statistically.ResultsAbnormal expression of E-cadherin was found in either endometrioid carcinoma or atypical hyperplasia,which was significantly higher than that in other lesions (P<0.05).High expression of Fascin was significantly higher in carcinoma than those in other precursor lesions (P<0.05).Abnormal expression E-cadherin and high expression of Fascin was observed to be associated with tumor FIGO stage and depth of myometrial invasion,but not correlated with lymph node metastasis (P>0.05).ConclusionAltered expression of E-cadherin and fascin might be involved in the mechanism of carcinogensis of endometrioid carcinoma with co-operative effect,and play some important role in the development of tumor and in differential diagnosis of malignancy and its precursor lesions.
E-cadherin; Fascin; endometrioid carcinoma; precursor lesions
10.15972/j.cnki.43-1509/r.2016.02.004
2015-11-10;
2016-02-20
广州市花都区科技计划项目(13-HDWS-003).
*通讯作者,E-mail:694777171@qq.com.
R737.33
A
蒋湘莲)
