绿茶提取物对红曲黄酒酿造特性的影响
2016-12-15林晓婕黄飞何志刚梁璋成李维新
林晓婕,黄飞,何志刚,梁璋成,李维新
福建省农业科学院农业工程技术研究所,福建省农产品(食品)加工重点实验室,福建 福州 350003
绿茶提取物对红曲黄酒酿造特性的影响
林晓婕,黄飞,何志刚*,梁璋成,李维新
福建省农业科学院农业工程技术研究所,福建省农产品(食品)加工重点实验室,福建 福州 350003
研究了绿茶提取物(Green tea extract, GTE)对红曲黄酒酿造过程中红曲霉和酵母菌的生物量、产酶特性及其酿造特性的影响。在传统红曲黄酒酿造工艺的基础上,添加不同浓度醇提取的GTE共发酵,研究GTE对红曲霉和酵母的生长代谢产酶总量及红曲黄酒出酒率的影响。结果表明,添加2%的GTE进行共发酵,纯水提取的GTE和15%的乙醇溶液提取的GTE,其EGCG、ECG含量较低,对红曲霉和酵母菌的生长、代谢产酶均有促进作用,与对照相比红曲霉生物量分别提高2.4%和5.0%,产酶总量分别提高26.4%和47.8%,淀粉酶酶活分别提高了6.3%和11.8%;酵母菌生物量分别提高了9.4%和10.4%,产酶总量分别提高了21.2%和30.5%;出酒率分别提高了10.67和13.87百分点。75%的乙醇溶液提取的GTE,其EGCG、ECG含量较高,对红曲霉产酶和酵母菌的生长、代谢产酶有抑制作用,与对照相比出酒率降低了9.28百分点。
绿茶提取物;红曲黄酒;红曲霉;酵母菌
福建红曲黄酒以糯米为主要原料,红曲米为糖化剂,用山泉精酿而成。传统黄酒存在热性高,易“上火”,色泽不稳定等问题[1-3]。为此,本课题组研究了影响红曲黄酒寒热性的相关因子,通过绿茶共发酵技术,研制出了温和清爽型的红曲茶黄酒。前期研究结果表明,在红曲黄酒酿造过程中,添加绿茶共发酵,不但显著降低了黄酒的热度,而且有利于黄酒红色、黄色色价的保持,同时可明显提高黄酒的出酒率[4],但添加绿茶共发酵对红曲黄酒酿造特性的影响尚不明确。
红曲霉、酵母菌是红曲黄酒发酵过程中起到糖化发酵的关键微生物。红曲霉是一种小型丝状腐生真菌,能代谢产生淀粉酶、糖化酶、酯化酶等,其中,淀粉酶在红曲黄酒酿造过程中起到液化作用。红曲霉生长及产酶能力直接影响糯米的液化水平[5-7]。酵母是酒精发酵的关键菌,能够在无氧条件下代谢糖产生酒精,其生长与产酶能力显著影响酿酒过程中酒精发酵生成效率和最终产品品质[8]。因此,红曲霉及酵母的生长及发酵能力将直接影响到出酒率。
本文研究不同浓度醇提取的绿茶提取物对红曲霉、酵母菌的生物量、酶学及酿造特性的影响,以期为优化黄酒酿制工艺参数等提供理论依据,在温和型黄酒酿造的深入开发和应用方面提供技术支持。
1 试验材料
1.1原料
天山绿茶,宁德蕉城区市购;红曲霉L-25、酵母菌JH301,由本实验室自主选育、保存;古田平湖红曲米,市购。
1.2仪器与试剂
1.2.1仪器
E2695型高效液相色谱仪及2998型光电二极管阵列检测器,美国Waters公司;DHG-9070型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;GX-04多功能粉碎机,上海高翔食品机械厂;KQ-300VDE型超声波清洗器,昆山市超声仪器有限公司;电热恒温水浴锅,上海精密实验设备有限公司;BS224S电子天平,赛多利斯科学仪器有限公司;UV-1750紫外分光光度计,岛津仪器有限公司;SPX智能型生化培养箱,宁波江南仪器厂;YXQ-LS-505II立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂。
1.2.2试剂
标准品均购自美国sigma公司;淀粉酶试剂盒购自南京建成生物科技有限公司;其他试剂均为国产AR级。
1.2.3培养基
(1)红曲霉活化培养基:NaNO30.2%、KH2PO40.2%、MgSO40.1%,葡萄糖6%,蛋白胨2%,pH自然,加玻璃珠,121℃灭菌20min备用。
(2)红曲产酶培养基:蛋白胨0.5%、酵母膏0.5%、可溶性淀粉3%、CaCl2·2H2O 0.05%、MnCl2·4H2O 0.05%、MgSO4·7H2O 0.05%、KH2PO40.1%、pH 7.0~7.2、121℃灭菌20min备用。
(3)麦芽培养基:10%麦芽汁1 L,pH 5.4,121℃灭菌20min备用。
(4)酒精发酵培养基:称取一定量的糯米,浸泡过夜后沥干、蒸煮、冷却至60℃左右,添加1.5倍的无菌水,再分别加入420 U·g-1的α-淀粉酶和3 360 U·g-1糖化酶,于60℃条件下酶解2 h,冷却,配制成固形物含量约30%的糖化液,以乳酸调整pH值为4.0,离心后分装于各发酵瓶中,煮沸10min,然后冷却备用。
2 试验方法
2.1绿茶提取物制备
为了模仿黄酒发酵过程中溶剂对绿茶活性物质的提取模式,因此选择了发酵初期溶剂模式(即纯水)和发酵终产物溶剂模式(即15%的乙醇溶液)分别提取绿茶活性物质,并参考多酚提取方式[9-10]选择75%的乙醇溶液提取绿茶酚类物质。
绿茶用多功能粉碎机打成粉末,精确称取适量粉末,固液比1∶20,分别加50mL的纯水、15%的乙醇溶液、75%的乙醇溶液,超声波100 Hz,40℃提取40min,分别得到纯水提取的GTE(GTE1)、15%的乙醇溶液提取的GTE(GTE2)和75%的乙醇溶液提取的GTE(GTE3)[9-10],分别分析其多酚含量。
2.2红曲霉生长与产酶水平试验
将红曲霉接入活化培养基,30℃,150 r·min-1摇床培养6 d,备用。产酶培养基中分别添加2%绿茶提取物GTE1、GTE2、GTE3,以添加2%的无菌水为对照(CK),接入活化好的红曲霉,接种量5%,30℃,150 r·min-1摇床培养6 d,检测红曲霉生长量、产酶情况[11]。
2.3酵母菌生长、产酶水平及发酵试验
将酵母菌接入麦芽培养基,25℃恒温培养24 h,备用。另取麦芽培养基,分别添加2%绿茶提取物GTE1、GTE2、GTE3,以添加2%的无菌水为对照(CK),接入活化的酵母菌,25℃过夜培养24 h,考察酵母菌的生长、产酶情况。
酒精发酵培养基中分别添加2%绿茶提取物GTE1、GTE2、GTE3,以添加2%的无菌水为对照(CK),接入活化好的酵母菌,接种量为5%,25℃下恒温发酵,至发酵结束后,取发酵液4 800 r·min-1离心10min,取上清液,检测酒精度、残糖指标[12]。
2.4绿茶提取物对出酒率的影响
取5 kg容量酒坛,加入2.4 kg水,100g古田红曲米,浸泡过夜。加入经浸泡、蒸煮、摊凉的糯米饭1.6 kg,分别加入质量分数为1‰的绿茶(GT)、2%的GTE1、GTE2、GTE3,搅拌均匀后在室温下发酵,以加入2%的无菌水为对照(CK),发酵结束后检测酒精度、出酒率和总酸。
2.5检测方法
2.5.1酚类的测量方法
采用高效液相色谱法[13]测定多酚含量,采用GB/T 21733—2008茶饮料[14]中的方法测定总酚含量。
2.5.2氨基酸的测定
采用GB/T 5009.124—2003食品中氨基酸的测定[15]中所列方法测定氨基酸含量。
2.5.3菌体生物量的测定
霉菌生物量的测定:发酵液的菌丝体经过滤,60℃烘干,称重,以重量法表示[11];酵母生物量的测定:采用浊度计法[16],发酵液稀释10倍后,在660nm下检测吸光度,扣除绿茶提取物的吸光度,以浊度增量OD600表示酵母生长量。
2.5.4霉菌、酵母菌产酶总量的测定
发酵液离心取上清液,分别以添加2%的无菌水、GTE1、GTE2、GTE3的培养基为空白,采用考马斯亮蓝法[17]测定上清液蛋白质含量,以蛋白质含量表示产酶总量。
2.5.5淀粉酶酶活的测定
采用试剂盒法测定上清液淀粉酶酶活力[18]。淀粉酶酶活定义:样品的淀粉酶酶活力单位即1g红曲米在40℃、pH 6.0的条件下,1 h液化1 mg可溶性淀粉,即为1个淀粉酶酶活力单位(U·g-1)。
2.5.6酒精度及总糖的测定
酒精度:采用高效液相色谱法测定[19];残糖、总酸测定:参考GB/T 13662—2008 黄酒[20]中总糖、总酸的检测;出酒率:以成品酒15°计,按以下公式计算:出酒率%=酒精度%×出酒量(kg)/大米用量(kg)/15%
2.6数据分析
采用DPS数据软件进行显著性分析。
3 结果与分析
3.1绿茶提取物的主要生化成分
由图1可知,随着提取溶剂中乙醇浓度的增大,总酚得率明显上升,当提取液为75%乙醇水溶液时,总酚含量高达2.022 mg·mL-1。这可能是因为鞣质、酚类具有较强的极性,易溶于乙醇等极性溶剂。图1和表1说明,提取物中含有丰富的蛋白质、糖类和氨基酸等营养物质。从表2中可以看出,提取物GTE3中EGCG和ECG含量分别为1.243 mg·mL-1和0.263 mg·mL-1,随着提取溶剂中乙醇浓度的增大,酯型儿茶素EGCG、ECG含量明显增加,这与刘湘、王增盛等的研究[21-22]相符。
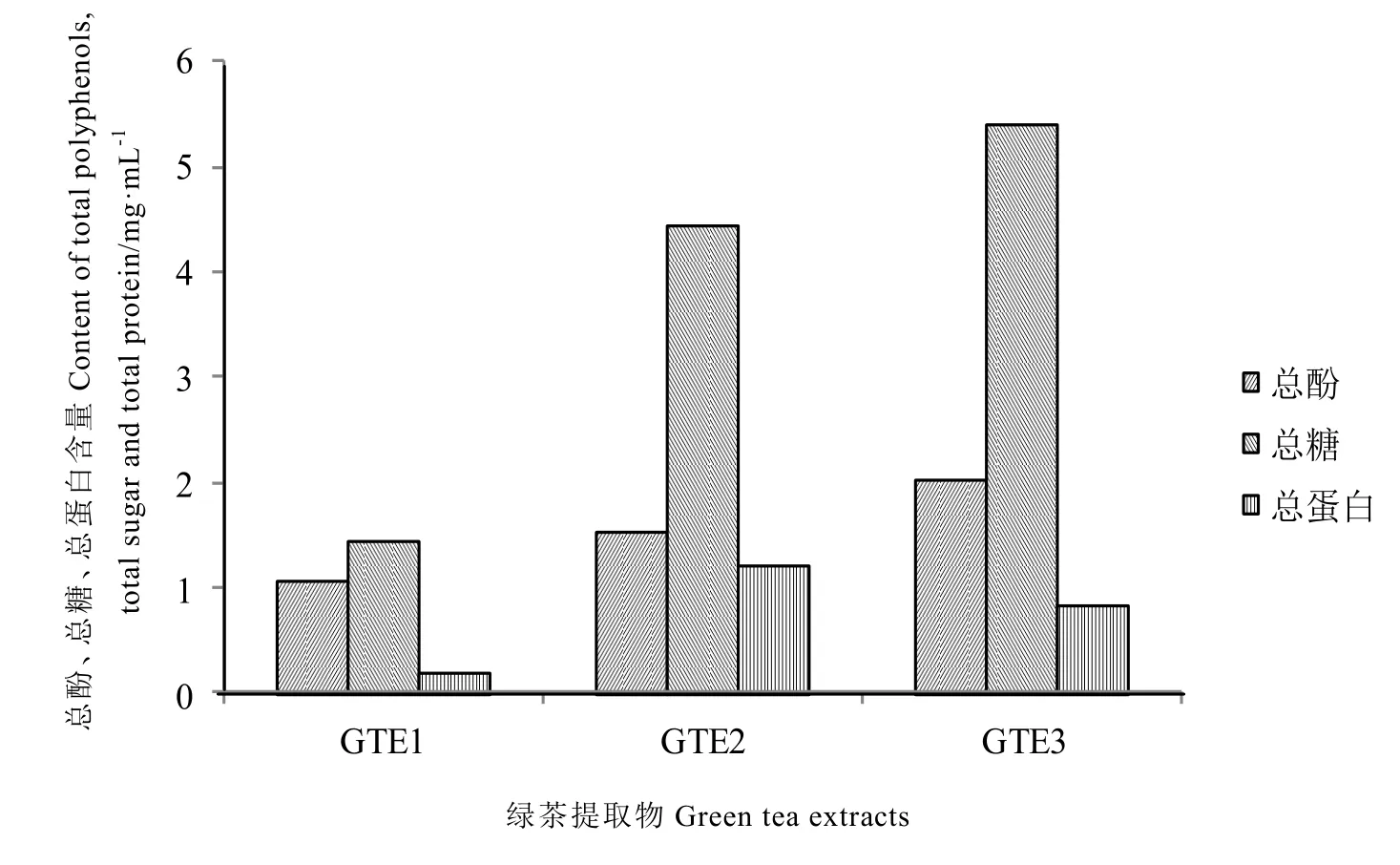
图1 绿茶提取物的主要营养成分Fig. 1 Essential nutrient ingreen tea extracts

表1 绿茶提取物的氨基酸含量Table 1 Amino acids ingreen tea extracts

表2 绿茶提取物的多酚含量Table 2 Polyphenols ingreen tea extracts
3.2绿茶提取物对红曲霉生长及产酶特性的影响
绿茶提取物对红曲霉生长代谢相关指标的影响结果如表3所示。从表中可以看出,与CK相比,添加GTE1的红曲霉生物量提高了2.4%,达显著水平(P<0.05),产酶总量和淀粉酶酶活分别较CK提高了26.4%和6.3%,达极显著水平(P<0.01)。添加GTE2的红曲霉生物量、产酶总量和淀粉酶酶活分别较CK提高了5.0%、47.8%和11.8%,三者均达极显著水平(P<0.01)。可以说明,水和低浓度醇溶剂提取的GTE1和GTE2中EGCG、ECG含量都较低,对红曲霉生长、代谢产酶有促进作用。这也间接说明,在发酵后期,随着酒体的变化,绿茶浸出物内溶物质的改变,提取物对红曲霉生长和产酶代谢的促进作用逐渐加大。GTE3对红曲霉的生长虽然没有明显的抑制作用,但产酶总量较CK下降10.4%,达显著水平(P<0.05),可以说明,GTE3对红曲霉的产酶代谢有抑制作用,这可能是因为较高浓度的茶多酚能够下调曲霉相关基因的表达[23-24]。
3.3绿茶提取物对酵母菌生长及产酶总量的影响
绿茶提取物对酵母菌生长代谢的相关指标测定结果如表4所示。表4表明,与CK相比,添加GTE1和GTE2处理的生物量分别提高了9.4%和10.4%,产酶总量分别较CK提高了21.2%和30.5%,均达极显著水平(P<0.01);酒精度分别较CK高0.18和0.25百分点,残糖降低了23.8%和26.0%,可以说明,GTE1和GTE2中EGCG、ECG含量较低,对酵母菌生长和产酶总量有促进作用,进而促进了酵母代谢糖类产生酒精。与CK相比,添加GTE3处理的生物量和产酶总量分别下降了7.4%和8.5%,酒精度下降了0.42百分点,残糖提高了2.9倍,可以说明,GTE3中EGCG、ECG含量较高,对酵母菌生长和产酶代谢有抑制作用,因此,降低了糖类的转化率,降低了发酵产物的酒精度。付慧等[25-27]在茶多酚对酵母等真菌生长代谢影响的研究中表明,茶多酚对真菌无抑制作用。Yongli Wang[28]等研究表明,在茶多酚低添加量(100mg·kg-1)的条件下,培根中酵母菌的微生物总数较空白对照增加;在高添加量(>200mg·kg-1)的条件下,培根中酵母菌微生物总量下降。这可能是因为低浓度的EGCG、ECG促进了酵母菌的生长,而高浓度的EGCG、ECG抑制了酵母菌的生长,与本文研究结果相符。

表3 绿茶提取物对红曲霉生长及产酶特性的影响Table 3 Effects ofgreen tea extracts on thegrowth of monascus and productivity of enzymes

表4 绿茶提取物对酵母菌生长及产酶总量的影响Table 4 Effects ofgreen tea extracts on thegrowth of yeasts and productivity of enzymes
3.4绿茶提取物对出酒率的影响
分别将绿茶和3种提取物加入红曲黄酒进行共发酵,考察绿茶与各提取物对黄酒品质的影响,发酵结束后检测结果如表5所示。由表5可知,红曲黄酒CK的酒精度和出酒率分别为11.03%和218.33%。添加绿茶、GTE1、GTE2的红曲黄酒酒精度分别较CK高0.52、0.50和0.52百分点,出酒率分别较CK高15.4、10.67和13.87百分点,均达到极显著水平(P<0.01),三者之间无显著差异,可以说明,三者对红曲黄酒的出酒率均有显著的促进作用,GTE1和GTE2对红曲黄酒酿造产物的影响和绿茶的影响较为接近。添加GTE3的红曲黄酒酒精度和出酒率分别较CK降低了0.35和9.28百分点。在试验中还发现,添加绿茶、GTE1和GTE2的红曲黄酒总酸较CK低了1.0g·L-1左右,添加GTE3的红曲黄酒总酸较CK低约1.5g·L-1,可以说明,绿茶及其提取物都能抑制酒体产酸。当添加的提取物总酚含量超过2mg·L-1时,酒体的抑制酸化效果大大增加。付慧[25]等在茶多酚对细菌生长代谢的影响研究中发现,茶多酚对细菌有较强的抑制活性。由于茶多酚抑制了细菌的生长代谢,抑制了细菌对营养物质的竞争利用,从而抑制了黄酒酸化。

表5 绿茶提取物对红曲黄酒酿造出酒率的影响Table 5 Effects ofgreen tea extracts on alcohol yield of hongquglutinous rice wine
4 结论与讨论
本试验结果表明,GTE1和GTE2能促进红曲霉和酵母菌的生长代谢和产酶,从而提高红曲黄酒的出酒率,原因可能有以下三点,第一,GTE中茶多酚主要为酯型儿茶素EGCG和ECG,酿酒酵母和曲霉能以之为碳源进行代谢[29],在发酵过程中,霉菌或酵母菌产生单宁酶,水解酯型儿茶素[30];第二,GTE1和GTE2中微量的EGCG、ECG等儿茶素,提高了微生物的抗氧化能力[31],有利于保护细胞膜结构[19],延长酵母菌和霉菌的时序寿命(Chronological life span,CLS),从而促进了霉菌的代谢和酵母菌的生长代谢;第三,GTE1和GTE2的提取溶剂为强极性溶剂,提取液中含有种类丰富的糖类、氨基酸、蛋白质等物质,为酵母提供了生长所需的碳、氮源[32]。Helena Orozco等[33]研究发现,氨基酸能补充酵母新陈代谢中的氨基酸不足,延长酵母最长寿命(Maximum life span),并在酒类发酵后期保持细胞完整性。高醇浓度溶剂提取的GTE3中EGCG、ECG含量较高,反而起抑制作用,EGCG、ECG能附着于酵母细胞膜上,与蛋白质结合降低酵母细胞膜的透性,与糖蛋白结合降低细胞膜的流动性,并最终导致细胞死亡[33],从而抑制了酵母菌的生长代谢和产酶。GTE3对红曲霉代谢产酶的影响可能类似于酵母菌,其作用机制有待进一步研究。
添加绿茶提取物能抑制黄酒酸化,主要原因可能是茶多酚能引起细菌细胞壁和细胞膜损伤,降低细菌细胞膜稳定性,增加细菌细胞膜通透性,致使细胞周质和胞内酶等组分发生泄漏,使细菌内的物质运输、能量转化、信息传递等生理代谢发生紊乱,进而导致细菌活性下降,引起细菌死亡[34-35]在发酵过程中,黄酒中的大部分有机酸主要由乳酸菌等细菌产生,酿造过程中添加茶多酚,使产有机酸的乳酸菌得到抑制。
由于绿茶种类很多,不同产地、不同加工工艺的绿茶,其EGCG、ECG、氨基酸等物质含量也有差别。不同来源绿茶的提取物,以及EGCG、ECG纯品对红曲黄酒酿酒品质的影响也有差别,对发酵关键微生物红曲霉、酵母菌和乳酸菌等作用机制的研究还有待进一步深入。
[1] 倪莉, 吕旭聪, 黄志清, 等. 黄酒的生理功效及其生理活性物质研究进展[J]. 中国食品学报, 2012, 12(3): 1-7.
[2] Lv X C, Huang X L, Zhang W, et al. Yeast diversity of traditional alcohol fermentation starters for Hong Quglutinous rice wine brewing, revealed by culture-dependent and culture-independent methods [J]. Food Control, 2013, 34(1): 183-190.
[3] 林鑫. 提高闽派黄酒品质综合技术的研究[D]. 福州: 福建农林大学, 2011: 7.
[4] 梁璋成, 何志刚, 刘淑梅, 等. 绿茶对红曲黄酒酿造品质及寒热性影响研究[J]. 茶叶科学, 2016, 36(3): 293-300.
[5] Feng Y L, Shao Y C, Chen F S, et al. Monascus pigments [J]. Applied Microbiology and Biotechnology, 2012, 96(6): 1421-1440.
[6] 邵伟, 谈玉, 唐明, 等. 红曲霉产淀粉酶特性研究[J]. 中国酿造, 2006(7): 25-27.
[7] 林秋, 马莹莹, 杨建刚, 等. 红曲霉酒曲的制备[J]. 食品与发酵工业, 2015, 41(7): 99-103.
[8] 隗程峰, 姚晓玲, 朱正军, 等. 黄酒酿造原料及微生物研究新进展[J]. 酿酒, 2015, 42(5): 96-101.
[9] 郑海燕, 张建新, 刘丽丽, 等. 超声波提取绿茶多酚的工艺研究[J]. 西北农业学报, 2009, 18(2): 261-264.
[10] 宋传奎, 肖斌, 王艳丽, 等. 超声波辅助提取茶多酚工艺条件的优化[J]. 西北农林科技大学学报: 自然科学版, 2011, 39(5): 133-146.
[11] 蔡颖慧, 潘佩平, 黄潇, 等. 红曲霉产琥珀酸与酯化酶的变化规律[J]. 食品科学, 2014, 35(13): 178-181.
[12] 刘杰, 傅勤峰, 蒋启海, 等. 两株酵母菌协同酿造黄酒的控制工艺[J]. 食品研究与开发, 2015, 36(1): 82-84.
[13] 杨亦扬, 马立锋, 黎星辉, 等. 氮素水平对茶树新梢叶片代谢谱及其昼夜变化的影响[J]. 茶叶科学, 2013, 33(6): 491-499.
[14] 中国轻工业联合会. GB/T 21733—2008 茶饮料[S]. 北京:中国标准出版社, 2008: 5-6.
[15] 中国轻工业联合会. GB/T5009.124—2003食品中氨基酸的测定[S]. 北京: 中国标准出版社, 2008: 117-119.
[16] 王林松, 岳田利, 赵志华, 等. 高发酵力苹果酒酵母的筛选[J]. 农产品加工: 学刊, 2007(3): 28-30.
[17] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2002: 71-74.
[18] 倪莉, 吴智广, 张雯, 等. 福建红曲中的红曲霉的生理生化特性研究[J]. 福州大学学报: 自然科学版, 2009, 37(6): 929-934.
[19] 王成涛, 张婵, 尹胜, 等. 儿茶酚对运动发酵单胞菌抗氧化防御体系的影响[J]. 中国食品学报, 2014, 14(8): 21-26.
[20] 中国轻工业联合会. GB/T 13662—2008 黄酒[S]. 北京:中国标准出版社, 2008.
[21] 刘湘, 汪秋安. 天然产物化学[M]. 北京: 化学出版社, 2010: 10-14, 151-157.
[22] 王增盛, 张莹, 童小麟, 等. 黑茶初制中茶多酚和碳水化合物的变化[J]. 茶叶科学, 1991, 11(增刊1): 23-28.
[23] Mo H Z, Zhang H, Wu Q H, et al. Inhibitory effects of tea extract on aflatoxin production by Aspergillus flavus [J]. Letters in Applied Microbiology, 2013, 56: 462-466.
[24] Mo H Z, Chen Y, Huang L Y, et al. Neuroprotective effect of tea polyphenols on oxyhemoglobin induced subarachnoid hemorrhage in mice [J]. Oxidative Medicine and Cellular Longevity, 2013(1): 42-55.
[25] 付慧, 杨萍, 汪秋宽. 茶多酚的制备及其抑菌活性的研究[J]. 食品科技, 2012, 37(6): 273-276.
[26] Jean M S. Interactions between yeast, oxygen and polyphenols during alcoholic fermentations: Practical implications [J]. Food Science and Technology, 2006, 39(9): 959-965.
[27] 张华艳, 戚丽, 张正竹. 咖啡碱对茶树主要叶部病原真菌的抑制作用[J]. 南京农业大学学报, 2010, 33(2): 63-67.
[28] Wang Y L, Li F, Zhuang H, et al. Effects of plant polyphenols and α-Tocopherol on lipid oxidation, microbiological characteristics, and biogenic amines formation in dry-cured bacons [J]. Journal of Food Science, 2015, 80(3): 547-555.
[29] 谢美华, 陈华红, 陈玉红, 等. 几种普洱茶发酵微生物对茶多酚代谢的初步研究[J]. 食品科技, 2013, 38(5): 82-85.
[30] 刘文瑶, 陈忠正, 李斌, 等. 绿茶茶汤混菌发酵过程中内质成分的变化[J]. 茶叶科学, 2011, 31(3): 225-229.
[31] 陈玲, 王成涛, 童军茂, 等. 抗氧化剂对运动发酵单胞菌有氧胁迫和生长代谢的影响[J]. 食品科学, 2009, 30(17): 278-281.
[32] 蒋立文, 刘德华, 廖卢燕, 等. 红茶菌发酵过程中主要化学成分变化的研究[J]. 食品科学, 2007, 28(3): 238-240.
[33] Helena O, Emilia M, Agustin A. Two-carbon metabolites, polyphenols and vitamins influence yeast chronological life span in winemaking conditions [J]. Microbial Cell Factories, 2012, 11: 104-114.
[34] 王慧敏, 朱军莉, 陆海霞. 茶多酚抑制腐败希瓦氏菌机理研究[J]. 茶叶科学, 2014, 34(2): 149-155.
[35] Bong-Jeun An, Jae-Hoon Kwak, Jun-Ho Son. Biological and anti-microbial activity of irradiatedgreen tea polyphenols [J]. Food Chemistry, 2004, 88: 549-555.
Effects of Green Tea Extracts on Brewing Characteristics of Hongqu Glutinous Rice Wine
LIN Xiaojie, HUANG Fei, HE Zhigang*, LIANG Zhangcheng, LI Weixin
Institute of Agricultural Engineering Technology, Fujian Academy of Agricultural Sciences, Fujian Key Laboratory of Agricultural Product (Food) Processing, Fuzhou 350003, China
The effects ofgreen tea extracts on the biomass of monascus and yeasts, productivity of enzymes and brewing characteristics were investigated. Based on traditional fermentation technology for hongquglutinous rice wine,green tea extracts by different ethanol solvents were added for fermentation and their effects ongrowth and metabolites of monascus and yeasts as well as alcohol yield were studied. The results showed that when 2% GTE was added for fermentation,green tea extracts by water or 15% ethanol-water solution resulted in relatively low EGCG and ECG. Moreover, they also exhibited promoting effects ongrowth of monascus, yeasts and the metabolites of enzymes. For example, the biomass of monascus increased by 2.4% and 5.0%, the productivity of enzymes increased by 26.4% and 47.8%, diastase activity increased by 6.3% and 11.8%, the biomass of yeasts increased by 9.4% and 10.4%, the productivity of enzymes increased by 21.2% and 30.5%, the enzyme activity increased by 6.3% and 11.8%, the alcohol yield increased by 10.67 and 13.87 percent point with the control. Extracts ofgreen tea by 75% ethanol-water solution led to the highest EGCG and ECG, which exhibited negative effects on thegrowth of monascus and yeasts and the productivity of enzymes in monascus. The alcohol yield also decreased by 9.28 percent point.
green tea extracts, hongquglutinous rice wine, monascus, yeast
TS272.5+1;TS261.4
A
1000-369X(2016)06-631-08
2016-06-15
2016-08-23
福建省属公益类科研院所基本科研专项(2014R1015-5、2016R1014-7)、福州市科技项目(2015-G-75)。
林晓婕,女,硕士,助理研究员,主要从事食品资源开发与利用研究,E-mail:njgzx@163.com。*通讯作者
