茶尺蠖为害提高邻近茶苗对茶尺蠖幼虫的防御能力
2016-12-15雷舒李喜旺孙晓玲王志英辛肇军
雷舒,李喜旺,孙晓玲,王志英,辛肇军*
1. 东北林业大学,黑龙江 哈尔滨 150040;2. 中国农业科学院茶叶研究所,浙江 杭州 310008;3. 农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008
茶尺蠖为害提高邻近茶苗对茶尺蠖幼虫的防御能力
雷舒1,2,李喜旺2,3,孙晓玲2,3,王志英1*,辛肇军2,3*
1. 东北林业大学,黑龙江 哈尔滨 150040;2. 中国农业科学院茶叶研究所,浙江 杭州 310008;3. 农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008
本文研究了茶树虫害诱导挥发物(Herbivore-induced plant volatiles, HIPVs)对邻近茶苗防御能力的影响。将健康茶苗放在茶尺蠖取食的茶苗附近,作为HIPVs的处理,测定了茶树防御相关基因在不同处理下的表达水平、抗性防御物质的水平,并检测了茶尺蠖危害茶苗邻近植株对茶尺蠖幼虫生长的影响。研究结果表明,与对照相比,茶尺蠖幼虫为害茶苗释放的HIPVs在处理后24 h和12 h内分别显著诱导邻近茶苗CsiLOX1和CsiACS1基因的表达水平,这些挥发物还能增强茶尺蠖取食诱导的防御基因的表达。HIPVs处理3 d后,茶树的重要防御物质多酚氧化酶(Polyphenol oxidases, PPOs)活性显著高于对照,是对照的1.36倍,同时,取食这些茶苗的茶尺蠖幼虫体重也显著低于对照。上述结论表明茶尺蠖取食诱导的挥发物能够作为信号物质在茶树中传递,并能够通过增强茉莉酸和乙烯抗虫途径提高对茶尺蠖的抗性。
茶树;茶尺蠖;临近茶树;诱导防御反应
植物在与植食性昆虫的长期协同进化过程中,获得了多种诱导防御反应来抵御其为害[1-2]。在识别植食性昆虫激发子(Elicitor)的基础上,植物通过激活体内多种信号转导途径(如茉莉酸、水杨酸、乙烯等),继而诱导防御相关基因表达水平的上升、防御化合物的积累以及虫害诱导挥发物(Herbivore-induced plant volatiles,HIPVs)的大量释放,从而对植食性昆虫产生直接或间接防御反应[3-4]。为增强自身的生存竞争能力,植物还能通过个体内或个体间的化学信号交流对即将到来的为害进行防御准备[3,5-6]。其中,HIPVs作为重要化学信号可以在个体间传递的现象已在利马豆Phaseolus lunatus L.、烟草Nicotiana attenuate L.、番茄Lycopersicon esculentum Mill.、桤木Alnusglutinosa等多种植物中得到证实[7-10]。大量研究结果揭示HIPVs能够诱导邻近的同种或异种植物产生防御反应以增加个体的适应性[3,11-12]。例如,靠近损伤植株后,健康糖槭Acer saccharum体内的酚类物质和单宁的浓度都显著提高[7]。
茶尺蠖(Ectropis obliqua Prout)是茶园中发生普遍且危害严重的食叶性害虫种类之一,年发生6~7代,严重发生时可将茶树吃成光杆甚至直接导致茶树死亡。茶尺蠖幼虫的取食为害,可以提高茶树叶片茉莉酸和乙烯信号分子含量,以及脂氧合酶基因(CsiLOX1)、乙烯合成酶基因(CsiACS1)等多种防御基因的转录水平[13-14];同时还能诱导茶树释放大量的挥发性有机化合物,显著影响茶尺蠖成虫和其幼虫寄生蜂——单白绵绒茧蜂Apanteles sp.的寄主选择行为[15-17];而茶尺蠖幼虫取食处理和机械损伤加其反吐物处理却会抑制茶树叶片中重要防御化合物多酚氧化酶(PPOs)的活性[18]。然而,茶尺蠖幼虫为害诱导茶树释放的挥发物能否作为化学信号在茶树间传递,以及它们能否诱导邻近茶树的防御变化等问题仍不得而知。鉴于此,本研究通过检测健康茶苗与茶尺蠖幼虫为害苗的邻近植株茶树叶片中CsiLOX1和CsiACS1转录水平的表达量,以及比较不同处理植株PPOs活性及茶尺蠖幼虫的生长发育速率,确定茶尺蠖幼虫为害诱导茶树释放的挥发物对邻近植物防御水平的影响,以期为从虫害诱导茶树挥发物中筛选可诱导茶树防御的化学激发子提供理论基础。
1 材料与方法
1.1供试茶苗
供试茶苗为龙井43,2年生扦插苗,于(26±2)℃温室中培养,光照12L∶12D,相对湿度60%~70%,每4个月施1次有机肥。选择长势良好、无病虫害茶苗用于试验。
1.2供试茶尺蠖
茶尺蠖幼虫采自御茶村茶业有限公司所属茶园(浙江,绍兴)。室内饲养于RXZ智能型人工气候箱内,温度(25±2)℃,相对湿度60%~80%,光照周期为14L∶10D,饲以新鲜茶树叶片。室内饲养1代后,第2代茶尺蠖初孵幼虫用于生物测定,3龄幼虫用于茶苗处理。
1.3茶苗处理
试验在(25±2)℃,相对湿度60%~80%,光照条件为16L∶8D的条件下进行。茶苗隔天浇一次水,在75cm×75cm×150cm的密闭容器中进行处理(图1),容器中间以灭菌透气纱布隔开。虫害苗为50头3龄茶尺蠖幼虫(TG)取食的茶苗,50%茶尺蠖取食后记录处理时间。在每组实验中,5株虫害苗或健康苗分别与5株健康苗(受体植物)同时放置于容器两端。与健康苗同时放置的受体植物称为Receiver-C(简称对照C),与虫害苗同时放置的受体植物称为Receiver-T(简称处理T)。第1组茶苗于处理0、12、24、48、72 h后分别取对照C和处理T的芽下第2叶,用于靶标基因转录水平检测;第2组茶苗于处理72 h后取芽下第2叶用于PPO活性检测;第3组茶苗于处理3 d后从装置中取出,利用1头茶尺蠖(3龄)取食对照C(TG)或处理T第2叶位6 h(双处理),样品用于靶标基因转录水平检测。每组处理5个重复。

图1 茶尺蠖幼虫危害诱导临近茶苗防御反应处理装置图Fig. 1 Setup of container used for treatment

表1 用于qRT-PCR的引物分布情况Table 1 Description of the primers used for qRT-PCR
1.4基因表达量分析
取0.10g样品,采用试剂盒(TIANGEN,天根生化科技有限公司,北京)进行总RNA提取和反转录,具体操作步骤详见产品说明。以SYBR Green为荧光标记染料,茶树GAPDH基因为内参基因,引物序列见表1。实时荧光定量PCR(qRT-PCR)采用20μL体系:10μL SYBR®Green Supermix(Bio-rad),正向和反向引物各1μL(10μmol·L-1),cDNA模板1μL,ddH2O补足至20μL。PCR反应条件为95℃预变性30 s;95℃变性5 s,60℃退火30 s,40个循环。每个样品重复3次,反应结束后收集CT值进行分析。
1.5生物测定
虫害苗和健康茶苗在装置中放置3 d后,用于生物测定。实验条件同茶苗处理。将初孵幼虫接种对照C或处理T的第2叶进行取食,每叶2头,并用透明尼龙网袋固定,每盆苗接种10头,共接种5盆苗。茶尺蠖取食6 d后取下称重(精确到0.1 mg)。
1.6多酚氧化酶活性测定
多酚氧化酶活性测定采用分光光度计法,以邻苯二酚为底物,脯氨酸为催化剂,于460nm波长处测定吸光值的变化。以每分钟变化0.01个OD值为1个酶活力单位(units),酶活性表示为:酶活力单位(units)/总蛋白含量(mg)/反应时间(min)(U·mg-1·min-1)。具体方法参详见文献[19]。
1.7数据分析
数据均在Win7操作系统下采用Statictica 6.0(Statistica,SAS,Institute,lnc.,Cary,NC,USA)软件进行分析。两种不同处理之间CsiLOX1和CsiACS1基因的表达水平的差异、PPOs活性的差异,以及茶尺蠖幼虫在两个不同处理上生长发育的差异分析采用独立样本t-检验。CsiLOX1和CsiACS1基因在对照、茶尺蠖幼虫取食和虫害苗处理和茶尺蠖幼虫取食三者之间的差异显著性分析采用单因素方差分析(ANOVA),如果方差分析差异显著(P<0.05),则进行Duncan’s新复极差法多重比较。
2 结果与分析
2.1邻近茶苗CsiLOX1和CsiACS1基因的表达水平
CsiLOX1和CsiACS1分别是茉莉酸和乙烯途径上的关键合成酶基因[20-21],在茶树中已有报道。实验结果表明,随着暴露时间的延长,处理T中CsiLOX1的相对表达水平在24 h开始显著升高,一直持续到72 h(图2-A);而CsiACS1的相对表达水平在12 h开始显著升高,一直持续到48 h,但是在72 h与对照C相比,没有显著差异(图2-B)。
2.2邻近茶苗中CsiLOX1和CsiACS1受茶尺蠖幼虫的诱导表达水平
TG取食6 h后,CsiLOX1的表达量比对照C提高3.0倍,而双处理苗CsiLOX1的表达量比对照C提高5.0倍,且TG取食与双处理之间具有显著差异(图3-A)。同样地,TG取食和双处理6 h均能显著提高CsiACS1的相对表达水平,且双处理的诱导表达水平显著高于TG取食(图3-B)。

图2 茶尺蠖幼虫为害对邻近茶苗CsiLOX1(A)和CsiACS1(B)表达量的影响Fig. 2 The effects of TG-induced plant volatiles on the relative expression levels of CsiLOX1 (A)and CsiACS1(B)in neighboring tea plants
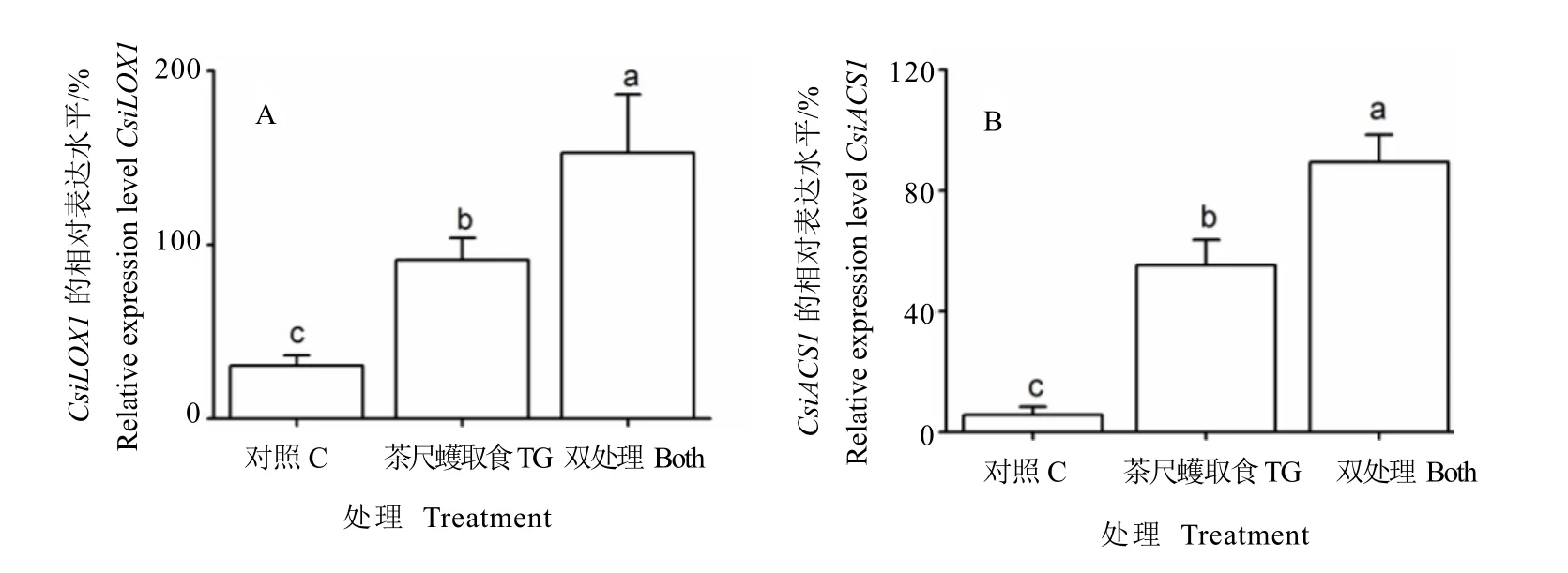
图3 茶尺蠖幼虫为害对邻近茶苗茶尺蠖诱导的CsiLOX1(A)和CsiACS1(B)基因表达量的影响Fig. 3 The effects of TG-induced plant volatiles on the TG-induced relative expression levels of CsiLOX1(A)and CsiACS1(B)in neighboring tea plants

图4 茶尺蠖幼虫为害对邻近茶苗茶尺蠖PPO活性(A)及对茶尺蠖初孵幼虫体质量的影响(B)Fig. 4 The effects of TG-induced plant volatiles on PPO activity (A) and mass of freshly hatched TG larvae (B)
2.3茶尺蠖幼虫为害苗诱导了邻近茶苗的直接防御反应
暴露3 d后处理T叶片的PPO活性为(2.43±0.27) U·mg-1·min-1,显著高于对照C(图4-A)。初孵的茶尺蠖幼虫在处理T上取食6 d后的体质量显著低于对照C上的幼虫体质量,为对照的76.1%(图4-B)。
3 讨论
植物的地上或地下部分均能感知由植食性昆虫取食或产卵造成的机械损伤和某些来自虫体的诱导物[22-24],从而激活HIPVs的合成和释放[4]。HIPVs作为化学信号可以在植物、植食性昆虫与天敌之间传递,从而引起植物的直接或间接防御反应,并能引起邻近植株的“窃听”(Priming)行为[25-27]。茉莉酸和乙烯是植物(包括茶树)体内两条重要的抗虫信号途径,LOX和ACS是这两个生物合成途径上的关键酶[4,20-21]。大量研究结果发现,HIPVs可诱导临近健康植株(“窃听”植株)相关防御基因的表达、毒素或挥发性互益素的产生,从而直接启动植物的防御体系[4,28-29]。我们的前期研究结果表明,茶尺蠖幼虫为害可诱导茶树多种挥发性有机化合物的产生,并且受不同为害密度和为害时间的影响[16,30]。本研究将健康苗与茶尺蠖幼虫为害苗在保证气体流通但不接触的前提下放置于同一密闭容器中,即相当于将健康苗暴露于茶尺蠖幼虫取食诱导的茶树挥发物中,实验结果表明暴露一定时间后茶树处理T中CsiLOX1和CsiACS1基因的表达量显著高于对照C(图2),并且上述两个基因在茶尺蠖幼虫取食的处理T茶苗中的表达水平显著高于茶尺蠖幼虫取食过的对照C的表达水平(图3);进一步的研究还发现处理T叶片中多酚氧化酶的含量显著高于对照C(图4-A),在处理T取食6 d的初孵茶尺蠖幼虫的体重显著低于对照C(图4-B)。综上,我们的研究结果首次证实茶尺蠖幼虫取食诱导的茶树挥发物可以作为化学信号被邻近茶苗所感知,并通过激活茉莉酸和乙烯途径从而诱导邻近苗的直接防御反应,这一现象与利马豆Phaseolus lunatus L.、烟草Nicotiana attenuate L.、番茄Lycopersicon esculentum Mill.、桤木Alnusglutinosa上发现的相似[7-10]。本结果有益地补充了HIPVs作为化学信号物质在植物个体间传递的认识。
HIPVs的生态功能一直是化学生态学研究的热点之一,它的多种组分均能在植物间传递化学通讯信号,如茉莉酸甲酯、水杨酸甲酯、乙烯、顺-3-己烯醇、顺-3-己烯基乙酸酯和罗勒烯等[5,14,31-33]。业已证明,顺-3-己烯醇是茶尺蠖幼虫取食诱导茶树挥发物中的重要组分[16],能够诱导茶树对茶尺蠖幼虫的直接和间接抗性[14]。然而,茶尺蠖幼虫取食诱导茶树挥发物中的其他组分是否能够诱导相似的防御反应尚有待进一步研究。因此,接下来我们将进一步挖掘虫害诱导茶树挥发物中具有抗性激发功能的单组分,从而将其发掘成为茶树的抗虫激发子,进而为茶树害虫的防治提供新型策略。
[1] Kachroo A, Robin GP. Systemic signaling during plant defense [J]. Curr Opin Plant Biol, 2013, 16(4): 527-533.
[2] Schweiger R, Heise AM, Persicke M, et al. Interactions between the jasmonic and salicylic acid pathway modulate the plant metabolome and affect herbivores of different feeding types [J]. Plant Cell Environ, 2014, 37(7): 1574-1585.
[3] Dicke M, Baldwin IT. The evolutionary context for herbivore induced plant volatiles: beyond the cry for help [J]. Trends Plant Sci, 2010, 15(3): 167-175.
[4] Wu JQ, Baldwin IT. New insights into plant responses to the attack frominsect herbivores [J]. Annu Rev Genet, 2010, 44: 1-24.
[5] Engelberth J, Contreras CF, Dalvi C, et al. Early transcriptome analyses of Z-3-Hexenol-treated Zea mays revealed distinct transcriptional networks and anti-herbivore defense potential ofgreen leaf volatiles [J]. PLoS ONE, 2013, 8(10): e77465.
[6] Scala A, Allmann S, Mirabella R, et al. Green leaf volatiles: a plant’s multifunctional weapon against herbivores and pathogens [J]. Int J Mol Sci, 2013, 14(9): 17781-17811.
[7] Baldwin IT, Schultz JC. Rapid changes in tree leaf chemistry induced by damage: Evidence for communication between plants [J]. Science, 1983, 221(4607): 277-279.
[8] Kessler A, Baldwin IT. Plant responses to insect herbivory: the emerging molecular analysis [J]. Annual Rev Plant Biol, 2002, 53: 299-328.
[9] Arimura GI, Ozawa R, Nishioka T, et al. Herbivore-induced volatiles induced the emission of ethylene in neighboring lima bean plants [J]. Plant J, 2002, 29(1): 87-98.
[10] Tscharntke T, Thiessen S, Dolch R, et al. Herbivory, induced resistance, and interplant signal transfer in Alnusglutinosa [J]. Biochem Syst Ecol, 2001, 29(10): 1025-1047.
[11] Farmer EE. Surface-to-air signal [J]. Nature, 2001, 411(6839): 854-856.
[12] 穆丹, 付建玉, 刘守安, 等. 虫害诱导的植物挥发物代谢调控机制研究进展[J]. 生态学报, 2010, 30(15): 4221-4233.
[13] Xin Z, Zhang Z, Chen Z, et al. Salicylhydroxamic acid (SHAM) negatively mediates tea herbivore-induced direct and indirect defense against the teageometrid Ectropis obliqua [J]. J Plant Res, 2014, 127(4): 565-572.
[14] Xin Z, Li X, Li J, et al. Application of chemical elicitor (Z)-3-hexenol enhances direct and indirect plant defenses against teageometrid Ectropis obliqua [J]. BioControl, 2016, 61(1): 1-12.
[15] Wang GC, Liang HY, Sun XL, et al. Antennal olfactory responses of Apanteles sp. (Hymenoptera: Braconidae) to herbivore-induced plant volatiles [J]. Adv Mater Res, 2012, 393/394/395: 604-607.
[16] Sun XL, Wang GC, Gao Y, et al. Volatiles emitted from tea plants infested by Ectropis obliqua larvae are attractive to conspecific moths [J]. J Chem Ecol, 2014, 40(10): 1080-1089.
[17] Sun XL, Li XW, Xin ZJ, et al. Development of synthetic volatile attractant for male Ectropis obliqua moths [J]. J Integr Agr, 2016, 15(7): 1532-1539.
[18] Yang ZW, Duan XN, Jin S, et al. Regurgitant derived from the teageometrid Ectropis obliqua suppresses wound-induced polyphenol oxidases activity in tea plants [J]. J Chem Ecol, 2013, 39(6): 744-751.
[19] 孙晓玲, 蔡晓明, 马春雷, 等. 茉莉酸甲酯和机械损伤对茶树叶片多酚氧化酶时序表达的影响[J]. 西北植物学报2011, 31(9): 1805-1810.
[20] Liu S, Han B. Differential expression pattern of an acidic 9/13 lipoxygenase in flower opening and senescence and in leaf response to phloem feeders in the tea plant [J]. BMC Plant Biol, 2010, 10(1): 228-243.
[21] 张亚丽, 乔小燕, 陈亮. 茶树ACC氧化酶基因全长cDNA的克隆与表达分析[J] 茶叶科学, 2008, 28(6): 459-467.
[22] Mithofer A, Wanner G, Boland W. Effects of feeding Spodoptera littoralis on Lima bean leaves. II. Continuous mechanical wounding resembling insect feeding is sufficient to elicit herbivory-related volatile emission [J]. Plant Physiol, 2005, 137(3): 1160-1168.
[23] Hilker M, Meiners T. Early herbivore alert: insect eggs induce plant defense [J]. J Chem Ecol, 2006, 32(7): 1379-1397.
[24] Tamiru A, Bruce TJA, Woodcock CM, et al. Maize landracesrecruit egg and larval parasitoids in response to egg deposition by a herbivore [J]. Ecol Lett, 2011, 14: 1075-1083.
[25] Turlings TCJ, Wäckers FL. Recruitment of predators and parasitoids by herbivore-damaged plants [M]//Cardé RT, Millar J. Advances in insect chemical ecology. Cambridge: Cambridge University Press, 2004: 21-75.
[26] Kim J, Felton GW. Priming of antiherbivore defensive responses in plants [J]. Insect Sci, 2013, 20(3): 273-285.
[27] Delory BM, Delaplace P, Fauconnier ML, et al. Root-emitted volatile organic compounds: can they mediate belowground plant-plant interactions? [J]. Plant Soil, 2016, 402(1): 1-26.
[28] Arimura G, Ozawa R, Shimoda T, et al. Herbivory-induced volatiles elicit defencegenes in lima bean leaves [J]. Nature, 2000, 406(6795): 512-514.
[29] Arimura G, Kost C, Boland W. Herbivore-induced, indirect plant defences [J]. BBA-Mol Cell Biol L, 2005, 1734(2): 91-111.
[30] Cai XM, Sun XL, Dong WX, et al. Herbivore species, infestation time, and herbivore density affect induced volatiles in tea plants [J]. Chemoecology, 2014, 24(1): 1-14.
[31] Engelberth J, Alborn HT, Schmelz EA, et al. Airborne signals prime plants against insect herbivore attack [J]. Proc Natl Acad Sci USA, 2004, 101(6): 1781-1785.
[32] Kessler A, Halitschke R, Diezel C, et al. Priming of plant defense responses in nature by airborne signaling between Artemisia tridentata and Nicotiana attenuata [J]. Oecologia, 2006, 148(2): 280-292.
[33] Matthes MC, Bruce TJA, Ton J, V, et al. The transcriptome of cis-jasmone-induced resistance in Arabidopsis thaliana and its role in indirect defence [J]. Planta, 2010, 232(5): 1163-1180.
Infestation of Ectropis obliqua Enhances Neighboring Tea Plant Defenses Against Conspecific Larvae
LEI Shu1,2, LI Xiwang2,3, SUN Xiaoling2,3, WANG Zhiying1*, XIN Zhaojun2,3*
1. Northeast Forestry University, Harbin 150040, China; 2. Tea Research Institute of Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 3. Key Laboratory of Tea Biology and Resource Utilization of Ministry of Agriculture, Hangzhou 310008, China
In this study, the effect of herbivore-induced plant volatiles (HIPVs) from tea plant on the defense responses of neighboring tea plants was analyzed. The expression levels of defense-relatedgenes, the content of defense compound in tea and the mass of Ectropis obliqua (TG) larvae were measured respectively. Compared with the control plants, the results showed that HIPVs released from TG-infested tea plants significantly induced the relative expression levels of CsiLOX1 and CsiACS1 in the neighboring tea plants within 24 h and 12 h. TG-induced expression of CsiLOX1 and CsiACS1 were also enhanced by HIPVs. Three days after HIPVs exposure, the polyphenol oxidases(PPOs) activity in the treated tea leaves was 1.36-fold higher than that of control. Meanwhile, the HIPVs-treated tea plants reduced the performance of TG. The above results showed that volatiles released from TG-infested tea can convey information to those neighboring plants and then trigger the induced defense responses against TG by modulating JA and ET signaling pathways in tea.
Camellia sinesis, Ectropis obliqua, neighboring tea plants, induced defense response
S571.1;S435.711
A
1000-369X(2016)06-587-07
2016-08-03
2016-08-17
公益性行业(农业)科研专项经费(201403030)、国家自然科学基金项目资助(31272053、31401758)、浙江省科技厅公益技术研究农业项目资助(2015C32081、2016C32026)。
雷舒,女,硕士研究生,主要从事茶树植物保护方面的研究。*通讯作者:zyw0451@sohu.com,xinzhaojun@mail.tricaas.com
