运动干预骨骼肌、心肌线粒体动力学研究现状
——心肌线粒体动力学研究展望
2016-12-14赵永才
赵永才
运动干预骨骼肌、心肌线粒体动力学研究现状
——心肌线粒体动力学研究展望
赵永才
大量研究发现,线粒体在细胞代谢、能量生成和凋亡调节等方面起到关键作用,线粒体动力学是目前的研究热点,主要包括线粒体融合-分裂两个过程,这种循环过程受细胞能量需求和代谢状态影响。线粒体融合-分裂在各类组织细胞中均可观察到,但成年心肌细胞至今观察困难,以致心脏组织细胞线粒体融合-分裂的作用易被忽视。现在较多研究已经证实,心肌线粒体动力学在细胞稳态和心脏生理功能中发挥重要作用。一些研究考察了运动对骨骼肌线粒体动力学的影响,少数研究也涉及到心肌线粒体动力学对运动的应答。
线粒体分裂;线粒体融合;骨骼肌;心肌;运动
线粒体是细胞氧化磷酸化的场所,生成三磷酸腺苷(ATP),线粒体不是简单的能量生成器,还广泛参与细胞离子平衡、生成氧自由基发挥信号调节、控制凋亡和坏死等[43]。从20世纪末开始,研究发现线粒体也不是静态的“能量工厂”,而是不断变化的细胞器,可通过融合-分裂满足能量生成和生理调节,在稳定状态下,线粒体融合-分裂保持相对平衡,以此维持线粒体形态和生理功能[15]。线粒体这种不断通过融合-分裂保持其网络稳态的过程称为线粒体动力学,融合-分裂的相对速度决定线粒体形态、数量及分布,该过程由特定的蛋白精确调控完成[27]。心肌细胞需要ATP持续不断地供给,其能量消耗巨大,线粒体密度极高,其能量生成和生理调节更显重要。由于心肌细胞线粒体空间结构复杂,有着不同于其他组织的特殊性,导致对心肌细胞线粒体的研究相对滞后。目前,心肌线粒体动力学的有关研究已深入开展,运动对心肌线粒体动力学影响的研究陆续展开。
1 心肌细胞线粒体动力学生理意义和分子机制
心肌细胞线粒体可以通过融合-分裂方式利用健康线粒体来修复和补充其损失的线粒体DNA(mtDNA)和蛋白,满足生理供能需要同时协助清除受损线粒体[24]。线粒体融合能促进能量交换,尤其重要的是促进mtDNA交换,环境应激、衰老等因素能引起mtDNA的变异,而线粒体通过融合交换mtDNA可对变异mtDNA进行校正,实现线粒体的自我修复[30]。线粒体分裂有利于能量快速转移到不同区域,供给ATP,而且线粒体分裂会产生不均匀子代,子代轻微受损,可与健康线粒体发生融合修复。如果子代线粒体受损严重,存在融合缺陷,难以修复,易生成更多活性氧(ROS)危及细胞,则会被线粒体自噬降解。因此,线粒体分裂配合自噬,对清理受损线粒体并重复利用内容物,合成新线粒体尤为重要[33]。另外,线粒体分裂过度也可加速内源性凋亡发生,抑制线粒体分裂可减轻缺氧刺激引发的心肌凋亡,而诱发线粒体过度分裂易导致膜电位丢失和细胞色素C释放[52]。
哺乳动物调控线粒体融合的蛋白为Mitofusin 1(Mfnl)、Mitofusin 2(Mfn2)和Optic atrophy 1(Opal)。Mfnl/2定位于线粒体外膜,在外膜融合中起重要作用;Opal定位于线粒体内膜,促进内膜融合。Mfnl/2基因敲除后,线粒体外膜融合受抑制,而抑制Opal基因表达并不影响线粒体外膜融合,但可抑制内膜融合,表明线粒体内外膜融合相对独立[25]。介导线粒体分裂的蛋白主要有Dynamin-related protein-1(Drp-l)、Fission protein 1(Fisl) 和Mitochondrial Fission Factor(Mff)。Fisl定位于线粒体外膜,Fisl募集胞浆Drp-l转位至线粒体外膜,并集中于潜在的分裂位点,多个Drp-1分子形成指环结构,通过水解GTP改变分子间距离,最终导致线粒体分裂,生成2个子代线粒体,此后,Drp-1可返回胞浆,循环反复发挥作用[14]。Drp-1/Mff也可互动结合,促进线粒体的分裂,紫外线照射可加强Drp-1(Ser 637)去磷酸化,促进其在线粒体膜上的定位,加强Drp-1与Mff的结合,促进线粒体分裂,产生更多的线粒体碎裂片断,凋亡增加[55](图1)。
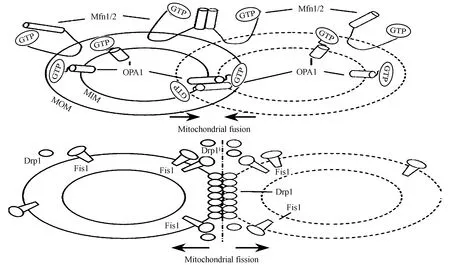
图1 线粒体融合-分裂示意图[15]
2 心肌细胞线粒体融合-分裂发生的证据及特点
心肌线粒体密度很大,不断合成ATP供应细胞需要,左心室肌细胞线粒体容积比甚至达35%左右,线粒体动力学变化应该会影响到心脏生理功能[25]。心肌细胞线粒体分布拥挤,无法形成典型的网络结构,而且,原代心肌细胞培养和转染难度较大,导致心肌线粒体融合-分裂形态学的研究相对困难。其他器官组织通过形态学观察取得了线粒体融合-分裂发生的证据,但心肌还未直接观察到线粒体融合-分裂的发生,心肌线粒体动力学是否有生理意义受到质疑。通过电子显微镜观察发现,心肌线粒体分布具有自身规律,大致分为肌膜下线粒体和肌原纤维间线粒体,肌膜下线粒体形态相对多变,而肌原纤维间线粒体形态相对稳定,从形态特点和分布状况推测,肌膜下线粒体可能具有更强的融合-分裂能力[14]。
虽然,通过形态学无法观察到心肌线粒体动力学特点,但近年来,分子学技术证实了心肌细胞确实存在线粒体融合-分裂现象。Chen等[16]人制造了小鼠心肌Mfnl/2表达抑制模型。Mfnl/2表达抑制3周后,30%的线粒体形态正常,其余线粒体变小,透明度增加,整体密度增加,线粒体蛋白/细胞体积比增加了60%,此研究测算出小鼠心肌线粒体融合-分裂循环周期约为16天(而培养的成纤维细胞仅几分钟),该研究认为,心肌线粒体融合-分裂虽然缓慢,但生理作用明显。目前,有研究认为,Mfnl/2与心室功能关系密切,Mfn2敲除的小鼠心脏肥大、心室功能紊乱、心肌细胞ROS生成增加[22]。而且,Mfnl与Mfn2作用还有所差别,Mfn2除了促进线粒体融合外,还能加强心肌线粒体和肌浆网的联系,促进Ca2+的交换,因此维持心室功能显著[26]。而Mfnl具有替代Mfn2的功能,只保留Mfn2单个等位基因而删除Mfnl,心肌病发生,而保留Mfn1单个等位基因而删除Mfn2,则心脏生理功能不受影响[26]。氧化应激干预发现新生大鼠心肌细胞Mfn1表达降低,同时伴随心肌凋亡增加、线粒体分裂增多;敲除Mfn1则加剧上述干预造成的心肌损伤,而过表达Mfn1则减轻过氧化氢所引发的心肌损伤[40]。
线粒体分裂调节蛋白对心脏生理功能的影响也非常明显。Ashrafian等[8]应用化学诱变剂诱导小鼠Drp-l基因突变,抑制心肌线粒体分裂,发现线粒体变长,氧化磷酸化水平降低,ATP生成减少,心肌线粒体总数显著减少,并出现扩张型心肌病。Ong等[45]人利用mdivi-1抑制小鼠心肌Drp-l表达,观察其对缺氧的反应,发现,相比对照组,Drp-l抑制小鼠的心肌在缺氧刺激后线粒体分裂较少,且梗死面积更小。而来自Sharp等[48]人的研究同样验证了mdivi-1的效果,发现,无论是新生鼠心肌细胞,还是成年心肌细胞,缺氧再灌注模型中使用mdivi-1抑制Drp-l均有效降低了活性氧生成、减少了线粒体分裂,减少凋亡。以上研究表明,心肌线粒体融合-分裂调节功能一旦受到干扰,其形态及生理功能便会出现明显变化,证明心肌线粒体融合-分裂不但存在,且发挥重要作用。
除了对线粒体动力学蛋白表达水平进行干预,观察心肌线粒体动力学外,还有研究对蛋白活力及修饰进行干预,观察心肌线粒体动力学的意义。Disatnik等[23]人通过使用Drp-1抑制剂P110观察其对缺血再灌注的影响,研究发现,灌注期注射P110能显著减轻线粒体分裂,保持ATP的合成及线粒体体积。由于P110对Drp-l生理活性无影响,只特异性干扰Drp-1与Fis1的联系,可见,抑制Drp-1与其他蛋白联系,同样对心肌功能产生了重要影响。Kim等[38]发现SUMO化修饰能有效保护Drp-l,减少降解,有利于Drp-l促线粒体分裂功能,研究发现,小鼠心肌过表达SENP5能有效解除心肌Drp-l SUMO修饰作用,但心肌功能紊乱,增殖降低、凋亡增加,表明,抑制Drp-l修饰功能,同样能导致心脏生理功能紊乱。Wang等[53]人的研究通过操控上游micoRNA-499间接改变Drp-l的磷酸化水平,发现,Drp-l(Ser637)去磷酸化状态更有利于小鼠心肌线粒体分裂,心肌缺氧应激下,Drp-l去磷酸化能引起更显著的心肌凋亡和线粒体分裂片断。另一项研究[48]使用FK506注射抑制小鼠心肌钙调磷酸酶,减少其对Drp-1(Ser637)的去磷酸化作用,缺血再灌注后发现,心肌线粒体分裂相对减少,功能下降较少。相反,丝氨酸/苏氨酸激酶Pim-1能够促进Drp-1磷酸化,促进其胞浆定位,减少线粒体分裂[20]。有研究发现,过表达Pim-1能够有效保护心肌缺血再灌注后的生理功能,可提高Bcl-2表达,减少凋亡[9],这可能与Pim-1促Drp-1磷酸化有关。
综上所述,心肌线粒体能够自我更新、不断适应环境,通过融合-分裂来进行修复或自我清除,上述研究证明,心肌线粒体动力学不但存在,而且,配合线粒体自噬组成线粒体质量控制的重要环节,维持心肌细胞生理稳态。
3 运动与肌肉线粒体动力学关系研究现状
3.1 运动与骨骼肌线粒体融合-分裂的研究
国外对运动与肌肉线粒体融合-分裂的研究多局限于骨骼肌。Cartoni等[11]人通过考察Mfn1/2急性运动后的变化,发现健康男性进行1次10 km自行车运动,股外侧肌Mfn1/2 mRNA缓慢增加,运动后24 h才显著高于运动前,但免疫印迹法只检测了3名受试者,其Mfn2蛋白表达变化无统计学意义,这项研究的价值在于发现人体骨骼肌急性运动后线粒体融合蛋白基因表达增加。Hernández-Alvarez等[32]人发现,健康人群12周耐力训练后骨骼肌Mfn2表达显著升高,1 h急性运动对Mfn2无影响;而2型糖尿病人群则相反,Mfn2蛋白对耐力训练不敏感,急性运动后表达显著下降,这项研究的意义是发现了Mfn2蛋白表达对常人耐力训练有升高适应。Iqbal等[34]人的研究也发现,大鼠耐力训练后肌肉线粒体Opa1和Mfn2蛋白表达显著提高,而肢体长期静止不用,Opa1和Mfn2表达显著下降。综上,人和动物的研究均表明长期运动训练具有加强骨骼肌线粒体融合的作用。
Picard等[46]人的研究发现,3 h急性转轮运动能够明显影响小鼠骨骼肌线粒体形态适应,但免疫印迹法测定发现,Mfn2和Opa1蛋白无论是比目鱼肌还是腓肠肌均无显著变化。此研究和人体研究[32]结果相似,那就是急性运动对线粒体融合蛋白影响不大。Caffin等[10]的研究发现,Opa1基因缺乏小鼠相比正常小鼠耐力训练后线粒体生物发生明显受阻,但Opa1基因缺乏小鼠训练后的耐力水平却明显超过正常小鼠,且脂代谢增强,提示,线粒体动力学特点不但受运动影响,而且,自身变化也能影响运动能力。Greene等[31]人发现,肥胖且胰岛素抵抗小鼠腓肠肌PGC-1α无显著变化,但Mfn2和Opa1显著降低,分裂蛋白无明显变化,提示,骨骼肌线粒体趋向分裂,而4周中等强度转轮训练仅提高了腓肠肌Opa1表达,对整体线粒体动力学影响不明显,而PGC-1α基因过表达可有效改善线粒体质量控制水平。
抗阻练习相关研究对此也有探索,Kitaoka等[39]人使用电刺激诱发大鼠进行下肢力量练习,一次性抗阻练习结束24 h内骨骼肌线粒体融合、分裂蛋白均无显著变化;4周抗阻训练引起Mfn1、Mfn2和Opa1升高,认为抗阻训练对线粒体合成影响不大,但融合能力提高有助于改善线粒体质量。Kang等[37]人考察骨骼肌固定后废用性萎缩模型线粒体动力学的变化,发现小鼠下肢2~3周时间肢体固定显著降低了胫骨前肌Mfn2表达,提高了Fis1表达,caspase-3等凋亡因子显著增加,认为线粒体密度降,且mtDNA拷贝的变化与线粒体分裂片断化增加、融合降低有关。
Fealy等[28]人安排17名肥胖且胰岛素抵抗人群进行12周耐力训练,训练前、后提取股外侧肌肉,发现训练显著提高了胰岛素敏感性和脂代谢水平,磷酸化Drp-1表达显著下降,且Mfn1/2表达有升高趋势,认为运动改善胰岛素抵抗与线粒体融合-分裂变化有关。此研究和前期研究[32,34]结论类似,即长期训练有提高骨骼肌线粒体融合的趋势,不同之处在于发现Drp-1对长期训练有降低适应。Molina等[44]的研究认为,心衰但射血分数正常的患者骨骼肌线粒体融合-分裂与运动摄氧量有关,相比健康人,心衰患者股外侧肌线粒体柠檬酸合酶活性降低了29%,Mfn2降低了54%,而且,Mfn2表达与6 min步行试验最大距离和摄氧量峰值成显著正相关,提示,线粒体融合能力对摄氧量的保持具有重要意义。
总体上,国外对此的研究更多关注骨骼肌线粒体融合蛋白,认为Mfn2等融合蛋白对耐力训练或抗阻训练适应性提高,肥胖及心衰病人骨骼肌线粒体融合能力降低,而运动能扭转这种趋势,但是,对于线粒体分裂调节因子考察较少。
漆正堂等[4]人通过考察不同负荷跑台训练对大鼠骨骼肌线粒体动力学的影响,发现8周大强度间歇性跑台训练显著降低骨骼肌线粒体膜Drp-1蛋白表达,提高Mfn2蛋白表达,而低强度训练对各类蛋白及mRNA影响不大。该研究团队还发现,大鼠骨骼肌废用性萎缩模型下Mfn1 mRNA显著增加,而Mfn2 mRNA显著降低,Drp-1和Fis1 mRNA增加无显著性,Drp-1蛋白却显著降低,而Mfn2蛋白无显著变化[47]。该系列研究认为,骨骼肌线粒体融合-分裂对不同负荷训练有不同适应特征,间歇性大负荷训练能诱导线粒体Drp-1蛋白下调、Mfn2蛋白上调,促进线粒体融合,抑制分裂。该研究与国外研究结果[32,34]类似,提示,长期运动训练可以提高骨骼肌线粒体融合,抑制分裂。该研究团队的系列研究对线粒体融合-分裂调节蛋白考察比较全面,关注不同负荷长期训练的意义,和刘慧君等人关于急性运动系列研究具有互补作用。另外该研究从基因表达和蛋白水平进行研究,发现,mRNA表达和蛋白表达不相吻合,甚至颠倒,表明,线粒体融合-分裂相关基因转录后存在修饰作用,运动对相关蛋白修饰因素的影响有待研究。
结合现有的研究可发现,运动训练有提高骨骼肌线粒体融合的效果,一次急性运动有提高线粒体分裂的效果,运动产生这类变化有何意义,可以结合线粒体融合-分裂与能量代谢之间的关系进行分析。研究发现,无论是酵母菌还是哺乳动物,线粒体融合有利于维持其功能和自我修复,有利于能量合成[50]。融合蛋白变异后线粒体膜电位、三羧酸循环及电子链传递受阻,ATP合成降低。线粒体融合能力降低也导致携带缺损mtDNA的线粒体无法修复,进而导致电子链部分蛋白编码合成受阻,影响能量合成[42]。而线粒体分裂有利于隔离受损严重的线粒体成分,阻止其进入修复程序,配合自噬而被清除[33],这对于维持线粒体健康状态及能量合成至关重要。笔者认为,运动训练能够提高骨骼肌融合蛋白表达,表明,线粒体自我修复机能在提高,各类不良应激发生时(如ROS增加),可更有效地融合修补其mtDNA损伤,保持线粒体整体健康和功能。目前,有研究还发现,Mfn2具有促进受损线粒体Pink1/Parkin信号动员的效果,加强受损线粒体的自噬消除,保持线粒体整体健康水平[17]。因此,耐力训练引发Mfn2上调,既有利于健康线粒体的修复,也有利于严重受损线粒体的清除。而急性运动应激过大,线粒体受损异常mtDNA增多,线粒体分裂水平超过了生理状态需要,虽有利于迅速清理受损子代线粒体,但凋亡水平可能增加,其分析如图2所示。
3.2 运动与心肌线粒体融合-分裂的研究
运动与心肌线粒体融合-分裂关系的研究报道总量较少,但多集中于近年(表1)。刘涛[2]研究发现,心梗大鼠hFis1蛋白表达增加,Mfn2表达降低。心梗大鼠运动训练后PGC-1α等蛋白表达增加,Fis1和Mfn2蛋白表达降低,认为,心衰后心肌线粒体融合-分裂平衡失衡,线粒体趋向分裂,而运动训练可对抗此过程。这是早期针对运动干预心肌线粒体动力学的研究,但这项研究指标选取太少,不够全面,当时的基础医学研究可能限制了该研究内容。在马静芬[3]的研究中,大鼠分别进行45 min、90 min、120 min一次性跑台运动,发现心肌Mfn1、Mfn2表达均显著性下降,Opa1在120 min运动后也显著降低;而Drp-1、Fis1急性运动后均显著性上调,所有指标运动后48 h恢复。陶小平等[6]人通过研究急性大负荷运动对大鼠心肌能量代谢的影响,发现,运动后即刻Drp-1蛋白表达显著上升,Mfn2蛋白表达显著下降,而且Drp-1和Mfn2的变化趋势在运动后30 min达到峰值,认为一次大负荷运动导致心肌线粒体分裂增加、融合能力下降。以上两项研究结论一致,即急性运动能促进心肌线粒体分裂、但抑制融合。这两项心肌的研究与国内骨骼肌的相关研究结论类似,可认为,心肌、骨骼肌线粒体对急性运动应答趋向分裂、融合降低。值得注意的是,这两项研究恢复期样本采集间隔差异较大,其中,一项研究每隔12 h取样[3],另一项不超过40 min取样[6],恢复特点难以比较,相似之处是Mfn2恢复快于Drp-1。

图2 运动影响骨骼肌、心肌线粒体动力学特点示意图

表1 运动影响心肌线粒体融合-分裂的研究现状
运动训练对心肌线粒体动力的影响有少量相关报道。Jiang等[36]人发现,心梗大鼠心肌线粒体功能紊乱,分裂增加、融合下降,伴随ERK1/2-JNK-P53信号增强。对心梗大鼠进行8周有氧训练,发现,心肌线粒体呼吸控制率和P/O显著提高, Mfn2和Opa1蛋白表达显著提升,Drp-1显著下降,认为有氧训练能够改善心梗大鼠心肌线粒体动力学功能,降低心肌凋亡信号。这项研究考察了病理状态下运动训练和心肌动力学的关系,然而,长期训练对生理状态心肌动力学有何影响,却鲜有系统报道。赵永才等[7]人考察了耐力训练和Drp-1的关系,发现,8周游泳训练可降低小鼠心肌Drp-1的表达。但此研究重点考察了P53上下游凋亡调节通路对运动训练的适应特点,并未系统考察心肌线粒体动力学对长期训练的应答,也未涉及融合蛋白的研究。Veeranki等[51]的研究考察了肥胖型糖尿病小鼠的心脏功能,发现5周跑台耐力训练可改善心脏射血能力,通过提高Cx43蛋白表达以改善细胞间隙通讯功能,同时还发现,糖尿病小鼠心肌Mfn2/Drp-1蛋白表达比值下降,而耐力训练能有效扭转这种趋势,提高Mfn2 表达,降低Drp-1表达。
4 运动干预心肌线粒体动力学研究展望
4.1 病理状态相关研究缺乏
虽然,目前有几项实验研究考察了运动与心肌线粒体的动力学关系,但研究主要考察急性运动与生理状态下心肌线粒体动力学的关系。近年有研究[36]考察了有氧训练改善心梗模型线粒体动力学的功能,糖尿病心肌线粒体动力学也有了初步研究,但更多病理模型下心肌线粒体动力学有何特点,如病理性肥大、高血压、心衰等模型下心肌线粒体动力学呈现何种特点,不同负荷和运动方式对其有何干预作用,目前还缺乏相关研究,在应用基础研究领域,值得关注。
4.2 指标选择合理性问题
目前,对调节线粒体融合-分裂的蛋白功能不断进行鉴定,评价线粒体融合-分裂的指标也不断丰富,但就运动干预线粒体融合-分裂的指标选取比较简单,目前的研究多选取Mfn2和Drp-1蛋白,这对评价线粒体动力学变化还不够。例如,Drp-1的转录后修饰、磷酸化和泛素化均能改变其对线粒体的分裂功能[13]。Drp-1蛋白磷酸化和去磷酸化亚型心肌胞浆均存在,Drp-1磷酸化可被上游MicroRNA控制[53],而且,Drp-1反复来往于胞浆和线粒体外膜,胞浆Drp-1无论是否磷酸化,都具有潜在促进线粒体分裂的能力[54]。例如,Drp-1(Ser637)去磷酸化促进Drp-1线粒体膜定位,而磷酸化有利于其返回胞浆[19,12],但Drp-1(Ser616)的磷酸化却有利于Drp-1在有丝分裂时促进线粒体的分裂[49]。目前,相关研究多测定整体蛋白,因此,选取线粒体动力学评价指标时除了整体蛋白测定外,线粒体膜定位蛋白、磷酸化或者去磷酸化水平的测定很有必要。
4.3 衰老心肌线粒体动力学值得关注
衰老心肌脂代谢下降,糖代谢依赖性增强,ROS生成增加,易启动线粒体途径凋亡信号,对病理刺激敏感性增加,认为与线粒体生物合成能力下降,动力学失衡有关系[41]。衰老心肌动力学研究缺乏,Jendrach等[35]人早期研究证实,脐带静脉内皮细胞衰老后mtDNA变异较多,且线粒体融合-分裂能力均显著下降。Zhao等[56]人发现,25月龄老年大鼠心肌脂质代谢能力降低,Mfn2、PGC-1α、LC3-II表达显著下降,认为心肌线粒体合成、融合及自噬下降是衰老心肌脂质代谢下降的原因。而Crane等[18]人发现,衰老骨骼肌Drp-1、Mfn2蛋白表达显著下降,但该研究考察肌细胞脂质超微结构的变化,线粒体动力学研究很不全面。有研究提出,衰老线粒体动力学下降的假说:“预防线粒体损伤扩大适应机制”[29],认为衰老线粒体氧化应激增加,较高融合-分裂速度可能导致更多的错误修复,易导致细胞凋亡流失,降低融合-分裂速度可减少凋亡,但代价是线粒体整体质量下降。衰老后心肌线粒体动力学具体呈现何种特点,对运动有何适应,目前鲜有研究报道。4.4 心肌线粒体动力学与自噬结合研究较少
线粒体动力学是线粒体质量控制的一个重要环节,线粒体质量控制还包括生物合成、活性氧监控与自噬等[29]。目前认为,线粒体动力学与线粒体自噬关系极为密切,融合-分裂是修补线粒体的机制,也是自噬清理损坏线粒体的一种机制,是线粒体自噬的前提;线粒体自噬有助于物质的重新利用,也是线粒体融合-分裂发生的基础[22]。心肌线粒体数量巨大,其质量控制更为复杂,运动干预心肌线粒体动力学和自噬会产生何种变化,对线粒体质量控制产生何种影响还有待进一步研究。
[1]刘慧君,姜宁,赵斐,等.急性运动中骨骼肌线粒体移动相关基因表达与线粒体动力学的关系[J].天津体育学院学报,2010,25(2):118-121.
[2]刘涛.运动对慢性心衰心肌线粒体功能、生物合成与融合分裂的调节作用[D].北京:北京体育大学,2009.
[3]马静芬.急性运动中心肌线粒体动态变化对心肌炎症反应的影响[D].天津:天津体育学院,2014.
[4]漆正堂,郭维,张媛,等.不同运动方式对大鼠骨骼肌线粒体融合分裂基因及Mfn2、Drp1蛋白表达的影响[J].中国运动医学杂志,2011,30(2):143-148.
[5]孙卫东,丁虎,刘晓然,等.骨骼肌线粒体对细胞能量需求的快速应答:mfn1/2与fis1基因在急性运动中的动态表达[J].中国运动医学杂志,2008,27(5):544-550.
[6]陶小平,彭雄辉.一次大负荷跑台运动后大鼠心肌能量代谢及线粒体形态动力学的变化研究[J].北京体育大学学报,2014,37(3):64-70.
[7]赵永才,郑兵.运动训练对心肌线粒体途径miR-30-p53-Drp-1凋亡通路的影响[J].中国运动医学杂志,2015,34(2):128-133.
[8]ASHRAFIAN H,DOCHERTY I,LEO V,etal.A mutation in the mitochondrial fission gene Dnm1l leads to cardiomyopathy[J].PLoS Genet,2010,6(6):el001000.
[9]BORILLO G A,MASON M,QUIJADA P,etal.Pim-1 kinase protects mitochondrial integrity in cardiomyocytes[J].Circ Res,2010,106(7):1265-1274.
[10]CAFFIN F,PROLA A,PIQUEREAU J,etal.Altered skeletal muscle mitochondrial biogenesis but improved endurance capacity in trained OPA1-deficient mice[J].J Physiol,2013,591(23):6017-6037.
[11]CARTONI R,L GER B,HOCK MB,etal.Mitofusins 1/2 and ERRalpha expression are increased in human skeletal muscle after physical exercise[J].J Physiol,2005,567(1):349-358.
[12]CEREGHETTI G M,STANGHERLIN A,MARTINS DE BRITO O,etal.Dephosphorylation by calcineurin regulates translocation of Drp1 to mitochondria[J].Proc Natl Acad Sci,2008,105(41):15803-15808.
[13]CHANG C R,BLACKSTONE C.Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1[J].Ann N Y Acad Sci,2010,1201(1):34-39.
[14]CHAPPIE J S,DYDA F.Building a fission machine-structural insights into dynamin assembly and activation[J].J Cell Sci,2013,126(13):2773-2784.
[15]CHEN L,KNOWLTON A A.Mitochondrial dynamics in heart failure[J].Congest Heart Fail,2011,17(6):257-261.
[16]CHEN Y,LIU Y,DORN GW 2ND.Mitochondrial fusion is essential for organelle function and cardiac homeostasis[J].Circ Res,2011,109(12):1327-1331.
[17]CHEN Y,DORN G W 2ND.PINK1-phosphorylated mitofusin 2 is a Parkin receptor for culling damaged mitochondria[J].Sci,2013,340(6131):471-475.
[18]CRANE J D,DEVRIES M C,SAFDAR A,etal.The effect of aging on human skeletal muscle mitochondrial and intramyocellular lipid ultrastructure[J].J Gerontol A Biol Sci Med Sci,2010,65(2):119-128.
[19]CRIBBS J T,STRACK S.Reversible phosphorylation of Drp1 by cyclic AMP dependent protein kinase and calcineurin regulates mitochondrial fission and cell death[J].EMBO Rep,2007,8(10):939-944.
[20]DIN S,MASON M,V LKERS M,etal.Pim-1 preserves mitochondrial morphology by inhibiting dynamin-related protein 1 translocation[J].Proc Natl Acad Sci USA,2013,110(15):5969-5974.
[21]DING H,JIANG N,LIU H,etal.Response of mitochondrial fusion and fission protein gene expression to exercise in rat skeletal muscle[J].Biochim Biophys Acta,2010,1800(3):250-256.
[22]DISATNIK M H,HWANG S,FERREIRA J C,etal.New therapeutics to modulate mitochondrial dynamics and mitophagy in cardiac diseases[J].J Mol Med(Berl),2015,93(3):279-287.
[23]DISATNIK M H,FERREIRA J C,CAMPOS J C,etal.Acute inhibition of excessive mitochondrial fission after myocardial infarction prevents long-term cardiac dysfunction[J].J Am Heart Assoc,2013,2(5):e000461.
[24]DORN G W 2ND,KITSIS R N.The mitochondrial dynamism-mitophagy-cell death interactome:multiple roles performed by members of amitochondrial molecular ensemble[J].Circ Res,2015,116(1):167-182.
[25]DORN G W 2ND.Mitochondrial dynamics in heart disease[J].Biochim Biophys Acta,2013,1833(1):233-241.
[26]DORN G W 2ND,SONG M,WALSH K.Functional implications of mitofusin 2-mediated mitochondrial-SR tethering[J].J Mol Cell Cardiol,2015,78:123-128.
[27]ESCOBAR-HENRIQUES M,ANTON F.Mechanistic perspective of mitochondrial fusion:tubulation vs.fragmentation[J].Biochim Biophys Acta,2013,1833(1):162-175.
[28]FEALY C E,MULYA A,LAI N,etal.Exercise training decreases activation of the mitochondrial fission protein dynamin-related protein-1 in insulin-resistant human skeletal muscle.J Appl Physiol,2014,117(3):239-245.
[29]FIGGE M T,OSIEWACZ H D,REICHERT A S.Quality control of mitochondria during aging:Is there a good and a bad side of mitochondrial dynamics[J].Bioessays,2013,35(4):314-322.
[30]GAZIEV A I,ABDULLAEV S,PODLUTSKY A.Mitochondrial function and mitochondrial DNA maintenance with advancing age[J].Biogerontology,2014,15(5):417-438.
[31]GREENE N P,LEE D E,BROWN J L,etal.Mitochondrial quality control,promoted by PGC-1α,is dysregulated by Western diet-induced obesity and partially restored by moderate physical activity in mice[J].Physiol Rep,2015,3(7):e12470.
[32]HERN NDEZ-ALVAREZ M I,THABIT H,BURNS N,etal.Subjects with early-onset type 2 diabetes show defective activation of the skeletal muscle PGC-1{alpha}/Mitofusin-2 regulatory pathway in response to physical activity[J].Diabetes Care,2010,33(3):645-651.
[33]IKEDA Y,SCIARRETTA S,NAGARAJAN N,etal.New insights into the role of mitochondrial dynamics and autophagy during oxidative stress and aging in the heart[J].Oxid Med Cell Longev,2014,2014:210934.
[34]IQBAL S,OSTOJIC O,SINGH K,etal.Expression of mitochondrial fission and fusion regulatory proteins in skeletal muscle during chronic use and disuse[J].Muscle Nerve,2013,48(6):963-970.
[35]JENDRACH M,POHL S,V TH M,etal.Morpho-dynamic changes of mitochondria during ageing of human endothelial cells[J].Mech Ageing Dev,2005,126(6-7):813-821.
[36]JIANG H K,WANG Y H,SUN L,etal.Aerobic interval training attenuates mitochondrial dysfunction in rats post-myocardial infarction:roles of mitochondrial network dynamics[J].Int J Mol Sci,2014,15(4):5304-5322.
[37]KANG C,YEO D,JI L L.Muscle immobilization activates mitophagy and disrupts mitochondrial dynamics in mice[J].Acta Physiol(Oxf),2016,218(3):188-197.
[38]KIM E Y,ZHANG Y,BEKETAEV I,etal.SENP5,a SUMO isopeptidase,induces apoptosis and cardiomyopathy.J Mol Cell Cardiol.2015,78:154-64.
[39]KITAOKA Y,OGASAWARA R,TAMURA Y,etal.Effect of electrical stimulation-induced resistance exercise on mitochondrial fission and fusion proteins in rat skeletal muscle[J].Appl Physiol Nutr Metab,2015,40(11):1137-1142.
[40]LI J,ZHOU J,LI Y,etal.Mitochondrial fission controls DNA fragmentation by regulating endonuclease G[J].Free Radic Biol Med,2010,49(4):622-631.
[41]LESNEFSKY E J,CHEN Q,HOPPEL C L.Mitochondrial Metabolism in Aging Heart[J].Circ Res,2016,118(10):1593-1611.
[42]MALKA F,GUILLERY O,CIFUENTES-DIAZ C,etal.Separate fusion of outer and inner mitochondrial membranes[J].EMBO Rep,2005,6(9):853-859.
[43]MARUNOUCHI T,TANONAKA K.Cell Death in the Cardiac Myocyte[J].Biol Pharm Bull,2015,38(8):1094-1097.[44]MOLINA A J,BHARADWAJ M S,VAN HORN C,etal.Skeletal muscle mitochondrial content,oxidative capacity,and Mfn2 expression are reduced in older patients with heart failure and preserved ejection fraction and are related to exercise intolerance[J].JACC Heart Fail,2016,4(8)636-645.
[45]ONG S B,SUBRAYAN S,LIM S Y,etal.Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J].Circulation,2010,121(18):2012-2022.
[46]PICARD M,GENTIL B J,MCMANUS M J,etal.Acute exercise remodels mitochondrial membrane interactions in mouse skeletal muscle[J].J Appl Physiol,2013,115(10):1562-1571.
[47]QI Z,ZHANG Y,GUO W,etal.Increased Insulin Sensitivity and Distorted Mitochondrial Adaptations during Muscle Unloading[J].Int J Mol Sci,2012,13(12):16971-16985.
[48]SHARP W W,FANG Y H,HAN M,etal.Dynamin-related protein 1(Drp1)-mediated diastolic dysfunction in myocardial ischemia-reperfusion injury:Therapeutic benefits of Drp1 inhibition to reduce mitochondrial fission[J].FASEB J,2014,28(1):316-326.
[49]TAGUCHI N,ISHIHARA N,JOFUKU A,etal.Mitotic phosphorylation of dynamin-related GTPase Drp1 participates in mitochondrial fission[J].J Biol Chem,2007,282(15):11521-11529.
[50]TONDERA D,GRANDEMANGE S,JOURDAIN A,etal.SLP-2 is required for stress-induced mitochondrial hyperfusion[J].EMBO J,2009,28(11):1589-1600.
[51]VEERANKI S,GIVVIMANI S,KUNDU S,etal.Moderate intensity exercise prevents diabetic cardiomyopathy associated contractile dysfunction through restoration of mitochondrial function and connexin 43 levels in db/db mice[J].J Mol Cell Cardiol,2016,92:163-173.
[52]WANG K,LIU C Y,ZHANG X J,etal.miR-361-regulated prohibitin inhibits mitochondrial fission and apoptosis and protects heart from ischemia injury[J].Cell Death Differ,2015,22(6):1058-1068.
[53]WANG J X,JIAO J Q,LI Q,etal.miR-499 regulates mitochondrial dynamics by targeting calcineurin and dynamin-related protein-1[J].Nat Med,2011,17(1):71-78.
[54]WASIAK S,ZUNINO R,MCBRIDE H M.Bax/Bak promote sumoylation of DRP1 and its stable association with mitochondria during apoptotic cell death[J].J Cell Biol,2007,177(3):439-450.
[55]ZHANG Z,LIU L,WU S,etal.Drp1,Mff,Fis1,and MiD51 are coordinated to mediate mitochondrial fission during UV irradiation-induced apoptosis[J].FASEB J,2016,30(1):466-476.
[56]ZHAO L,ZOU X,FENG Z,etal.Evidence for association of mitochondrial metabolism alteration with lipid accumulation in aging rats[J].Exp Gerontol,2014,56(8):3-12.
A Review of Mitochondrial Dynamics in Skeletal Muscle and Cardiomyocyte Affected by Exercise —Research Prospects of Cardiac Mitochondrial Dynamics
ZHAO Yong-cai
Mitochondria have been widely studied for their critical role in cellular metabolism,energy production and apoptosis.Mitochondrial dynamics is a research focus,and that process involves mitochondrial fusion and fission,which depend on cellular energy requirements and metabolic status.Mitochondrial fusion and fission have been observed in almost every cell type except adult cardiomyocytes,which easily develop a notion that mitochondrial dynamics is dispensable in the heart.Many studies have indicated that mitochondrial dynamics plays a crucial role in the maintenance of normal cellular homeostasis and cardiac function.Some studies investigated the effects of exercise on mitochondrial dynamics in skeletal muscle,and a few studies focused on cardiomyocytes.
mitochondrialfission;mitochondrialfusion;skeletalmuscle;cardiomyocyte;exercise
1000-677X(2016)11-0075-07
10.16469/j.css.201611009
2015-11-25;
2016-11-08
唐山师范学院科学研究基金项目(2016B04)。
赵永才(1980-),男,陕西渭南人,副教授,硕士,主要研究方向为运动心脏适应机制及血液免疫学,Tel:(0315)3863302,E-mail:zyc8256@sina.com。
唐山师范学院 体育系,河北 唐山 063000 Tangshan Normal University,Tangshan 063000,China.
G804.7
A
