猪繁殖与呼吸综合征疫苗对猪血液指标的影响
2016-12-09沈国顺赵一霏郭士琪刘丽霞
孙 雪,沈国顺,赵一霏,李 帅,郭士琪,董 烨,刘丽霞
(沈阳农业大学畜牧兽医学院,辽宁沈阳 110866)
猪繁殖与呼吸综合征疫苗对猪血液指标的影响
孙 雪,沈国顺,赵一霏,李 帅,郭士琪,董 烨,刘丽霞*
(沈阳农业大学畜牧兽医学院,辽宁沈阳 110866)
为确定猪繁殖与呼吸综合征疫苗对猪血液指标的影响,制定科学有效的疫苗免疫程序,选取42头未免健康断奶仔猪,随机分为4组,对照组(A组)、弱毒苗免疫组(B组)、灭活苗免疫组(C组)和弱毒苗+灭活苗联合免疫组(D组)。分别于免疫前、免疫后14、28、42、56、70 d以前腔静脉采血进行血常规分析。结果显示,免疫后,D组白细胞数始终高于B组,并于免疫42 d后显著高于其他3组(P<0.01);免疫28 d后,D组淋巴细胞数显著高于B组(P<0.01);各组红细胞数、血红蛋白浓度、中性粒细胞数及中值细胞数均呈现缓慢上升趋势,且D组的高于其他3组(P>0.05)。表明同时免疫弱毒苗+灭活苗能够更好的刺激猪血液细胞增殖。
猪繁殖与呼吸综合征;疫苗;淋巴细胞;白细胞
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)由猪繁殖与呼吸综合征病毒(PRRSV)引起,在世界范围内流行,不同年龄、品种和性别的猪均可感染,以妊娠母猪和1月龄以内的仔猪最易感[1],临床主要引起仔猪呼吸障碍和怀孕母猪繁殖障碍,主要表现为流产、木乃伊胎和死胎[2]。该病于19世纪80年代末出现在美国,我国最早于1991年在台湾出现该病,1996年首次报道该病,2006年暴发高致病性PRRS(HP-PRRSV)。PRRSV主要感染猪肺泡巨噬细胞(PAMs)[3],影响 PRRSV的递呈和清除,使动物体免疫力下降,引发免疫抑制,并诱发继发感染,给养猪业造成严重的经济损失。该病免疫预防仍是最有效的途径之一[4-5],但疫苗使用过程中也存在一定的问题,防控效果不是很理想[6],在外源感染方面疫苗效力不够,且PRRSV疫苗株已经被分离,表明疫苗可能会引起猪的疾病[7]。近年来许多研究者致力于新型疫苗的开发,包括病毒重组载体疫苗、DNA疫苗和植物制备的亚单位疫苗[8-10]。本试验通过对不同PRRS疫苗免疫后猪血液指标的影响进行研究,旨在探索该病最佳的免疫程序,为PRRS的有效防控提供依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物与疫苗 35日龄未免疫健康断奶仔猪42头,由沈阳农业大学科研猪场提供,平均体重8.87 kg。PRRS弱毒疫苗由勃林格殷格翰动物保健(美国)有限公司生产;高致病性PRRS灭活疫苗(NVDC-JXA1株)由杭州荐量兽用生物制品有限公司生产。
1.1.2 主要仪器 Uritest-3000型全自动血细胞分析仪。
1.2 方法
1.2.1 试验设计 将42头未免疫健康断奶仔猪随机分为A、B、C、D 4组,A为对照组,B~D为试验组且各设一个重复,A组(6)肌注生理盐水2 mL/头份 ;B1组(6)、B2组(6)肌注PRRS弱毒疫2 mL/头份 ;C1组(6)、C2组(6)肌注PRRS灭活疫苗2 mL/头份 ;D1组(6)、D2组(6)肌注PRRS弱毒+PRRS灭活疫苗弱毒疫苗,1 mL/头份+灭活疫苗1 mL/头份 ;均为35日龄首免,首免28 d后加强免疫。分别于免疫前、免疫后14、28、42、56、70 d时对所有试验猪前腔静脉采血,采用全自动血液细胞分析仪对白细胞数(WBC)、红细胞数(RBC)、淋巴细胞数(LY)、中性粒细胞数(GR)、血红蛋白浓度(HGB)、中值细胞数(MID)等指标进行测定。
2 结果
2.1 疫苗免疫对猪血液白细胞数的影响
免疫后14 d,B组白细胞数显著低于其他3组(P<0.05);免疫后28 d,D组显著高于A、C组(P<0.05),与B组差异性不显著;免疫后42 d,B组的显著低于C组(P<0.01);免疫后56 d和70 d,D组的均显著高于A、B、C 3组(P<0.01)(图1)。
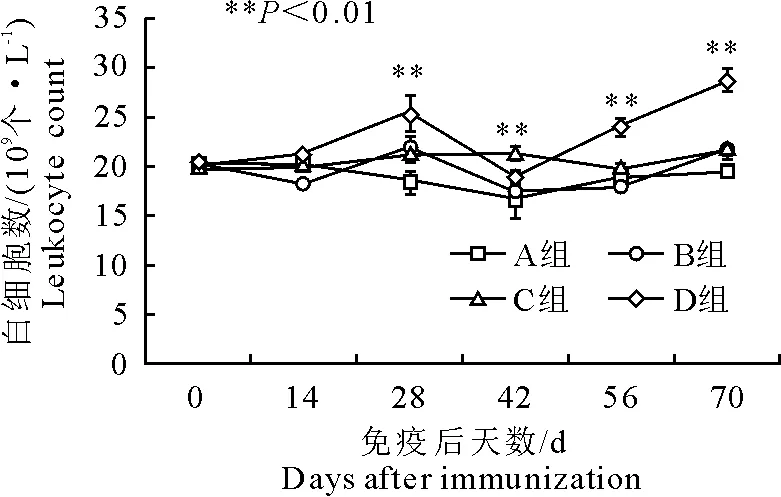
图1 免疫后白细胞数变化
2.2 疫苗免疫对血液淋巴细胞数的影响
免疫后14 d,C组淋巴细胞数最高,但各组间差异性不显著(P>0.05);免疫后28 d,B、C、D 3组的均显著高于A组(P<0.01);42 d时,B组显著低于C、D两组(P<0.01);免疫后56 d和70 d,D组显著高于A、B、C 3组(P<0.01)(图2)。
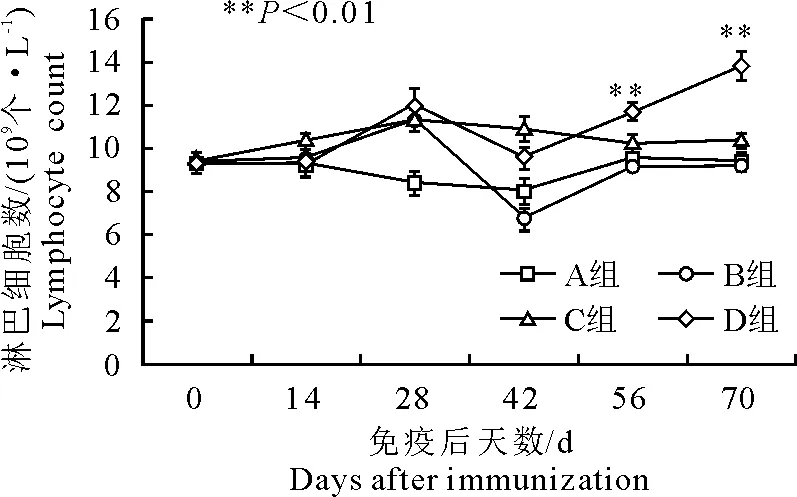
图2 免疫后淋巴细胞数变化
2.3 疫苗免疫后对红细胞数的影响
各组红细胞数均缓慢上升。免疫14 d后D组红细胞数高于其他3组(P>0.05),免疫42 d后,A组高于B组(P>0.05),试验组(B、C、D组)红细胞数与对照组红细胞数(A组)无显著性差异(P>0.05)(图3)。
2.4 疫苗免疫对血红蛋白浓度的影响
各组血红蛋白浓度均缓慢上升。免疫14 d后D组血红蛋白浓度高于其他3组(P>0.05),70 d时,D组的低于B组,试验组(B、C、D组)血红蛋白浓度与对照组(A组)血红蛋白浓度无显著性差异(P>0.05)(图4)。
2.5 疫苗免疫后对中性粒细胞数影响
各组中性粒细胞数均缓慢上升。免疫后D组中性粒细胞数高于其他3组(P>0.05),70 d时,B组的高于D组(P>0.05)。免疫后试验组(B、C、D组)中性粒细胞数高于对照组(A组)中性粒细胞数,但差异不显著(P>0.05)(图5)。
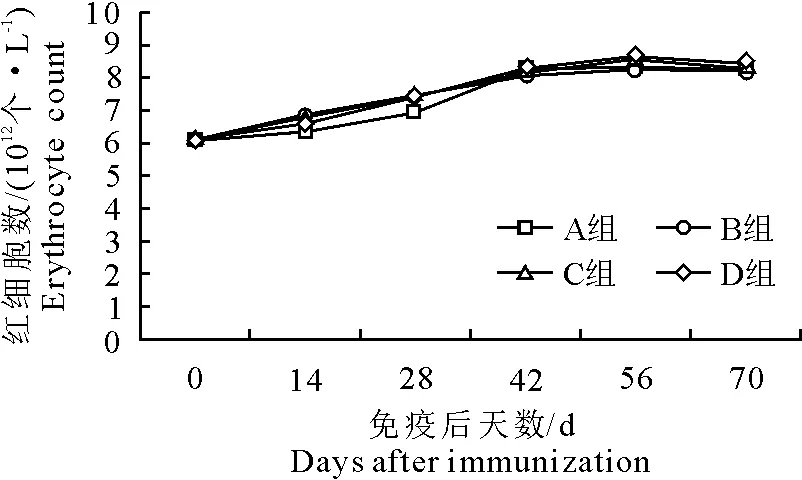
图3 免疫后红细胞数变化
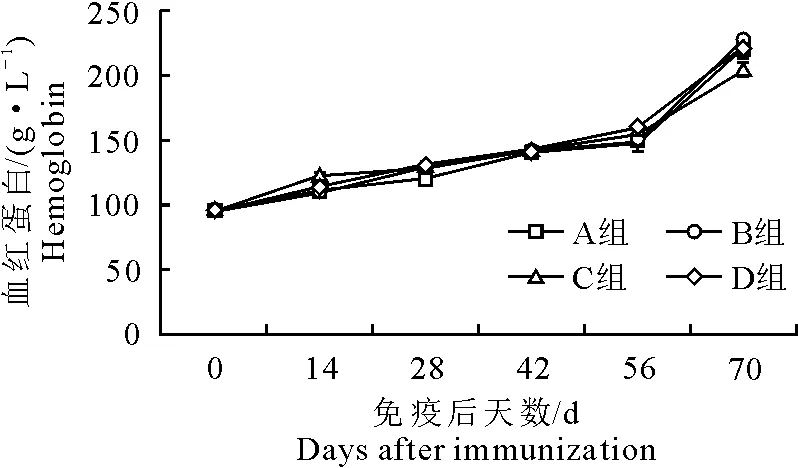
图4 免疫后血红蛋白浓度变化
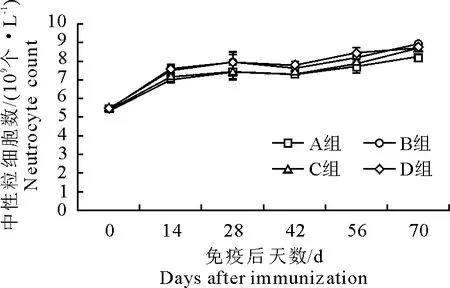
图5 免疫后中性粒细胞数变化
2.6 疫苗免疫对中值细胞数影响
免疫14 d后D组中值细胞数高于其他3组(P>0.05)。70 d时,D组的高于A组和C组,但差异不显著(P>0.05)(图6)。
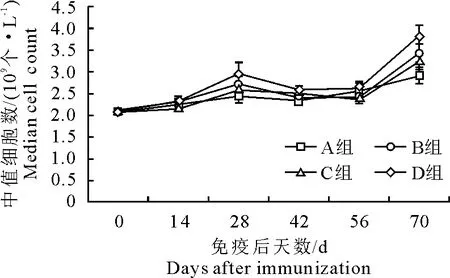
图6 免疫后中值细胞数变化
3 讨论
PRRS已成为危害养猪业最严重的疫病之一[11]。为防控该病,除快速准确的诊断外,做好仔猪的免疫接种也是预防该病最重要的途径之一。血液是机体抵御感染的第一道防线,起主要作用的是血液中白细胞,如巨噬细胞和淋巴细胞[12]。它们通过吞噬和产生抗体等方式来抵御和消灭入侵的病原微生物。本研究首免后,D组白细胞数和淋巴细胞数始终高于A组和B组,且免疫后42 d白细胞数和淋巴细胞数显著高于其他3组(P<0.01),表明同时免疫猪蓝耳病灭活苗和弱毒苗组,能够更好的刺激机体白细胞的增殖与分化。在免疫28 d后,弱毒苗免疫组(B组)白细胞数和淋巴细胞数均显著低于C组和D组(P<0.01),且免疫后42 d时B组淋巴细胞数与免疫后28 d时相比显著下降(P<0.05)。这可能是接种PRRSV活疫苗毒力偏强所致,因为免疫灭活苗组(C组)白细胞数和淋巴细胞数变化不明显(P>0.05)。免疫后试验组(B、C、D组)的红细胞数、中性粒细胞数、中值细胞数及血红蛋白浓度与A组无明显差异(P>0.05),表明PRRS疫苗免疫并没有对猪机体造成损伤,这与张韬[13]的报道一致。本研究中D组的白细胞数和淋巴细胞数等血液指标高于B组和C组,表明PRRS弱毒苗和灭活苗同时免疫能够更有效地刺激机体免疫细胞的增殖。
[1] 王 璐,肖 红,顾 盼,等.猪繁殖与呼吸综合征病毒样颗粒的构建[J].中国兽医科学,2015,45(11):1142-1147.
[2] 林思远,洪绍锋,黄加滨,等.PRRSV广西分离株GXYL-1403全基因克隆与序列分析[J].动物医学进展,2016,37(2):44-49.
[3] Villarreal,LP,Defilippis,VR.Gottlieb,KA,et al.Acute and persistent viral life strategies and their relationship to emerging diseases[J].Virology,2000,272(1):1-6.
[4] 徐小艳,徐正军,陈昌海,等.高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)免疫效果及安全性试验[J].畜牧与兽医,2014,46(4):118-119.
[5] 冷 雪,李真光,夏铭崎,等.高致病性猪繁殖与呼吸综合征活疫苗(TJM-F92株)安全性和免疫保护效果研究[J].中国预防兽医学报,2014,36(7):563-566.
[6] 王艳丰,张丁华,李 燕,等.河南某规模化猪场FMD、PCVD、PRRS、PR疫苗免疫抗体检测与分析[J].动物医学进展,2015,36(6):167-170.
[7] Caroline B.Modified-live PRRSV subtype 1 vaccine provides a partial clinical and virological protection upon challenge with East European subtype 3 PRRSV strain Lena[J].Porcine Health Manag,2016,2(1):12.
[8] Sanipa S,Piya W,Sawang K,et al.A novel DNA vaccine for reduction of PRRSV-induced negative immunomodulatory effects:A proof of concept[J].Vaccine,2015,33(32):3997-4003.
[9] Decorte I,Van Breedam W,Van der S,et al.Detection of total and PRRSV-specific antibodies in oral fluids collected with different rope types from PRRSV-vaccinated and experimentally infected pigs[J].BMC Vet Res,2014,10(1):1-23.
[10] 李亮亮,张雪梅,汤小龙,等.猪繁殖与呼吸综合征核酸疫苗研究进展[J].动物医学进展,2014,35(3):87-91.
[11] 罗忠永,王 印,杨泽晓.猪繁殖与呼吸综合征病毒LAMP检测方法的建立[J].动物医学进展,2016,37(3):1-5.
[12] 陈 静,刘显军,边连全,等.仔猪免疫系统的建立及早期断奶对仔猪免疫功能的影响研究[J].吉林农业科学,2011,36(1):35-40.
[13] 张 韬.猪蓝耳病疫苗免疫对猪生理生化指标的影响[J].中国畜牧兽医文摘,2015,31(10):60.
Effect of PRRS Vaccines on Blood Indexes in Swine
SUN Xue,SHEN Guo-Shun,ZHAO Yi-Fei,LI Shuai,GUO Shi-Qi,DONG Ye,lIU Li-Xia
(CollegeofAnimalScienceandVeterinaryMedicine,ShenyangAgriculturalUniversity,Shenyang,Liaoning,110161,China)
In order to determine the effect of the different vaccines of PRRS on blood indexes in swine,to make more scientific and effective immune programs of PRRS,42 healthy and weaned piglets were randomly divided into 4 groups,control group(group A ),immunization of attenuated vaccine in group B,immunization of inactivated vaccine in group C,immunization of attenuated and inactivated vaccines in group D.Blood samples were taken from cranialvenacavaon the 14th,28th,42th,56th,70th day after immunization for blood analysis.The results showed:the average number of leukocytes of group D in the 70th day was significantly higher than that of group B (P<0.01),after 42th day the average number of leukocytes of group D was significantly higher than that of other groups(P<0.01); after immunization 28th day,lymphocyte count of group D was significantly higher than that of group B (P<0.01); the number of erythrocytes and hemoglobin concentration,the neutrocytes and median cells in each group showed a slow upward trend, and the values in group D was higher than that in other three groups (P>0.05).It showed that the immunization of attenuated vaccines and inactivated could better stimulate the porcine blood cell proliferation.
PRRS;vaccine;lymphocyte;leukocyte
2016-05-08
辽宁省农业公关及产业化项目(2014202004)
孙 雪(1991-),女,辽宁盘锦人,硕士,主要从事预防免疫研究。*通讯作者
S852.659.6
B
1007-5038(2016)11-0123-03
